Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Рандомизированное фиктивно контролируемое исследование черепной электростимуляции боли и физической функции при фибромиалгии с использованием биомаркеров визуализации мозга
В этой статье
Резюме
Настоящее исследование представляет собой рандомизированное плацебо-контролируемое исследование для определения эффективности краниальной электростимуляции (CES) для уменьшения боли и функции при фибромиалгии и дальнейшей разработки магнитно-резонансной томографии с функциональными связями покоя (rs-fcMRI) в качестве клинического инструмента для оценки нейронных коррелятов и механизмов хронической боли и обезболивающей реакции.
Аннотация
Фибромиалгия — это хронический болевой синдром, который проявляется совокупностью широких симптомов, включая снижение физической функции, усталость, когнитивные нарушения и другие соматические жалобы. Доступные методы лечения часто недостаточны для лечения симптомов, при этом недостаточный контроль боли обычно приводит к использованию опиоидов для попыток лечения. Черепная электростимуляция (CES) является многообещающим нефармакологическим вариантом лечения болевых состояний, в котором используется импульсная стимуляция электрическим током для изменения функции мозга с помощью чрескожных электродов. Эти нейронные механизмы и применение CES для облегчения симптомов фибромиалгии требуют дальнейшего изучения.
В общей сложности 50 участников из Системы здравоохранения по делам ветеранов Атланты (VAHCS) с диагнозом фибромиалгия были включены в группу, а затем были рандомизированы в группу плацебо плюс стандартная терапия или активную группу CES плюс стандартная терапия. Исходные оценки были получены до начала лечения. Оба вмешательства проводились в течение 12 недель, а участники оценивались через 6 недель и 12 недель после начала лечения. Первичный исход заключался в том, наблюдались ли боль и функциональные улучшения при применении КЭИ. Кроме того, исходная и последующая магнитно-резонансная томография в состоянии покоя (rs-fcMRI) были получены в 6-недельном и 12-недельном временных точках для оценки клинического применения биомаркеров нейронных связей и лежащих в их основе нейронных ассоциаций, связанных с эффектами лечения.
Это рандомизированное плацебо-контролируемое исследование для определения эффективности КЭИ для уменьшения боли и функции при фибромиалгии и дальнейшей разработки рс-фМРТ в качестве клинического инструмента для оценки нейронных коррелятов и механизмов хронической боли и анальгетической реакции.
Введение
Из многих существующих состояний хронической боли одним из самых сложных заболеваний для диагностики, клинической оценки и лечения является фибромиалгия. Фибромиалгия – это изнурительный хронический болевой синдром, который включает в себя хроническую широко распространенную боль, снижение физической функции, усталость, психоэмоциональные нарушения и нарушения сна, а также различные соматические жалобы, затрагивающие примерно 2-3% населения в Северной и Южной Америке (около 8 миллионов человек в США). 1. Диагностика заболевания в значительной степени зависит от понимания пациентом своего собственного профиля симптомов и болевого опыта, и без этого правильного понимания болезни как врачом, так и пациентом, методы лечения теряют значительную эффективность2. Для наилучшего обслуживания всех пациентов необходимо более точное определение происхождения и влияния фибромиалгии, а также надежный клинический биомаркер для диагностики и лечения фибромиалгии.
Даже при подтвержденном диагнозе трудности с процессом лечения только нарастают. В целом, хроническая боль поражает больше людей, чем болезни сердца, диабет и рак вместе взятые. Субъективный характер его оценки делает его основным фактором опиоидной эпидемии, особенно учитывая сложность отличия неполностью вылеченной физической боли от расстройства, связанного с употреблением психоактивных веществ, и поведения, связанного с поиском наркотиков3. В 2020 году в США произошло 91 799 смертей от передозировки наркотиков (на 30% больше, чем в 2019 году), и основной причиной этих смертей были признаны опиоиды (74,8% всех смертей от передозировки наркотиков в 2020 году)4. Таким образом, необходимы нефармакологические альтернативы для лечения хронической боли и фибромиалгии, чтобы замедлить опиоидную эпидемию, что особенно важно для ветеранов, где риск самоубийства и расстройства, связанного с употреблением опиоидов, выше. Поэтому нефармакологические и комплементарные методы лечения часто используются в качестве методов лечения первой линии6.
Поиск новых, эффективных вмешательств при фибромиалгии привел многих исследователей и клиницистов к методам неинвазивной стимуляции мозга, включая стимуляцию черепа. Несмотря на то, что патофизиологические механизмы, приводящие к развитию заболевания, окончательно не определены, существующие данные подтверждают идею о том, что фибромиалгия является нарушением дисфункции вегетативной нервной системы и центральных (т.е. головного и спинного мозга) механизмов обработки боли 7,8. Стимуляция определенных областей мозга может привести к улучшению функции в этих областях обработки информации. Повторяющаяся транскраниальная магнитная стимуляция (рТМС) и транскраниальная стимуляция постоянным током (tDCS) коррелируют с уменьшением боли, но также связаны с раздражением кожи головы в месте активации, головными болями и недоступностью за пределами лечебных учреждений9. Неинвазивная стимуляция блуждающего нерва (nVNS), которая может обеспечить нейромодуляцию за счет стимуляции кожи на шее или на уровне уха, обладает потенциалом для лечения хронической боли, а инвазивная стимуляция блуждающего нерва (VNS) показала улучшение симптомов хронической боли10. Тем не менее, ни инвазивные, ни неинвазивные VNS не были в достаточной степени изучены в литературе или полностью валидированы для использования в лечении фибромиалгии 11,12,13,14.
Краниальная электростимуляция (CES) — это нефармакологическая, неинвазивная процедура стимуляции мозга, которая заключается в импульсном переменном микротоке (менее 0,5 мА), вводимом через чрескожные электроды, размещенные на мочках ушей. Он удивительно доступен и может быть доставлен с помощью портативных устройств, используемых пациентами в их собственном жилом пространстве. По сравнению с другими методами стимуляции черепа, неинвазивный характер и удобство самостоятельного применения пациентом в домашних условиях увеличивают потенциал CES как полезного варианта для широко распространенного лечения фибромиалгии и самостоятельного снятия боли. Он был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в качестве средства для лечения бессонницы, депрессии, тревоги и боли15.
В настоящем исследовании оценивается эффективность CES в качестве метода лечения фибромиалгии путем сравнения активной CES (вводимой настоящим исследуемым устройством) и фиктивной CES (вводимой фиктивным исследуемым устройством). Существуют некоторые предварительные данные в поддержку использования CES в лечении болевых состояний, таких как фибромиалгия16,17. Исследование 2001 года, в котором приняли участие 60 человек, рандомизированных в группу активной или фиктивной КЭИ в течение 3 недель ежедневных сеансов по 60 минут, показало улучшение на 28% баллов по болевым ощущениям, на 27% улучшение общих показателей боли иотсутствие эффекта плацебо. КЭИ не оценивалась у ветеранов, а также не была адекватно оценена у мужчин с фибромиалгией. В систематическом обзоре CES, финансируемом Управлением по делам ветеранов (VA), опубликованном в 2018 году, сделан вывод о том, что доказательств недостаточно для того, чтобы CES оказывала клинически значимое влияние на фибромиалгию, учитывая, что большинство испытаний имели небольшие размеры выборки, короткую продолжительность и высокий риск смещения из-за неадекватного ослепления. Тем не менее, обзор позволяет предположить, что КЭИ не вызывает серьезных побочных эффектов, и имеются малоубедительные доказательства, свидетельствующие о скромных преимуществах у пациентов с тревогой и депрессией. Таким образом, необходимы дальнейшие исследования в отношении использования этого одобренного FDA устройства с низким уровнем риска, особенно при фибромиалгии.
Чтобы полностью оценить эффективность, исследователи оценили физическую форму наряду с нейронными биомаркерами и болевым опытом. Целью лечения хронических болевых состояний является улучшение физической функции. Фибромиалгия последовательно коррелирует с негативным влиянием как на физическую функцию, так и на восприятие пациентами своих собственных физических способностей20. В предыдущих исследованиях для определения выносливости и подвижности использовались простые оценки физической подготовки, такие как тест на 6-минутную ходьбу (6MWT)20,21, пятикратный тест «Сидя, чтобы стоять» (5TSTS)20, а также различные измерения несущей способности и силы в контексте повседневнойдеятельности22. Чтобы учесть стандартные показатели, а также смягчить количество напряженной активности, необходимой непосредственно перед МРТ, исследовательская группа использовала 30-секундный тест на сидячее положение на стуле в качестве меры выносливости и подвижности, а также как сгибание рук на бицепс, так и тест на хват рук вкачестве мер силы. Движения, необходимые для каждой из этих оценок, очень распространены в повседневной деятельности, поэтому это четкая мера того, как люди физически функционируют в своей повседневной жизни, как с лечением, так и без него.
Даже при субъективной оценке боли и измерении эффективности физической функции механизмы CES не до конца понятны. Предыдущие исследования нейровизуализации были направлены на лучшее понимание путем изучения прямого влияния CES на сетевую связность в мозге. Feusner et al.24 обнаружили, что CES связана с корковой деактивацией при стимуляции на 0,5 Гц и 100 мкА двусторонней лобной, теменной и задней срединной областей, и предположили, что частота стимуляции может иметь больший эффект, чем интенсивность тока, в отношении корковой деактивации. Их группа обнаружила значительное влияние на некоторые, но не на все узлы сети стандартного режима (DMN). Авторы предполагают, что, основываясь на этих данных, CES может влиять на функциональную связность в состоянии покоя. Было показано, что фибромиалгия и другие хронические болевые состояния влияют на внутренние связи мозга в областях, связанных с болью и восприятием, поэтому методы лечения, которые изменяют функциональные связи в ответ, могут оказаться полезными и эффективными. Дальнейшее изучение долгосрочных эффектов ежедневного лечения в отношении клинического улучшения, а также того, как активация в мозге умерших соотносится с ранее наблюдаемым снижением частоты электроэнцефалограммы, необходимо для дальнейшего понимания терапевтическогомеханизма действия.
Магнитно-резонансная томография в состоянии покоя (rs-fcMRI) — это метод нейровизуализации, который позволяет наблюдать эти изменения функциональной связи. Продольная фМРТ состояния покоя позволяет клиницистам и исследователям установить базовый уровень связи в состоянии покоя и отслеживать изменения с течением времени в ответ на методы лечения CES. Это также помогает определить, как изменения в функциональной связности коррелируют с различиями в переживании боли. В первоначальных исследованиях нейровизуализации фибромиалгии для изучения головного мозга использовались позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ), но в этом отношении есть проблемы с обоими методами: ОФЭКТ имеет более низкое разрешение, чем ПЭТ, а ПЭТ-сканирование является инвазивным, что не является предпочтительным для пациентов, испытывающих хроническую боль. Функциональная магнитно-резонансная томография (фМРТ) имеет большее разрешение, чем ОФЭКТ, но она исследует активность мозга в ответ на конкретные действия пациента или восприятиестимулов. Именно сканирование rs-fcMRI может выявить функциональную связь между областями мозга и может быть в состоянии определить, где и как существует фибромиалгия, а также лучшиеметоды лечения.
Оценка эффективности нефармакологических методов лечения болевых состояний, таких как фибромиалгия, имеет первостепенное значение как в нынешних условиях опиоидной эпидемии, так и при изучении хронической боли как фактора риска самоубийства. Кроме того, отсутствие адекватных клинических биомаркеров боли является признанным пробелом в знаниях. Использование комбинации поведенческих измерений и нейровизуализации в несколько временных точек для оценки ответа на лечение является новым подходом к оценке фибромиалгии, как и использование аурикулярной КЭС в качестве лечения.
Протокол направлен на устранение пробела в исследованиях фибромиалгии путем изучения влияния CES на боль и исходы физических функций, а также оценки нейровизуализации в качестве инструмента для прогностических и ответных биомаркеров, связанных с клиническими исходами терапии CES31.
протокол
Исследование проводилось с одобрения Университета Эмори (IRB 112768) и Институциональных наблюдательных советов Атланты VA (1585632-2; Внутренний справочный номер: 003), а также в Комитет по исследованиям и разработкам штата Атланта (регистрационный номер Совета директоров: 3881). Все испытуемые дали свое информированное согласие на включение в исследование до того, как они приняли участие в этом исследовании. Визуальное представление временной шкалы протокола исследования см. на рисунке 1.
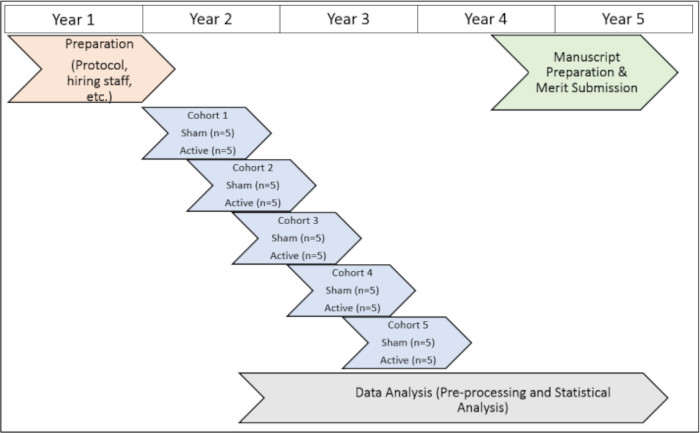
Рисунок 1: График исследования. Визуальное представление графика выполнения процедур исследования в течение испытательного периода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Набор участников доступными способами
- Следуйте соответствующим институциональным рекомендациям по распространению материалов по набору учащихся (листовки, посты, электронные письма, звонки и т. д.) и утвержденным методам набора.
ПРИМЕЧАНИЕ: В настоящее исследование набирались с помощью писем о наборе в определенные когорты и последующих телефонных звонков потенциальным участникам. Подробная информация о заказе устройств CES для исследования включена в дополнительные инструкции по заказу устройств CES (Дополнительный файл 1). - Когда кто-то выражает заинтересованность в участии в исследовании, проверьте его по телефону, чтобы убедиться, что он соответствует всем критериям включения и исключения.
- Включить участников, которые соответствуют критериям отбора: возраст 20-60 лет (предел, установленный во время предварительного исследования для минимизации структурных изменений мозга из-за старения)31; диагноз фибромиалгии по Американскому колледжу ревматологии 2016 г., критерии32; праворукость (с целью обеспечения согласованности структуры и функций мозга); оценка боли 4 или выше по шкале оценки боли Министерства обороны и ветеранов (DVPRS)33 в течение 3 месяцев до зачисления; последовательный и стабильный прием лекарств, связанных с ФМ, в течение как минимум 4 недель до включения в исследование34; и способность безопасно переносить МРТ.
- Для скрининга фибромиалгии заполните новый клинический диагностический критерий фибромиалгии32 вместе с потенциальным участником, чтобы получить его индекс распространенной боли (WPI) и балл тяжести (SS). Оценивайте в соответствии с рекомендациями, указанными внизу страницы.
- Для скрининга оценки боли попросите потенциальных участников устно оценить их среднюю, постоянную боль за последние 3 месяца по шкале от нуля до десяти.
- Для скрининга МРТ заполните форму проверки безопасности МРТ, указав потенциального участника, предоставленного учреждением или самим центром сканирования.
- Спросите участников обо всех возможных критериях исключения. Критерии исключения включают в себя наличие в анамнезе судорог или неврологических состояний, которые изменяют мозг; беременность; клаустрофобия, несовместимые с МРТ имплантаты или другие состояния, несовместимые с МРТ; и наличие в анамнезе неконтролируемого психического заболевания или аутоиммунного заболевания, которое приводит к боли и может лучше объяснить симптомы31.
- Если к ним применим какой-либо из критериев исключения, они не проходят проверку. Не включайте их в исследование.
- Включить участников, которые соответствуют критериям отбора: возраст 20-60 лет (предел, установленный во время предварительного исследования для минимизации структурных изменений мозга из-за старения)31; диагноз фибромиалгии по Американскому колледжу ревматологии 2016 г., критерии32; праворукость (с целью обеспечения согласованности структуры и функций мозга); оценка боли 4 или выше по шкале оценки боли Министерства обороны и ветеранов (DVPRS)33 в течение 3 месяцев до зачисления; последовательный и стабильный прием лекарств, связанных с ФМ, в течение как минимум 4 недель до включения в исследование34; и способность безопасно переносить МРТ.
- Когда кто-то пройдет скрининг, запишите его на прием с согласия и базовое МРТ. Запланируйте 2 часа для получения согласия и время сканирования.
2. Проведение базового, промежуточного и постучаствующего исследования (см. Таблицу 1)
ПРИМЕЧАНИЕ: Все приемы проходят в месте установки МРТ-сканера.
| Время | Научно-исследовательская деятельность | |
| Этап 1 | Неделя 1 | Подбор, отбор, зачисление |
| Этап 2 | Неделя 2–3 | Базовые оценки, rs-fcMRI |
| Этап 3 | Недели 2–14 | Вмешательство |
| Этап 4 | Неделя 6–10 | Острое наблюдение, рс-фкМРТ (6 недель лечения) |
| Этап 5 | Неделя 12–16 | Долгосрочное наблюдение, рс-фкМРТ (12 недель лечения) |
Таблица 1: Дизайн исследования. Хронология этапов индивидуального участия в течение 12 недель исследования.
- Перед каждым базовым визитом подготовьте устройство CES, чтобы принести его каждому участнику.
- Откройте чехол и убедитесь, что устройство находится внутри (оно должно быть в пузырчатой пленке). Снимите заднюю часть устройства и вставьте в него две батарейки типа ААА.
- Установите устройство на место. Включите устройство, чтобы убедиться, что оно работает, прежде чем подносить его участнику. Удерживайте верхнюю кнопку в течение примерно 2 секунд, пока экран не загорится, чтобы включить ее, и удерживайте ее в течение примерно 2 секунд, пока экран не погаснет, чтобы выключить ее.
- Убедитесь, что в каждом чехле есть устройство, дополнительные батарейки, шнурок, небольшой аппликатор раствора и ушные зажимы. Убедитесь, что сумка для передачи участникам содержит чехол для устройства, флакон с проводящим раствором, дополнительную крышку для наполнения небольшого аппликатора раствора и дополнительные электродные подушечки с ушным зажимом.
- После того, как их согласие и исходное МРТ-сканирование будут назначены, встретьтесь с участником в месте установки МРТ-сканера для встречи с двумя копиями формы согласия, устройством CES и его материалами, документами для тестирования на соответствие требованиям и пакетом анкет для заполнения. Кроме того, возьмите с собой устройство для передачи данных, через которое будут передаваться данные МРТ, к месту проведения анализа.
ПРИМЕЧАНИЕ: В этом исследовании использовался USB-накопитель с шифрованием.- Для оформления документов о праве на участие включите новые клинические диагностические критерии фибромиалгии32 и DVPRS33.
ПРИМЕЧАНИЕ: DVPRS должен быть включен при каждом посещении. - Для тестов физической функции включите форму для записи результатов каждого теста 20,21,35.
- В анкетах, которые будут заполнять участники, укажите соответствующие показатели PROMIS (PROMIS Scale v1.2 - Global Health, Neuro-QOL Item Bank v2.0 - Cognition Function - Short Form, PROMIS Item Bank v1.0 - Substance Use/Alcohol: Alcohol Use, PROMIS Item Bank v1.0 - Emotional Distress - Anxiety - Short Form 7a, PROMIS Item Bank v1.0 - Emotional Distress-Depression - Short Form 4a, PROMIS Item Bank v1.0 - Fatigue - Short Form 6a, PROMIS Item Bank v1.0 - Pain Interference - краткая форма 4a, PROMIS Item Bank v1.2 - Физическая функция - краткая форма 8b, PROMIS Item Bank v2.0 - Социальная изоляция - краткая форма 4a)36.
- Для оформления документов о праве на участие включите новые клинические диагностические критерии фибромиалгии32 и DVPRS33.
- В месте проведения МРТ проведите базовый визит. Заранее позвоните участнику для подтверждения.
- Прочитайте форму полного согласия вместе с участником, чтобы убедиться, что он понимает информацию. Спросите их, хотят ли они принять участие, и если они согласны, попросите их напечатать свое имя, подписать и поставить дату на бланке.
- После получения согласия, если участник решит участвовать в исследовании, заполните вместе с ним документы по тестированию на включение. Если они имеют право продолжить, выполните следующие действия; Если они не соответствуют требованиям, прекратите их участие в исследовании на этом этапе.
- Убедитесь, что документы для тестирования соответствия включают новые клинические диагностические критерии фибромиалгии и DVPRS.
- Если после инклюзивного тестирования участник имеет право на участие, объясните ему, как использовать устройство CES.
- Извлеките устройство из чехла и покажите участникам, как его включать и выключать с помощью кнопки в верхней части. Напомните участникам, что устройство автоматически деактивируется по истечении 60 минут.
- Покажите участникам, как прикрепить шнур для ушных зажимов сбоку. Противоположный конец шнура от зажимов вставляется в небольшое отверстие с левой стороны устройства с маркировкой «1».
- Покажите, как снять старые электродные подушечки с ушных зажимов и прикрепить новые. Чтобы удалить старые прокладки, потяните клей вверх от места его соединения с зажимами. Чтобы прикрепить новые контактные площадки, совместите отверстие в запасных электродных колодках с выступающей областью в центре зажима и плотно прижмите.
ПРИМЕЧАНИЕ: Не тяните электродные прокладки за мягкую часть сверху. Он подвержен разрывам и оставит клей прилипшим к зажимам. - Покажите, как прикрепить зажимы к мочкам ушей, и попросите их попробовать это один раз. Сожмите зеленые кончики зажима, чтобы открыть его, поместите мочку уха между ними и аккуратно закройте зажим, чтобы прикрепить.
- Покажите им, как снять пластиковую крышку с маленького аппликатора раствора и наполнить его раствором из большой бутылки (см. шаги 2.3.3.6-2.3.3.8). Напомните им, что раствор необходим для правильной работы устройства.
- Чтобы снять верхнюю часть небольшого аппликатора раствора, снимите колпачок и плотно прижмите к боковой стороне наконечника. Пластиковый наконечник будет отсоединяться от остальной части бутылки.
- Прикрепите альтернативный колпачок для наполнения маленького аппликатора к верхней части большого флакона с раствором. Нажмите на маленькую насадку, вставьте ее в маленький аппликатор и сожмите большую бутылку, чтобы наполнить.
- Скажите участникам, что они должны добавлять всего около 1-2 капель раствора в каждую электродную подушечку для ушных зажимов. Излишки раствора следует смыть перед использованием.
- Проинструктируйте участников использовать устройство каждый день недели в течение 60 минут вечером, примерно за 1 час до отхода ко сну. Проинструктируйте участников о том, как пользоваться устройством в состоянии покоя (т.е. сидеть неподвижно или лежа, не двигаясь).
ПРИМЕЧАНИЕ: Как по времени, так и по положению участникам разрешалось нормально изменять условия их использования в домашних условиях, чтобы повысить практический характер этой терапии для домашнего использования. Не были заданы параметры для звука, разрешенного в окружающей среде, или требуемого хранилища устройства. - Раздайте участникам пустой журнал устройств и объясните, что им необходимо ввести каждую дату использования устройства, оценку боли до и после использования устройства, а также время использования устройства.
- Если участники не могут использовать свое устройство в течение определенного периода времени в течение 6 недель между приемами, но могут записаться на последующие приемы, позвольте им остаться в исследовании. Если они не могут воспользоваться устройством или приехать на ознакомительные визиты, прекратите их участие. В дополнительном журнале устройств CES (Дополнительный файл 2) см. журнал приборов, использованный в этом исследовании.
ПРИМЕЧАНИЕ: Следующие шаги будут повторяться во время всех трех посещений.
- После объяснения устройства попросите участника выполнить три коротких теста на физическую функцию23. Для каждого теста будет записано максимальное количество баллов (общее количество повторений для первых двух и сила за попытку для третьего).
ПРИМЕЧАНИЕ: Секундомером, использованным для этого исследования, был Apple iPhone 12.- Проведите тест на стойку 30 с креслом. Выполните шаги 2.3.4.2-2.3.4.6.
- Поставьте стул спинкой к стене испытательной комнаты. Предложите участнику сесть на стул спиной к спинке стула.
- Попросите участника подняться в полное положение стоя, а затем сесть обратно до упора, прислонившись спиной к спинке стула, столько раз, сколько он сможет за 30 с.
ПРИМЕЧАНИЕ: Если они постукивают по стулу, но не полностью перекладывают свой вес на него в сидячем положении, повторение не засчитывается. - Скажите участникам, когда нужно начать. Запустите таймер, когда они начнут двигаться.
- Попросите участников делать сгибания рук с гантелями с каждой стороны в течение 30 с каждой стороны. Начните сначала с правой руки, а затем двигайтесь влево.
- Запишите общее количество завитков с каждой стороны. Используйте гирю весом 5 фунтов для женщин и гирю весом 8 фунтов для мужчин. Убедитесь, что участники сидят во время теста на сгибание рук.
- Пусть участники проведут три испытания силы хвата каждой рукой на динамометре. Выполните шаги 2.3.4.8-2.3.4.11. Начните сначала с правой руки, а затем двигайтесь влево.
- Поместите динамометр в руку участника. Они должны сжимать ручку внизу и не касаться циферблата вверху.
- Скажите участникам сжать динамометр как можно сильнее, а затем отпустите. Стрелка на циферблате остановится на максимальном уровне силы хвата, который она продемонстрировала.
- Запишите их показатели силы захвата, записав на циферблате число, до которого доходит стрелка. Сбросьте диск между повторениями, поворачивая маленькую ручку на лицевой стороне циферблата против часовой стрелки до тех пор, пока стрелка не упрется в ноль.
- Убедитесь, что участники сидят на своих местах для теста на рукоятку.
ПРИМЕЧАНИЕ: Между каждой серией участники получают около 15-20 секунд отдыха, перекладывая оборудование в другую руку. Между каждым тестом участники будут отдыхать около 2 минут, пока готовится оборудование и документы для следующего.
- После тестов на физическую функцию попросите участников заполнить пакет анкеты с помощью ручки. После этого проверьте пакет, чтобы убедиться, что они ответили на все вопросы.
- После того, как все обзоры, тесты и анкеты будут заполнены, подведите участников к самому МРТ-сканеру (всю информацию о протоколе МРТ см. в разделе 3). Просмотрите форму скрининга вместе с техниками МРТ и убедитесь, что участники удалили весь металл со своего тела.
- Убедитесь, что на членах исследовательской группы нет металла.
- Помогите техникам МРТ удобно расположить участников в сканере. Проводите протокол МРТ.
- Проинструктируйте участников о процедурах безопасности (кнопка тестового звонка и динамики).
- Напомните участникам, чтобы они вообще не двигались во время сканирования.
- Напомните участникам об общей продолжительности сканирования, которая должна составлять 60 минут.
- Когда сканирование будет завершено, помогите участникам выбраться из сканера.
- После сканирования завершите базовый визит участников и запланируйте их промежуточный визит на 6 недель позже. Всего у участников будет три ознакомительных визита, каждый с интервалом в 6 недель. Отправка данных МРТ на защищенные серверы исследования для анализа.
- В запланированный день проведите промежуточный визит, следуя шагам базового визита. Позвоните участнику заранее для подтверждения.
- Администрирование DVPRS. Попросите участников вернуть свой первый завершенный журнал устройства и предоставить им второй журнал устройства.
- Выполните шаги 2.3.4-2.3.6 (то же, что и при базовом визите).
- Завершите визит участников в середине визита и запланируйте его на 6 недель позже. Отправка данных МРТ на защищенные серверы исследования для анализа.
- В запланированный день проведите послевизитную операцию, следуя шагам промежуточного визита. Заранее позвоните участнику для подтверждения.
- Администрирование DVPRS. Попросите участников вернуть второй заполненный журнал устройства.
- Выполните шаги 2.3.4-2.3.6 (то же, что и в базовом и промежуточном посещениях). Для последнего визита не требуется дополнительное планирование посещений.
- Если требуется какая-либо информация для выплаты компенсации участникам, подготовьте и запросите эту информацию во время этого визита.
ПРИМЕЧАНИЕ: В этом исследовании их имя и адрес требовались для выдачи чеков от Управления по делам ветеранов Атланты на компенсацию. - Завершите пост-визит участников. Отправка данных МРТ на защищенные серверы исследования для анализа.
ПРИМЕЧАНИЕ: На протяжении всего исследования обязательно звоните и связывайтесь с участниками между визитами, чтобы убедиться, что они используют устройство, заполняют журналы устройств и знают, когда состоится их следующий визит.
3. Настройка протоколов МРТ
- Для протокола МРТ необходимо получить данные BOLD rs-fMRI на 3T МРТ-сканере с 32-канальной катушкой головки с фазированной решеткой с использованием последовательности градиентной эхопланарной визуализации (EPI). Используйте следующие параметры MR: FOV (Field of View) = 220 мм2; TR (время повторения)/TE (время эха) = 1500/25 мс, коэффициент многополосного ускорения = 3; угол откидывания = 50°; размер матрицы 110 x 110; толщина ломтика = 2 мм; Коэффициент GRAPPA = 2; Частичный фурье 6/8; 34 фазо-кодирующие опорные линии, 72 чередующихся осевых среза, охватывающих весь мозг, примерно 350 объемов сканирования для получения 8 минут данных фМРТ в состоянии покоя для стабильной оценки связующих сетей.
- В протоколе анатомического намагничивания T1w подготовлено быстрое градиентное эхо (MPRAGE), задается TR = 2530 мс, TE = 3 мс, угол поворота = 7°, толщина среза = 0,8 мм, фазовое разрешение 1 мм. Захват T1w длится около 6 минут.
- Получение результатов диффузионно-взвешенной визуализации (DWI) на 3-теральном МРТ-сканере с 32-канальной катушкой с фазированной решеткой головки с использованием схемы визуализации диффузионного спектра. Соберите в общей сложности 129 направлений диффузионной выборки с максимальным значением b 3000 с/мм2, разрешением в плоскости 2x2мм2 и толщиной среза 2 мм.
- Получение физиологических данных (кардиореспираторных данных с использованием ремня для мониторинга дыхания и пульсоксиметрии) одновременно (с блокировкой по времени) с данными фМРТ.
- Безопасная передача данных МРТ из места расположения сканера в защищенное место для предварительной обработки и анализа. Конвертация DICOMS в NIFTI в соответствии с форматированием BIDS с использованием dc2bids v2.1.6.
- Очистка данных отдельных идентификаторов. Используйте номер субъекта исследования во всех данных, где это применимо. Проведите проверку качества, чтобы убедиться в отсутствии аномальных артефактов, таких как чрезмерное движение, с помощью MRIQC v21.0.0.
4. Предварительная обработка и анализы
- После того, как данные МРТ исследования будут получены, используйте два отдельных конвейера для их анализа: один для анализа функциональной связи между участниками, а другой для анализа трактографии белого вещества.
- Предварительная обработка структурных данных T1w и rsfMRI субъектов с помощью fMRIPrep v20.2.5, включая экстракцию мозга, сегментацию тканей и нормализацию T1-взвешенных (T1w) изображений, а также оценку опорного объема, оценку движения головы, коррекцию времени среза и регистрацию в T1w для функциональных изображений. В результате этого процесса данные T1w и рсфМРТ нормализуются в пространство MNI152NLin2009cAsym.
- Используйте предварительно обработанные данные МРТ в анализе функциональной связности (CONN).
- Смотрите дополнительный документ fMRIPrep Boilerplate (Дополнительный файл 3, 37-56). Для получения дополнительной информации перейдите по ссылке: https://fmriprep.org/en/stable/
- Импортируйте предварительно обработанный набор данных в CONN Toolbox v22a для дальнейшей обработки.
ПРИМЕЧАНИЕ: CONN Toolbox обновлен с v21a до v22a во время этого исследования.- На этапе подготовки установите ковариаты2-го уровня, чтобы определить исследуемые группы (TRUE против SHAM) для последующего анализа и обеспечить качество изображений T1w и rsfMRI. Гладкие данные фМРТ через 8 мм гауссово ядро.
- После предварительной обработки удалите шум из данных, чтобы удалить посторонние и физиологические шумы.
ПРИМЕЧАНИЕ: В этом исследовании был рассчитан анализ первого уровня, но он не оценивался и не использовался, поскольку исследователей не интересуют результаты по одному субъекту. - Выберите семена/ROI и ковариаты по теме и установите контрасты. Запустите анализ начальных значений в воксельные вычисления на уровне группы.
- После завершения действий по настройке, предварительной обработке и шумоподавлению конвейеров задайте пороговые значения кластера и вокселей для просмотра шаблонов подключения.
- Смотрите дополнительный рисунок 1 и дополнительный документ CES CONN Instructions (дополнительный файл 4).
- Использование корреляционной трактографии57 для определения продольных изменений целостности белого вещества, коррелирующих с экспериментальной группой, для выявления пучков тракта и областей, связанных с лечением CES. Ниже приведены основные этапы анализа:
- Конвертируйте необработанные изображения DWI из формата .dcm (DICOM) в формат .nii.gz (NIfTI).
- Предварительная обработка изображений для коррекции искажений, вызванных восприимчивостью, с помощью FSL (версия 6.0.6) TOPUP58,59 и для вихретоковых искажений с помощью инструмента EDDY60 от FSL.
- Создавайте метрики контроля качества изображения DWI, связанные с движением на уровне одного объекта и на уровне исследования, с помощью инструментов EDDY QC от FSL.
- Проведите двустороннее повторное измерение ANOVA по этим показателям контроля качества, чтобы выявить любые межгрупповые вариации, которые могут исказить результаты групповой трактографии. Если метрика показывает значимую дисперсию между группами (p > 0,05), то она должна учитываться как ковариата в корреляционном трактографическом анализе.
- Импортируйте предварительно обработанные данные в DSI Studio (версия "Chen" от 21 ноября 2022 г.), где они будут преобразованы в файлы .src (исходные). Для получения дополнительной информации о DSI Studio посетите веб-сайт программного обеспечения (https://dsi-studio.labsolver.org).
- Реконструируйте импортированные данные диффузии с помощью диффеоморфной реконструкции Q-Space (QSDR)61 для определения ориентации волокон белого вещества в пространстве шаблонов MNI. Для каждого изображения выводится файл .fib (ориентация волокна). Варианты реконструкции следующие:
метод (выбор метода реконструкции) - QSDR
param0 (длина диффузионной выборки) - 1.25 (это значение по умолчанию)
шаблон (в какое пространство шаблона реконструировать данные) - ICBM152
align_acpc (нужно ли поворачивать объем изображения для выравнивания ac-pc) - 0 (false) - Создайте базу данных коннектометрии из этих файлов .fib, которая извлекает значения количественной анизотропии (QA) из восстановленных данных диффузии. Рассчитайте продольное изменение QA для каждого субъекта в базе данных. Добавьте в базу данных демографические данные, такие как группа эксперимента, возраст, пол, а также любые ковариаты, выявленные на этапе контроля качества, с помощью файла .csv.
- Затем загрузите базу данных коннектометрии в графический интерфейс Group Connectometry Analysis.
- Выберите ковариаты, которые будут учитываться в анализе. Одна из этих выбранных ковариат обозначается как переменная исследования.
- Для этого анализа выберите Группа в качестве переменной исследования. Будут выявлены участки с продольными изменениями в QA, коррелированными с группой , в то время как влияние других выбранных ковариат будет регрессировано.
- Для анализа групповой коннектометрии можно выбрать следующие варианты:
- FDR Control (False Discovery Rate cutoff, будут выведены только участки со значимой корреляцией ниже FDR) - 0.05
- Length Threshold (значение в вокселах от минимальной длины тракта, используемое в качестве нулевой гипотезы) - 20 вокселей (или 40 мм для размеров вокселей 2 мм)
- T порог (порог измерения t-stat для корреляционного эффекта) - 2,5
- Study region (эта панель позволяет включать/исключать регионы из анализа) - выберите Whole Brain с отмеченной опцией - Exclude Cerebellum
ПРИМЕЧАНИЕ: Для этого исследования мозжечок был исключен из-за того, что при некоторых диффузионных сканированиях части мозжечка были отрезаны во время регистрации.
- Нажмите кнопку Run Connectometry для выполнения анализа, в результате которого будет выведено несколько файлов:
- Файл .fib, который хранит t-статистику и может быть открыт в студии DSI для визуализации t-статистики участков с возрастающим QA (хранится как «inc_t») или уменьшающимся QA (хранится как «dec_t»), которые коррелируют с Group.
- .fdr_dist.values.txt, в котором перечислены значения FDR по отношению к длине участка
- .inc.tt.gz, представляющий собой файл трактографии, в котором хранятся тракты с увеличенным продольным контролем качества, коррелированными с исследуемой переменной. (Группа в нашем случае). В файле .dec.tt.gz хранятся тракты со сниженным продольным QA, коррелированным с исследуемой переменной.
- Файл .report.html, в котором удобно представлены результаты коннектометрии вместе с вложенными графиками трактов, рисунками, а также шаблонной информацией об этапах корреляционного трактографического анализа для публикации.
ПРИМЕЧАНИЕ: Чтобы увидеть примеры кода R, использованного в этом исследовании, см. дополнительные графики CES R Code (Дополнительный файл 5) и дополнительные файлы CES eddy-qc Anova с кодом R (Дополнительный файл 6).
Результаты
Что касается результатов набора, то участники в основном набирались путем рассылки писем о наборе и последующих телефонных звонков в соответствии с изложенными правилами системы здравоохранения штата Атланта. Исследовательская группа набрала в общей сложности 50 уч?...
Обсуждение
Методы настоящего исследования обеспечивают не только возможность высокоэффективного метода лечения фибромиалгии, но и возможность улучшить процесс диагностики фибромиалгии с первого момента ее болевого симптоматического профиля. Использование как активной CES, так и фиктивной CES, с ...
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье. Мнения, выраженные в этой статье, принадлежат авторам и не обязательно отражают позицию или политику Департамента по делам ветеранов или правительства Соединенных Штатов.
Благодарности
Авторы выражают признательность исследователям из Центра визуальной и нейрокогнитивной реабилитации, в том числе доктору Брюсу Кроссону и доктору Лизе Кришнамурти, за их вклад в работу. Авторы также благодарят Грейс Ингхэм за неоценимую помощь в съемочном процессе. Эта работа была частично поддержана премией Министерства по делам ветеранов США за исследования и развитие карьеры IK2 RX003227 (Анна Вудбери) и грантом Центра 5I50RX002358. Спонсор не играет никакой роли в планировании исследования, сборе данных, управлении, анализе, интерпретации или составлении отчетности.
Материалы
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
Ссылки
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- Department of Veterans Affairs. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain Medicine. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim Available from: https://alpha-stim.com/blog/nbc4-washington-electrotherapy-device-treats-anxiety-insomnia-depression/ (2021)
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. Electromedical Products International, Inc. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), 1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47, 102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23, 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. . Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), 0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study). NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. . General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены