Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine randomisierte, scheinkontrollierte Studie zur kranialen elektrischen Stimulation bei Fibromyalgie-Schmerzen und körperlicher Funktion unter Verwendung von bildgebenden Biomarkern des Gehirns
In diesem Artikel
Zusammenfassung
Bei der aktuellen Studie handelt es sich um eine randomisierte, placebokontrollierte Studie zur Bestimmung der Wirksamkeit der kranialen Elektrostimulation (CES) zur Verbesserung von Schmerzen und Funktion bei Fibromyalgie und zur Weiterentwicklung der Magnetresonanztomographie (rs-fcMRT) als klinisches Instrument zur Beurteilung der neuronalen Korrelate und Mechanismen chronischer Schmerzen und analgetischer Reaktion.
Zusammenfassung
Fibromyalgie ist ein chronisches Schmerzsyndrom, das mit einer Konstellation von Symptomen einhergeht, darunter verminderte körperliche Funktion, Müdigkeit, kognitive Störungen und andere somatische Beschwerden. Die verfügbaren Therapien sind bei der Behandlung der Symptome oft unzureichend, wobei eine unzureichende Schmerzkontrolle häufig zum Opioidkonsum für den Versuch der Behandlung führt. Die kraniale elektrische Stimulation (CES) ist eine vielversprechende nicht-pharmakologische Behandlungsoption für Schmerzzustände, bei der die Stimulation mit gepulstem elektrischem Strom zur Veränderung der Gehirnfunktion über transkutane Elektroden verwendet wird. Diese neuronalen Mechanismen und die Anwendungen von CES bei der Linderung von Fibromyalgie-Symptomen bedürfen weiterer Forschung.
Insgesamt 50 Teilnehmer des Atlanta Veterans Affairs Healthcare System (VAHCS), bei denen Fibromyalgie diagnostiziert wurde, wurden aufgenommen und dann blockrandomisiert entweder in eine Placebo-plus-Standardtherapie- oder eine aktive CES- plus Standardtherapiegruppe eingeteilt. Die Ausgangsbewertungen wurden vor Beginn der Behandlung eingeholt. Beide Interventionen fanden über einen Zeitraum von 12 Wochen statt, und die Teilnehmer wurden 6 Wochen und 12 Wochen nach Behandlungsbeginn untersucht. Im primären Endpunkt wurde untersucht, ob Schmerzen und funktionelle Verbesserungen bei der Anwendung von CES auftreten. Darüber hinaus wurde die Magnetresonanztomographie (rs-fcMRT) zu Studienbeginn und zur Nachbeobachtung der funktionellen Konnektivität im Ruhezustand zu den Zeitpunkten von 6 Wochen und 12 Wochen durchgeführt, um die klinische Anwendung von Biomarkern der neuronalen Konnektivität und die zugrunde liegenden neuronalen Assoziationen im Zusammenhang mit Behandlungseffekten zu beurteilen.
Hierbei handelt es sich um eine randomisierte, placebokontrollierte Studie zur Bestimmung der Wirksamkeit von CES zur Verbesserung von Schmerzen und Funktion bei Fibromyalgie und zur Weiterentwicklung der rs-fcMRT als klinisches Instrument zur Beurteilung der neuronalen Korrelate und Mechanismen chronischer Schmerzen und analgetischer Reaktionen.
Einleitung
Von den vielen bestehenden Zuständen chronischer Schmerzen ist Fibromyalgie eine der am schwierigsten zu diagnostizierenden, klinisch zu beurteilenden und zu behandelnden Krankheiten. Fibromyalgie ist ein schwächendes chronisches Schmerzsyndrom, das chronische, weit verbreitete Schmerzen, verminderte körperliche Funktion, Müdigkeit, psycho-emotionale und Schlafstörungen sowie verschiedene somatische Beschwerden umfasst, von denen etwa 2-3% der Allgemeinbevölkerung in Amerika (etwa 8 Millionen Menschen in den USA) betroffen sind. 1. Die Diagnose der Krankheit hängt stark davon ab, ob der Patient sein eigenes Symptomprofil und sein Schmerzempfinden versteht, und ohne dieses angemessene Verständnis der Krankheit sowohl durch den Arzt als auch durch den Patienten verlieren die Behandlungsmethoden erheblich an Wirksamkeit2. Eine bessere Definition der Ursprünge und Auswirkungen von Fibromyalgie sowie ein zuverlässiger klinischer Biomarker zur Diagnose und Behandlung von Fibromyalgie sind notwendig, um allen Patienten bestmöglich zu dienen.
Selbst bei einer gesicherten Diagnose nehmen die Schwierigkeiten mit dem Behandlungsprozess nur zu. Insgesamt sind mehr Menschen von chronischen Schmerzen betroffen als Herzerkrankungen, Diabetes und Krebs zusammen. Die subjektive Natur seiner Bewertung macht es zu einem Haupttreiber für die Opioid-Epidemie, insbesondere angesichts der Schwierigkeit, unvollständig behandelte körperliche Schmerzen von Substanzgebrauchsstörungen und drogensuchendem Verhalten zu unterscheiden3. Im Jahr 2020 gab es in den Vereinigten Staaten 91.799 Todesfälle durch Überdosierung (ein Anstieg von 30 % gegenüber 2019), und Opioide waren die Hauptursache für diese Todesfälle (74,8 % aller Todesfälle durch Überdosierung im Jahr 2020)4. Daher sind nicht-pharmakologische Alternativen für die Behandlung chronischer Schmerzen und Fibromyalgie erforderlich, um die Opioid-Epidemie zu verlangsamen, was besonders wichtig ist in der Veteranenbevölkerung, wo das Risiko für Selbstmord und Opioidkonsumstörungen höher ist5. Nicht-pharmakologische und komplementäre Therapien werden daher häufig als Erstlinienbehandlungen eingesetzt6.
Die Suche nach neuartigen, wirksamen Fibromyalgie-Interventionen hat viele Forscher und Kliniker zu Methoden der nicht-invasiven Hirnstimulation, einschließlich der Schädelstimulation, geführt. Auch wenn die pathophysiologischen Mechanismen, die zur Entwicklung der Krankheit führen, noch nicht endgültig geklärt sind, unterstützen die vorhandenen Erkenntnisse die Idee, dass Fibromyalgie eine Störung der Dysfunktion des autonomen Nervensystems und der zentralen (d. h. des Gehirns und des Rückenmarks) Schmerzverarbeitungsmechanismen ist 7,8. Die Stimulation bestimmter Bereiche des Gehirns könnte zu einer verbesserten Funktion in diesen Bereichen der Verarbeitung führen. Die repetitive transkranielle Magnetstimulation (rTMS) und die transkranielle Gleichstromstimulation (tDCS) wurden mit einer Schmerzreduktion korreliert, wurden aber auch mit Reizungen der Kopfhaut an der Aktivierungsstelle, Kopfschmerzen und Unzugänglichkeit außerhalb der Behandlungseinrichtungen in Verbindung gebracht9. Die nichtinvasive Vagusnervstimulation (nVNS), die durch Stimulation der Haut am Hals oder auf Höhe des Ohrs eine Neuromodulation bewirken kann, hat das Potenzial für die Behandlung chronischer Schmerzen, und es wurde gezeigt, dass die invasive Vagusnervstimulation (VNS) chronische Schmerzsymptome verbessert10. Weder invasive noch nicht-invasive VNS wurden jedoch in der Literatur ausreichend erforscht oder vollständig für den Einsatz bei der Behandlung von Fibromyalgie validiert 11,12,13,14.
Die kraniale elektrische Stimulation (CES) ist eine nicht-pharmakologische, nicht-invasive Hirnstimulationsbehandlung, die aus gepulstem, wechselndem Mikrostrom (weniger als 0,5 mA) besteht, der über transkutane Elektroden appliziert wird, die an den Ohrläppchen platziert werden15. Es ist bemerkenswert zugänglich und kann über tragbare Geräte verabreicht werden, die von Patienten in ihren eigenen Wohnräumen verwendet werden. Im Vergleich zu anderen kranialen Stimulationsmethoden erhöht die nicht-invasive Natur und die Bequemlichkeit der Selbstanwendung des Patienten zu Hause das Potenzial von CES als vorteilhafte Option für die weit verbreitete Anwendung der Fibromyalgie-Behandlung und das Selbstmanagement von Schmerzen. Es wurde von der U.S. Food and Drug Administration (FDA) zur Behandlung von Schlaflosigkeit, Depressionen, Angstzuständen und Schmerzen zugelassen15.
Die aktuelle Studie bewertet die Wirksamkeit von CES als Fibromyalgie-Behandlungsmethode, indem sie aktives CES (verabreicht von einem echten Studiengerät) mit Schein-CES (verabreicht von einem Scheinstudiengerät) vergleicht. Es gibt einige vorläufige Evidenz, die den Einsatz von CES bei der Behandlung von Schmerzzuständen wie Fibromyalgie unterstützen16,17. Eine Studie aus dem Jahr 2001 mit 60 Teilnehmern, die 3 Wochen lang täglich 60-minütige Sitzungen auf aktive oder Schein-CES randomisiert wurden, ergab eine Verbesserung der Tender-Punkte-Werte um 28 %, eine Verbesserung der allgemeinen Schmerzwerte um 27 % und keinen Placebo-Effekt18. CES wurde weder in einer Veteranenpopulation noch bei Männern mit Fibromyalgie angemessen untersucht. Eine von Veterans Affairs (VA) finanzierte systematische Überprüfung von CES, die 2018 veröffentlicht wurde, kam zu dem Schluss, dass die Evidenz für CES nicht ausreicht, um klinisch wichtige Auswirkungen auf Fibromyalgie zu haben, da die meisten Studien kleine Stichprobengrößen, kurze Dauer und ein hohes Risiko für Verzerrungen aufgrund unzureichender Verblindung aufwiesen. Die Überprüfung deutet jedoch darauf hin, dass CES keine schwerwiegenden Nebenwirkungen verursacht, und es gibt wenig aussagekräftige Evidenz, die auf einen bescheidenen Nutzen bei Patienten mit Angstzuständen und Depressionen hindeutet19. Daher ist weitere Forschung in Bezug auf die Verwendung dieses von der FDA zugelassenen Produkts mit geringem Risiko gerechtfertigt, insbesondere bei Fibromyalgie.
Um die Wirksamkeit vollständig zu bewerten, bewerteten die Forscher die körperliche Fitness zusammen mit neuronalen Biomarkern und Schmerzerfahrungen. Der Zweck der Behandlung chronischer Schmerzzustände besteht darin, die körperliche Funktion zu verbessern. Fibromyalgie ist durchweg mit negativen Auswirkungen sowohl auf die körperliche Funktion als auch auf die Wahrnehmung der eigenen körperlichen Fähigkeiten der Patienten korreliert20. Frühere Studien haben einfache körperliche Fitnessbewertungen verwendet, um Ausdauer und Mobilität zu bestimmen, wie z. B. der 6-Minuten-Gehtest (6MWT)20,21, Five Time Sit to Stand (5TSTS)20 und verschiedene Messungen der Tragfähigkeit und Kraft im Rahmen täglicher Aktivitäten22. Um Standardmessungen zu berücksichtigen und gleichzeitig den Umfang der anstrengenden Aktivitäten zu verringern, die unmittelbar vor einer MRT-Untersuchung erforderlich sind, verwendete das Studienteam den 30-Sekunden-Stuhlsitz-Stand-Test als Maß für Ausdauer und Beweglichkeit sowie sowohl Bizeps-Curls als auch einen Handgrifftest als Kraftmaß23. Die Bewegungen, die in jeder dieser Bewertungen erforderlich sind, sind im Alltag sehr verbreitet, so dass es ein klares Maß dafür ist, wie Menschen in ihrem täglichen Leben körperlich funktionieren, sowohl mit als auch ohne Behandlung.
Selbst bei subjektiven Schmerzbewertungen und Wirksamkeitsmessungen der körperlichen Funktion sind die Mechanismen des CES nicht vollständig verstanden. Frühere Neuroimaging-Studien haben versucht, die direkte Wirkung von CES auf die Netzwerkkonnektivität im Gehirn besser zu verstehen. Feusner et al.24 fanden heraus, dass CES mit einer kortikalen Deaktivierung für 0,5 Hz und 100 μA Stimulation von bilateralen frontalen, parietalen und posterioren Mittellinienregionen assoziiert ist, und postulierten, dass die Häufigkeit der Stimulation in Bezug auf die kortikale Deaktivierung einen größeren Effekt haben könnte als die aktuelle Intensität. Ihre Gruppe fand signifikante Auswirkungen auf einige, aber nicht alle Knoten des Default Mode Network (DMN). Die Autoren vermuten, dass CES auf der Grundlage dieser Daten die funktionelle Konnektivität im Ruhezustand beeinflussen kann. Es wurde gezeigt, dass Fibromyalgie und andere chronische Schmerzzustände die intrinsische Gehirnkonnektivität in Regionen beeinflussen, die mit Schmerzen und Wahrnehmung verbunden sind25,26, so dass sich Behandlungen, die die funktionelle Konnektivität als Reaktion darauf verändern, sowohl als vorteilhaft als auch als wirksam erweisen könnten. Um den therapeutischen Wirkmechanismus besser zu verstehen, ist eine weitere Erforschung der längerfristigen Auswirkungen der täglichen Behandlung in Bezug auf die klinische Verbesserung sowie der Frage, wie eine gestörte Aktivierung im Gehirn mit zuvor beobachteten Abnahmen der Elektroenzephalogrammfrequenz zusammenhängt, erforderlich27.
Die Magnetresonanztomographie (rs-fcMRT) ist die Neuroimaging-Methode, die es ermöglicht, diese funktionellen Konnektivitätsänderungen zu beobachten. Die longitudinale Ruhezustands-fMRT ermöglicht es Klinikern und Forschern, eine Ausgangsbasis für die Konnektivität im Ruhezustand zu ermitteln und Veränderungen im Laufe der Zeit als Reaktion auf CES-Behandlungsmethoden zu verfolgen. Es hilft auch zu bestimmen, wie Veränderungen in der funktionellen Konnektivität mit Unterschieden in der Schmerzerfahrung korrelieren. Erste Studien zur Neurobildgebung bei Fibromyalgie verwendeten Positronen-Emissions-Tomographie (PET) und Einzelphotonen-Emissions-Computertomographie (SPECT), um das Gehirn zu untersuchen, aber es gibt in dieser Hinsicht Probleme mit beiden Techniken: SPECT hat eine geringere Auflösung als PET, und PET-Scans sind invasiv, was für Patienten mit chronischen Schmerzen nicht vorzuziehen ist. Funktionelle Magnetresonanztomographie (fMRT) hat eine höhere Auflösung als SPECT, untersucht jedoch die Gehirnaktivität als Reaktion auf die spezifischen Aktionen oder Reizwahrnehmungen der Patienten28. Es sind rs-fcMRT-Scans, die die funktionelle Konnektivität zwischen Regionen des Gehirns skizzieren und möglicherweise bestimmen können, wo und wie Fibromyalgie existiert, sowie die besten Behandlungsmethoden28.
Die Bewertung der Wirksamkeit nicht-pharmakologischer Behandlungen für Schmerzzustände wie Fibromyalgie ist sowohl im aktuellen Umfeld der Opioid-Epidemie als auch bei der Untersuchung chronischer Schmerzen als Risikofaktor für Selbstmord von größter Bedeutung29,30, der in der Veteranenbevölkerung erheblich erhöht ist. Darüber hinaus ist der Mangel an adäquaten klinischen Biomarkern für Schmerzen eine anerkannte Wissenslücke. Die Verwendung einer Kombination aus Verhaltensmessungen und Neuroimaging zu mehreren Zeitpunkten zur Beurteilung des Ansprechens auf die Behandlung ist ein neuartiger Ansatz zur Bewertung von Fibromyalgie, ebenso wie die Verwendung von aurikulärem CES als Behandlung.
Das Protokoll zielt darauf ab, die Lücke in der Fibromyalgie-Forschung zu schließen, indem die Auswirkungen von CES auf Schmerzen und körperliche Funktionsergebnisse untersucht und die Neurobildgebung als Instrument für prädiktive und ansprechende Biomarker im Zusammenhang mit den klinischen Ergebnissen der CES-Therapie bewertetwird 31.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die Studie wurde unter Genehmigung der Emory University (IRB 112768) und des Atlanta VA Institutional Review Boards (1585632-2; Interne Referenznummer: 003) sowie das Atlanta VA R&D Committee (Board Reference Number: 3881). Alle Probanden gaben ihre Einverständniserklärung zur Einschluss, bevor sie an dieser Studie teilnahmen. Für eine visuelle Darstellung des Zeitplans des Studienprotokolls siehe Abbildung 1).
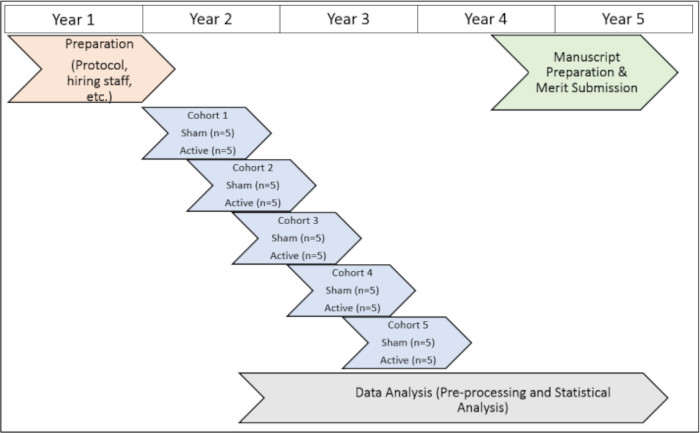
Abbildung 1: Zeitleiste der Studie. Eine visuelle Darstellung des Zeitplans für die Durchführung der Studienverfahren während des Testzeitraums. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Rekrutierung der Teilnehmer über die verfügbaren Methoden
- Befolgen Sie die erforderlichen jeweiligen institutionellen Richtlinien für die Verbreitung von Studienrekrutierungsmaterialien (Flyer, Posts, E-Mails, Anrufe usw.) und genehmigte Rekrutierungsmethoden.
HINWEIS: Die aktuelle Studie wurde über das Versenden von Rekrutierungsschreiben an bestimmte Kohorten und anschließende Telefonanrufe bei potenziellen Teilnehmern rekrutiert. Die Details zur Bestellung der CES-Geräte für die Studie sind in der ergänzenden CES-Gerätebestellanleitung (Ergänzungsdatei 1) enthalten. - Wenn jemand Interesse an einer Studienteilnahme bekundet, überprüfen Sie ihn am Telefon, um sicherzustellen, dass er alle Ein- und Ausschlusskriterien erfüllt.
- Schließen Sie Teilnehmer ein, die die Zulassungskriterien erfüllen: Alter 20-60 Jahre (Grenzwert, der während der Vorstudie festgelegt wurde, um strukturelle Veränderungen des Gehirns aufgrund des Alterns zu minimieren)31; Diagnose von Fibromyalgie durch das American College of Rheumatology 2016, Kriterium32; Rechtshändigkeit (um Konsistenz in der Struktur und Funktion des Gehirns zu gewährleisten); Schmerzwert von 4 oder höher auf der Defense and Veterans Pain Rating Scale (DVPRS)33 in den 3 Monaten vor der Einschreibung; konsistente und stabile FM-bezogene Medikation für mindestens 4 Wochen vor der Aufnahme in die Studie34; und die Fähigkeit, MRT sicher zu tolerieren.
- Füllen Sie für den Fibromyalgie-Screening-Teil das neue klinische Fibromyalgie-Diagnosekriterium32 mit dem potenziellen Teilnehmer aus, um seinen WPI-Score (Broad Pain Index) und seinen Schweregrad (SS) zu erhalten. Bewerten Sie gemäß den Richtlinien, die unten auf der Seite aufgeführt sind.
- Bitten Sie potenzielle Teilnehmer für den Teil des Schmerz-Score-Screenings, ihre durchschnittlichen, konstanten Schmerzen in den letzten 3 Monaten auf einer Skala von null bis zehn verbal zu bewerten.
- Füllen Sie für den MRT-Screening-Teil ein MRT-Sicherheitsscreening-Formular mit dem potenziellen Teilnehmer aus, das von einer Institution oder der Scannereinrichtung selbst bereitgestellt wird.
- Fragen Sie die Teilnehmer nach allen möglichen Ausschlusskriterien. Zu den Ausschlusskriterien gehören Anfälle oder neurologische Erkrankungen in der Vorgeschichte, die das Gehirn verändern; Schwangerschaft; Klaustrophobie, MRT-inkompatible Implantate oder andere Erkrankungen, die mit der MRT nicht vereinbar sind; und eine Vorgeschichte von unkontrollierten psychiatrischen Erkrankungen oder Autoimmunerkrankungen, die zu Schmerzen führen und die Symptome besser erklären können31.
- Wenn eines der Ausschlusskriterien auf sie zutrifft, fallen sie beim Screening durch. Nehmen Sie sie nicht in die Studie auf.
- Schließen Sie Teilnehmer ein, die die Zulassungskriterien erfüllen: Alter 20-60 Jahre (Grenzwert, der während der Vorstudie festgelegt wurde, um strukturelle Veränderungen des Gehirns aufgrund des Alterns zu minimieren)31; Diagnose von Fibromyalgie durch das American College of Rheumatology 2016, Kriterium32; Rechtshändigkeit (um Konsistenz in der Struktur und Funktion des Gehirns zu gewährleisten); Schmerzwert von 4 oder höher auf der Defense and Veterans Pain Rating Scale (DVPRS)33 in den 3 Monaten vor der Einschreibung; konsistente und stabile FM-bezogene Medikation für mindestens 4 Wochen vor der Aufnahme in die Studie34; und die Fähigkeit, MRT sicher zu tolerieren.
- Wenn jemand das Screening besteht, planen Sie ihn für seinen Einverständnistermin und den MRT-Basisscan ein. Planen Sie 2 Stunden für die Einwilligungs- und Scanzeit ein.
2. Durchführung von Studienterminen zu Studienbeginn, während und nach der Teilnahme (siehe Tabelle 1)
HINWEIS: Alle Termine finden am Standort des MRT-Scanners statt.
| Zeit | Forschungstätigkeit | |
| Phase 1 | Woche 1 | Rekrutierung, Screening, Einschreibung |
| Phase 2 | Woche 2–3 | Baseline-Assessments, rs-fcMRT |
| Phase 3 | Wochen 2–14 | Eingriff |
| Phase 4 | Woche 6–10 | Akute Nachsorge, rs-fcMRT (6 Wochen nach Behandlungsbeginn) |
| Phase 5 | Woche 12–16 | Langzeit-Follow-up, rs-fcMRT (12 Wochen nach Behandlungsbeginn) |
Tabelle 1: Forschungsdesign. Eine Zeitleiste der Phasen der individuellen Teilnahme über die 12 Wochen der Studie.
- Bereiten Sie vor jedem Basisbesuch ein CES-Gerät vor, das Sie jedem Teilnehmer mitbringen können.
- Öffnen Sie das Gehäuse, um sicherzustellen, dass sich das Gerät darin befindet (es sollte in Luftpolsterfolie sein). Entfernen Sie die Rückseite des Geräts und legen Sie zwei AAA-Batterien ein.
- Setzen Sie das Gerät wieder ein. Schalten Sie das Gerät ein, um sicherzustellen, dass es funktioniert, bevor Sie es dem Teilnehmer übergeben. Halten Sie die obere Taste etwa 2 Sekunden lang gedrückt, bis der Bildschirm aufleuchtet, um sie einzuschalten, und halten Sie sie etwa 2 Sekunden lang gedrückt, bis der Bildschirm leer wird, um sie auszuschalten.
- Stellen Sie sicher, dass jede Hülle das Gerät, zusätzliche Batterien, ein Schlüsselband, einen kleinen Lösungsapplikator und Ohrclips enthält. Stellen Sie sicher, dass die Tasche, die Sie den Teilnehmern geben, das Gerätegehäuse, eine Flasche mit leitender Lösung, eine zusätzliche Kappe zum Befüllen des kleinen Lösungsapplikators und zusätzliche Ohrclip-Elektrodenpads enthält.
- Sobald die Einwilligung und der MRT-Basisscan geplant wurden, treffen Sie den Teilnehmer am Standort des MRT-Scanners für den Termin mit zwei Kopien der Einverständniserklärung, einem CES-Gerät und seinen Materialien, Unterlagen für die Eignungstests und einem Fragebogenpaket, das er ausfüllen muss. Bringen Sie zusätzlich das Datenübertragungsgerät mit, über das die MRT-Daten an die Analysestelle übertragen werden.
HINWEIS: In dieser Studie wurde ein verschlüsseltes USB-Laufwerk verwendet.- Zu den Zulassungsunterlagen gehören das neue klinische Fibromyalgie-Diagnosekriterium32 und das DVPRS33.
HINWEIS: Die DVPRS sollte bei jedem Besuch enthalten sein. - Fügen Sie für die physischen Funktionstests ein Formular bei, in dem die Ergebnisse der einzelnen Testsaufgezeichnet werden können 20,21,35.
- In die Fragebögen, die die Teilnehmer ausfüllen werden, sind die entsprechenden PROMIS-Messungen anzugeben (PROMIS Scale v1.2 - Global Health, Neuro-QOL Item Bank v2.0 - Cognition Function - Short Form, PROMIS Item Bank v1.0 - Substance Use/Alcohol: Alcohol, PROMIS Item Bank v1.0 - Emotional Distress - Anxiety - Short Form 7a, PROMIS Item Bank v1.0 - Emotional Distress-Depression - Short Form 4a, PROMIS Item Bank v1.0 - Fatigue - Short Form 6a, PROMIS Item Bank v1.0 - Schmerzstörung - Kurzform 4a, PROMIS Item Bank v1.2 - Physische Funktion - Kurzform 8b, PROMIS Item Bank v2.0 - Soziale Isolation - Kurzform 4a)36.
- Zu den Zulassungsunterlagen gehören das neue klinische Fibromyalgie-Diagnosekriterium32 und das DVPRS33.
- Führen Sie am MRT-Standort den Baseline-Besuch durch. Rufen Sie den Teilnehmer im Voraus an, um dies zu bestätigen.
- Lesen Sie die vollständige Einverständniserklärung mit dem Teilnehmer durch, um sicherzustellen, dass er die Informationen verstanden hat. Fragen Sie sie, ob sie teilnehmen möchten, und wenn sie einverstanden sind, lassen Sie sie ihren Namen ausdrucken, das Formular unterschreiben und datieren.
- Wenn sich der Teilnehmer nach der Einwilligung für die Teilnahme an der Studie entscheidet, füllen Sie mit ihm die Unterlagen für die Einschlusstests aus. Wenn sie berechtigt sind, fortzufahren, führen Sie die folgenden Schritte aus. Wenn sie nicht teilnahmeberechtigt sind, beenden Sie ihre Studienteilnahme zu diesem Zeitpunkt.
- Stellen Sie sicher, dass die Unterlagen für die Eignungsprüfung die neuen klinischen Diagnosekriterien für Fibromyalgie und die DVPRS enthalten.
- Wenn ein Teilnehmer nach dem Inklusionstest berechtigt ist, erklären Sie ihm, wie das CES-Gerät zu verwenden ist.
- Nehmen Sie das Gerät aus der Hülle und zeigen Sie den Teilnehmern, wie sie es mit der Taste oben ein- und ausschalten können. Erinnern Sie die Teilnehmer daran, dass sich das Gerät nach Ablauf von 60 Minuten automatisch deaktiviert.
- Zeigen Sie den Teilnehmern, wie sie das Ohrclip-Kabel an der Seite befestigen. Das gegenüberliegende Ende des Kabels von den Clips wird in ein kleines Loch auf der linken Seite des Geräts gesteckt, das mit einer "1" gekennzeichnet ist.
- Zeigen Sie, wie Sie die alten Elektrodenpads von den Ohrclips entfernen und neue anbringen. Um alte Pads zu entfernen, ziehen Sie den Kleber an der Stelle, an der er mit den Clips verbunden ist, nach oben. Um neue Pads anzubringen, richten Sie das Loch in den Ersatzelektrodenpads an der erhabenen Stelle in der Mitte des Clips aus und drücken Sie es fest nach unten.
HINWEIS: Ziehen Sie die Elektrodenpads nicht an der weichen Stelle an der Oberseite. Es neigt zum Reißen und lässt den Kleber an den Clips kleben. - Zeigen Sie, wie Sie die Ohrclips an ihren Ohrläppchen befestigen und lassen Sie sie es einmal ausprobieren. Drücken Sie die grünen Spitzen des Clips zusammen, um ihn zu öffnen, positionieren Sie das Ohrläppchen dazwischen und schließen Sie den Clip vorsichtig, um ihn zu befestigen.
- Zeigen Sie ihnen, wie sie den Kunststoffdeckel vom kleinen Lösungsapplikator entfernen und ihn mit der Lösung aus der größeren Flasche füllen (siehe Schritte 2.3.3.6-2.3.3.8). Erinnern Sie sie daran, dass die Lösung notwendig ist, damit das Gerät ordnungsgemäß funktioniert.
- Um die Oberseite des Applikators für die kleine Lösung zu entfernen, entfernen Sie die Kappe und drücken Sie fest gegen die Seite der Spitze. Die Plastikspitze löst sich vom Rest der Flasche.
- Befestigen Sie die alternative Kappe zum Befüllen des kleinen Applikators oben an der Oberseite der größeren Lösungsflasche. Schieben Sie die kleine Düse nach oben, schieben Sie sie in den kleinen Applikator und drücken Sie die große Flasche zum Befüllen zusammen.
- Sagen Sie den Teilnehmern, dass sie nur etwa 1-2 Tropfen der Lösung auf jedes Ohrclip-Elektrodenpad geben sollten. Überschüssige Lösung sollte vor der Anwendung abgetupft werden.
- Weisen Sie die Teilnehmer an, das Gerät jeden Tag der Woche für 60 Minuten abends, ca. 1 Stunde vor dem Schlafengehen, zu benutzen. Weisen Sie die Teilnehmer an, das Gerät in Ruhe zu benutzen (d.h. still sitzen oder liegen, sich nicht bewegen).
HINWEIS: Sowohl für die Zeit als auch für die Position wurden den Teilnehmern normale Variationen in ihrer häuslichen Nutzungsumgebung erlaubt, um den praktischen Charakter dieser Therapie für den Heimgebrauch zu erhöhen. Es wurden keine Parameter für den in der Umgebung zulässigen Klang oder den erforderlichen Gerätespeicher festgelegt. - Geben Sie den Teilnehmern ein leeres Geräteprotokoll und erklären Sie, dass sie jedes Datum der Gerätenutzung, ihren Schmerzwert vor und nach der Gerätenutzung und den Zeitpunkt der Gerätenutzung eingeben müssen.
- Wenn die Teilnehmer in den 6 Wochen zwischen den Terminen für einen bestimmten Zeitraum nicht in der Lage sind, ihr Gerät zu benutzen, aber die Nachsorgetermine wahrnehmen können, lassen Sie sie in der Studie bleiben. Wenn sie nicht in der Lage sind, das Gerät zu benutzen oder es nicht zu den Studienbesuchen zu schaffen, beenden Sie ihre Teilnahme. Im ergänzenden CES-Geräteprotokoll (Ergänzende Datei 2) finden Sie das in dieser Studie verwendete Geräteprotokoll.
HINWEIS: Die folgenden Schritte werden bei allen drei Besuchen wiederholt.
- Lassen Sie den Teilnehmer nach der Geräteerklärung drei kurze körperliche Funktionstests absolvieren23. Für jeden Test wird eine maximale Anzahl für die Punktzahl aufgezeichnet (Gesamtzahl der Wiederholungen für die ersten beiden und Kraft pro Versuch für den dritten).
HINWEIS: Die für diese Studie verwendete Stoppuhr war ein Apple iPhone 12.- Verabreichen Sie den 30 s Stuhl Sitzstand-Test. Führen Sie die Schritte 2.3.4.2-2.3.4.6 aus.
- Stellen Sie einen Stuhl mit dem Rücken an die Wand des Testraums. Lassen Sie den Teilnehmer mit dem Rücken gegen die Stuhllehne auf dem Stuhl sitzen.
- Weisen Sie den Teilnehmer an, sich in eine volle stehende Position zu erheben und sich dann so oft wie möglich in 30 Sekunden mit dem Rücken gegen die Stuhllehne zu setzen.
HINWEIS: Wenn sie auf den Stuhl klopfen, aber ihr Gewicht im Sitzen nicht wieder vollständig auf ihn verlagern, zählt die Wiederholung nicht. - Sagen Sie den Teilnehmern, wann sie anfangen sollen. Starten Sie den Timer, wenn sie sich in Bewegung setzen.
- Lassen Sie die Teilnehmer mit einer Hantel auf jeder Seite 30 Sekunden lang pro Seite Armbeuger machen. Beginnen Sie zuerst mit dem rechten Arm und bewegen Sie sich dann nach links.
- Notieren Sie die Gesamtzahl der Locken pro Seite. Verwenden Sie ein 5-Pfund-Gewicht für Frauen und ein 8-Pfund-Gewicht für Männer. Stellen Sie sicher, dass die Teilnehmer für den Armbeugetest Platz nehmen.
- Lassen Sie die Teilnehmer drei Griffkrafttests mit jedem Arm auf einem Prüfstand durchführen. Führen Sie die Schritte 2.3.4.8-2.3.4.11 aus. Beginnen Sie zuerst mit dem rechten Arm und bewegen Sie sich dann nach links.
- Legen Sie den Prüfstand in die Hand des Teilnehmers. Sie sollten den Griff unten zusammendrücken und das Zifferblatt oben nicht berühren.
- Sagen Sie den Teilnehmern, dass sie den Prüfstand so fest wie möglich zusammendrücken und dann loslassen sollen. Die Nadel auf dem Zifferblatt stoppt bei der höchsten Griffstärke, die sie angezeigt haben.
- Notieren Sie die Ergebnisse der Griffstärke, indem Sie die Zahl, die die Nadel erreicht, auf dem Zifferblatt notieren. Setze das Zifferblatt zwischen den Wiederholungen zurück, indem du den kleinen Knopf an der Vorderseite des Zifferblatts gegen den Uhrzeigersinn drehst, bis die Nadel auf Null steht.
- Stellen Sie sicher, dass die Teilnehmer für den Handgrifftest Platz genommen haben.
HINWEIS: Zwischen den einzelnen Serien erhalten die Teilnehmer etwa 15-20 Sekunden Ruhe, während sie die Ausrüstung in die andere Hand wechseln. Zwischen jedem Test erhalten die Teilnehmer etwa 2 Minuten Ruhe, während die Ausrüstung und der Papierkram für den nächsten vorbereitet werden.
- Lassen Sie die Teilnehmer nach den körperlichen Funktionstests das Fragebogenpaket mit einem Stift ausfüllen. Überprüfen Sie anschließend die Packung, um sicherzustellen, dass sie alle Fragen beantwortet haben.
- Nachdem alle Überprüfungen, Tests und Fragebögen abgeschlossen sind, führen Sie die Teilnehmer zum MRT-Scanner selbst (alle Informationen zum MRT-Protokoll finden Sie in Abschnitt 3). Überprüfen Sie das Screening-Formular mit den MRT-Technikern und stellen Sie sicher, dass die Teilnehmer alle Metalle von ihrer Person entfernt haben.
- Stellen Sie sicher, dass die Mitglieder des Studienteams kein Metall an ihren Personen haben.
- Helfen Sie MRT-Technikern, die Teilnehmer bequem in den Scanner zu bringen. Verwalten Sie das MRT-Scan-Protokoll.
- Weisen Sie die Teilnehmer in die Sicherheitsverfahren ein (Testanruftaste und Lautsprecher).
- Erinnern Sie die Teilnehmer daran, sich während des Scans überhaupt nicht zu bewegen.
- Erinnern Sie die Teilnehmer an die Gesamtdauer des Scans, die 60 Minuten betragen sollte.
- Wenn der Scan abgeschlossen ist, helfen Sie den Teilnehmern aus dem Scanner.
- Beenden Sie nach dem Scan den Basisbesuch der Teilnehmer und planen Sie ihren Zwischenbesuch auf 6 Wochen später. Die Teilnehmer haben insgesamt drei Studienbesuche im Abstand von jeweils 6 Wochen. Übertragen Sie MRT-Daten zur Analyse an die sicheren Server der Studie.
- Führen Sie am geplanten Tag den Mid-Visit gemäß den Schritten des Baseline-Besuchs durch. Rufen Sie den Teilnehmer im Voraus an, um dies zu bestätigen.
- Verwalten Sie das DVPRS. Bitten Sie die Teilnehmer, ihr erstes abgeschlossenes Geräteprotokoll zurückzugeben, und stellen Sie ihnen ein zweites Geräteprotokoll zur Verfügung.
- Führen Sie die Schritte 2.3.4 bis 2.3.6 aus (wie beim Basisbesuch).
- Beenden Sie den Besuch der Teilnehmer während des Besuchs und planen Sie ihren Nachbesuch auf 6 Wochen später. Übertragen Sie MRT-Daten zur Analyse an die sicheren Server der Studie.
- Führen Sie am geplanten Tag den Nachbesuch durch, indem Sie die Schritte des mittleren Besuchs befolgen. Rufen Sie den Teilnehmer im Voraus an, um dies zu bestätigen.
- Verwalten Sie das DVPRS. Lassen Sie die Teilnehmer ihr zweites abgeschlossenes Geräteprotokoll zurückgeben.
- Führen Sie die Schritte 2.3.4 bis 2.3.6 aus (wie bei den Baseline- und Mid-Visits). Für den letzten Besuch ist keine zusätzliche Besuchsplanung erforderlich.
- Wenn Informationen benötigt werden, um die Teilnehmer zu entschädigen, bereiten Sie diese Informationen vor und fordern Sie sie bei diesem Besuch an.
HINWEIS: Für diese Studie waren deren Name und Adresse erforderlich, um Schecks von der VA von Atlanta für Entschädigung auszustellen. - Beenden Sie den Nachbesuch der Teilnehmer. Übertragen Sie MRT-Daten zur Analyse an die sicheren Server der Studie.
HINWEIS: Achten Sie während der gesamten Studie darauf, die Teilnehmer zwischen den Besuchen anzurufen und sich bei ihnen zu melden, um sicherzustellen, dass sie das Gerät verwenden, die Geräteprotokolle ausfüllen und wissen, wann ihr nächster Besuch sein wird.
3. Einrichten von MRT-Scan-Protokollen
- Für das MRT-Scan-Protokoll erfassen Sie BOLD rs-fMRT auf einem 3T-MRT-Scanner mit einer 32-Kanal-Phased-Array-Kopfspule unter Verwendung einer EPI-Sequenz (Gradient Echoplanar Imaging). Verwenden Sie die folgenden MR-Parameter: FOV (Field of View)= 220 mm2; TR (Wiederholzeit)/TE (Echozeit) = 1500/25 ms, Multiband-Beschleunigungsfaktor = 3; Flip-Winkel = 50°; 110 x 110 Matrixgröße; Dicke der Scheibe = 2 mm; GRAPPA-Faktor = 2; Partieller Fourier von 6/8; 34 Phasenkodierungsreferenzlinien, 72 verschachtelte axiale Schnitte, die das gesamte Gehirn abdecken, etwa 350 Scanvolumen, um 8 Minuten fMRT-Daten im Ruhezustand für eine stabile Schätzung von Konnektivitätsnetzwerken zu erhalten.
- Im Protokoll für das anatomische T1w-Magnetisierungspräpariertes Rapid Gradient Echo (MPRAGE) ist TR = 2530 ms, TE = 3 ms, Flip-Winkel = 7°, Schichtdicke = 0,8 mm, 1 mm Phasenauflösung eingestellt. Die T1w-Erfassung dauert ca. 6 min.
- Erfassen Sie diffusionsgewichtete Bildgebungsscans (DWI) auf einem 3T-MRT-Scanner mit einer 32-Kanal-Phased-Array-Kopfspule unter Verwendung eines Diffusionsspektrum-Bildgebungsschemas. Erfassen Sie insgesamt 129 Diffusionsabtastrichtungen mit einem maximalen b-Wert von 3000 s/mm2, einer Auflösung in der Ebene von 2 x 2 mm2 und einer Schichtdicke von 2 mm.
- Erfassen Sie physiologische Daten (kardiorespiratorische Daten unter Verwendung eines Atemmonitorgurts und einer Pulsoximetrie) gleichzeitig (zeitgebunden) mit den fMRT-Daten.
- Übertragen Sie die MRT-Daten sicher vom Scannerstandort an einen sicheren Ort zur Vorverarbeitung und Analyse. Konvertieren Sie DICOMS in NIFTIs, um der BIDS-Formatierung mit dc2bids v2.1.6 zu entsprechen.
- Bereinigen Sie die Daten einzelner Identifikatoren. Verwenden Sie auf allen Daten gegebenenfalls eine Probandennummer. Führen Sie eine Qualitätsprüfung durch, um sicherzustellen, dass keine anomalen Artefakte, wie z. B. übermäßige Bewegungen, in den Daten über MRIQC v21.0.0 aufgetreten sind.
4. Vorverarbeitung und Analysen
- Sobald die MRT-Daten aus der Studie eingegangen sind, verwenden Sie zwei separate Pipelines, um sie zu analysieren: eine zur Analyse der funktionellen Konnektivität zwischen den Teilnehmern und eine andere zur Analyse der Traktographie der weißen Substanz.
- Vorverarbeitung der strukturellen T1w- und rsfMRT-Daten der Probanden über fMRIPrep v20.2.5, einschließlich Hirnextraktion, Gewebesegmentierung und Normalisierung der T1-gewichteten (T1w) Bilder sowie Schätzung des Referenzvolumens, der Schätzung der Kopfbewegung, der Korrektur des Schichtzeitplans und der Registrierung im T1w für die funktionellen Bilder. Dieser Prozess führt dazu, dass die T1w- und rsfMRT-Daten in den MNI152NLin2009cAsym-Raum normalisiert werden.
- Verwenden Sie die vorverarbeiteten MRT-Daten in der funktionalen Konnektivitätsanalyse (CONN).
- Siehe das ergänzende fMRIPrep Boilerplate-Dokument (Ergänzende Datei 337-56). Weitere Informationen finden Sie unter dem Link: https://fmriprep.org/en/stable/
- Importieren Sie den vorverarbeiteten Datensatz zur weiteren Verarbeitung in die CONN Toolbox v22a.
HINWEIS: Die CONN Toolbox wurde während dieser Studie von v21a auf v22a aktualisiert.- Legen Sie in der Einrichtungsphase Kovariaten der 2. Ebene fest, um die Studiengruppen (TRUE vs. SHAM) für die spätere Analyse zu definieren und die Qualität der T1w- und rsfMRT-Bilder sicherzustellen. Glatte fMRT-Daten über einen 8 mm Gaußschen Kern.
- Entrauschen Sie die Daten nach der Vorverarbeitung, um externes und physiologisches Rauschen zu entfernen.
HINWEIS: In dieser Studie wurde die Analyse der ersten Ebene berechnet, aber nicht ausgewertet oder verwendet, da die Forscher nicht an Ergebnissen mit einzelnen Probanden interessiert sind. - Wählen Sie Seeds/ROIs und Subjektkovariaten und legen Sie Kontraste fest. Führen Sie eine Seed-to-Voxel-Analyse auf Gruppenebene durch.
- Nachdem die Einrichtungs-, Vorverarbeitungs- und Rauschunterdrückungsschritte für die Pipelines abgeschlossen sind, legen Sie die Cluster- und Voxelschwellenwerte fest, um Konnektivitätsmuster anzuzeigen.
- Siehe Ergänzende Abbildung 1 und das ergänzende Dokument CES CONN Instructions (Supplementary File 4).
- Verwenden Sie die Korrelationstraktographie57 Bestimmung von longitudinalen Veränderungen der Integrität der weißen Substanz, korreliert mit der Versuchsgruppe, um Traktbündel und Regionen zu identifizieren, die mit der CES-Behandlung assoziiert sind. Im Folgenden sind die wichtigsten Analyseschritte aufgeführt:
- Konvertieren Sie die DWI-Rohbilder aus .dcm (DICOM) in das .nii.gz-Format (NIfTI).
- Die Bilder werden vorbearbeitet, um durch Suszeptibilität induzierte Verzerrungen mit dem TOPUP58,59 von FSL (Version 6.0.6) und mit dem EDDY-Tool60 von FSL um Wirbelstromverzerrungen zu korrigieren.
- Generieren Sie DWI-Metriken zur Bildqualitätskontrolle (QC) in Bezug auf Bewegungen auf der Ebene einzelner Probanden und Studien mit den EDDY-QC-Tools von FSL.
- Führen Sie eine bidirektionale ANOVA mit wiederholten Messungen für diese QC-Metriken durch, um Abweichungen zwischen den Gruppen zu identifizieren, die die Ergebnisse der Gruppentraktographie verwirren könnten. Wenn eine Metrik eine signifikante Varianz zwischen den Gruppen aufweist (p > 0,05), sollte sie in der Korrelationstraktographie-Analyse als Kovariate berücksichtigt werden.
- Importieren Sie die vorverarbeiteten Daten in DSI Studio (Version "Chen", 21. November 2022), wo sie in .src-Dateien (Quelldateien) konvertiert werden. Weitere Informationen zu DSI Studio finden Sie auf der Website der Software (https://dsi-studio.labsolver.org).
- Rekonstruieren Sie die importierten Diffusionsdaten mit der Q-Space Diffeomorphic Reconstruction (QSDR)61 , um die Faserorientierungen der weißen Substanz im MNI-Template-Raum zu bestimmen. Für jedes Bild wird eine .fib-Datei (Faserausrichtung) ausgegeben. Die Optionsauswahl für die Rekonstruktion ist:
Methode (Auswahl der Rekonstruktionsmethode) - QSDR
param0 (Länge der Diffusionsabtastung) - 1,25 (dies ist die Standardeinstellung)
Vorlage (in welchen Vorlagenbereich Daten rekonstruiert werden sollen) - ICBM152
align_acpc (ob das Bildvolumen gedreht werden soll, um den AC-PC auszurichten) - 0 (falsch) - Erstellen Sie aus diesen .fib-Dateien eine Konnektometriedatenbank, die die quantitativen Anisotropiewerte (QA) aus den rekonstruierten Diffusionsdaten extrahiert. Berechnen Sie die longitudinale Veränderung der Qualitätssicherung für jedes Subjekt in der Datenbank. Fügen Sie der Datenbank demografische Daten wie Versuchsgruppe, Alter, Geschlecht sowie alle im QC-Schritt identifizierten Kovariaten über eine .csv-Datei hinzu.
- Laden Sie als Nächstes die Konnektometrie-Datenbank in die Group Connectometry Analysis GUI.
- Wählen Sie Kovariaten aus, die in der Analyse berücksichtigt werden sollen. Eine dieser ausgewählten Kovariaten wird als Variable "Studie" bezeichnet.
- Wählen Sie für diese Analyse Gruppe als Studienvariable aus. Trakte mit longitudinalen Veränderungen in der QA, die mit der Gruppe korreliert sind, werden identifiziert, während der Effekt der anderen ausgewählten Kovariaten regressiert wird.
- Die Optionsauswahl für die Gruppenkonnektometrie-Analyse lautet:
- FDR-Kontrolle (Grenzwert für die False-Discovery-Rate, es werden nur Bezirke mit einer signifikanten Korrelation unterhalb von FDR ausgegeben) - 0,05
- Längenschwellenwert (Wert in Voxeln der minimalen Traktlänge, der als Nullhypothese verwendet wird) - 20 Voxel (oder 40 mm für 2 mm Voxelgrößen)
- T-Schwellenwert (t-stat-Messschwelle für Korrelationseffekt) - 2,5
- Studienregion (in diesem Bereich können Regionen in die Analyse einbezogen/ausgeschlossen werden) - Wählen Sie Gesamtes Gehirn mit - Kleinhirn ausschließen aktiviert
HINWEIS: Für diese Studie wurde das Kleinhirn ausgeschlossen, da bei einigen der Diffusionsscans Teile des Kleinhirns während der Aufnahme abgeschnitten wurden.
- Klicken Sie auf die Schaltfläche Connect Connect ausführen , um die Analyse durchzuführen, die mehrere Dateien ausgibt:
- Eine .fib-Datei, in der die t-stats gespeichert sind und die in DSI Studio geöffnet werden kann, um die t-stats von Trakten mit steigender QA (gespeichert als "inc_t") oder abnehmender QA (gespeichert als "dec_t") zu visualisieren, die mit der Gruppe korrelieren.
- Ein .fdr_dist.values.txt, der die FDR-Werte in Bezug auf die Länge des Trakts auflistet
- Eine .inc.tt.gz bei der es sich um eine Traktographiedatei handelt, in der die Trakte mit erhöhter longitudinaler QA gespeichert sind, die mit der Studienvariablen korreliert sind. (Gruppe in unserem Fall). In einer .dec.tt.gz-Datei werden die Trakte mit verminderter longitudinaler QA gespeichert, die mit der Studienvariablen korreliert sind.
- Eine .report.html Datei, in der die Konnektometrieergebnisse zusammen mit eingebetteten Traktdiagrammen, Bildern sowie den Standardinformationen zu den Schritten der Korrelationstraktographie-Analyse zur Veröffentlichung bequem angezeigt werden.
HINWEIS: Beispiele für den für diese Studie verwendeten R-Code finden Sie in den ergänzenden CES R Code Plots (Ergänzende Datei 5) und die ergänzenden R Code CES eddy-qc Anova-Dateien (Ergänzende Datei 6).
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
In Bezug auf die Rekrutierungsergebnisse wurden die Teilnehmer in erster Linie durch das Versenden von Rekrutierungsschreiben und Nachverfolgungsanrufe auf der Grundlage der dargelegten Vorschriften des Atlanta VA Healthcare System rekrutiert. Das Studienteam rekrutierte insgesamt 50 Teilnehmer, was die Wirksamkeit der verwendeten Methoden zur Erreichung des Rekrutierungsziels belegt (siehe Abbildung 2). Die Verwendung der neuen diagnostischen Kriterien für ...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Methoden der vorliegenden Studie bieten nicht nur die Möglichkeit einer hochwirksamen Behandlungsmethode für Fibromyalgie, sondern auch die Möglichkeit, den diagnostischen Prozess der Fibromyalgie bereits ab dem ersten Auftreten ihres Schmerzsymptomprofils zu verbessern. Die Verwendung sowohl des aktiven CES als auch des Schein-CES, wobei die Entdeckung des Typs jedes einzelnen Produkts von Seriennummern und einem separaten Schlüssel abhängig war, ermöglichte die Verblindung sowohl der Probanden als auch der Fo...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass ihnen keine konkurrierenden finanziellen Interessen oder persönlichen Beziehungen bekannt sind, die die in diesem Artikel berichtete Arbeit beeinflusst haben könnten. Die in diesem Artikel geäußerten Ansichten sind die der Autoren und spiegeln nicht unbedingt die Position oder Politik des Ministeriums für Veteranenangelegenheiten oder der Regierung der Vereinigten Staaten wider.
Danksagungen
Die Autoren möchten sich für die Unterstützung der Forscher des Zentrums für visuelle und neurokognitive Rehabilitation, einschließlich Dr. Bruce Crosson und Dr. Lisa Krishnamurthy, für ihren Beitrag zu der Arbeit bedanken. Die Autoren danken auch Grace Ingham für ihre unschätzbare Hilfe bei den Dreharbeiten. Diese Arbeit wurde teilweise durch den United States Department of Veterans Affairs Rehabilitation Research and Development Service, den Career Development Award IK2 RX003227 (Anna Woodbury) und den Center Grant 5I50RX002358 unterstützt. Der Geldgeber spielt keine Rolle bei der Studienplanung, der Datenerfassung, dem Management, der Analyse, der Interpretation oder der Berichterstattung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
Referenzen
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , Department of Veterans Affairs. (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97(2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446(2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95(2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , https://alpha-stim.com/blog/nbc4-washington-electrotherapy-device-treats-anxiety-insomnia-depression/ (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68(2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425(2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436(2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , Mineral Wells. Texas. (2016).
- Lein, D. H. Jr, Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350(2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102(2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76(1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13(2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14(2014).
- Yeh, F. -C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -C., Tseng, W. -Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , Hilbert Press. Boston, MA. (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198(2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123(2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , Hilbert Press. Boston, MA. (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , Hilbert Press. Boston, MA. (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten