Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo aleatorizado y controlado simulado de estimulación eléctrica craneal para el dolor y la función física de la fibromialgia, en el que se utilizaron biomarcadores de imágenes cerebrales
En este artículo
Resumen
El estudio actual es un ensayo aleatorizado controlado con placebo para determinar la eficacia de la estimulación eléctrica craneal (CES) para mejorar el dolor y la función en la fibromialgia y desarrollar aún más la resonancia magnética de conectividad funcional en reposo (rs-fcMRI) como herramienta clínica para evaluar los correlatos neurales y los mecanismos del dolor crónico y la respuesta analgésica.
Resumen
La fibromialgia es un síndrome de dolor crónico que se presenta con una constelación de síntomas amplios, que incluyen disminución de la función física, fatiga, alteraciones cognitivas y otras quejas somáticas. Las terapias disponibles a menudo son insuficientes para tratar los síntomas, y el control inadecuado del dolor suele conducir al uso de opioides para intentar tratarlo. La estimulación eléctrica craneal (CES) es una opción de tratamiento no farmacológico prometedora para las condiciones de dolor que utiliza la estimulación de corriente eléctrica pulsada para modificar la función cerebral a través de electrodos transcutáneos. Estos mecanismos neuronales y las aplicaciones de CES en el alivio de los síntomas de la fibromialgia requieren una mayor exploración.
Un total de 50 participantes del Sistema de Atención Médica de Asuntos de Veteranos de Atlanta (VAHCS, por sus siglas en inglés) diagnosticados con fibromialgia fueron inscritos y luego asignados al azar en bloques a un grupo de placebo más terapia estándar o a un grupo activo de CES más terapia estándar. Las evaluaciones basales se obtuvieron antes del inicio del tratamiento. Ambas intervenciones ocurrieron durante 12 semanas, y los participantes fueron evaluados a las 6 semanas y 12 semanas después del inicio del tratamiento. El resultado primario investigó si el dolor y las mejorías funcionales ocurren con la aplicación de CES. Además, se obtuvieron imágenes de resonancia magnética de conectividad funcional en estado de reposo (rs-fcMRI) de referencia y seguimiento en los puntos de tiempo de 6 y 12 semanas para evaluar las aplicaciones clínicas de los biomarcadores de conectividad neuronal y las asociaciones neuronales subyacentes relacionadas con los efectos del tratamiento.
Se trata de un ensayo aleatorizado controlado con placebo para determinar la eficacia de CES para mejorar el dolor y la función en la fibromialgia y desarrollar aún más la rs-fcMRI como herramienta clínica para evaluar los correlatos neurales y los mecanismos del dolor crónico y la respuesta analgésica.
Introducción
De los muchos estados existentes de dolor crónico, una de las enfermedades más difíciles de diagnosticar, evaluar clínicamente y tratar es la fibromialgia. La fibromialgia es un síndrome de dolor crónico debilitante que implica dolor crónico generalizado, disminución de la función física, fatiga, trastornos psicoemocionales y del sueño, y diversas quejas somáticas que afectan aproximadamente al 2-3% de la población general en las Américas (alrededor de 8 millones de personas en los EE. UU.) 1. El diagnóstico de la enfermedad depende en gran medida de la comprensión que el paciente tenga de su propio perfil de síntomas y experiencia con el dolor, y sin esa comprensión adecuada de la enfermedad tanto por parte del clínico como del paciente, los métodos de tratamiento pierden una eficacia considerable2. Una mejor definición de los orígenes y el impacto de la fibromialgia, así como un biomarcador clínico confiable para guiar el diagnóstico y el tratamiento de la fibromialgia son necesarios para servir mejor a todos los pacientes.
Incluso con un diagnóstico confirmado, las dificultades con el proceso de tratamiento no hacen más que crecer. En general, el dolor crónico afecta a más personas que las enfermedades cardíacas, la diabetes y el cáncer combinados. La naturaleza subjetiva de su evaluación lo coloca como un impulsor principal de la epidemia de opioides, especialmente dada la dificultad para discernir el dolor físico tratado de manera incompleta del trastorno por uso de sustancias y el comportamiento de búsqueda de drogas3. En 2020, ocurrieron 91,799 muertes por sobredosis de drogas en los Estados Unidos (un aumento del 30% con respecto a 2019), y se descubrió que los opioides eran la principal causa de estas muertes (74.8% de todas las muertes por sobredosis de drogas en 2020)4. Por lo tanto, se necesitan alternativas no farmacológicas para el tratamiento del dolor crónico y la fibromialgia para frenar la epidemia de opioides, lo cual es particularmente importante en la población de veteranos donde el riesgo de suicidio y trastorno por consumo de opioides es mayor5. Por lo tanto, las terapias no farmacológicas y complementarias se utilizan a menudo como tratamientos de primera línea6.
La búsqueda de intervenciones novedosas y eficaces para la fibromialgia ha llevado a muchos investigadores y médicos a métodos de estimulación cerebral no invasiva, incluida la estimulación craneal. A pesar de que los mecanismos fisiopatológicos que resultan en el desarrollo de la enfermedad no han sido determinados definitivamente, la evidencia existente apoya la idea de que la fibromialgia es un trastorno de disfunción del sistema nervioso autónomo y mecanismos centrales de procesamiento del dolor (es decir, cerebro y médula espinal) 7,8. La estimulación de ciertas áreas del cerebro podría conducir a una mejor función en esas áreas de procesamiento. La estimulación magnética transcraneal repetitiva (EMTr) y la estimulación transcraneal de corriente directa (tDCS) se han correlacionado con reducciones en el dolor, pero también se han asociado con irritación del cuero cabelludo en el sitio de activación, dolores de cabeza e inaccesibilidad fuera de las instalaciones de tratamiento9. La estimulación no invasiva del nervio vago (ENVn), que puede proporcionar neuromodulación a través de la estimulación sobre la piel en el cuello o a nivel del oído, tiene el potencial para el tratamiento del dolor crónico, y se ha demostrado que la estimulación invasiva del nervio vago (ENV) mejora los síntomas del dolor crónico10. Sin embargo, ni la ENV invasiva ni la no invasiva han sido suficientemente exploradas en la literatura ni completamente validadas para su uso en el tratamiento de la fibromialgia 11,12,13,14.
La estimulación eléctrica craneal (CES) es un tratamiento de estimulación cerebral no farmacológico y no invasivo que consiste en una microcorriente alterna pulsada (menos de 0,5 mA) aplicada a través de electrodos transcutáneos colocados en los lóbulos de las orejas15. Es notablemente accesible y se puede administrar a través de dispositivos portátiles utilizados por los pacientes dentro de sus propios espacios vitales. En comparación con otros métodos de estimulación craneal, la naturaleza no invasiva y la conveniencia de la autoaplicación del paciente en el hogar aumentan el potencial de CES como una opción beneficiosa para el uso generalizado del tratamiento de la fibromialgia y el autocontrol del dolor. Ha sido aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) como tratamiento para el insomnio, la depresión, la ansiedady el dolor.
El presente estudio evalúa la eficacia de CES como modalidad de tratamiento de la fibromialgia comparando el CES activo (administrado por un dispositivo de estudio verdadero) frente al CES simulado (administrado por un dispositivo de estudio simulado). Existen algunas evidencias preliminares que apoyan el uso de CES en el tratamiento de condiciones dolorosas como la fibromialgia16,17. Un estudio de 2001 de 60 participantes asignados aleatoriamente a CES activo o simulado durante 3 semanas de sesiones diarias de 60 minutos reveló una mejora del 28% en las puntuaciones de puntos sensibles, una mejora del 27% en las puntuaciones generales de dolor y ningún efecto placebo18. El CES no se ha evaluado en una población de veteranos, ni se ha evaluado adecuadamente en hombres con fibromialgia. Una revisión sistemática del CES financiada por el Departamento de Asuntos de los Veteranos (VA) publicada en 2018 concluyó que la evidencia es insuficiente para que el CES tenga efectos clínicamente importantes sobre la fibromialgia, dado que la mayoría de los ensayos tenían tamaños de muestra pequeños, duraciones cortas y un alto riesgo de sesgo debido a un cegamiento inadecuado. Sin embargo, la revisión sugiere que el CES no causa efectos secundarios graves, y existe evidencia de baja fuerza que sugiere beneficios modestos en pacientes con ansiedad y depresión19. Por lo tanto, se justifica más investigación sobre el uso de este dispositivo de bajo riesgo aprobado por la FDA, particularmente en la fibromialgia.
Con el fin de evaluar completamente la eficacia, los investigadores evaluaron la aptitud física junto con los biomarcadores neuronales y la experiencia con el dolor. El propósito del tratamiento de los estados de dolor crónico es mejorar la función física. La fibromialgia se correlaciona consistentemente con efectos negativos tanto en la función física como en la percepción de los pacientes de sus propias capacidades físicas20. Estudios previos han utilizado evaluaciones simples de la aptitud física para determinar la resistencia y la movilidad, como la prueba de caminata de 6 minutos (6MWT)20,21, cinco veces sentado para pararse (5TSTS)20 y varias medidas de capacidad de carga y fuerza en el contexto de las actividades diarias22. Para tener en cuenta las medidas estándar y al mismo tiempo mitigar la cantidad de actividad extenuante requerida justo antes de una resonancia magnética, el equipo del estudio utilizó la prueba de 30 segundos Chair Sit Stand Test como medida de resistencia y movilidad, y tanto los curls de bíceps como una prueba de agarre de manos como medidasde fuerza. Los movimientos requeridos en cada una de estas evaluaciones son muy comunes en las actividades cotidianas, por lo que es una medida clara de cómo están funcionando físicamente las personas en su día a día, tanto con tratamiento como sin él.
Incluso con evaluaciones subjetivas del dolor y medidas de eficacia de la función física, los mecanismos del CES no se comprenden completamente. Los estudios de neuroimagen anteriores han buscado una mejor comprensión al explorar el efecto directo de CES en la conectividad de red en el cerebro. Feusner et al.24 encontraron que el CES se asocia con la desactivación cortical para la estimulación de 0,5 Hz y 100 μA de las regiones frontal, parietal y posterior de la línea media bilateral y postularon que la frecuencia de estimulación puede tener más efecto que la intensidad actual en relación con la desactivación cortical. Su grupo encontró efectos significativos en algunos, pero no en todos los nodos de la red de modo predeterminado (DMN). Los autores sugieren que, con base en estos datos, el CES puede afectar a la conectividad funcional en estado de reposo. Se ha demostrado que la fibromialgia y otros estados de dolor crónico afectan la conectividad cerebral intrínseca en regiones asociadas con el dolor y la percepción25,26, por lo que los tratamientos que alteran la conectividad funcional en respuesta podrían resultar beneficiosos y efectivos. Se necesita una mayor exploración de los efectos a largo plazo del tratamiento diario en relación con la mejoría clínica, así como de cómo la activación fallecida en el cerebro se relaciona con las disminuciones previamente observadas en las frecuencias de electroencefalograma, para comprender mejor el mecanismo de acción terapéutico27.
La resonancia magnética de conectividad funcional en estado de reposo (rs-fcMRI) es el método de neuroimagen que permite observar estos cambios en la conectividad funcional. La resonancia magnética funcional en estado de reposo longitudinal permite a los médicos e investigadores establecer una línea de base de la conectividad del estado de reposo y realizar un seguimiento de las alteraciones a lo largo del tiempo en respuesta a los métodos de tratamiento de CES. También ayuda a determinar cómo los cambios en la conectividad funcional se correlacionan con las diferencias en la experiencia del dolor. Los estudios iniciales de neuroimagen para la fibromialgia utilizaron la tomografía por emisión de positrones (PET) y la tomografía computarizada por emisión de fotón único (SPECT) para examinar el cerebro, pero existen problemas con ambas técnicas en este sentido: la SPECT tiene una resolución más baja que la PET, y las tomografías por emisión de positrones son invasivas, lo que no es preferible para los pacientes que experimentan dolor crónico. Las imágenes de resonancia magnética funcional (fMRI) tienen mayor resolución que la SPECT, pero examinan la actividad cerebral en respuesta a las acciones o percepciones específicas de los estímulos de los pacientes28. Son las resonancias magnéticas rs-fc las que pueden describir la conectividad funcional entre las regiones del cerebro y pueden ser capaces de determinar dónde y cómo existe la fibromialgia, así como los mejores métodos de tratamiento28.
La evaluación de la eficacia de los tratamientos no farmacológicos para las condiciones dolorosas como la fibromialgia es de suma importancia tanto en el contexto actual de la epidemia de opioides como en el examen del dolor crónico como factor de riesgo para el suicidio29,30, que se incrementa sustancialmente entre la población veterana. Además, la falta de biomarcadores clínicos adecuados para el dolor es una laguna de conocimiento reconocida. El uso de una combinación de medidas conductuales y neuroimagen en múltiples puntos temporales para evaluar la respuesta al tratamiento es un enfoque novedoso para la evaluación de la fibromialgia, al igual que la utilización del CES auricular como tratamiento.
El protocolo tiene como objetivo abordar el vacío en la investigación de la fibromialgia mediante la investigación de los efectos del CES en los resultados del dolor y la función física y la evaluación de la neuroimagen como una herramienta para biomarcadores predictivos y de respuesta relacionados con los resultados clínicos de la terapia con CES31.
Protocolo
El estudio se llevó a cabo bajo la aprobación de las Juntas de Revisión Institucional de la Universidad de Emory (IRB 112768) y del VA de Atlanta (1585632-2; Número de referencia interna: 003), así como el Comité de Investigación y Desarrollo de Atlanta VA (Número de referencia de la Junta: 3881). Todos los sujetos dieron su consentimiento informado para la inclusión antes de participar en este estudio. Para obtener una representación visual de la línea de tiempo del protocolo de estudio, consulte la Figura 1).
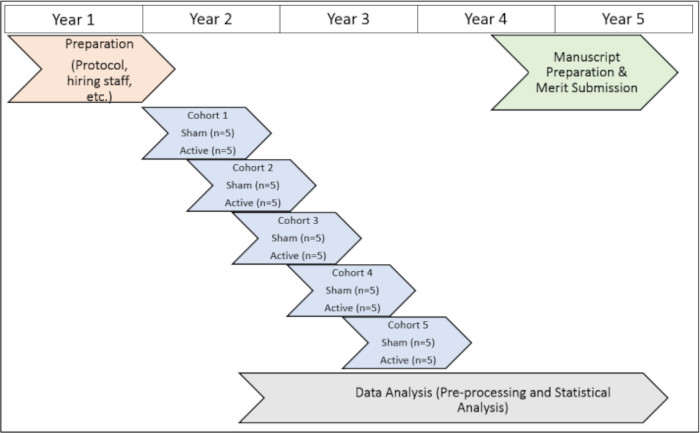
Figura 1: Cronología del estudio. Una representación visual de la línea de tiempo para la ejecución de los procedimientos del estudio durante el período de prueba. Haga clic aquí para ver una versión más grande de esta figura.
1. Reclutamiento de participantes a través de los métodos disponibles
- Seguir las pautas institucionales respectivas requeridas para difundir los materiales de reclutamiento del estudio (folletos, publicaciones, correos electrónicos, llamadas, etcétera) y los métodos de reclutamiento aprobados.
NOTA: El presente estudio reclutó a través de cartas de reclutamiento a cohortes específicas y llamadas telefónicas de seguimiento a posibles participantes. Los detalles sobre el pedido de los dispositivos CES para el estudio se incluyen en las instrucciones complementarias para el pedido de dispositivos CES (Archivo complementario 1). - Cuando alguien exprese interés en participar en el estudio, examínelo por teléfono para asegurarse de que cumpla con todos los criterios de inclusión y exclusión.
- Incluir participantes que cumplan con los criterios de elegibilidad: edad de 20 a 60 años (límite establecido durante el estudio preliminar para minimizar los cambios estructurales cerebrales debidos al envejecimiento)31; diagnóstico de fibromialgia por el Colegio Americano de Reumatología 2016 criterio32; diestros (para proporcionar consistencia en la estructura y función del cerebro); puntuación de dolor de 4 o más en la Escala de Calificación del Dolor de Defensa y Veteranos (DVPRS)33 en los 3 meses anteriores a la inscripción; medicación constante y estable relacionada con la FM durante al menos 4 semanas antes de la inscripción34; y la capacidad de tolerar de forma segura la resonancia magnética.
- Para la parte de detección de fibromialgia, complete el nuevo criterio diagnóstico clínico de fibromialgia32 con el participante potencial para obtener su puntuación del índice de dolor generalizado (WPI) y la puntuación de gravedad (SS). Puntúe de acuerdo con las pautas que se enumeran en la parte inferior de la página.
- Para la parte de detección de la puntuación de dolor, pida a los posibles participantes que califiquen verbalmente su dolor promedio y constante durante los últimos 3 meses en una escala de cero a diez.
- Para la parte de detección de resonancia magnética, complete un formulario de evaluación de seguridad de resonancia magnética con el posible participante proporcionado por una institución o por la propia instalación de escáner.
- Pregunte a los participantes sobre todos los posibles criterios de exclusión. Los criterios de exclusión incluyen antecedentes de convulsiones o afecciones neurológicas que alteran el cerebro; embarazo; claustrofobia, implantes incompatibles con la resonancia magnética u otras afecciones incompatibles con la resonancia magnética; y antecedentes de enfermedad psiquiátrica no controlada o enfermedad autoinmune que provoca dolor y puede explicar mejor los síntomas31.
- Si se les aplica alguno de los criterios de exclusión, no pasan la selección. No los incluyas en el estudio.
- Incluir participantes que cumplan con los criterios de elegibilidad: edad de 20 a 60 años (límite establecido durante el estudio preliminar para minimizar los cambios estructurales cerebrales debidos al envejecimiento)31; diagnóstico de fibromialgia por el Colegio Americano de Reumatología 2016 criterio32; diestros (para proporcionar consistencia en la estructura y función del cerebro); puntuación de dolor de 4 o más en la Escala de Calificación del Dolor de Defensa y Veteranos (DVPRS)33 en los 3 meses anteriores a la inscripción; medicación constante y estable relacionada con la FM durante al menos 4 semanas antes de la inscripción34; y la capacidad de tolerar de forma segura la resonancia magnética.
- Cuando alguien pase la prueba de detección, programe su cita de consentimiento y la resonancia magnética de referencia. Programe 2 horas para el consentimiento y el tiempo de escaneo.
2. Administrar las citas de estudio iniciales, intermedias y posteriores al estudio (consulte la Tabla 1)
NOTA: Todas las citas se llevan a cabo en el centro del escáner de resonancia magnética.
| Hora | Actividad investigadora | |
| Fase 1 | Semana 1 | Reclutamiento, Selección, Inscripción |
| Fase 2 | Semana 2–3 | Evaluaciones iniciales, rs-fcMRI |
| Fase 3 | Semanas 2–14 | Intervención |
| Fase 4 | Semana 6–10 | Seguimiento agudo, rs-fcMRI (6 semanas de tratamiento) |
| Fase 5 | Semana 12–16 | Seguimiento a largo plazo, rs-fcMRI (12 semanas de tratamiento) |
Tabla 1: Diseño de la investigación. Una línea de tiempo de las fases de participación individual durante las 12 semanas del estudio.
- Antes de cada visita inicial, prepare un dispositivo CES para llevar a cada participante.
- Abra la carcasa para asegurarse de que el dispositivo esté dentro (debe estar en plástico de burbujas). Retire la parte posterior del dispositivo e inserte dos pilas AAA.
- Vuelva a colocar el dispositivo. Encienda el dispositivo para asegurarse de que funciona antes de llevárselo al participante. Mantenga presionado el botón superior durante unos 2 segundos hasta que la pantalla se ilumine para encenderlo, y manténgalo presionado durante aproximadamente 2 segundos hasta que la pantalla se quede en blanco para apagarlo.
- Asegúrese de que cada estuche contenga el dispositivo, baterías adicionales, un cordón, un pequeño aplicador de solución y pinzas para los oídos. Asegúrese de que la bolsa que se entregará a los participantes contenga la carcasa del dispositivo, un frasco de solución conductora, una tapa adicional para llenar el pequeño aplicador de solución y almohadillas de electrodos de clip para los oídos adicionales.
- Una vez que se haya programado su consentimiento y la resonancia magnética de referencia, reúnase con el participante en la ubicación del escáner de resonancia magnética para la cita con dos copias del formulario de consentimiento, un dispositivo CES y sus materiales, la documentación de la prueba de elegibilidad y un paquete de cuestionario para que lo complete. Además, traiga el dispositivo de transferencia de datos a través del cual se transferirán los datos de la resonancia magnética al sitio de análisis.
NOTA: Este estudio utilizó una unidad USB encriptada.- Para la documentación de elegibilidad, incluya los nuevos criterios diagnósticos clínicos de fibromialgia32 y el DVPRS33.
NOTA: El DVPRS debe incluirse para cada visita. - Para las pruebas de función física, incluya un formulario para registrar los resultados de cada prueba 20,21,35.
- Para los cuestionarios que los participantes completarán, incluya las medidas PROMIS apropiadas (Escala PROMIS v1.2 - Salud Global, Banco de Ítems Neuro-QOL v2.0 - Función Cognitiva - Forma Corta, Banco de Ítems PROMIS v1.0 - Uso de Sustancias/Alcohol: Consumo de Alcohol, Banco de Ítems PROMIS v1.0 - Angustia Emocional - Ansiedad- Forma Corta 7a, Banco de Ítems PROMIS v1.0 - Angustia Emocional-Depresión - Forma Corta 4a, Banco de Artículos PROMIS v1.0 - Fatiga - Forma Corta 6a, Banco de Artículos PROMIS v1.0 - Interferencia del Dolor - Forma Corta 4a, Banco de Artículos PROMIS v1.2 - Función Física - Forma Corta 8b, Banco de Artículos PROMIS v2.0 - Aislamiento Social - Forma Corta 4a)36.
- Para la documentación de elegibilidad, incluya los nuevos criterios diagnósticos clínicos de fibromialgia32 y el DVPRS33.
- En el lugar de la resonancia magnética, administre la visita de referencia. Llame al participante con anticipación para confirmar.
- Lea el formulario de consentimiento completo con el participante asegurándose de que comprende la información. Pregúnteles si les gustaría participar y, si están de acuerdo, pídales que escriban su nombre, firmen y fechen el formulario.
- Después de dar su consentimiento, si el participante decide participar en el estudio, complete la documentación de la prueba de inclusión con él. Si son elegibles para continuar, complete los pasos a continuación; Si no son elegibles, termine su participación en el estudio en este punto.
- Asegúrese de que la documentación de las pruebas de elegibilidad incluya los nuevos criterios clínicos de diagnóstico de fibromialgia y el DVPRS.
- Si un participante es elegible después de la prueba de inclusión, explíquele al participante cómo usar el dispositivo CES.
- Retire el dispositivo de la carcasa y muestre a los participantes cómo encenderlo y apagarlo con el botón en la parte superior. Recuerde a los participantes que el dispositivo se desactivará automáticamente después de que hayan transcurrido 60 minutos.
- Muestre a los participantes cómo sujetar el cordón de la pinza para la oreja a un lado. El extremo opuesto del cable de los clips se conecta a un pequeño orificio en el lado izquierdo del dispositivo etiquetado con un "1".
- Demuestre cómo quitar las almohadillas de electrodos viejas de los clips para los oídos y colocar otras nuevas. Para quitar las almohadillas viejas, tire del adhesivo desde donde se conecta a los clips. Para colocar nuevas almohadillas, alinee el orificio de las almohadillas de electrodos de repuesto con el área elevada en el centro del clip y presione firmemente.
NOTA: No tire de las almohadillas de los electrodos por la parte blanda de la parte superior. Es propenso a romperse y dejará el adhesivo pegado a los clips. - Demuéstreles cómo sujetar los clips a los lóbulos de las orejas y pídales que lo prueben una vez. Apriete las puntas verdes del clip para abrirlo, coloque el lóbulo de la oreja entre ellos y cierre suavemente el clip para sujetarlo.
- Muéstreles cómo quitar la tapa de plástico del aplicador de solución pequeño y llenarla con la solución del frasco más grande (consulte los pasos 2.3.3.6-2.3.3.8). Recuérdeles que la solución es necesaria para que el dispositivo funcione correctamente.
- Para quitar la parte superior del pequeño aplicador de solución, retire la tapa y presione firmemente contra el costado de la punta. La punta de plástico se desprenderá del resto de la botella.
- Coloque la tapa alternativa para llenar el aplicador pequeño en la parte superior del frasco de solución más grande. Empuje hacia arriba la boquilla pequeña, deslícela en el aplicador pequeño y exprima la botella grande para llenarla.
- Dígales a los participantes que solo deben agregar alrededor de 1 o 2 gotas de la solución a cada almohadilla de electrodo de clip para la oreja. Cualquier exceso de solución debe eliminarse antes de usar.
- Indique a los participantes que utilicen el dispositivo todos los días de la semana durante 60 minutos por la noche, aproximadamente 1 hora antes de acostarse. Indique a los participantes que usen el dispositivo mientras están en reposo (es decir, sentados quietos o acostados, sin moverse).
NOTA: Tanto para el tiempo como para la posición, se permitieron a los participantes variaciones normales en el entorno de uso de su hogar para aumentar la naturaleza práctica de esta terapia para uso doméstico. No se establecieron parámetros para el sonido permitido en el entorno ni para el almacenamiento requerido en el dispositivo. - Entregue a los participantes un registro de dispositivo en blanco y explique que deben ingresar cada fecha de uso del dispositivo, su puntuación de dolor antes y después del uso del dispositivo y el tiempo de uso del dispositivo.
- Si los participantes no pueden usar su dispositivo durante un período de tiempo durante las 6 semanas entre las citas, pero pueden asistir a las citas de seguimiento, permítales permanecer en el estudio. Si no pueden usar el dispositivo o asistir a las visitas del estudio, finalice su participación. Consulte el registro de dispositivos CES complementario (Archivo complementario 2) para ver el registro de dispositivos que utilizó este estudio.
NOTA: Los siguientes pasos se repetirán durante las tres visitas.
- Después de la explicación del dispositivo, pida al participante que complete tres pruebas cortas de función física23. Para cada prueba, se registrará un número máximo para la puntuación (total de repeticiones para las dos primeras y fuerza por prueba para la tercera).
NOTA: El cronómetro utilizado para este estudio fue un iPhone 12 de Apple.- Administre la prueba de pie sentado en silla de 30 s. Siga los pasos 2.3.4.2-2.3.4.6.
- Coloque una silla con la espalda contra la pared de la sala de pruebas. Pida al participante que se siente en la silla con la espalda contra el respaldo de la silla.
- Indique al participante que se levante a una posición de pie completa y luego se siente completamente hacia abajo con la espalda contra el respaldo de la silla tantas veces como pueda en 30 segundos.
NOTA: Si golpea la silla pero no vuelve a poner completamente su peso sobre ella en una posición sentada, la repetición no cuenta. - Dígales a los participantes cuándo empezar. Inicie el temporizador cuando comiencen a moverse.
- Pida a los participantes que hagan flexiones de brazos con una mancuerna a cada lado durante 30 segundos por lado. Comience con el brazo derecho primero y luego muévase hacia el izquierdo.
- Registre el número total de rizos por lado. Use un peso de 5 libras para las mujeres y un peso de 8 libras para los hombres. Asegúrese de que los participantes estén sentados para la prueba de flexión de brazos.
- Pida a los participantes que hagan tres pruebas de fuerza de agarre con cada brazo en un dinamómetro. Siga los pasos 2.3.4.8-2.3.4.11. Comience con el brazo derecho primero y luego muévase hacia el izquierdo.
- Coloque el dinamómetro en la mano del participante. Deben apretar la empuñadura en la parte inferior y no tocar el dial en la parte superior.
- Dígales a los participantes que aprieten el dinamómetro lo más fuerte que puedan y luego suéltelo. La aguja en el dial se detendrá en el nivel más alto de fuerza de agarre que mostraron.
- Registre sus resultados de fuerza de agarre anotando el número que alcanza la aguja en el dial. Reinicie el dial entre repeticiones girando la pequeña perilla en la parte delantera de la esfera en sentido contrario a las agujas del reloj hasta que la aguja descanse en cero.
- Asegúrese de que los participantes estén sentados para la prueba de agarre manual.
NOTA: Entre cada serie, los participantes reciben alrededor de 15-20 segundos de descanso mientras cambian el equipo a su otra mano. Entre cada prueba, los participantes recibirán unos 2 minutos de descanso mientras se prepara el equipo y la documentación para la siguiente.
- Después de las pruebas de función física, pida a los participantes que completen el paquete del cuestionario con un bolígrafo. Revisa el paquete después para asegurarte de que hayan respondido todas las preguntas.
- Después de completar todas las revisiones, pruebas y cuestionarios, acompañe a los participantes hasta el escáner de resonancia magnética (para obtener toda la información sobre el protocolo de resonancia magnética, consulte la sección 3). Revise el formulario de evaluación con los técnicos de resonancia magnética y asegúrese de que los participantes hayan eliminado todo el metal de su persona.
- Asegúrese de que los miembros del equipo del estudio no tengan metal en sus cuerpos.
- Ayude a los técnicos de resonancia magnética a introducir cómodamente a los participantes en el escáner. Administrar el protocolo de resonancia magnética.
- Instruya a los participantes sobre los procedimientos de seguridad (botón de llamada de prueba y altavoces).
- Recuerde a los participantes que no se muevan en absoluto durante la exploración.
- Recuerde a los participantes la duración total de la exploración, que debe ser de 60 minutos.
- Cuando se haya completado el escaneo, ayude a los participantes a salir del escáner.
- Después de la exploración, finalice la visita inicial de los participantes y programe su visita intermedia para 6 semanas después. Los participantes tendrán tres visitas de estudio en total, cada una con 6 semanas de diferencia. Envíe los datos de la resonancia magnética a los servidores seguros del estudio para su análisis.
- El día programado, administre la visita intermedia siguiendo los pasos de la visita de referencia. Llame al participante con anticipación para confirmar.
- Administre el DVPRS. Pida a los participantes que devuelvan su primer registro de dispositivo completado y que les proporcionen un segundo registro de dispositivo.
- Realice los pasos 2.3.4-2.3.6 (igual que en la visita inicial).
- Termine la mitad de la visita de los participantes y programe su visita posterior para 6 semanas después. Envíe los datos de la resonancia magnética a los servidores seguros del estudio para su análisis.
- El día programado, administre la post-visita siguiendo los pasos de la mitad de la visita. Llame al participante con anticipación para confirmar.
- Administre el DVPRS. Pida a los participantes que devuelvan su segundo registro de dispositivo completado.
- Realice los pasos 2.3.4-2.3.6 (igual que en la línea de base y en las visitas intermedias). No se necesita una programación de visita adicional para la última visita.
- Si se necesita alguna información para compensar a los participantes, prepare y solicite esa información en esta visita.
NOTA: Este estudio requirió su nombre y dirección para emitir cheques del VA de Atlanta para obtener una compensación. - Finalizar la post-visita de los participantes. Envíe los datos de la resonancia magnética a los servidores seguros del estudio para su análisis.
NOTA: A lo largo del estudio, asegúrese de llamar y comunicarse con los participantes entre visitas para asegurarse de que estén usando el dispositivo, completando los registros del dispositivo y al tanto de cuándo será su próxima visita.
3. Configuración de protocolos de resonancia magnética
- Para el protocolo de resonancia magnética, adquiera BOLD rs-fMRI en un escáner de resonancia magnética 3T con una bobina de cabeza de matriz en fase de 32 canales utilizando una secuencia de imágenes ecoplanares de gradiente (EPI). Utilice los siguientes parámetros de RM: FOV (Campo de visión) = 220 mm2; TR (tiempo de repetición)/TE (tiempo de eco) = 1500/25 ms, factor de aceleración multibanda =3; ángulo de giro = 50°; tamaño de matriz de 110 x 110; espesor de la rebanada = 2 mm; Factor GRAPPA = 2; Fourier parcial de 6/8; 34 líneas de referencia de codificación de fase, 72 cortes axiales intercalados que cubren todo el cerebro, aproximadamente 350 volúmenes de escaneo para producir 8 minutos de datos de resonancia magnética funcional en estado de reposo para una estimación estable de las redes de conectividad.
- En el protocolo para la magnetización anatómica T1w preparó el eco de gradiente rápido (MPRAGE), ajuste TR = 2530 ms, TE = 3 ms, ángulo de volteo = 7°, espesor de corte = 0,8 mm, resolución de fase de 1 mm. La adquisición de T1w dura aproximadamente 6 min.
- Adquiera escaneos de imágenes ponderadas por difusión (DWI) en un escáner de resonancia magnética 3T con una bobina de cabezal de matriz en fase de 32 canales utilizando un esquema de imágenes de espectro de difusión. Recoja un total de 129 direcciones de muestreo de difusión con un valor b máximo de 3000 s/mm2, una resolución en el plano de 2x2mm2 y un grosor de corte de 2 mm.
- Adquiera datos fisiológicos (datos cardiorrespiratorios utilizando un cinturón de monitor respiratorio y oximetría de pulso) simultáneamente (bloqueados en el tiempo) con los datos de resonancia magnética funcional.
- Transfiera de forma segura los datos de resonancia magnética desde la ubicación del escáner a un sitio seguro para el preprocesamiento y el análisis. Convierta DICOMS a NIFTI para cumplir con el formato BIDS utilizando dc2bids v2.1.6.
- Limpie los datos de identificadores individuales. Utilice un número de sujeto de estudio en todos los datos cuando corresponda. Realice un control de calidad para asegurarse de que no se produjeron artefactos anómalos, como un movimiento excesivo, en los datos a través de MRIQC v21.0.0.
4. Preprocesamiento y análisis
- Una vez que se hayan recibido los datos de resonancia magnética del estudio, utilice dos conductos separados para analizarlos: uno para analizar la conectividad funcional entre los participantes y otro para analizar la tractografía de la sustancia blanca.
- Preprocese los datos estructurales de T1w y rsfMRI de los sujetos a través de fMRIPrep v20.2.5, incluida la extracción cerebral, la segmentación de tejidos y la normalización de las imágenes ponderadas en T1 (T1w), así como la estimación del volumen de referencia, la estimación del movimiento de la cabeza, la corrección del tiempo de corte y el registro en el T1w para las imágenes funcionales. Este proceso da como resultado los datos de T1w y rsfMRI normalizados en el espacio MNI152NLin2009cAsym.
- Utilice los datos de resonancia magnética preprocesados en el análisis de conectividad funcional (CONN).
- Véase el documento complementario de fMRIPrep Boilerplate (Archivo Suplementario 3, 37-56). Para obtener más detalles, consulte el enlace: https://fmriprep.org/en/stable/
- Importe el conjunto de datos preprocesado en CONN Toolbox v22a para su posterior procesamiento.
NOTA: CONN Toolbox se actualizó de v21a a v22a durante este estudio.- En la fase de configuración, establecer covariables de2º nivel para definir los grupos de estudio (TRUE vs. SHAM) para su posterior análisis y asegurar la calidad de las imágenes T1w y rsfMRI. Datos suaves de fMRI a través de un kernel gaussiano de 8 mm.
- Después del preprocesamiento, elimine el ruido de los datos para eliminar el ruido extraño y fisiológico.
NOTA: Este estudio calculó el análisis de primer nivel, pero no lo evaluó ni lo utilizó ya que los investigadores no están interesados en resultados de un solo sujeto. - Elija semillas/ROI y covariables de sujeto y establezca contrastes. Ejecute un análisis de semilla a vóxel a nivel de grupo.
- Una vez completados los pasos de configuración, preprocesamiento y eliminación de ruido de las canalizaciones, establezca los umbrales de clúster y vóxel para ver los patrones de conectividad.
- Consulte la Figura complementaria 1 y el documento complementario de las Instrucciones de CES CONN (Archivo complementario 4).
- Utilizar la tractografía correlacional57 para determinar los cambios longitudinales en la integridad de la sustancia blanca correlacionados con el grupo experimental para identificar los haces del tracto y las regiones asociadas con el tratamiento con CES. A continuación se muestran los principales pasos del análisis:
- Convierta las imágenes DWI sin procesar de .dcm (DICOM) a formato .nii.gz (NIfTI).
- Preprocese las imágenes para corregir las distorsiones inducidas por la susceptibilidad utilizando el TOPUP58,59 de FSL (versión 6.0.6) y las distorsiones por corrientes de Foucault utilizando la herramienta EDDY60 de FSL.
- Genere métricas de control de calidad de imagen (QC) DWI relacionadas con el movimiento a nivel de sujeto individual y estudio utilizando las herramientas de control de calidad EDDY de FSL.
- Ejecute un ANOVA de medidas repetidas de dos vías en estas métricas de control de calidad para identificar cualquier varianza entre grupos que pueda confundir los resultados de la tractografía grupal. Si una métrica muestra una varianza entre grupos que es significativa (p > 0,05), entonces debe tenerse en cuenta como una covariable en el análisis de tractografía correlacional.
- Importe los datos preprocesados en DSI Studio (versión "Chen", 21 de noviembre de 2022), donde se convierten en archivos .src (fuente). Para obtener más información sobre DSI Studio, consulte el sitio web del software (https://dsi-studio.labsolver.org).
- Reconstruya los datos de difusión importados utilizando la reconstrucción difeomorfa del espacio Q (QSDR)61 para determinar las orientaciones de las fibras de materia blanca en el espacio plantilla MNI. Se genera un archivo .fib (orientación de fibra) para cada imagen. Las opciones seleccionadas para la reconstrucción son:
método (selección del método de reconstrucción) - QSDR
param0 (longitud de muestreo de difusión) - 1.25 (este es el valor predeterminado)
template (en qué espacio de plantilla se van a reconstruir los datos) - ICBM152
align_acpc (si se debe rotar el volumen de la imagen para alinear AC-PC) - 0 (falso) - Cree una base de datos de conectometría a partir de estos archivos .fib, que extraiga los valores de anisotropía cuantitativa (QA) de los datos de difusión reconstruidos. Calcule el cambio longitudinal en el control de calidad para cada sujeto en la base de datos. Agregue datos demográficos como el grupo del experimento, la edad, el sexo, junto con las covariables identificadas en el paso de control de calidad a través de un archivo .csv a la base de datos.
- A continuación, cargue la base de datos de conectometría en la GUI de análisis de conectometría de grupo.
- Seleccione las covariables que se considerarán en el análisis. Una de estas covariables seleccionadas se designa como variable de estudio.
- Para este análisis, seleccione Grupo como variable de estudio. Se identificarán los distritos con cambios longitudinales en el control de calidad correlacionados con el grupo , mientras que el efecto de las otras covariables seleccionadas se reducirá.
- Las opciones seleccionadas para el análisis de conectometría de grupo son:
- Control FDR (corte de tasa de falsos descubrimientos, solo se emitirán los distritos con una correlación significativa por debajo de FDR) - 0.05
- Umbral de longitud (valor en vóxeles de la longitud mínima del tracto utilizada como hipótesis nula): 20 vóxeles (o 40 mm para tamaños de vóxeles de 2 mm)
- Umbral T (umbral de medición t-stat para el efecto de correlación) - 2.5
- Región de estudio (este panel permite incluir/excluir regiones del análisis) - seleccione Todo el cerebro con - Excluir cerebelo marcado
NOTA: Para este estudio, se excluyó el cerebelo debido a que algunas de las exploraciones de difusión tenían partes del cerebelo cortadas durante la adquisición.
- Presione el botón Ejecutar conectometría para realizar el análisis, que genera varios archivos:
- Un archivo .fib que almacena las estadísticas t y se puede abrir en DSI Studio para visualizar las estadísticas t de los distritos con un control de calidad creciente (almacenado como "inc_t") o decreciente (almacenado como "dec_t"), que se correlacionan con el grupo.
- Un .fdr_dist.values.txt, que enumera los valores de FDR con respecto a la longitud del tracto
- Un .inc.tt.gz que es un archivo de tractografía que almacena los tractos con un aumento del QA longitudinal correlacionado con la variable de estudio. (Grupo en nuestro caso). Un archivo .dec.tt.gz almacena los distritos con una QA longitudinal disminuida correlacionada con la variable de estudio.
- Un archivo .report.html que informa convenientemente los resultados de la conectometría junto con gráficos de tracto incrustados, imágenes, así como la información repetitiva sobre los pasos del análisis de tractografía correlacional para su publicación.
NOTA: Para ver ejemplos del código R utilizado para este estudio, consulte los gráficos complementarios del código R CES (Archivo complementario 5) y los archivos complementarios de Anova del código R CES eddy-qc (Archivo complementario 6).
Resultados
En cuanto a los resultados de reclutamiento, los participantes fueron reclutados principalmente a través del envío de cartas de reclutamiento y llamadas telefónicas de seguimiento basadas en las regulaciones descritas del Sistema de Atención Médica de VA de Atlanta. El equipo del estudio reclutó a un total de 50 participantes, lo que demuestra la eficacia de los métodos utilizados para cumplir el objetivo de reclutamiento (véase la Figura 2). El uso d...
Discusión
Los métodos del presente estudio brindan no solo la posibilidad de una modalidad de tratamiento altamente efectiva para la fibromialgia, sino también la oportunidad de mejorar el proceso diagnóstico de la fibromialgia desde la primera instancia de su perfil de síntomas de dolor. El uso tanto del CES activo como del CES simulado, en el que el descubrimiento del tipo de cada dispositivo individual dependía de los números de serie y de una clave separada, permitió el cegamiento tanto de los sujetos como de los invest...
Divulgaciones
Los autores declaran que no tienen intereses financieros o relaciones personales contradictorias que puedan haber influido en el trabajo reportado en este artículo. Las opiniones expresadas en este artículo son las de los autores y no reflejan necesariamente la posición o política del Departamento de Asuntos de Veteranos o del gobierno de los Estados Unidos.
Agradecimientos
Los autores desean agradecer el apoyo de los investigadores del Centro de Rehabilitación Visual y Neurocognitiva, incluidos el Dr. Bruce Crosson y la Dra. Lisa Krishnamurthy, por su contribución al trabajo. Los autores también agradecen a Grace Ingham por su inestimable ayuda en el proceso de filmación. Este trabajo fue apoyado en parte por el Departamento de Asuntos de Veteranos, el Departamento de Asuntos de Veteranos, el Servicio de Rehabilitación, Investigación y Desarrollo, el Premio de Desarrollo Profesional, IK2 RX003227 (Anna Woodbury) y el Centro Grant 5I50RX002358. El financiador no desempeña ningún papel en el diseño del estudio, la recopilación de datos, la gestión, el análisis, la interpretación o la presentación de informes.
Materiales
| Name | Company | Catalog Number | Comments |
| 3T Siemens MAGNETOM Prisma Scanner | Siemens Healthineers | N/A | From Emory's website: "The Siemens Magnetom Prisma 3T whole-body MR system is equipped with: a state-of-the art gradient system with a maximum (per axis) strength of 80 mT/m and slew rate of 200 T/m/sec 64 independent RF receiver channels capable of 204 receiver connections a 2-channel RF transmitter. Multiple coils are available, including: a 64-channel head/neck coil with 52 channels for imaging of the head region a 32-channel head-only coil a 20-channel head/neck coil with 16 channels for head spine array coil flexible chest coil large and small flexible coil for extremity imaging. |
| Alpha-Stim AID Kit | Electromedical Products International Inc. | SKU: 500KIT | A total of 50 devices ordered for research purposes. From the site: "A prescription or order from a licensed healthcare professional is required to purchase this device (within the USA). FDA cleared for anxiety, insomnia and pain only, with approval for depression outside of the United States." |
| CONN Toolbox v21a16 (RRID:SCR_009550) | Whitfield-Gabrieli and Nieto-Castanon | Version v21a16 (RRID:SCR_009550) | CONN is an open-source SPM-based cross-platform software for the computation, display, and analysis of functional connectivity Magnetic Resonance Imaging (fcMRI). CONN is used to analyze resting state data (rsfMRI) as well as task-related designs. |
| DSI Studio (RRID:SCR_009557) | Fang-Cheng (Frank) Yeh | RRID:SCR_009557 | DSI Studio is a tractography software tool that maps brain connections and correlates findings with neuropsychological disorders. It is a collective implementation of several diffusion MRI methods, including diffusion tensor imaging (DTI), generalized q-sampling imaging (GQI), q-space diffeomorphic reconstruction (QSDR), diffusion MRI connectometry, and generalized deterministic fiber tracking. |
| fMRIPrep 20.2.5 (RRID:SCR_016216) | NiPreps (NeuroImaging PREProcessing tools) | Version 20.2.5. (RRID:SCR_016216) | A functional magnetic resonance imaging (fMRI) data preprocessing pipeline that is designed to provide an easily accessible, state-of-the-art interface that is robust to variations in scan acquisition protocols and that requires minimal user input, while providing easily interpretable and comprehensive error and output reporting. It performs basic processing steps (coregistration, normalization, unwarping, noise component extraction, segmentation, skull-stripping, etc.) providing outputs that can be easily submitted to a variety of group level analyses, including task-based or resting-state fMRI, graph theory measures, and surface or volume-based statistics. |
| MRIQC | NiPreps (NeuroImaging PREProcessing tools) | MRIQC extracts no-reference IQMs (image quality metrics) from structural (T1w and T2w) and functional MRI (magnetic resonance imaging) data. (not directly used for analyses) | |
| Sammons Preston Jamar Hydraulic Hand Dynamometer | Alpha Med Inc. | SKU SAMP5030J1 | From the website: Ideal for routine screening of grip strength and initial and ongoing evaluation of clients with hand trauma and dysfunction. Unit comes with carrying/storage case, certificate of calibration and complete instructions. Warranted for one full year. The warranty does not cover calibration. Latex free. |
| SPRI 5-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (E) Dark Blue | 5-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
| SPRI 8-Pound Vinyl-Coated Weight | SPRI | Amazon | N/A | Color: (H) Black |8-Pound. Appears on Amazon: Dumbbells Hand Weights Set of 2 - Vinyl Coated Exercise & Fitness Dumbbell for Home Gym Equipment Workouts Strength Training Free Weights for Women, Men (1-10 Pound, 12, 15, 18, 20 lb), https://www.amazon.com/stores/SPRI/Weights/page/9D10835A-CFAB-4DA1-BEE9-AE993C6B5BC1 |
Referencias
- Heidari, F., Afshari, M., Moosazadeh, M. Prevalence of fibromyalgia in general population and patients, a systematic review and meta-analysis. Rheumatology International. 37 (9), 1527-1539 (2017).
- Dennis, N. L., Larkin, M., Derbyshire, S. W. G. 'A giant mess' - making sense of complexity in the accounts of people with fibromyalgia. British Journal of Health Psychology. 18 (4), 763-781 (2013).
- Woodbury, A. Opioids for nonmalignant chronic pain. AMA Journal of Ethics. 17 (3), 202-208 (2015).
- Hedegaard, H., Minino, A. M., Spencer, M. R., Warner, M. Drug overdose deaths in the United States, 1999-2020. NCHS Data Brief. 428, 1-8 (2021).
- . Report No.: 17-01846-316. Opioid prescribing to high-risk veterans receiving VA purchased care. Office of Healthcare Inspections. , (2017).
- Perry, R., Leach, V., Davies, P., Penfold, C., Ness, A., Churchill, R. An overview of systematic reviews of complementary and alternative therapies for fibromyalgia using both AMSTAR and ROBIS as quality assessment tools. Systematic Reviews. 6 (1), 97 (2017).
- Martinez-Lavin, M., Hermosillo, A. G. Dysautonomia in Gulf War syndrome and in fibromyalgia. The American Journal of Medicine. 118 (4), 446 (2005).
- Petersel, D. L., Dror, V., Cheung, R. Central amplification and fibromyalgia: disorder of pain processing. Journal of Neuroscience Research. 89 (1), 29-34 (2011).
- Marlow, N. M., Bonilha, H. S., Short, E. B. Efficacy of transcranial direct current stimulation and repetitive transcranial magnetic stimulation for treating fibromyalgia syndrome: A systematic review. Pain Practice. 13 (2), 131-145 (2013).
- Molero-Chamizo, A., et al. Noninvasive transcutaneous vagus nerve stimulation for the treatment of fibromyalgia symptoms: A study protocol. Brain sciences. 12 (1), 95 (2022).
- Cimpianu, C. L., et al. Vagus nerve stimulation in psychiatry: A systematic review of the available evidence. Journal of Neural Transmission. 124 (1), 145-158 (2017).
- Napadow, V., et al. Evoked pain analgesia in chronic pelvic pain patients using respiratory-gated auricular vagal afferent nerve stimulation. Pain Medicine (Malden, Mass). 13 (6), 777-789 (2012).
- Zhang, Y., et al. Transcutaneous auricular vagus nerve stimulation (taVNS) for migraine: an fMRI study. Regional Anesthesia and Pain. 46 (2), 145-150 (2021).
- Tassorelli, C., et al. Noninvasive vagus nerve stimulation as acute therapy for migraine: The randomized PRESTO study. Neurology. 91 (4), e364-e373 (2018).
- . NBC4 Washington - Electrotherapy Device Treats Anxiety, Insomnia, Depression. Alpha-Stim. , (2021).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Bourguignon, C. A randomized, controlled, double-blind pilot study of the effects of cranial electrical stimulation on activity in brain pain processing regions in individuals with fibromyalgia. Explore (NY). 9 (1), 32-40 (2013).
- Taylor, A. G., Anderson, J. G., Riedel, S. L., Lewis, J. E., Kinser, P. A., Bourguignon, C. Cranial electrical stimulation improves symptoms and functional status in individuals with fibromyalgia. Pain Management Nursing. 14 (4), 327-335 (2013).
- Lichtbroun, A. S., Raicer, M. M., Smith, R. B. The treatment of fibromyalgia with cranial electrotherapy stimulation. Journal of Clinical Rheumatology. 7 (2), 72-78 (2001).
- Shekelle, P. G., Cook, I. A., Miake-Lye, I. M., Booth, M. S., Beroes, J. M., Mak, S. Benefits and harms of cranial electrical stimulation for chronic painful conditions, depression, anxiety, and insomnia: A systematic review. Annals of Internal Medicine. 168 (6), 414-421 (2018).
- Dailey, D. L., et al. Perceived function and physical performance are associated with pain and fatigue in women with fibromyalgia. Arthritis Research & Therapy. 18, 68 (2016).
- Gowans, S. E., deHueck, A., Voss, S., Silaj, A., Abbey, S. E., Reynolds, W. J. Effect of a randomized, controlled trial of exercise on mood and physical function in individuals with fibromyalgia. Arthritis & Rheumatism. 45 (6), 519-529 (2001).
- Jones, J., Rutledge, D. N., Jones, K. D., Matallana, L., Rooks, D. S. Self-Assessed physical function levels of women with fibromyalgia: A national survey. Women's Health Issues. 18 (5), 406-412 (2008).
- Rikli, R. E., Jones, C. J. Development and validation of criterion-referenced clinically relevant fitness standards for maintaining physical independence in later years. The Gerontologist. 53 (2), 255-267 (2013).
- Feusner, J. D., et al. Effects of cranial electrotherapy stimulation on resting state brain activity. Brain and Behavior. 2 (3), 211-220 (2012).
- Harris, R. E., et al. Pregabalin rectifies aberrant brain chemistry, connectivity, and functional response in chronic pain patients. Anesthesiology. 119 (6), 1453-1464 (2013).
- Napadow, V., Harris, R. E. What has functional connectivity and chemical neuroimaging in fibromyalgia taught us about the mechanisms and management of 'centralized' pain. Arthritis Research & Therapy. 16 (5), 425 (2014).
- Schroeder, M. J., Barr, R. E. Quantitative analysis of the electroencephalogram during cranial electrotherapy stimulation. Clinical Neurophysiology. 112 (11), 2075-2083 (2001).
- Cordes, D., et al. Mapping functionally related regions of brain with functional connectivity MR imaging. American Journal of Neuroradiology. 21 (9), 1636-1644 (2000).
- Hassett, A. L., Aquino, J. K., Ilgen, M. A. The risk of suicide mortality in chronic pain patients. Current Pain and Headache Reports. 18 (8), 436 (2014).
- Stenager, E., Christiansen, E., Handberg, G., Jensen, B. Suicide attempts in chronic pain patients. A register-based study. Scandinavian Journal of Pain. 5 (1), 4-7 (2014).
- Woodbury, A., et al. Feasibility of auricular field stimulation in fibromyalgia: Evaluation by functional magnetic resonance imaging, randomized trial. Pain Medicine. 22 (3), 715-726 (2021).
- Wolfe, F., et al. Revisions to the 2010/2011 fibromyalgia diagnostic criteria. Seminars in Arthritis and Rheumatism. 46 (3), 319-329 (2016).
- Polomano, R. C., et al. Psychometric testing of the defense and veterans pain rating scale (DVPRS): A new pain scale for military population. Pain Medicine. 17 (8), 1505-1519 (2016).
- Electromedical Products International, Inc. . Scientific and clinical literature examination for the Alpha-Stim M microcurrent and cranial electrotherapy stimulator. , (2016).
- Lein, D. H., Alotaibi, M., Almutairi, M., Singh, H. Normative reference values and validity for the 30-second chair-stand test in healthy young adults. International Journal of Sports Physical Therapy. 17 (5), 907-914 (2022).
- Revicki, D. A., Cook, K. F., Amtmann, D., Harnam, N., Chen, W. H., Keefe, F. J. Exploratory and confirmatory factor analysis of the PROMIS pain quality item bank. Quality of Life Research. 23 (1), 245-255 (2014).
- Tustison, N. J., et al. N4ITK: improved N3 bias correction. IEEE Transactions on Medical Imaging. 29 (6), 1310-1320 (2010).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12 (1), 26-41 (2008).
- Zhang, Y., Brady, M., Smith, S. Segmentation of brain MR images through a hidden Markov random field model and the expectation-maximization algorithm. IEEE Transactions on Medical Imaging. 20 (1), 45-57 (2001).
- Dale, A. M., Fischl, B., Sereno, M. I. Cortical surface-based analysis: I. Segmentation and surface reconstruction. NeuroImage. 9 (2), 179-194 (1999).
- Klein, A., et al. Mindboggling morphometry of human brains. PLoS Computational Biology. 13 (2), e1005350 (2017).
- Fonov, V. S., Evans, A. C., McKinstry, R. C., Almli, C. R., Collins, D. L. Unbiased nonlinear average age-appropriate brain templates from birth to adulthood. NeuroImage. 47 (Supplement 1), S102 (2009).
- Evans, A. C., Janke, A. L., Collins, D. L., Baillet, S. Brain templates and atlases. NeuroImage. 62 (2), 911-922 (2012).
- Greve, D. N., Fischl, B. Accurate and robust brain image alignment using boundary-based registration. NeuroImage. 48 (1), 63-72 (2009).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. NeuroImage. 17 (2), 825-841 (2002).
- Cox, R. W., Hyde, J. S. Software tools for analysis and visualization of fMRI data. NMR in Biomedicine. 10 (4-5), 171-178 (1997).
- Pruim, R. H. R., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., Beckmann, C. F. ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. NeuroImage. 112, 267-277 (2015).
- Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., Petersen, S. E. Methods to detect, characterize, and remove motion artifact in resting state fMRI. NeuroImage. 84, 320-341 (2014).
- Behzadi, Y., Restom, K., Liau, J., Liu, T. T. A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. NeuroImage. 37 (1), 90-101 (2007).
- Satterthwaite, T. D., et al. An improved framework for confound regression and filtering for control of motion artifact in the preprocessing of resting-state functional connectivity data. NeuroImage. 64, 240-256 (2013).
- Lanczos, C. Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics Series B Numerical Analysis. 1 (1), 76 (1964).
- Oscar, E., et al. fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods. 16, 111-116 (2019).
- Oscar, E., et al. FMRIPrep. Software. Zenodo. , (2018).
- Gorgolewski, K. J., et al. Nipype: a flexible, lightweight and extensible neuroimaging data processing framework in python. Frontiers in Neuroinformatics. 5, 13 (2011).
- Gorgolewski, K. J., et al. Nipype. Software. Zenodo. , (2018).
- Abraham, A., et al. Machine learning for neuroimaging with scikit-learn. Frontiers in Neuroinformatics. 8, 14 (2014).
- Yeh, F. -. C., Badre, D., Verstynen, T. Connectometry: A statistical approach harnessing the analytical potential of the local connectome. NeuroImage. 125 (2016), 162-171 (2015).
- Andersson, J. L. R., Skare, S., Ashburner, J. How to correct susceptibility distortions in spin-echo echo-planar images: application to diffusion tensor imaging. NeuroImage. 20 (2), 870-888 (2003).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (S1), 208-219 (2004).
- Andersson, J. L. R., Sotiropoulos, S. N. An integrated approach to correction for off-resonance effects and subject movement in diffusion MR imaging. NeuroImage. 125, 1063-1078 (2016).
- Yeh, F. -. C., Tseng, W. -. Y. I. NTU-90: a high angular resolution brain atlas constructed by -q-space diffeomorphic reconstruction. Neuroimage. 58 (1), 91-99 (2011).
- Nieto-Castanon, A. Cluster-Level Inferences. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Hemington, K. S., Wu, Q., Kucyi, A., Inman, R. D., Davis, K. D. Abnormal cross-network functional connectivity in chronic pain and its association with clinical symptoms. Brain Structure & Function. 221 (8), 4203-4219 (2016).
- Ichesco, E., et al. Altered resting state connectivity of the insular cortex in individuals with fibromyalgia. Journal of Pain. 15 (8), 815-826 (2014).
- Kim, J., et al. The somatosensory link in fibromyalgia: functional connectivity of the primary somatosensory cortex is altered by sustained pain and is associated with clinical/autonomic dysfunction. Arthritis & Rheumatology. 67 (5), 1395-1405 (2015).
- Napadow, V., LaCount, L., Park, K., As-Sanie, S., Clauw, D. J., Harris, R. E. Intrinsic brain connectivity in fibromyalgia is associated with chronic pain intensity. Arthritis and Rheumatism. 62 (8), 2545-2555 (2010).
- Napadow, V., Kim, J., Clauw, D. J., Harris, R. E. Decreased intrinsic brain connectivity is associated with reduced clinical pain in fibromyalgia. Arthritis and Rheumatism. 64 (7), 2398-2403 (2012).
- Puiu, T., et al. Association of alterations in gray matter volume with reduced evoked-pain connectivity following short-term administration of pregabalin in patients with fibromyalgia. Arthritis & Rheumatology. 68 (6), 1511-1521 (2016).
- Fallon, N., Chiu, Y., Nurmikko, T., Stancak, A. Functional Connectivity with the default mode network is altered in fibromyalgia patients. PLoS One. 11 (7), e0159198 (2016).
- Wang, Y., Kang, J., Kemmer, P. B., Guo, Y. An efficient and reliable statistical method for estimating functional connectivity in large scale brain networks using partial correlation. Frontiers in Neuroscience. 10, 123 (2016).
- Mease, P. J., et al. Estimation of minimum clinically important difference for pain in fibromyalgia. Arthritis Care and Research (Hoboken). 63 (6), 821-826 (2011).
- Bingel, U., et al. Somatotopic organization of human somatosensory cortices for pain: a single trial fMRI study. NeuroImage. 23 (1), 224-232 (2004).
- Wager, T. D., et al. Pain in the ACC. Proceedings of the National Academy of Sciences of the United States of America. 113 (18), E2474-E2475 (2016).
- Nieto-Castanon, A. . FMRI Denoising Pipeline. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Friston, K. J., Williams, S., Howard, R., Frackowiak, R. S., Turner, R. Movement-related effects in fMRI time-series. Magnetic Resonance in Medicine. 35 (3), 346-355 (1996).
- Hallquist, M. N., Hwang, K., Luna, B. The nuisance of nuisance regression: spectral misspecification in a common approach to resting-state fMRI preprocessing reintroduces noise and obscures functional connectivity. NeuroImage. 82, 208-225 (2013).
- Chai, X. J., Nieto-Castanon, A., Ongur, D., Whitfield-Gabrieli, S. Anticorrelations in resting state networks without global signal regression. NeuroImage. 59 (2), 1420-1428 (2012).
- Nieto-Castanon, A. General Linear Model. Handbook of Functional Connectivity Magnetic Resonance Imaging Methods in CONN. , (2020).
- Worsley, K. J., Marrett, S., Neelin, P., Vandal, A. C., Friston, K. J., Evans, A. C. A unified statistical approach for determining significant signals in images of cerebral activation. Human Brain Mapping. 4 (1), 58-73 (1996).
- Chumbley, J., Worsley, K., Flandin, G., Friston, K. Topological FDR for neuroimaging. NeuroImage. 49 (4), 3057-3064 (2010).
- Page, S. J., Persch, A. C. Recruitment, retention, and blinding in clinical trials. The American Journal of Occupational Therapy. 67 (2), 154-161 (2013).
- McGrath, R. E., Mitchell, M., Kim, B. H., Hough, L. Evidence for response bias as a source of error variance in applied assessment. Psychological Bulletin. 136 (3), 450-470 (2010).
- Robinson-Papp, J., George, M. C., Dorfman, D., Simpson, D. M. Barriers to chronic pain measurement: A qualitative study of patient perspectives. Pain Medicine. 16 (7), 1256-1264 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados