A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الإجهاد الخفيف المزمن غير المتوقع في الفئران على أساس الطب المنغولي
* These authors contributed equally
In This Article
Summary
يحدد هذا البروتوكول نموذج الإجهاد المعتدل المزمن غير المتوقع (CUMS) للاكتئاب بناء على النظرية الطبية المنغولية ، إلى جانب طرق التحقق من صحة الاختبارات السلوكية.
Abstract
الاكتئاب هو اضطراب عاطفي سائد ويشكل سببا رئيسيا للإعاقة العالمية. تساهم قيود التدخلات الدوائية الحالية في العبء الصحي الكبير المنسوب إلى هذه الحالة. هناك حاجة ملحة لفهم أعمق للآليات الأساسية للاكتئاب ، مما يجعل النماذج قبل السريرية ذات الإمكانات الانتقالية ذات قيمة عالية. يفترض الطب المنغولي ، وهو مجموعة فرعية من الطب التقليدي ، أن حدوث المرض يرتبط ارتباطا وثيقا بتوازن الرياح والصفراء والبلغم. في هذه الدراسة ، نقدم بروتوكولا لطريقة الإجهاد الخفيف المزمن غير المتوقع (CUMS) في الفئران. في هذا الإطار ، تتعرض الفئران لسلسلة من الضغوطات المتقلبة والخفيفة للحث على نمط ظاهري يشبه الاكتئاب ، يحاكي التسبب في الاكتئاب البشري. تشمل المقايسات السلوكية المستخدمة في هذا البروتوكول اختبار تفضيل السكروز (SPT) ، مما يدل على انعدام التلذذ - وهو أحد الأعراض الأساسية للاكتئاب. اختبار المجال المفتوح (OFT) ، الذي يقيس مستويات القلق ؛ واختبار موريس للمتاهة المائية (MWM) ، الذي يقيم الذاكرة المكانية وقدرات التعلم. توضح طريقة CUMS القدرة على إحداث anhedonia والتسبب في عجز سلوكي طويل الأجل. علاوة على ذلك ، فإن هذا البروتوكول أكثر توافقا مع النظرية الطبية المنغولية من النماذج الحيوانية الأخرى المصممة لاستنباط سلوك يشبه الاكتئاب. يوفر تطوير هذا النموذج الحيواني والبحوث اللاحقة أساسا قويا للدراسات المبتكرة المستقبلية في مجال الطب المنغولي.
Introduction
الاضطراب الاكتئابي الشديد (MDD) هو مرض عقلي منتشر ، ويحتل المرتبة الثالثة كسبب رئيسي للإعاقة على مستوى العالم ويؤثر على أكثر من 300 مليون شخص1,2,3. والجدير بالذكر أن التقديرات تشير إلى أن ما لا يقل عن نصف الأفراد المصابين لا يتلقون العلاج المناسب.4. بالنظر إلى هذه الفجوة ، تعمل النماذج الحيوانية كأداة حاسمة للتحقيق في مسببات الاكتئاب. حتى الآن ، يوجد أكثر من 20 نموذجا حيوانيا مختلفا للاكتئاب5. من بين هؤلاء ، نموذج الإجهاد المعتدل المزمن الذي لا يمكن التنبؤ به (CUMS) ، الذي صقله بول وينر في عام 1987 ، هو الأكثر استخداما6. يعمل نموذج CUMS على فرضية أن تعريض القوارض لمجموعة متنوعة من الضغوطات الاجتماعية والبيئية يؤدي إلى أعراض مشابهة للقلق والتوتر والاكتئاب. تتضمن المنهجية تعريض لضغوط خفيفة مختلفة على مدى عدة أسابيع ، وبلغت ذروتها في مجموعة من التغييرات السلوكية ، بما في ذلك انعدام التلذذ والسلوكيات الشبيهة بالاكتئاب.7,8. ويرافق هذه التغييرات تحولات في ملامح الغدد الصماء والناقلات العصبية ، مثل انخفاض في 5-HT9,10. تعكس هذه النتائج عن كثب تلك التي لوحظت في البشر الذين تم تشخيصهم ب MDD ، وبالتالي التحقق من صحة فائدة النموذج. يتم تقييم نموذج CUMS بشكل خاص لفعاليته في تقييم مضادات الاكتئاب ، مما يدل على مستويات عالية من الصلاحية السطحية والهيكلية والتنبؤية11,12. على عكس النماذج الأخرى ، فإن CUMS حساس لآثار الإدارة المزمنة لمضادات الاكتئاب أحادية الأمين. على سبيل المثال ، ثبت أن مثبطات امتصاص السيروتونين الانتقائية (SSRIs) مثل سيتالوبرام وباروكستين وفلوكستين تمنع وتعكس anhedonia في ظل ظروف الإجهاد المزمن12,13. بالإضافة إلى ذلك ، أثبتت مضادات الاكتئاب الجديدة سريعة المفعول ، مثل الكيتامين ، فعاليتها في هذا النموذج.14,15. في المقابل ، فإن الاختبارات الأخرى مثل اختبار السباحة القسرية (FST) واختبار تعليق الذيل (TST) أقل موثوقية لنمذجة التغيرات السلوكية طويلة المدى ، وغالبا ما تعكس التكيف مع الإجهاد الحاد بدلا من تحمل أعراض الاكتئاب.16. تؤكد هذه الخصائص على الصلاحية القوية لنموذج CUMS في أبحاث الاكتئاب. واحدة من أبرز ميزات نموذج CUMS ، المعترف بها لموثوقيتها العالية في الدراسات الكلاسيكية ، هي anhedonia - عدم القدرة على تجربة المتعة أو الاهتمام بالأنشطة اليومية17,18. يتم تقييم هذه الظاهرة بشكل شائع باستخدام اختبارات تفضيل السكروز ، وقد ثبت أن العديد من مضادات الاكتئاب تعكس انخفاض استهلاك السكروز. كما يتم استخدام العديد من المقاييس الأخرى بشكل شائع في أدبيات CUMS ، بما في ذلك اختبار المجال المفتوح (OFT) ، الذي يقيم السلوك الحركي الإرادي ، والميول الاستكشافية ، والتوتر ، وبالتالي قياس شدة الاكتئاب19. اختبارات أخرى مثل المتاهة المرتفعة زائد (EPM) تقييم السلوكيات الشبيهة بالقلق ، اختبار متاهة موريس المائية (MWM) يفحص الأداء المعرفي20، ويقيم FST القابلية للمشاعر السلبية واليأس السلوكي20. علاوة على ذلك ، فإن غالبية الضغوطات التي تؤثر على البشر ذات طبيعة اجتماعية. الأفراد الذين لديهم علاقات اجتماعية دون المستوى الأمثل ، والتي تتميز بأنشطة اجتماعية وشبكات ودعم محدودة ، معرضون لخطر متزايد للإصابة بأمراض مختلفة21,22. هذا مهم أيضا في حالة القوارض ، الذين هم اجتماعية تعيش في مجموعات. على سبيل المثال ، تظهر الفئران التي يتم إيواؤها في عزلة خصائص ما يسمى بمتلازمة العزلة ، والتي تحفز الإجهاد الاجتماعي وتسرع ظهور الاكتئاب.23.
يفترض الطب المنغولي ، وهو فرع مهم من الطب الصيني ، أن ظهور المرض هو تفاعل معقد بين العوامل الجوهرية والخارجية. تشمل هذه العوامل الخارجية ، التي يشار إليها باسم الحالات المساعدة الأربعة ، تغير المناخ ، والنظام الغذائي ، ونمط الحياة ، والأحداث المفاجئة مثل العدوى والحوادث المذهلة والاضطرابات النفسية. يتم تصور عملية المرض على أنها تفاعل مستمر بين ثلاثة عناصر - يشار إليها باسم الأنواع الثلاثة من homors - والمكونات الجسدية السبعة بالتنسيق مع الحالات المساعدة الأربعة24. يرى الطب المنغولي أن جسم الإنسان يعمل ككيان متكامل ، يتم الحفاظ عليه من خلال توازن نسبي بين الهومورز الثلاثة. يعتبر الاضطراب في هذا التوازن مقدمة للمرض24. نظرا للدور المحوري للتجارب على في سد الفجوة بين الطب التقليدي والحديث ، فمن الأهمية بمكان تطوير نماذج حيوانية ذات صلة بالبحث في مجال الطب المنغولي. وفقا لذلك ، استخدمنا منهجية عزل لمدة 28 يوما إلى جانب CUMS لمحاكاة هذه الضغوطات الفسيولوجية والنفسية. اخترنا تسعة ضغوط محددة لا يمكن التنبؤ بها وسعينا إلى دعم طريقة النمذجة هذه من خلال نظرية هومورز الثلاثة للطب المنغولي. يعد إنشاء نموذج حيواني قوي أمرا أساسيا للنهوض بالبحوث الأساسية في الطب المنغولي وسيساهم بشكل كبير في دراساته التأسيسية.
Protocol
حصلت البروتوكولات التجريبية على موافقة من لجنة أخلاقيات رعاية التجارب على بجامعة منغوليا الطبية الداخلية (YKD202301172) والتزمت بإرشادات المعاهد الوطنية للصحة لرعاية وأخلاقياته. رقم الترخيص لمركز لدينا هو NO.110324230102364187. تم الحصول على أربعة وعشرين من ذكور فأر Sprague-Dawley (SD) ، كل منها يبلغ من العمر 8 أسابيع (200 جم ± 20 جم) ، وإيواؤها في بيئة خاضعة للرقابة بدرجة حرارة 22 درجة مئوية ± 2 درجة مئوية ورطوبة 55٪ ± 15٪. إطعام الفئران مع اتباع نظام غذائي صيانة القوارض والمياه النقية مع الكيزان الذرة للفراش. تعرضت الفئران لدورة ضوء / مظلمة لمدة 12 ساعة / 12 ساعة لمدة أسبوع واحد قبل التجربة.
1. إنشاء نموذج الفئران CUMS
- تجميع
- قسم الفئران ال 24 عشوائيا إلى مجموعتين: مجموعة التحكم (CON) ، والتي لن تتعرض للعزل أو الإجهاد ، ومجموعة النموذج (MOD). تحتوي كل مجموعة على 12 فأرا.
- ضع الفئران في أقفاص قياسية بقياس 55 سم × 40 سم × 20 سم ، مع 6 فئران لكل قفص. احتفظ بتخصيص القفص طوال فترة التأقلم ما لم يذكر خلاف ذلك.
- املأ كل قفص تربية بفراش جديد واستبدله مرتين في الأسبوع.
- إجراء فترة التأقلم 1 أسبوع. السماح للفئران بالوصول غير المقيد إلى الطعام والماء ، إلا أثناء تطبيق CUMS الضغط. الحفاظ على بيئة ثابتة مع درجة حرارة 22 درجة مئوية ± 2 درجة مئوية ، ورطوبة 55٪ ± 15٪ ، ودورة ضوء / مظلمة لمدة 12 ساعة / 12 ساعة من الساعة 08:00 إلى الساعة 20:00 ، ما لم ينص على خلاف ذلك.
- قبل بدء التجربة ، تعامل مع الفئران يوميا لتأقلمها مع الباحث وتقليل الضغط الإضافي أثناء المرحلة التجريبية.
- العزلة مع الإجهاد الخفيف المزمن غير المتوقع
- ضع مجموعات MOD و CON في نفس الوقت في غرف منفصلة. إيواء فئران مجموعة MOD بشكل فردي ، مع الحفاظ على فئران مجموعة CON معا. الحفاظ على جميع الشروط الأخرى ثابتة.
- تنفيذ نظام الإجهاد لمدة 28 يوما25. لمنع التعود ولضمان عدم القدرة على التنبؤ بالإجهاد ، قم بإدارة ضغوط عشوائية واحدة يوميا ، وتجنب استخدام نفس الضغوطات في أيام متتالية.
- قم بتطبيق أحد الضغوطات التسعة التالية بشكل عشوائي26,27 في أيام مختلفة: الحرمان من الماء لمدة 24 ساعة ، والحرمان من الطعام لمدة 24 ساعة ، والحشو الرطب ، وميل القفص ، وانعكاس دورة الضوء / الظلام ، والتعرض للبرد عند 4 درجات مئوية ، والتعرض للحرارة عند 45 درجة مئوية ، أو 1 دقيقة لقط الذيل ، أو 15 دقيقة من الاهتزاز عند 160 دورة في الدقيقة. ويرد التصميم المحدد في الجدول 1.
- أثناء تطبيق الضغوطات ، قم بتقييد الوصول إلى الطعام والماء لمجموعة MOD حتى ينتهي الضغط ، باستثناء أثناء انعكاس دورة الضوء / الظلام. لم يكن مطلوبا من مجموعة CON تقييد الماء والنظام الغذائي.
- طرق الإجهاد
- ابدأ التجربة من خلال تطبيق محفزات الاكتئاب بالتزامن مع العزل لمدة 28 يوما على جميع الفئران ، باستثناء المجموعة الضابطة. منزل هذه الفئران في أقفاص فردية. راجع الجدول 2 لمعرفة الحالات المتعلقة بمحفزات الاكتئاب.
- لتنفيذ طريقة مشبك الذيل ، قم بتأمين ذيل الفئران من مجموعة MOD عن طريق تثبيت الذيل بمشبك ورق قياسي على مسافة 1-2 سم من جذر ذيل الفئران. قم بقياس وقت التثبيت لمدة 1 دقيقة (ن = 12).
- في طريقة الحرمان من الماء ، احجب الماء عن فأر مجموعة MOD عن طريق إزالة زجاجة الماء الخاصة به وسجلها لمدة 24 ساعة.
ملاحظة: تم تسجيل وقت بدء الحرمان من المياه بحيث يمكن حساب وقت الانتهاء بدقة؛ لوحظ سلوك الفئران خلال هذه الفترة ، بما في ذلك النشاط والشهية والحالة العقلية. - في طريقة الحرمان من الطعام ، حجب الطعام عن فأر مجموعة MOD وسجل لمدة 24 ساعة.
ملاحظة: سجل الوقت الذي يبدأ فيه الحرمان من الطعام بحيث يمكن حساب وقت الانتهاء بدقة ؛ التأكد من أن الفئران رطبة بشكل كاف خلال هذه الفترة ؛ ومراقبة سلوك الفئران خلال هذه الفترة ، بما في ذلك النشاط والحالة العقلية ، إلخ. - للتحفيز البارد عند 4 درجات مئوية ، ضع فأرا من مجموعة MOD في دلو من الماء البارد وسجله لمدة 5 دقائق. تأكد من أن درجة حرارة الماء تظل ثابتة طوال الاختبار. في ختام التجربة ، جفف الفئران بمنفاخ وأعده إلى قفصه الأصلي.
ملاحظة: حافظ على درجة حرارة الماء البارد عند 4 درجات مئوية باستخدام مقياس حرارة ومكعبات ثلج لتنظيم درجة حرارة الماء عند ارتفاعه. يجب تغيير الماء بانتظام للتأكد من أن جودة المياه نظيفة ودرجة الحرارة ثابتة. عند السباحة ، يجب غمر جميع أطراف وجذوع الفئران في الماء البارد باستثناء الرأس. يجب أن يكون عمق الماء أكبر من طول جسم الجرذ لمنع الجرذ من القفز من الماء بسبب ملامسته لقاع الدلو. - لإدارة الإجهاد الحراري 45 درجة مئوية ، ضع فأر مجموعة MOD في حاضنة وسجل لمدة 5 دقائق ، مما يضمن بقاء درجة الحرارة مستقرة طوال الاختبار.
- في انعكاس دورة الضوء والظلام ، قم بتغليف القفص بقطعة قماش سوداء لمدة 1 ساعة لمحاكاة ظلام النهار. بعد ذلك ، قم بإضاءة القفص لمدة 12 ساعة أثناء الليل لتقليد ضوء النهار. سجل سلوك الفئران ، وتناول الطعام والماء ، وأنماط النوم لمدة 24 ساعة.
- لتجربة الحشو الرطب ، أدخل 200 مل من الماء في قفص يحتوي على 100 جرام من الحشو. إيواء فأر مجموعة MOD في القفص الرطب وتسجيل سلوك الفئران تحت ضغط الفراش الرطب ، بما في ذلك النشاط والشهية وتناول الماء وما إلى ذلك. لاحظ ما إذا كانت هناك أي سلوكيات غير طبيعية أو ردود فعل غير مريحة ، مثل حالة الجلد والشعر للفئران ، والتي قد تكون ناجمة عن الحشو الرطب ، وسجلها في الوقت المناسب للتحليل اللاحق لمدة 24 ساعة. بعد الاختبار ، جفف الفئران بمنفاخ وأعده إلى قفص به نشارة خشبية جديدة.
- في طريقة انحدار القفص ، ضع فأر مجموعة MOD في قفص مائل بزاوية 45 درجة على الحائط وسجل لمدة 24 ساعة. استخدم هيكل إطار القفص لضبط الزاوية وتثبيت القفص في مكانه.
ملاحظة: حساب الوقت من البداية إلى النهاية ومراقبة سلوك الفئران خلال فترة إمالة القفص بما في ذلك النشاط والشهية والحالة العقلية، والتأكد من ضبط زاوية القفص المائل بشكل صحيح وبقائه ثابتا لضمان دقة التجربة وقابليتها للتكرار. - للاهتزاز عالي السرعة ، ضع فأرا من مجموعة MOD في شاكر ميكانيكي مضبوط على 160 دورة في الدقيقة وسجل الجرذ لمدة 15 دقيقة. يتم استخدام طرق الاختبار السلوكي لاحقا لتقييم الإنشاء الناجح للنموذج.
- بعد تطبيق الضغوطات ، انقل أقفاص مجموعة MOD من غرفة CUMS إلى غرفة السكن. خلال فترة التعرض للإجهاد لمدة 4 أسابيع ، حافظ على مجموعة CON في أقفاصهم المنزلية الموجودة في غرفة السكن.
- الاحتياطات أثناء التجارب
- نقل أقفاص مجموعة MOD مرة أخرى إلى غرفة السكن العامة بعد تطبيق الضغط في غرفة CUMS.
- مراقبة الحيوانات أثناء نمذجة CUMS
- أثناء لقط الذيل ، من المرجح أن يكافح بسبب التحفيز المستحث. طوال هذه الفترة ، راقب المشبك باستمرار. إذا تم إزاحته ، فقم بإيقاف المؤقت مؤقتا ، وأعد تطبيق المشبك ، ثم استأنف المؤقت لمدة 1 دقيقة.
- لا تفرض الحرمان من الماء وضغوط الفراش الرطب في وقت واحد.
ملاحظة: يساعد تجنب الفرض المتزامن للحشو الرطب والحرمان من الماء في الحفاظ على سلامة التجارب ، ويقلل من المتغيرات المربكة ، ويعزز رفاهية. - قد تؤدي درجة حرارة جسم ودرجة حرارة الغرفة المحيطة إلى رفع درجة حرارة الماء أثناء السباحة في الماء البارد. لذلك ، اضبط عن طريق إضافة الماء المثلج أو مكعبات الثلج للحفاظ على درجة حرارة ثابتة للماء.
- مراقبة الفئران على فترات 30 دقيقة أثناء تطبيق الضغوطات ، إلا أثناء انعكاس النهار. انتبه بشكل خاص لعلامات الضيق غير العادي ، مثل الارتعاش أو الخمول أو قلة الحركة. إذا لوحظت مثل هذه الأعراض - خاصة انخفاض حرارة الجسم المحتمل أثناء السباحة في الماء البارد 4 درجات مئوية والفراش الرطب - قم بإزالة الجرذ على الفور من الضغط.
ملاحظة: قم بإزالة التجارب من الدراسة عندما يكون لديها مشاكل صحية ، مثل العدوى ، والصدمات الشديدة ، والسلوكيات العدوانية ، والحركة غير الطبيعية ، وما إلى ذلك ، وعادة ما تدور شروط إزالة من الدراسة حول حماية صحتهم وسلامتهم مع ضمان سلامة النتائج التجريبية. - إجراء عمليات تفتيش يومية للجروح أو غيرها من التشوهات الجسدية أو السلوكية في كل فئران. إذا لوحظت أي تشوهات ، استشر الطبيب البيطري المختبري لتحديد ما إذا كان ينبغي استبعاد الفئران من التجربة.
- تزن كل فأر كل 3 أيام. إذا فقد أكثر من 20٪ من وزن جسمه القاعدي قبل التغذية ، فيجب استبعاده من التجربة.
2. الاختبارات السلوكية
- للبدء ، قم بإعطاء محفزات الاكتئاب بالتزامن مع العزل لمدة 28 يوما لجميع الفئران ، باستثناء المجموعة الضابطة. منزل الفئران في أقفاص فردية. راجع الجدول 2 للحصول على تفاصيل حول حالات محفزات الاكتئاب.
- لاختبار المجال المفتوح ، قسم الصندوق الأسود إلى 25 قسما مربعا بمساحة متساوية. قم بتثبيت نظام تحليل تتبع الفيديو في المربع. ضع الجرذ في الساحة المركزية وراقب أنشطته الأفقية والرأسية لمدة 5 دقائق.
ملاحظة: أبعاد الصندوق 500 مم × 500 مم × 300 مم. سيتم جمع بيانات النشاط باستخدام نظام تتبع الفيديو لتقييم السلوكيات المرتبطة بالقلق في القوارض عند تعرضها لبيئة جديدة. - بعد ذلك ، قم بإحصاء عدد المربعات التي اجتازها الجرذ ، باستخدام جميع الكفوف ، لتحديد النشاط الأفقي. عد حالات الوقوف والاستمالة كمؤشرات للنشاط الرأسي. بعد كل اختبار ، قم بتعقيم الصندوق باستخدام 75٪ كحول للتخلص من أي روائح متبقية للفئران للاختبارات اللاحقة.
- بعد ذلك ، يتم تقييم anhedonia من خلال اختبار تفضيل السكروز. ضع زجاجتين على غطاء القفص: تحتوي الزجاجة A على ماء نقي ، بينما تحتوي الزجاجة B على محلول سكروز بنسبة 1٪. السماح بالوصول إلى كلا الحلين للفئران. قم بوزن الزجاجات قبل الاستهلاك وبعده لحساب معدلات تفضيل السكروز لمدة 60 دقيقة في الأيام 0 و 7 و 14 و 21 و 28. الصيغة هي كما يلي:
استهلاك السكروز =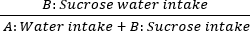 × 100٪
× 100٪ - لقياس الذاكرة المكانية وقدرات التعلم ، استخدم اختبار متاهة موريس المائية. قسم المجموعة إلى أربعة أرباع ، مرقمة من واحد إلى أربعة. ضع منصة استراحة مغمورة 1 سم تحت سطح الماء في الربع الثالث.
- أدخل الحليب إلى المسبح لزيادة عتامة الماء والحفاظ على درجة حرارة الماء حوالي 23 درجة مئوية طوال الإجراء التجريبي.
- ضع كل فأر في أرباع مختلفة من المتاهة ، مما يسمح لهم ب 120 ثانية لتحديد موقع المنصة المخفية. يجب أن تعتمد الفئران على الذاكرة المكانية ومهارات التعلم لتذكر موقع المنصة. بمجرد أن يتعلموا موقع المنصة ، يمكنهم السباحة إليها مباشرة. سجل وقت الكمون باستخدام نظام تتبع فيديو متاهة المياه موريس.
- ضع الفئران في مكان ثابت في حمام السباحة. إذا فشل الموضوع في تحديد موقع النظام الأساسي المخفي في غضون 120 ثانية ، فقم بتسجيل زمن الوصول على أنه 120 ثانية.
- أخيرا ، قم بإزالة المنصة المخفية ، ووضع الجرذ مرة أخرى في الماء ، وسجل عدد معابر المنطقة خلال فترة 120 ثانية.
3. التحليل الإحصائي
- لتقييم الاختلافات الكبيرة في المعلمات البيوكيميائية ، استخدم تحليل التباين أحادي الاتجاه (ANOVA) متبوعا باختبار دنكان اللاحق. قدم البيانات كمتوسط ± الخطأ المعياري (SE) واعتبر قيمة p أقل من 0.05 ذات دلالة إحصائية.
النتائج
نتائج الاختبارات السلوكية في نموذج اكتئاب الفئران الناجم عن CUMS
لتأكيد فعالية إجراء CUMS للحث على سلوكيات شبيهة بالاكتئاب ، تم إجراء فحص للتلاعب. تم تخصيص ذكور الفئران Sprague-Dawley (SD) بشكل عشوائي إما لمجموعة MOD أو CON لمدة 4 أسابيع ، كما هو موضح في الخطوة 1.2.3. بعد ذلك ، تم التضحية بالفئران ?...
Discussion
الاكتئاب هو اضطراب عقلي يتميز بأعراض مثل انخفاض الحالة المزاجية وقلة المتعة وانخفاض الطاقة30. في مجال أبحاث الاكتئاب ، يعد إنشاء نموذج حيواني موثوق به أمرا بالغ الأهمية لتعزيز التدخلات العلاجية. من بين النماذج الحيوانية المختلفة ، يعد نموذج CUMS جديرا بالملاحظة بشكل خاص لموثوق...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نحن ممتنون للأجهزة والمختبرات المقدمة من قبل نعرب عن امتناننا لكلية الطب المنغولية في الجامعة الطبية المنغولية الداخلية ، الصين.تم دعم هذه الدراسة من قبل ، لتوفير الأجهزة اللازمة ومرافق المختبرات. وتلقت هذه الدراسة دعما ماليا من المؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 81760762) ومشروع جامعة منغوليا الطبية الداخلية في الصين (المنحة رقم. YKD2022MS074)، ومشروع البحث العلمي للتعليم العالي في منغوليا الداخلية، الصين (المنحة رقم. NJZY22661) ومشروع الصندوق المفتوح للمختبر الرئيسي للطب الصيني والمنغولي في منطقة منغوليا الداخلية المتمتعة بالحكم الذاتي ، الصين (المنحة رقم. MYX2023-K07).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tube | service Biotechnology Co., Ltd | EP-150-M | |
| 1000 µL Pipette | service Biotechnology Co., Ltd | IC021198160223 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | IC012395160823 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | TP-10 | |
| 1250 µL pipette tip | service Biotechnology Co., Ltd | TP-1250 | |
| 2 mL centrifuge tube | service Biotechnology Co., Ltd | EP-200-M | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | TP-200 | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | IC021029160323 | |
| 300 µL Multi-Channel Pipette | service Biotechnology Co., Ltd | IC091006161022 | |
| 50 µL Pipette | service Biotechnology Co., Ltd | DS35110 | |
| Automatic plate washing machine | rayto Life Sciences Co., Ltd | RT-3100 | |
| Benchtop High-Speed Freezing Centrifuge | dalong construction Co., Ltd | D3024R | |
| electronic balance | Mettler Toledo International Trade (Shanghai) Co., Ltd | ME203E/02 | |
| Electrothermal blast drying oven | Labotery Experimental Instrument Equipment Co., Ltd | GEL-70 | |
| Enzyme Label Detector | BioTeK Co., Ltd | Epoch | |
| High Speed Tissue Grinder | service Biotechnology Co., Ltd | KZ- -F -F | |
| Horizontal Freezer | Mellow Group Co., Ltd | BCD-318AT | |
| Laboratory Ultrapure Water Machine | Jinan Aiken Environmental Protection Technology Co., Ltd | AK-RO-C2 | |
| Morris water maze video trail analysing system | Tai Meng Tech Co., Ltd | WMT-200 | |
| Rat 5-HT ELISA Kit | Lian Ke bio Co., Ltd,China | 96T/48T | |
| SPF grade Sprague Dawley (SD) rats | SPF (Beijing) Biotechnology Co | SCXK(JING)2019-0010 | |
| Sprague Dawley rats | Beijing Biotechnology Co., Ltd, China | SCXK (JING) 2019-0010 | |
| Vertical Refrigerated Display Cabinet | Xingx Group Co., Ltd | LSC-316C | |
| video tracking system | Tai Meng Tech Co., Ltd | ZH-ZFT | |
| vortex mixer | Servicebio technology Co., Ltd | MV-100 |
References
- Alqurashi, G. K., et al. The impact of chronic unpredictable mild stress-induced depression on spatial, recognition and reference memory tasks in mice: Behavioral and histological study. Behav Sci. 12 (6), 166 (2022).
- Yu, S., Wang, L., Jing, X., Wang, Y., An, C. Features of gut microbiota and short-chain fatty acids in patients with first-episode depression and their relationship with the clinical symptoms. Front Psychol. 14, 1088268 (2023).
- Duda, P., Hajka, D., Wójcicka, O., Rakus, D., Gizak, A. Gsk3β: A master player in depressive disorder pathogenesis and treatment responsiveness. Cells. 9 (3), 727 (2020).
- Correia, A. S., Vale, N. Tryptophan metabolism in depression: A narrative review with a focus on serotonin and kynurenine pathways. Int J Mol Sci. 23 (15), 8493 (2022).
- Hao, Y., Ge, H., Sun, M., Gao, Y. Selecting an appropriate animal model of depression. Int J Mol Sci. 20 (19), 4827 (2019).
- Willner, P., Towell, A., Sampson, D., Sophokleous, S., Muscat, R. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant. Psychopharmacology (Berl). 93 (3), 358-364 (1987).
- Nakase, S., Kitayama, I., Soya, H., Hamanaka, K., Nomura, J. Increased expression of magnocellular arginine vasopressin mrna in paraventricular nucleus of stress-induced depression-model rats. Life Sci. 63 (1), 23-31 (1998).
- Wu, X., et al. Involvement of kynurenine pathway between inflammation and glutamate in the underlying etiopathology of cums-induced depression mouse model. BMC Neurosci. 23 (1), 62 (2022).
- Zhang, C., et al. Minocycline ameliorates depressive behaviors and neuro-immune dysfunction induced by chronic unpredictable mild stress in the rat. Behav Brain Res. 356, 348-357 (2019).
- Ma, J., Wang, R., Chen, Y., Wang, Z., Dong, Y. 5-HT attenuates chronic stress-induced cognitive impairment in mice through intestinal flora disruption. J Neuroinflammation. 20 (1), 23 (2023).
- Nollet, M. Models of depression: Unpredictable chronic mild stress in mice. Curr Protoc. 1 (8), e208 (2021).
- Becker, M., Pinhasov, A., Ornoy, A. Animal models of depression: What can they teach us about the human disease. Diagnostics (Basel). 11 (1), 123 (2021).
- Petkovic, A., Chaudhury, D. Encore: Behavioural animal models of stress, depression and mood disorders. Front Behav Neurosci. 16, 931964 (2022).
- Okine, T., Shepard, R., Lemanski, E., Coutellier, L. Sex differences in the sustained effects of ketamine on resilience to chronic stress. Front Behav Neurosci. 14, 581360 (2020).
- Fitzgerald, P. J., et al. Sex- and stress-dependent effects of a single injection of ketamine on open field and forced swim behavior. Stress. 24 (6), 857-865 (2021).
- Doron, R., Burstein, O. The unpredictable chronic mild stress protocol for inducing anhedonia in mice. J Vis Exp. (140), e58184 (2018).
- De Vry, J., Schreiber, R. The chronic mild stress depression model: Future developments from a drug discovery perspective. Psychopharmacology (Berl). 134 (4), 349-350 (1997).
- Tong, J., et al. Antidepressant effect of helicid in chronic unpredictable mild stress model in rats. Int Immunopharmacol. 67, 13-21 (2019).
- Liu, H., et al. Tnf signaling pathway-mediated microglial activation in the pfc underlies acute paradoxical sleep deprivation-induced anxiety-like behaviors in mice. Brain Behav Immun. 100, 254-266 (2022).
- He, L. W., et al. Optimization of food deprivation and sucrose preference test in sd rat model undergoing chronic unpredictable mild stress. Animal Model Exp Med. 3 (1), 69-78 (2020).
- Ma, W., Wu, B., Gao, X., Zhong, R. Association between frailty and cognitive function in older chinese people: A moderated mediation of social relationships and depressive symptoms. J Affect Disord. 316, 223-232 (2022).
- Geng, C., et al. Systematic impacts of chronic unpredictable mild stress on metabolomics in rats. Sci Rep. 10 (1), 700 (2020).
- Holmes, T. H., Rahe, R. H. The social readjustment rating scale. J Psychosom Res. 11 (2), 213-218 (1967).
- Zhang, M., et al. Shuxie-1 decoction alleviated cums -induced liver injury via il-6/jak2/stat3 signaling. Front Pharmacol. 13, 848355 (2022).
- Antoniuk, S., Bijata, M., Ponimaskin, E., Wlodarczyk, J. Chronic unpredictable mild stress for modeling depression in rodents: Meta-analysis of model reliability. Neurosci Biobehav Rev. 99, 101-116 (2019).
- Hu, C., et al. Re-evaluation of the interrelationships among the behavioral tests in rats exposed to chronic unpredictable mild stress. PLoS One. 12 (9), e0185129 (2017).
- Li, Y., et al. Increased hippocampal fissure width is a sensitive indicator of rat hippocampal atrophy. Brain Res Bull. 137, 91-97 (2018).
- Hu, R. L. B. G., et al. Effects of the Mongolian medicine Zadi-5 on monoamine neurotransmitters in the brain of rats with chronic stress depression model. Info Traditional Chinese Med. 34 (06), 5-8 (2017).
- Zhou, Y., Cong, Y., Liu, H. Folic acid ameliorates depression-like behaviour in a rat model of chronic unpredictable mild stress. BMC Neurosci. 21 (1), 1 (2020).
- Zhuang, Y., Zeng, R., Liu, X., Yang, L., Chan, Z. Neoagaro-oligosaccharides ameliorate chronic restraint stress-induced depression by increasing 5-ht and bdnf in the brain and remodeling the gut microbiota of mice. Mar Drugs. 20 (11), 725 (2022).
- Socała, K., et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacol Res. 172, 105840 (2021).
- Song, J., Kim, Y. K. Animal models for the study of depressive disorder. CNS Neurosci Ther. 27 (6), 633-642 (2021).
- Abelaira, H. M., Réus, G. Z., Quevedo, J. Animal models as tools to study the pathophysiology of depression. Braz J Psychiatry. 35 Suppl 2, S112-S120 (2013).
- Strekalova, T., et al. Chronic mild stress paradigm as a rat model of depression: Facts, artifacts, and future perspectives. Psychopharmacology (Berl). 239 (3), 663-693 (2022).
- Markov, D. D. Sucrose preference test as a measure of anhedonic behavior in a chronic unpredictable mild stress model of depression: Outstanding issues. Brain Sci. 12 (10), 1287 (2022).
- Czéh, B., Fuchs, E., Wiborg, O., Simon, M. Animal models of major depression and their clinical implications. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 64, 293-310 (2016).
- Gururajan, A., Reif, A., Cryan, J. F., Slattery, D. A. The future of rodent models in depression research. Nat Rev Neurosci. 20 (11), 686-701 (2019).
- Markov, D. D., Novosadova, E. V. Chronic unpredictable mild stress model of depression: Possible sources of poor reproducibility and latent variables. Biology (Basel). 11 (11), 1621 (2022).
- Willner, P. The chronic mild stress (cms) model of depression: History, evaluation and usage. Neurobiol Stress. 6, 78-93 (2017).
- Lages, Y. V. M., Rossi, A. D., Krahe, T. E., Landeira-Fernandez, J. Effect of chronic unpredictable mild stress on the expression profile of serotonin receptors in rats and mice: A meta-analysis. Neurosci Biobehav Rev. 124, 78-88 (2021).
- Willner, P., et al. Validation of chronic mild stress in the wistar-kyoto rat as an animal model of treatment-resistant depression. Behavioural Pharmacology. 30 (2 and 3), 239-250 (2019).
- Slattery, D. A., Cryan, J. F. Modelling depression in animals: At the interface of reward and stress pathways. Psychopharmacology (Berl). 234 (9-10), 1451-1465 (2017).
- Sterley, T. L., et al. Social transmission and buffering of synaptic changes after stress. Nat Neurosci. 21 (3), 393-403 (2018).
- Brechbühl, J., et al. Mouse alarm pheromone shares structural similarity with predator scents. Proc Natl Acad Sci U S A. 110 (12), 4762-4767 (2013).
- Beck, R. C., Self, J. L., Carter, D. J. Sucrose preference thresholds for satiated and water-deprived rats. Psychol Rep. 16, 901-905 (1965).
- Hawkins, P., Golledge, H. D. R. The 9 to 5 rodent - time for change? Scientific and animal welfare implications of circadian and light effects on laboratory mice and rats. J Neurosci Methods. 300, 20-25 (2018).
- Daut, R. A., Ravenel, J. R., Watkins, L. R., Maier, S. F., Fonken, L. K. The behavioral and neurochemical effects of an inescapable stressor are time of day dependent. Stress. 23 (4), 405-416 (2020).
- Hu, R. L. B. G., et al. Experimental research on nutmeg wuwei pills against of depression model rats behavior and hippocampus monoamine neurotransmitters. Chinese J Exp Traditional Medical Formulae. 21 (11), 146-149 (2015).
- Hu, R. L. B. G., et al. Effects of Rou kou Wuwei Pill on the learning and memory abilities and the expression of BDNF and TrkB in hippocampus of depression rats. Chinese J Traditional Chines Med Pro. 32 (8), 3797-3800 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved