Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estrés crónico impredecible leve en ratas basado en la medicina mongola
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un modelo de estrés leve crónico impredecible (CUMS) para la depresión basado en la teoría médica mongola, junto con métodos para validar las pruebas de comportamiento.
Resumen
La depresión es un trastorno afectivo prevalente y constituye una de las principales causas de discapacidad en todo el mundo. Las limitaciones de las intervenciones farmacológicas actuales contribuyen a la importante carga sanitaria que se atribuye a esta afección. Existe una necesidad apremiante de una comprensión más profunda de los mecanismos subyacentes de la depresión, lo que hace que los modelos preclínicos con potencial traslacional sean muy valiosos. La medicina mongola, un subconjunto de la medicina tradicional, postula que la aparición de enfermedades está estrechamente relacionada con el equilibrio del viento, la bilis y la flema. En este estudio, presentamos un protocolo para el método de estrés leve crónico impredecible (CUMS) en ratas. Dentro de este marco, las ratas se someten a una serie de factores estresantes fluctuantes y leves para inducir un fenotipo similar a la depresión, imitando la patogénesis de la depresión humana. Los ensayos conductuales empleados en este protocolo incluyen la prueba de preferencia de sacarosa (SPT), indicativa de anhedonia, un síntoma central de la depresión; la prueba de campo abierto (OFT), que mide los niveles de ansiedad; y la prueba del laberinto acuático de Morris (MWM), que evalúa la memoria espacial y las habilidades de aprendizaje. El método CUMS demuestra la capacidad de inducir anhedonia y causar déficits conductuales a largo plazo. Además, este protocolo está más alineado con la teoría médica mongola que otros modelos animales diseñados para provocar un comportamiento similar a la depresión. El desarrollo de este modelo animal y la investigación posterior proporcionan una base sólida para futuros estudios innovadores en el ámbito de la medicina mongola.
Introducción
El trastorno depresivo mayor (TDM) es una enfermedad mental prevalente, que se sitúa como la tercera causa de discapacidad a nivel mundial y afecta a más de 300 millones de personas1,2,3. En particular, se estima que al menos la mitad de las personas afectadas no reciben el tratamiento adecuado4. Dada esta brecha, los modelos animales sirven como una herramienta crucial para investigar la etiología de la depresión. Hasta la fecha, existen más de 20 modelos animales diferentes para la depresión5. Entre estos, el modelo de estrés leve crónico impredecible (CUMS), refinado por Paul Winer en 1987, es el más utilizado6. El modelo CUMS opera sobre la premisa de que exponer a los roedores a una amplia gama de factores estresantes socioambientales conduce a síntomas similares a la ansiedad, la tensión y la depresión. La metodología consiste en exponer a los animales a varios factores estresantes leves durante varias semanas, que culminan en una serie de alteraciones del comportamiento, como la anhedonia y los comportamientos depresivos7,8. Estos cambios van acompañados de cambios en los perfiles endocrinos y de neurotransmisores, como una reducción de la 5-HT9,10. Estos resultados son muy similares a los observados en humanos diagnosticados con TDM, lo que valida la utilidad del modelo. El modelo CUMS es particularmente valorado por su efectividad en la evaluación de antidepresivos, manifestando altos niveles de validez superficial, estructural y predictiva11,12. A diferencia de otros modelos, el CUMS es sensible a los efectos de la administración crónica de antidepresivos monoaminérgicos. Por ejemplo, se ha demostrado que los inhibidores selectivos de la recaptación de serotonina (ISRS) como el citalopram, la paroxetina y la fluoxetina previenen y revierten la anhedonia en condiciones de estrés crónico12,13. Además, los nuevos antidepresivos de acción rápida, como la ketamina, también han demostrado eficacia en este modelo14,15. Por el contrario, otras pruebas como la prueba de natación forzada (FST) y la prueba de suspensión de cola (TST) son menos confiables para modelar cambios de comportamiento a largo plazo, a menudo reflejando adaptaciones al estrés agudo en lugar de soportar síntomas de depresión16. Estas características subrayan la robusta validez del modelo CUMS en la investigación de la depresión. Una de las características más sobresalientes del modelo CUMS, reconocido por su alta fiabilidad en los estudios clásicos, es la anhedonia, la incapacidad de experimentar placer o interés en las actividades cotidianas17,18. Este fenómeno se evalúa comúnmente utilizando pruebas de preferencia por la sacarosa, y se ha demostrado que muchos antidepresivos revierten la reducción del consumo de sacarosa. Varias otras métricas también se emplean comúnmente en la literatura de CUMS, incluida la prueba de campo abierto (OFT), que evalúa el comportamiento motor voluntario, las tendencias exploratorias y la tensión, midiendo así la gravedad de la depresión19. Otras pruebas, como el laberinto elevado (EPM) para evaluar comportamientos similares a la ansiedad, mientras que el test del laberinto acuático de Morris (MWM) examina el funcionamiento cognitivo20, y el FST evalúa la susceptibilidad a las emociones negativas y a la desesperación conductual20. Además, la mayoría de los factores estresantes que afectan a los seres humanos son de naturaleza social. Las personas con relaciones sociales subóptimas, caracterizadas por actividades sociales, redes y apoyo limitados, tienen un mayor riesgo de padecer diversas enfermedades21,22. Esto también es relevante en el caso de los roedores, que son animales sociales que viven en grupos. Por ejemplo, las ratas que se alojan en aislamiento exhiben características de lo que se denomina síndrome de aislamiento, que induce estrés social y acelera la aparición de la depresión23.
La medicina mongola, una rama importante de la medicina china, postula que la aparición de enfermedades es una interacción compleja entre factores intrínsecos y externos. Estos factores externos, conocidos como las cuatro condiciones auxiliares, abarcan el cambio climático, la dieta, el estilo de vida y eventos repentinos como infecciones, incidentes sorprendentes y trastornos psicológicos. El proceso de la enfermedad se conceptualiza como una interacción continua entre tres elementos, denominados los tres tipos de homores, y los Siete Constituyentes Corporales en concierto con lascuatro condiciones auxiliares. La medicina mongola sostiene que el cuerpo humano funciona como una entidad integrada, mantenida por un equilibrio relativo entre los tres homors. Se considera que una ruptura de este equilibrio es precursora de la enfermedad24. Dado el papel fundamental de la experimentación animal en la tendencia de puentes entre la medicina tradicional y la moderna, es crucial desarrollar modelos animales que sean relevantes para la investigación en el campo de la medicina mongola. En consecuencia, empleamos una metodología de aislamiento de 28 días junto con CUMS para simular estos factores estresantes fisiológicos y psicológicos. Seleccionamos nueve factores estresantes impredecibles específicos y buscamos respaldar este método de modelado a través de la teoría de los tres homores de la medicina mongola. El establecimiento de un modelo animal robusto es fundamental para avanzar en la investigación básica en medicina mongola y contribuirá significativamente a sus estudios fundamentales.
Protocolo
Los protocolos experimentales recibieron la aprobación del Comité de Ética del Cuidado de Experimentos Animales de la Universidad Médica de Mongolia Interior (YKD202301172) y se adhirieron a las pautas de los Institutos Nacionales de Salud para el cuidado y la ética de los animales. El número de licencia de nuestro centro de animales es NO.110324230102364187. Veinticuatro ratas macho Sprague-Dawley (SD), de 8 semanas de edad (200 g ± 20 g), fueron adquiridas y alojadas en un ambiente controlado con una temperatura de 22 °C ± 2 °C y una humedad de 55% ± 15%. Alimente a las ratas con una dieta de mantenimiento para roedores y agua pura con mazorcas de maíz como cama. Las ratas fueron sometidas a un ciclo de luz/oscuridad de 12 h/12 h durante 1 semana antes de la experimentación.
1. Establecimiento del modelo de rata CUMS
- Agrupación
- Divida las 24 ratas aleatoriamente en 2 grupos: el grupo de control (CON), que no estará expuesto al aislamiento ni al estrés, y el grupo modelo (MOD). Cada grupo contiene 12 ratas.
- Aloja a las ratas en jaulas estándar de 55 cm x 40 cm x 20 cm, con 6 ratas por jaula. Conserve la asignación de jaulas durante todo el período de aclimatación, a menos que se indique lo contrario.
- Llene cada jaula de cría con ropa de cama limpia y reemplácela dos veces por semana.
- Realice un período de aclimatación de 1 semana. Permita que las ratas tengan acceso irrestricto a la comida y al agua, excepto durante la aplicación de factores estresantes de CUMS. Mantenga un ambiente constante con una temperatura de 22 °C ± 2 °C, una humedad del 55 % ± un 15 % y un ciclo de luz/oscuridad de 12 h/12 h de 08:00 a 20:00, a menos que se indique lo contrario.
- Antes de iniciar el experimento, manipule las ratas diariamente para aclimatarlas al investigador y minimizar el estrés adicional durante la fase experimental.
- Aislamiento con estrés leve crónico impredecible
- Al mismo tiempo, coloque los grupos MOD y CON en habitaciones separadas. Aloje a las ratas del grupo MOD individualmente, mientras mantiene juntas a las ratas del grupo CON. Mantenga todas las demás condiciones constantes.
- Implementar un régimen de 28 días para factores estresantes25. Para prevenir la habituación y asegurar la imprevisibilidad del factor estresante, administre un factor estresante aleatorio por día, evitando el uso del mismo factor estresante en días consecutivos.
- Aplique aleatoriamente uno de los siguientes nueve factores estresantes26,27 en días diferentes: 24 h de privación de agua, 24 h de privación de alimentos, acolchado húmedo, inclinación de la jaula, inversión del ciclo de luz/oscuridad, exposición al frío a 4 °C, exposición al calor a 45 °C, 1 min de sujeción de la cola o 15 min de agitación a 160 rpm. El diseño específico se describe en la Tabla 1.
- Durante la aplicación del estresor, restrinja el acceso a alimentos y agua al grupo MOD hasta que el estrés haya terminado, excepto durante la inversión del ciclo de luz/oscuridad. El grupo CON no estaba obligado a restringir el agua y la dieta.
- Métodos de estrés
- Inicie el experimento aplicando estímulos de depresión junto con un aislamiento de 28 días a todas las ratas, excluyendo el grupo de control. Aloja a estas ratas en jaulas individuales. Consulte la Tabla 2 para conocer las afecciones relacionadas con los estímulos depresivos.
- Para realizar el método de sujeción de la cola, asegure la cola de una rata del grupo MOD sujetando la cola con un clip estándar a una distancia de 1-2 cm de la raíz de la cola de la rata. Mida el tiempo de sujeción durante 1 min (n = 12).
- En el método de privación de agua, retenga el agua de una rata del grupo MOD quitando su botella de agua y registre durante 24 h.
NOTA: La hora del inicio de la privación de agua se registró para que la hora de finalización pudiera calcularse con precisión; Se observó el comportamiento de las ratas durante este período, incluyendo actividad, apetito y estado mental. - En el método de privación de alimentos, retenga la comida de una rata del grupo MOD y registre durante 24 h.
NOTA: Registre la hora en que comienza la privación de alimentos para que la hora de finalización se pueda calcular con precisión; asegurarse de que las ratas estén adecuadamente hidratadas durante este período; y observar el comportamiento de las ratas durante este período, incluyendo la actividad y el estado mental, etcétera. - Para la estimulación en frío a 4 °C, coloque una rata del grupo MOD en un cubo de agua fría y registre durante 5 min. Asegúrese de que la temperatura del agua permanezca constante durante toda la prueba. Al final del experimento, seca la rata con un soplador y devuélvela a su jaula original.
NOTA: Mantenga la temperatura del agua fría a 4 °C utilizando un termómetro y cubitos de hielo para regular la temperatura del agua cuando sube. El agua debe cambiarse regularmente para garantizar que la calidad del agua esté limpia y la temperatura sea constante. Al nadar, todas las extremidades y trompas de las ratas deben sumergirse en agua fría, excepto la cabeza. La profundidad del agua debe ser mayor que la longitud del cuerpo de la rata para evitar que la rata salte fuera del agua debido al contacto con el fondo del balde. - Para administrar un estrés térmico de 45 °C, coloque una rata del grupo MOD en una incubadora y registre durante 5 minutos, asegurándose de que la temperatura permanezca estable durante toda la prueba.
- En la inversión del ciclo de luz-oscuridad, envuelva la jaula en un paño negro durante 1 h para simular la oscuridad diurna. Posteriormente, ilumine la jaula durante 12 h durante la noche para imitar la luz del día. Registre el comportamiento de la rata, la ingesta de comida y agua y los patrones de sueño durante 24 horas.
- Para el experimento de relleno húmedo, introduzca 200 ml de agua en una jaula que contenga 100 g de relleno. Aloje una rata del grupo MOD en la jaula húmeda y registre el comportamiento de las ratas bajo el estrés de la cama mojada, incluida la actividad, el apetito, la ingesta de agua, etcétera. Observe si hay comportamientos anormales o reacciones incómodas, como el estado de la piel y el pelo de las ratas, que pueden ser causados por el acolchado mojado, y regístrelos a tiempo para su posterior análisis durante 24 horas. Después de la prueba, seca la rata con un soplador y devuélvela a una jaula con virutas de madera fresca.
- En el método de inclinación de la jaula, coloque una rata del grupo MOD en una jaula inclinada en un ángulo de 45° contra una pared y registre durante 24 h. Utilice la estructura del marco de la jaula para ajustar el ángulo y asegurar la jaula en su lugar.
NOTA: Calcule el tiempo desde el principio hasta el final y observe el comportamiento de las ratas durante el período de inclinación de la jaula, incluida la actividad, el apetito y el estado mental, y asegúrese de que el ángulo de la jaula inclinada esté configurado correctamente y permanezca estable para garantizar la precisión y reproducibilidad del experimento. - Para agitar a alta velocidad, coloque una rata del grupo MOD en un agitador mecánico ajustado a 160 rpm y registre la rata durante 15 minutos. Posteriormente, se utilizan métodos de prueba de comportamiento para evaluar el establecimiento exitoso del modelo.
- Después de aplicar los factores estresantes, reubique las jaulas del grupo MOD de la sala CUMS a la sala de alojamiento. Durante el período de exposición al estrés de 4 semanas, mantenga al grupo CON en sus jaulas de casa situadas en la sala de alojamiento.
- Precauciones durante los experimentos
- Transfiera las jaulas del grupo MOD a la sala de alojamiento general después de aplicar el factor estresante en la sala CUMS.
- Seguimiento de animales durante el modelado CUMS
- Durante el pinzamiento de la cola, es probable que el animal tenga dificultades debido a la estimulación inducida. A lo largo de este período, controle continuamente la abrazadera. Si se desprende, detenga el temporizador, vuelva a aplicar la pinza y luego reanude el temporizador durante 1 minuto.
- No imponga simultáneamente factores estresantes de privación de agua y ropa de cama mojada.
NOTA: Evitar la imposición simultánea de almohadillas húmedas y la privación de agua ayuda a mantener la integridad experimental, reduce las variables de confusión y promueve el bienestar animal. - La temperatura corporal del animal y la temperatura ambiente de la habitación pueden elevar la temperatura del agua durante la natación en agua fría. Por lo tanto, ajuste agregando agua helada o cubitos de hielo para mantener una temperatura constante del agua.
- Observe a las ratas a intervalos de 30 minutos durante la aplicación de los factores estresantes, excepto durante la reversión diurna. Preste especial atención a los signos de angustia inusual, como escalofríos, letargo o falta de movimiento. Si se observan tales síntomas, en particular una hipotermia potencial durante la natación en agua fría a 4 °C y la ropa de cama mojada, retire inmediatamente a la rata del factor estresante.
NOTA: Retirar a los animales de experimentación del estudio cuando tengan problemas de salud, como infección, traumatismos graves, comportamientos agresivos, movilidad anormal, etcétera. Las condiciones para retirar a los animales del estudio suelen girar en torno a la protección de su salud y seguridad, al tiempo que se garantiza la integridad de los resultados experimentales. - Realice inspecciones diarias para detectar heridas u otras anomalías físicas o de comportamiento en cada rata. Si se observa alguna anomalía, consulte al veterinario del laboratorio para determinar si la rata debe excluirse del experimento.
- Pesa cada rata cada 3 días. Si un animal pierde más del 20% de su peso corporal basal previo a la alimentación, debe ser excluido del experimento.
2. Pruebas de comportamiento
- Para empezar, administre los estímulos de depresión junto con el aislamiento durante 28 días a todas las ratas, excluyendo el grupo de control. Aloja a las ratas en jaulas individuales. Consulte la Tabla 2 para obtener información específica sobre las condiciones de estímulos depresivos.
- Para la prueba de campo abierto, divida una caja negra en 25 secciones cuadradas de área igual. Instale un sistema de análisis de seguimiento de video en la caja. Coloque la rata en el cuadrado central y controle sus actividades horizontales y verticales durante 5 minutos.
NOTA: Las dimensiones de la caja son 500 mm x 500 mm x 300 mm. Los datos de actividad se recopilarán utilizando el sistema de seguimiento de video para evaluar los comportamientos relacionados con la ansiedad en los roedores cuando se exponen a un entorno nuevo. - Posteriormente, cuenta el número de cuadrados atravesados por la rata, utilizando todas las patas, para cuantificar la actividad horizontal. Cuente los casos de estar de pie y acicalarse como indicadores de actividad vertical. Después de cada prueba, desinfecte la caja con alcohol al 75% para eliminar cualquier olor residual de rata para pruebas posteriores.
- A continuación, se evalúa la anhedonia a través de la prueba de preferencia de sacarosa. Coloque dos botellas en la tapa de la jaula: la botella A contiene agua pura, mientras que la botella B contiene una solución de sacarosa al 1%. Permitir el acceso ad libitum a ambas soluciones para la rata. Pese los frascos antes y después del consumo para calcular las tasas de preferencia de sacarosa de 60 minutos en los días 0, 7, 14, 21 y 28. La fórmula es la siguiente:
Consumo de sacarosa =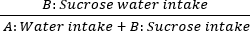 × 100%
× 100% - Para medir la memoria espacial y las habilidades de aprendizaje, emplee la prueba del laberinto acuático de Morris. Divida la piscina en cuatro cuadrantes, numerándolos del uno al cuatro. Coloque una plataforma de descanso sumergida a 1 cm por debajo de la superficie del agua en el tercer cuadrante.
- Introducir leche en la piscina para aumentar la opacidad del agua y mantener una temperatura del agua de aproximadamente 23 °C durante todo el procedimiento experimental.
- Coloque cada rata en varios cuadrantes del laberinto, permitiéndoles 120 segundos para localizar la plataforma oculta. Las ratas deben confiar en la memoria espacial y las habilidades de aprendizaje para recordar la ubicación de la plataforma. Una vez que aprenden la ubicación de la plataforma, pueden nadar directamente hacia ella. Registre el tiempo de latencia utilizando el sistema de seguimiento de video del laberinto acuático Morris.
- Coloca a la rata en un lugar fijo de la piscina. Si el sujeto no logra localizar la plataforma oculta dentro de los 120 s, registre la latencia como 120 s.
- Finalmente, retire la plataforma oculta, vuelva a colocar la rata en el agua y registre el número de cruces de zona durante un período de 120 s.
3. Análisis estadístico
- Para evaluar las diferencias significativas en los parámetros bioquímicos, se empleó el análisis de varianza unidireccional (ANOVA) seguido de la prueba post hoc de Duncan. Presentar los datos como media ± error estándar (SE) y considerar un valor p inferior a 0,05 como estadísticamente significativo.
Resultados
Resultados de las pruebas de comportamiento en el modelo de depresión en ratas inducida por CUMS
Para corroborar la eficacia del procedimiento CUMS para inducir conductas similares a la depresión, se realizó un control de manipulación. Las ratas macho Sprague-Dawley (SD) se asignaron aleatoriamente al grupo MOD o CON durante un período de 4 semanas, como se describe en el paso 1.2.3. Posteriormente, las ratas fueron sacrificadas y sus hipocampos fueron completamente diseccionados para la evaluaci...
Discusión
La depresión es un trastorno mental caracterizado por síntomas como bajo estado de ánimo, falta de placer y disminuciónde la energía. En el campo de la investigación de la depresión, el establecimiento de un modelo animal fiable es crucial para avanzar en las intervenciones terapéuticas. Entre varios modelos animales, el modelo CUMS es particularmente notable por su alta confiabilidad, validez y su congruencia con las características de la depresión humana31. Es m...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Estamos agradecidos por la instrumentación y el laboratorio proporcionados porextender nuestra gratitud a la facultad de medicina mongola de la Universidad Médica de Mongolia Interior, China.Este estudio fue apoyado por, por proporcionar la instrumentación necesaria y las instalaciones de laboratorio. Este estudio recibió apoyo financiero de la Fundación Nacional de Ciencias Naturales de China (Subvención Nº 81760762) y del Proyecto de la Universidad Médica de Mongolia Interior de China (Subvención Nº. YKD2022MS074), y el Proyecto de Investigación Científica de la Educación Superior en Mongolia Interior (China) (Subvención No. NJZY22661) y el Proyecto de Fondo Abierto del Laboratorio Clave de Medicina China y Mongolia en la Región Autónoma de Mongolia Interior, China (Subvención No. MYX2023-K07).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tube | service Biotechnology Co., Ltd | EP-150-M | |
| 1000 µL Pipette | service Biotechnology Co., Ltd | IC021198160223 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | IC012395160823 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | TP-10 | |
| 1250 µL pipette tip | service Biotechnology Co., Ltd | TP-1250 | |
| 2 mL centrifuge tube | service Biotechnology Co., Ltd | EP-200-M | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | TP-200 | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | IC021029160323 | |
| 300 µL Multi-Channel Pipette | service Biotechnology Co., Ltd | IC091006161022 | |
| 50 µL Pipette | service Biotechnology Co., Ltd | DS35110 | |
| Automatic plate washing machine | rayto Life Sciences Co., Ltd | RT-3100 | |
| Benchtop High-Speed Freezing Centrifuge | dalong construction Co., Ltd | D3024R | |
| electronic balance | Mettler Toledo International Trade (Shanghai) Co., Ltd | ME203E/02 | |
| Electrothermal blast drying oven | Labotery Experimental Instrument Equipment Co., Ltd | GEL-70 | |
| Enzyme Label Detector | BioTeK Co., Ltd | Epoch | |
| High Speed Tissue Grinder | service Biotechnology Co., Ltd | KZ- -F -F | |
| Horizontal Freezer | Mellow Group Co., Ltd | BCD-318AT | |
| Laboratory Ultrapure Water Machine | Jinan Aiken Environmental Protection Technology Co., Ltd | AK-RO-C2 | |
| Morris water maze video trail analysing system | Tai Meng Tech Co., Ltd | WMT-200 | |
| Rat 5-HT ELISA Kit | Lian Ke bio Co., Ltd,China | 96T/48T | |
| SPF grade Sprague Dawley (SD) rats | SPF (Beijing) Biotechnology Co | SCXK(JING)2019-0010 | |
| Sprague Dawley rats | Beijing Biotechnology Co., Ltd, China | SCXK (JING) 2019-0010 | |
| Vertical Refrigerated Display Cabinet | Xingx Group Co., Ltd | LSC-316C | |
| video tracking system | Tai Meng Tech Co., Ltd | ZH-ZFT | |
| vortex mixer | Servicebio technology Co., Ltd | MV-100 |
Referencias
- Alqurashi, G. K., et al. The impact of chronic unpredictable mild stress-induced depression on spatial, recognition and reference memory tasks in mice: Behavioral and histological study. Behav Sci. 12 (6), 166 (2022).
- Yu, S., Wang, L., Jing, X., Wang, Y., An, C. Features of gut microbiota and short-chain fatty acids in patients with first-episode depression and their relationship with the clinical symptoms. Front Psychol. 14, 1088268 (2023).
- Duda, P., Hajka, D., Wójcicka, O., Rakus, D., Gizak, A. Gsk3β: A master player in depressive disorder pathogenesis and treatment responsiveness. Cells. 9 (3), 727 (2020).
- Correia, A. S., Vale, N. Tryptophan metabolism in depression: A narrative review with a focus on serotonin and kynurenine pathways. Int J Mol Sci. 23 (15), 8493 (2022).
- Hao, Y., Ge, H., Sun, M., Gao, Y. Selecting an appropriate animal model of depression. Int J Mol Sci. 20 (19), 4827 (2019).
- Willner, P., Towell, A., Sampson, D., Sophokleous, S., Muscat, R. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant. Psychopharmacology (Berl). 93 (3), 358-364 (1987).
- Nakase, S., Kitayama, I., Soya, H., Hamanaka, K., Nomura, J. Increased expression of magnocellular arginine vasopressin mrna in paraventricular nucleus of stress-induced depression-model rats. Life Sci. 63 (1), 23-31 (1998).
- Wu, X., et al. Involvement of kynurenine pathway between inflammation and glutamate in the underlying etiopathology of cums-induced depression mouse model. BMC Neurosci. 23 (1), 62 (2022).
- Zhang, C., et al. Minocycline ameliorates depressive behaviors and neuro-immune dysfunction induced by chronic unpredictable mild stress in the rat. Behav Brain Res. 356, 348-357 (2019).
- Ma, J., Wang, R., Chen, Y., Wang, Z., Dong, Y. 5-HT attenuates chronic stress-induced cognitive impairment in mice through intestinal flora disruption. J Neuroinflammation. 20 (1), 23 (2023).
- Nollet, M. Models of depression: Unpredictable chronic mild stress in mice. Curr Protoc. 1 (8), e208 (2021).
- Becker, M., Pinhasov, A., Ornoy, A. Animal models of depression: What can they teach us about the human disease. Diagnostics (Basel). 11 (1), 123 (2021).
- Petkovic, A., Chaudhury, D. Encore: Behavioural animal models of stress, depression and mood disorders. Front Behav Neurosci. 16, 931964 (2022).
- Okine, T., Shepard, R., Lemanski, E., Coutellier, L. Sex differences in the sustained effects of ketamine on resilience to chronic stress. Front Behav Neurosci. 14, 581360 (2020).
- Fitzgerald, P. J., et al. Sex- and stress-dependent effects of a single injection of ketamine on open field and forced swim behavior. Stress. 24 (6), 857-865 (2021).
- Doron, R., Burstein, O. The unpredictable chronic mild stress protocol for inducing anhedonia in mice. J Vis Exp. (140), e58184 (2018).
- De Vry, J., Schreiber, R. The chronic mild stress depression model: Future developments from a drug discovery perspective. Psychopharmacology (Berl). 134 (4), 349-350 (1997).
- Tong, J., et al. Antidepressant effect of helicid in chronic unpredictable mild stress model in rats. Int Immunopharmacol. 67, 13-21 (2019).
- Liu, H., et al. Tnf signaling pathway-mediated microglial activation in the pfc underlies acute paradoxical sleep deprivation-induced anxiety-like behaviors in mice. Brain Behav Immun. 100, 254-266 (2022).
- He, L. W., et al. Optimization of food deprivation and sucrose preference test in sd rat model undergoing chronic unpredictable mild stress. Animal Model Exp Med. 3 (1), 69-78 (2020).
- Ma, W., Wu, B., Gao, X., Zhong, R. Association between frailty and cognitive function in older chinese people: A moderated mediation of social relationships and depressive symptoms. J Affect Disord. 316, 223-232 (2022).
- Geng, C., et al. Systematic impacts of chronic unpredictable mild stress on metabolomics in rats. Sci Rep. 10 (1), 700 (2020).
- Holmes, T. H., Rahe, R. H. The social readjustment rating scale. J Psychosom Res. 11 (2), 213-218 (1967).
- Zhang, M., et al. Shuxie-1 decoction alleviated cums -induced liver injury via il-6/jak2/stat3 signaling. Front Pharmacol. 13, 848355 (2022).
- Antoniuk, S., Bijata, M., Ponimaskin, E., Wlodarczyk, J. Chronic unpredictable mild stress for modeling depression in rodents: Meta-analysis of model reliability. Neurosci Biobehav Rev. 99, 101-116 (2019).
- Hu, C., et al. Re-evaluation of the interrelationships among the behavioral tests in rats exposed to chronic unpredictable mild stress. PLoS One. 12 (9), e0185129 (2017).
- Li, Y., et al. Increased hippocampal fissure width is a sensitive indicator of rat hippocampal atrophy. Brain Res Bull. 137, 91-97 (2018).
- Hu, R. L. B. G., et al. Effects of the Mongolian medicine Zadi-5 on monoamine neurotransmitters in the brain of rats with chronic stress depression model. Info Traditional Chinese Med. 34 (06), 5-8 (2017).
- Zhou, Y., Cong, Y., Liu, H. Folic acid ameliorates depression-like behaviour in a rat model of chronic unpredictable mild stress. BMC Neurosci. 21 (1), 1 (2020).
- Zhuang, Y., Zeng, R., Liu, X., Yang, L., Chan, Z. Neoagaro-oligosaccharides ameliorate chronic restraint stress-induced depression by increasing 5-ht and bdnf in the brain and remodeling the gut microbiota of mice. Mar Drugs. 20 (11), 725 (2022).
- Socała, K., et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacol Res. 172, 105840 (2021).
- Song, J., Kim, Y. K. Animal models for the study of depressive disorder. CNS Neurosci Ther. 27 (6), 633-642 (2021).
- Abelaira, H. M., Réus, G. Z., Quevedo, J. Animal models as tools to study the pathophysiology of depression. Braz J Psychiatry. 35 Suppl 2, S112-S120 (2013).
- Strekalova, T., et al. Chronic mild stress paradigm as a rat model of depression: Facts, artifacts, and future perspectives. Psychopharmacology (Berl). 239 (3), 663-693 (2022).
- Markov, D. D. Sucrose preference test as a measure of anhedonic behavior in a chronic unpredictable mild stress model of depression: Outstanding issues. Brain Sci. 12 (10), 1287 (2022).
- Czéh, B., Fuchs, E., Wiborg, O., Simon, M. Animal models of major depression and their clinical implications. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 64, 293-310 (2016).
- Gururajan, A., Reif, A., Cryan, J. F., Slattery, D. A. The future of rodent models in depression research. Nat Rev Neurosci. 20 (11), 686-701 (2019).
- Markov, D. D., Novosadova, E. V. Chronic unpredictable mild stress model of depression: Possible sources of poor reproducibility and latent variables. Biology (Basel). 11 (11), 1621 (2022).
- Willner, P. The chronic mild stress (cms) model of depression: History, evaluation and usage. Neurobiol Stress. 6, 78-93 (2017).
- Lages, Y. V. M., Rossi, A. D., Krahe, T. E., Landeira-Fernandez, J. Effect of chronic unpredictable mild stress on the expression profile of serotonin receptors in rats and mice: A meta-analysis. Neurosci Biobehav Rev. 124, 78-88 (2021).
- Willner, P., et al. Validation of chronic mild stress in the wistar-kyoto rat as an animal model of treatment-resistant depression. Behavioural Pharmacology. 30 (2 and 3), 239-250 (2019).
- Slattery, D. A., Cryan, J. F. Modelling depression in animals: At the interface of reward and stress pathways. Psychopharmacology (Berl). 234 (9-10), 1451-1465 (2017).
- Sterley, T. L., et al. Social transmission and buffering of synaptic changes after stress. Nat Neurosci. 21 (3), 393-403 (2018).
- Brechbühl, J., et al. Mouse alarm pheromone shares structural similarity with predator scents. Proc Natl Acad Sci U S A. 110 (12), 4762-4767 (2013).
- Beck, R. C., Self, J. L., Carter, D. J. Sucrose preference thresholds for satiated and water-deprived rats. Psychol Rep. 16, 901-905 (1965).
- Hawkins, P., Golledge, H. D. R. The 9 to 5 rodent - time for change? Scientific and animal welfare implications of circadian and light effects on laboratory mice and rats. J Neurosci Methods. 300, 20-25 (2018).
- Daut, R. A., Ravenel, J. R., Watkins, L. R., Maier, S. F., Fonken, L. K. The behavioral and neurochemical effects of an inescapable stressor are time of day dependent. Stress. 23 (4), 405-416 (2020).
- Hu, R. L. B. G., et al. Experimental research on nutmeg wuwei pills against of depression model rats behavior and hippocampus monoamine neurotransmitters. Chinese J Exp Traditional Medical Formulae. 21 (11), 146-149 (2015).
- Hu, R. L. B. G., et al. Effects of Rou kou Wuwei Pill on the learning and memory abilities and the expression of BDNF and TrkB in hippocampus of depression rats. Chinese J Traditional Chines Med Pro. 32 (8), 3797-3800 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados