È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Stress lieve cronico imprevedibile nei ratti basato sulla medicina mongola
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo delinea un modello di stress lieve cronico imprevedibile (CUMS) per la depressione basato sulla teoria medica mongola, insieme a metodi per convalidare i test comportamentali.
Abstract
La depressione è un disturbo affettivo prevalente e costituisce una delle principali cause di disabilità globale. I limiti degli attuali interventi farmacologici contribuiscono al notevole onere sanitario attribuito a questa condizione. C'è un urgente bisogno di una comprensione più profonda dei meccanismi alla base della depressione, rendendo i modelli preclinici con potenziale traslazionale molto preziosi. La medicina mongola, un sottoinsieme della medicina tradizionale, postula che l'insorgenza della malattia sia strettamente legata all'equilibrio tra vento, bile e catarro. In questo studio, introduciamo un protocollo per il metodo dello stress cronico imprevedibile lieve (CUMS) nei ratti. All'interno di questo quadro, i ratti sono sottoposti a una serie di fattori di stress fluttuanti e lievi per indurre un fenotipo simile alla depressione, imitando la patogenesi della depressione umana. I saggi comportamentali impiegati in questo protocollo includono il test di preferenza del saccarosio (SPT), indicativo di anedonia, un sintomo fondamentale della depressione; il test in campo aperto (OFT), che misura i livelli di ansia; e il test del labirinto d'acqua Morris (MWM), che valuta la memoria spaziale e le capacità di apprendimento. Il metodo CUMS dimostra la capacità di indurre anedonia e di causare deficit comportamentali a lungo termine. Inoltre, questo protocollo è più allineato con la teoria medica mongola rispetto ad altri modelli animali progettati per suscitare un comportamento simile alla depressione. Lo sviluppo di questo modello animale e la successiva ricerca forniscono una solida base per futuri studi innovativi nel campo della medicina mongola.
Introduzione
Il disturbo depressivo maggiore (MDD) è una malattia mentale prevalente, classificata come la terza causa di disabilità a livello globale e che colpisce oltre 300 milioni di persone1,2,3. In particolare, si stima che almeno la metà degli individui colpiti non riceva un trattamento adeguato4. Dato questo divario, i modelli animali fungono da strumento cruciale per indagare l'eziologia della depressione. Ad oggi, esistono più di 20 diversi modelli animali per la depressione5. Tra questi, il modello di stress cronico imprevedibile lieve (CUMS), perfezionato da Paul Winer nel 1987, è il più frequentemente utilizzato6. Il modello CUMS si basa sulla premessa che l'esposizione dei roditori a una vasta gamma di fattori di stress socio-ambientali porta a sintomi simili ad ansia, tensione e depressione. La metodologia prevede l'esposizione degli animali a vari fattori di stress lievi per diverse settimane, culminando in una serie di alterazioni comportamentali, tra cui anedonia e comportamenti depressivi7,8. Questi cambiamenti sono accompagnati da cambiamenti nei profili endocrini e dei neurotrasmettitori, come una riduzione della 5-HT9,10. Questi risultati rispecchiano da vicino quelli osservati negli esseri umani con diagnosi di MDD, convalidando così l'utilità del modello. Il modello CUMS è particolarmente apprezzato per la sua efficacia nella valutazione degli antidepressivi, manifestando alti livelli di validità superficiale, strutturale e predittiva11,12. A differenza di altri modelli, la CUMS è sensibile agli effetti della somministrazione cronica di antidepressivi monoaminergici. Ad esempio, è stato dimostrato che gli inibitori selettivi della ricaptazione della serotonina (SSRI) come il citalopram, la paroxetina e la fluoxetina prevengono e invertono l'anedonia in condizioni di stress cronico12,13. Inoltre, anche i nuovi antidepressivi ad azione rapida, come la ketamina, hanno dimostrato efficacia in questo modello14,15. Al contrario, altri test come il test di nuoto forzato (FST) e il test di sospensione della coda (TST) sono meno affidabili per modellare i cambiamenti comportamentali a lungo termine, spesso riflettendo gli adattamenti allo stress acuto piuttosto che i sintomi duraturi della depressione16. Queste caratteristiche sottolineano la solida validità del modello CUMS nella ricerca sulla depressione. Una delle caratteristiche più salienti del modello CUMS, riconosciuto per la sua elevata affidabilità negli studi classici, è l'anedonia, l'incapacità di provare piacere o interesse nelle attività quotidiane17,18. Questo fenomeno è comunemente valutato utilizzando test di preferenza del saccarosio e molti antidepressivi hanno dimostrato di invertire la riduzione del consumo di saccarosio. Diverse altre metriche sono comunemente impiegate nella letteratura CUMS, tra cui il test in campo aperto (OFT), che valuta il comportamento motorio volontario, le tendenze esplorative e la tensione, misurando così la gravità della depressione19. Altri test come il labirinto elevato plus (EPM) valutano comportamenti simili all'ansia, il test del labirinto d'acqua di Morris (MWM) esamina il funzionamento cognitivo20e l'FST valuta la suscettibilità alle emozioni negative e alla disperazione comportamentale20. Inoltre, la maggior parte dei fattori di stress che hanno un impatto sugli esseri umani sono di natura sociale. Gli individui con relazioni sociali non ottimali, caratterizzati da attività sociali, reti e supporto limitati, sono a maggior rischio di varie malattie21,22. Questo vale anche per i roditori, che sono animali sociali che vivono in gruppo. Ad esempio, i ratti che sono ospitati in isolamento mostrano le caratteristiche di quella che viene definita sindrome da isolamento, che induce stress sociale e accelera l'insorgenza della depressione23.
La medicina mongola, una branca significativa della medicina cinese, postula che l'insorgenza della malattia sia una complessa interazione tra fattori intrinseci ed esterni. Questi fattori esterni, indicati come le quattro condizioni ausiliarie, comprendono il cambiamento climatico, la dieta, lo stile di vita ed eventi improvvisi come infezioni, incidenti sorprendenti e disturbi psicologici. Il processo patologico è concettualizzato come un'interazione continua tra tre elementi, indicati come i tre tipi di omori, e i Sette Costituenti Corporei in concerto con le quattro condizioni ausiliarie24. La medicina mongola sostiene che il corpo umano funziona come un'entità integrata, mantenuta da un relativo equilibrio tra i tre omori. Una rottura di questo equilibrio è considerata un precursore della malattia24. Dato il ruolo centrale della sperimentazione animale nel collegare la medicina tradizionale e quella moderna, è fondamentale sviluppare modelli animali che siano rilevanti per la ricerca nel campo della medicina mongola. Di conseguenza, abbiamo impiegato una metodologia di isolamento di 28 giorni abbinata a CUMS per simulare questi fattori di stress fisiologici e psicologici. Abbiamo selezionato nove specifici fattori di stress imprevedibili e abbiamo cercato di sostenere questo metodo di modellazione attraverso la teoria dei tre omori della medicina mongola. La creazione di un modello animale robusto è fondamentale per far progredire la ricerca di base nella medicina mongola e contribuirà in modo significativo ai suoi studi fondamentali.
Protocollo
I protocolli sperimentali hanno ricevuto l'approvazione dal Comitato per l'etica della cura degli esperimenti animali dell'Università di medicina della Mongolia interna (YKD202301172) e hanno aderito alle linee guida del National Institutes of Health per la cura e l'etica degli animali. Il numero di licenza per il nostro centro per animali è NO.110324230102364187. Ventiquattro ratti maschi di Sprague-Dawley (SD), di 8 settimane di età (200 g ± 20 g), sono stati acquisiti e alloggiati in un ambiente controllato con una temperatura di 22°C ± 2°C e un'umidità del 55% ± del 15%. Nutri i ratti con una dieta di mantenimento per roditori e acqua pura con pannocchie di mais per lettiera. I ratti sono stati sottoposti a un ciclo luce/buio di 12 ore/12 ore per 1 settimana prima della sperimentazione.
1. Definizione del modello di ratto CUMS
- Raggruppamento
- Dividi i 24 ratti in modo casuale in 2 gruppi: il gruppo di controllo (CON), che non sarà esposto all'isolamento o allo stress, e il gruppo modello (MOD). Ogni gruppo contiene 12 ratti.
- Alloggia i ratti in gabbie standard di 55 cm x 40 cm x 20 cm, con 6 ratti per gabbia. Mantenere l'assegnazione della gabbia per tutto il periodo di acclimatamento, se non diversamente indicato.
- Riempi ogni gabbia di allevamento con lettiera fresca e sostituiscila due volte a settimana.
- Condurre un periodo di acclimatazione di 1 settimana. Consentire ai ratti l'accesso illimitato al cibo e all'acqua, tranne durante l'applicazione del fattore di stress CUMS. Mantenere un ambiente costante con una temperatura di 22°C ± 2°C, umidità del 55% ± 15% e un ciclo di luce/buio di 12 ore/12 ore dalle 08:00 alle 20:00, se non diversamente specificato.
- Prima di iniziare l'esperimento, maneggiare quotidianamente i ratti per acclimatarli al ricercatore e per ridurre al minimo lo stress aggiuntivo durante la fase sperimentale.
- Isolamento con stress lieve cronico imprevedibile
- Posizionare contemporaneamente i gruppi MOD e CON in stanze separate. Ospita i ratti del gruppo MOD individualmente, mantenendo insieme i ratti del gruppo CON. Mantenere costanti tutte le altre condizioni.
- Attuare un regime di stressor di 28 giorni25. Per prevenire l'assuefazione e garantire l'imprevedibilità del fattore di stress, somministrare un fattore di stress casuale al giorno, evitando l'uso dello stesso fattore di stress in giorni consecutivi.
- Applicare in modo casuale uno dei seguenti nove fattori di stress26,27 in giorni diversi: 24 ore di privazione dell'acqua, 24 ore di privazione del cibo, imbottitura bagnata, inclinazione della gabbia, inversione del ciclo luce/buio, esposizione al freddo a 4 °C, esposizione al calore a 45 °C, 1 min di bloccaggio della coda o 15 min di agitazione a 160 giri/min. Il design specifico è descritto nella Tabella 1.
- Durante l'applicazione del fattore di stress, limitare l'accesso al cibo e all'acqua al gruppo MOD fino a quando lo stress non è terminato, tranne durante l'inversione del ciclo luce/buio. Al gruppo CON non è stato richiesto di limitare l'acqua e la dieta.
- Metodi di stress
- Iniziare l'esperimento applicando stimoli depressivi in combinazione con l'isolamento di 28 giorni a tutti i ratti, escluso il gruppo di controllo. Ospita questi ratti in gabbie individuali. Fare riferimento alla Tabella 2 per le condizioni correlate agli stimoli depressivi.
- Per eseguire il metodo del morsetto della coda, fissare la coda di un ratto del gruppo MOD bloccando la coda con una graffetta standard a una distanza di 1-2 cm dalla radice della coda del ratto. Misurare il tempo di serraggio per una durata di 1 min (n = 12).
- Nel metodo di privazione dell'acqua, trattenere l'acqua da un ratto del gruppo MOD rimuovendo la sua bottiglia d'acqua e registrare per 24 ore.
NOTA: L'ora di inizio della privazione idrica è stata registrata in modo da poter calcolare con precisione l'ora di fine; È stato osservato il comportamento dei ratti durante questo periodo, compresa l'attività, l'appetito e lo stato mentale. - Nel metodo di privazione alimentare, trattenere il cibo da un ratto del gruppo MOD e registrare per 24 ore.
NOTA: Registrare l'ora in cui inizia la privazione di cibo in modo che l'ora di fine possa essere calcolata con precisione; garantire che i ratti siano adeguatamente idratati durante questo periodo; e osservare il comportamento dei ratti durante questo periodo, compresa l'attività e lo stato mentale, ecc. - Per la stimolazione a freddo a 4 °C, mettere un ratto del gruppo MOD in un secchio di acqua fredda e registrare per 5 minuti. Assicurarsi che la temperatura dell'acqua rimanga costante per tutta la durata del test. Al termine dell'esperimento, asciugare il ratto con un soffiatore e rimetterlo nella sua gabbia originale.
NOTA: Mantenere la temperatura dell'acqua fredda a 4 °C utilizzando un termometro e cubetti di ghiaccio per regolare la temperatura dell'acqua quando sale. L'acqua deve essere cambiata regolarmente per garantire che la qualità dell'acqua sia pulita e la temperatura costante. Durante il nuoto, tutti gli arti e i tronchi dei ratti devono essere immersi in acqua fredda tranne la testa. La profondità dell'acqua deve essere maggiore della lunghezza del corpo del ratto per evitare che il ratto salti fuori dall'acqua a causa del contatto con il fondo del secchio. - Per somministrare uno stress termico di 45 °C, posizionare un ratto del gruppo MOD in un'incubatrice e registrare per 5 minuti, assicurandosi che la temperatura rimanga stabile per tutta la durata del test.
- Nell'inversione del ciclo luce-buio, avvolgere la gabbia in un telo nero per 1 ora per simulare il buio diurno. Successivamente, illuminare la gabbia per 12 ore durante la notte per imitare la luce del giorno. Registra il comportamento del ratto, l'assunzione di cibo e acqua e i modelli di sonno per 24 ore.
- Per l'esperimento dell'imbottitura a umido, introdurre 200 ml di acqua in una gabbia contenente 100 g di imbottitura. Ospita un ratto del gruppo MOD nella gabbia umida e registra il comportamento dei ratti sotto stress da lettiera bagnata, inclusa l'attività, l'appetito, l'assunzione di acqua, ecc. Osservare se ci sono comportamenti anomali o reazioni scomode, come le condizioni della pelle e dei capelli dei ratti, che possono essere causate dall'imbottitura bagnata, e registrarli in tempo per le successive analisi per 24 ore. Dopo il test, asciugare il ratto con un soffiatore e rimetterlo in una gabbia con trucioli di legno fresco.
- Con il metodo dell'inclinazione della gabbia, posizionare un ratto del gruppo MOD in una gabbia inclinata di 45° contro un muro e registrare per 24 ore. Utilizzare la struttura del telaio della gabbia per regolare l'angolo e fissare la gabbia in posizione.
NOTA: Calcolare il tempo dall'inizio alla fine e osservare il comportamento dei ratti durante il periodo di inclinazione della gabbia, inclusi attività, appetito e stato mentale, e assicurarsi che l'angolo della gabbia inclinata sia impostato correttamente e rimanga stabile per garantire l'accuratezza e la riproducibilità dell'esperimento. - Per l'agitazione ad alta velocità, posizionare un ratto del gruppo MOD in un agitatore meccanico impostato a 160 giri/min e registrare il ratto per 15 minuti. Successivamente vengono utilizzati metodi di test comportamentali per valutare il successo della creazione del modello.
- Dopo aver applicato i fattori di stress, riposizionare le gabbie del gruppo MOD dalla stanza CUMS alla stanza di stabulazione. Durante il periodo di esposizione allo stress di 4 settimane, mantieni il gruppo CON nelle gabbie domestiche situate nella stanza dell'alloggio.
- Precauzioni durante gli esperimenti
- Trasferire le gabbie del gruppo MOD nella stanza di stabulazione generale dopo aver applicato il fattore di stress nella stanza CUMS.
- Monitoraggio degli animali durante la modellazione CUMS
- Durante il bloccaggio della coda, è probabile che l'animale lotti a causa della stimolazione indotta. Durante questo periodo, monitorare continuamente il morsetto. Se si sposta, mettere in pausa il timer, riapplicare il morsetto, quindi riprendere il timer per 1 minuto.
- Non imporre contemporaneamente la privazione dell'acqua e i fattori di stress della lettiera bagnata.
NOTA: Evitare l'imposizione simultanea di imbottitura bagnata e privazione di acqua aiuta a mantenere l'integrità sperimentale, riduce le variabili confondenti e promuove il benessere degli animali. - La temperatura corporea dell'animale e la temperatura ambiente possono aumentare la temperatura dell'acqua durante il nuoto in acque fredde. Pertanto, regolare aggiungendo acqua ghiacciata o cubetti di ghiaccio per mantenere una temperatura dell'acqua costante.
- Osservare i ratti a intervalli di 30 minuti durante l'applicazione di fattori di stress, tranne durante l'inversione diurna. Presta particolare attenzione ai segni di angoscia insolita, come brividi, letargia o mancanza di movimento. Se si osservano tali sintomi, in particolare la potenziale ipotermia durante il nuoto in acqua fredda a 4 °C e la lettiera bagnata, rimuovere immediatamente il ratto dal fattore di stress.
NOTA: Rimuovere gli animali da esperimento dallo studio quando hanno problemi di salute, come infezioni, traumi gravi, comportamenti aggressivi, mobilità anormale, ecc., Le condizioni per rimuovere gli animali dallo studio in genere ruotano attorno alla protezione della loro salute e sicurezza, garantendo al contempo l'integrità dei risultati sperimentali. - Condurre ispezioni quotidiane per ferite o altre anomalie fisiche o comportamentali in ciascun ratto. Se si osservano anomalie, consultare il veterinario di laboratorio per determinare se il ratto deve essere escluso dall'esperimento.
- Pesare ogni ratto ogni 3 giorni. Se un animale perde più del 20% del suo peso corporeo basale prima della poppata, deve essere escluso dall'esperimento.
2. Test comportamentali
- Per iniziare, somministrare gli stimoli della depressione in combinazione con l'isolamento per 28 giorni a tutti i ratti, escluso il gruppo di controllo. Alloggia i ratti in gabbie individuali. Fare riferimento alla Tabella 2 per le specifiche sulle condizioni degli stimoli depressivi.
- Per il test in campo aperto, suddividere una scatola nera in 25 sezioni quadrate di uguale area. Installa un sistema di analisi del tracciamento video nella confezione. Posiziona il ratto nel quadrato centrale e monitora le sue attività orizzontali e verticali per una durata di 5 min.
NOTA: Le dimensioni della scatola sono 500 mm x 500 mm x 300 mm. I dati sull'attività saranno raccolti utilizzando il sistema di tracciamento video per valutare i comportamenti legati all'ansia nei roditori quando esposti a un nuovo ambiente. - Successivamente, conta il numero di quadrati attraversati dal ratto, usando tutte le zampe, per quantificare l'attività orizzontale. Conta i casi di stare in piedi e di toelettarsi come indicatori di attività verticale. Dopo ogni test, igienizzare la scatola utilizzando alcol al 75% per eliminare eventuali odori residui di ratto per i test successivi.
- Successivamente, l'anedonia viene valutata attraverso il test di preferenza del saccarosio. Posizionare due bottiglie sul coperchio della gabbia: la bottiglia A contiene acqua pura, mentre la bottiglia B contiene una soluzione di saccarosio all'1%. Consentire l'accesso ad libitum a entrambe le soluzioni per il ratto. Pesare le bottiglie prima e dopo il consumo per calcolare i tassi di preferenza per il saccarosio di 60 minuti nei giorni 0, 7, 14, 21 e 28. La formula è la seguente:
Consumo di saccarosio =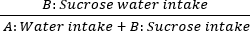 × 100%
× 100% - Per misurare la memoria spaziale e le capacità di apprendimento, utilizzare il test del labirinto d'acqua di Morris. Dividi la piscina in quattro quadranti, numerandoli da uno a quattro. Posizionare una piattaforma di riposo sommersa 1 cm sotto la superficie dell'acqua nel terzo quadrante.
- Introdurre il latte nella piscina per aumentare l'opacità dell'acqua e mantenere una temperatura dell'acqua di circa 23 °C durante tutta la procedura sperimentale.
- Posiziona ogni ratto in vari quadranti del labirinto, permettendogli di individuare la piattaforma nascosta a 120 secondi. I ratti devono fare affidamento sulla memoria spaziale e sulle capacità di apprendimento per ricordare la posizione della piattaforma. Una volta appresa la posizione della piattaforma, possono nuotare direttamente verso di essa. Registra il tempo di latenza utilizzando il sistema di tracciamento video del labirinto d'acqua Morris.
- Posiziona il ratto in una posizione fissa nella piscina. Se il soggetto non riesce a localizzare la piattaforma nascosta entro 120 s, registrare la latenza a 120 s.
- Infine, rimuovi la piattaforma nascosta, rimetti il topo in acqua e registra il numero di passaggi di zona in un periodo di 120 secondi.
3. Analisi statistica
- Per valutare le differenze significative nei parametri biochimici, utilizzare l'analisi della varianza a una via (ANOVA) seguita dal test post hoc di Duncan. Presentare i dati come media ± errore standard (SE) e considerare un valore p inferiore a 0,05 come statisticamente significativo.
Risultati
Risultati dei test comportamentali nel modello di depressione del ratto indotta da CUMS
Per corroborare l'efficacia della procedura CUMS nell'indurre comportamenti simili alla depressione, è stato eseguito un controllo di manipolazione. I ratti maschi di Sprague-Dawley (SD) sono stati assegnati in modo casuale al gruppo MOD o CON per un periodo di 4 settimane, come indicato nel passaggio 1.2.3. Successivamente, i ratti sono stati sacrificati e i loro ippocampi sono stati completamente sezionati per l...
Discussione
La depressione è un disturbo mentale caratterizzato da sintomi come umore basso, mancanza di piacere e riduzione dell'energia30. Nel campo della ricerca sulla depressione, la creazione di un modello animale affidabile è fondamentale per far avanzare gli interventi terapeutici. Tra i vari modelli animali, il modello CUMS è particolarmente degno di nota per la sua elevata affidabilità, validità e la sua congruenza con le caratteristiche della depressione umana31. È adat...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Siamo grati per la strumentazione e il laboratorio forniti daestendere la nostra gratitudine alla facoltà di medicina mongola dell'Università di Medicina della Mongolia Interna, in Cina. Questo studio è stato sostenuto da, per aver fornito la strumentazione e le strutture di laboratorio necessarie. Questo studio ha ricevuto sostegno finanziario dalla National Natural Sciences Foundation of China (Grant No. 81760762) e dall'Inner Mongolia Medical University Project of China (Grant No. YKD2022MS074), e il Progetto di Ricerca Scientifica sull'Istruzione Superiore nella Mongolia Interna, Cina (Grant No. NJZY22661) e il progetto Open Fund del laboratorio chiave di medicina cinese e mongola nella regione autonoma della Mongolia interna, in Cina (sovvenzione n. MYX2023-K07).
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tube | service Biotechnology Co., Ltd | EP-150-M | |
| 1000 µL Pipette | service Biotechnology Co., Ltd | IC021198160223 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | IC012395160823 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | TP-10 | |
| 1250 µL pipette tip | service Biotechnology Co., Ltd | TP-1250 | |
| 2 mL centrifuge tube | service Biotechnology Co., Ltd | EP-200-M | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | TP-200 | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | IC021029160323 | |
| 300 µL Multi-Channel Pipette | service Biotechnology Co., Ltd | IC091006161022 | |
| 50 µL Pipette | service Biotechnology Co., Ltd | DS35110 | |
| Automatic plate washing machine | rayto Life Sciences Co., Ltd | RT-3100 | |
| Benchtop High-Speed Freezing Centrifuge | dalong construction Co., Ltd | D3024R | |
| electronic balance | Mettler Toledo International Trade (Shanghai) Co., Ltd | ME203E/02 | |
| Electrothermal blast drying oven | Labotery Experimental Instrument Equipment Co., Ltd | GEL-70 | |
| Enzyme Label Detector | BioTeK Co., Ltd | Epoch | |
| High Speed Tissue Grinder | service Biotechnology Co., Ltd | KZ- -F -F | |
| Horizontal Freezer | Mellow Group Co., Ltd | BCD-318AT | |
| Laboratory Ultrapure Water Machine | Jinan Aiken Environmental Protection Technology Co., Ltd | AK-RO-C2 | |
| Morris water maze video trail analysing system | Tai Meng Tech Co., Ltd | WMT-200 | |
| Rat 5-HT ELISA Kit | Lian Ke bio Co., Ltd,China | 96T/48T | |
| SPF grade Sprague Dawley (SD) rats | SPF (Beijing) Biotechnology Co | SCXK(JING)2019-0010 | |
| Sprague Dawley rats | Beijing Biotechnology Co., Ltd, China | SCXK (JING) 2019-0010 | |
| Vertical Refrigerated Display Cabinet | Xingx Group Co., Ltd | LSC-316C | |
| video tracking system | Tai Meng Tech Co., Ltd | ZH-ZFT | |
| vortex mixer | Servicebio technology Co., Ltd | MV-100 |
Riferimenti
- Alqurashi, G. K., et al. The impact of chronic unpredictable mild stress-induced depression on spatial, recognition and reference memory tasks in mice: Behavioral and histological study. Behav Sci. 12 (6), 166 (2022).
- Yu, S., Wang, L., Jing, X., Wang, Y., An, C. Features of gut microbiota and short-chain fatty acids in patients with first-episode depression and their relationship with the clinical symptoms. Front Psychol. 14, 1088268 (2023).
- Duda, P., Hajka, D., Wójcicka, O., Rakus, D., Gizak, A. Gsk3β: A master player in depressive disorder pathogenesis and treatment responsiveness. Cells. 9 (3), 727 (2020).
- Correia, A. S., Vale, N. Tryptophan metabolism in depression: A narrative review with a focus on serotonin and kynurenine pathways. Int J Mol Sci. 23 (15), 8493 (2022).
- Hao, Y., Ge, H., Sun, M., Gao, Y. Selecting an appropriate animal model of depression. Int J Mol Sci. 20 (19), 4827 (2019).
- Willner, P., Towell, A., Sampson, D., Sophokleous, S., Muscat, R. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant. Psychopharmacology (Berl). 93 (3), 358-364 (1987).
- Nakase, S., Kitayama, I., Soya, H., Hamanaka, K., Nomura, J. Increased expression of magnocellular arginine vasopressin mrna in paraventricular nucleus of stress-induced depression-model rats. Life Sci. 63 (1), 23-31 (1998).
- Wu, X., et al. Involvement of kynurenine pathway between inflammation and glutamate in the underlying etiopathology of cums-induced depression mouse model. BMC Neurosci. 23 (1), 62 (2022).
- Zhang, C., et al. Minocycline ameliorates depressive behaviors and neuro-immune dysfunction induced by chronic unpredictable mild stress in the rat. Behav Brain Res. 356, 348-357 (2019).
- Ma, J., Wang, R., Chen, Y., Wang, Z., Dong, Y. 5-HT attenuates chronic stress-induced cognitive impairment in mice through intestinal flora disruption. J Neuroinflammation. 20 (1), 23 (2023).
- Nollet, M. Models of depression: Unpredictable chronic mild stress in mice. Curr Protoc. 1 (8), e208 (2021).
- Becker, M., Pinhasov, A., Ornoy, A. Animal models of depression: What can they teach us about the human disease. Diagnostics (Basel). 11 (1), 123 (2021).
- Petkovic, A., Chaudhury, D. Encore: Behavioural animal models of stress, depression and mood disorders. Front Behav Neurosci. 16, 931964 (2022).
- Okine, T., Shepard, R., Lemanski, E., Coutellier, L. Sex differences in the sustained effects of ketamine on resilience to chronic stress. Front Behav Neurosci. 14, 581360 (2020).
- Fitzgerald, P. J., et al. Sex- and stress-dependent effects of a single injection of ketamine on open field and forced swim behavior. Stress. 24 (6), 857-865 (2021).
- Doron, R., Burstein, O. The unpredictable chronic mild stress protocol for inducing anhedonia in mice. J Vis Exp. (140), e58184 (2018).
- De Vry, J., Schreiber, R. The chronic mild stress depression model: Future developments from a drug discovery perspective. Psychopharmacology (Berl). 134 (4), 349-350 (1997).
- Tong, J., et al. Antidepressant effect of helicid in chronic unpredictable mild stress model in rats. Int Immunopharmacol. 67, 13-21 (2019).
- Liu, H., et al. Tnf signaling pathway-mediated microglial activation in the pfc underlies acute paradoxical sleep deprivation-induced anxiety-like behaviors in mice. Brain Behav Immun. 100, 254-266 (2022).
- He, L. W., et al. Optimization of food deprivation and sucrose preference test in sd rat model undergoing chronic unpredictable mild stress. Animal Model Exp Med. 3 (1), 69-78 (2020).
- Ma, W., Wu, B., Gao, X., Zhong, R. Association between frailty and cognitive function in older chinese people: A moderated mediation of social relationships and depressive symptoms. J Affect Disord. 316, 223-232 (2022).
- Geng, C., et al. Systematic impacts of chronic unpredictable mild stress on metabolomics in rats. Sci Rep. 10 (1), 700 (2020).
- Holmes, T. H., Rahe, R. H. The social readjustment rating scale. J Psychosom Res. 11 (2), 213-218 (1967).
- Zhang, M., et al. Shuxie-1 decoction alleviated cums -induced liver injury via il-6/jak2/stat3 signaling. Front Pharmacol. 13, 848355 (2022).
- Antoniuk, S., Bijata, M., Ponimaskin, E., Wlodarczyk, J. Chronic unpredictable mild stress for modeling depression in rodents: Meta-analysis of model reliability. Neurosci Biobehav Rev. 99, 101-116 (2019).
- Hu, C., et al. Re-evaluation of the interrelationships among the behavioral tests in rats exposed to chronic unpredictable mild stress. PLoS One. 12 (9), e0185129 (2017).
- Li, Y., et al. Increased hippocampal fissure width is a sensitive indicator of rat hippocampal atrophy. Brain Res Bull. 137, 91-97 (2018).
- Hu, R. L. B. G., et al. Effects of the Mongolian medicine Zadi-5 on monoamine neurotransmitters in the brain of rats with chronic stress depression model. Info Traditional Chinese Med. 34 (06), 5-8 (2017).
- Zhou, Y., Cong, Y., Liu, H. Folic acid ameliorates depression-like behaviour in a rat model of chronic unpredictable mild stress. BMC Neurosci. 21 (1), 1 (2020).
- Zhuang, Y., Zeng, R., Liu, X., Yang, L., Chan, Z. Neoagaro-oligosaccharides ameliorate chronic restraint stress-induced depression by increasing 5-ht and bdnf in the brain and remodeling the gut microbiota of mice. Mar Drugs. 20 (11), 725 (2022).
- Socała, K., et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacol Res. 172, 105840 (2021).
- Song, J., Kim, Y. K. Animal models for the study of depressive disorder. CNS Neurosci Ther. 27 (6), 633-642 (2021).
- Abelaira, H. M., Réus, G. Z., Quevedo, J. Animal models as tools to study the pathophysiology of depression. Braz J Psychiatry. 35 Suppl 2, S112-S120 (2013).
- Strekalova, T., et al. Chronic mild stress paradigm as a rat model of depression: Facts, artifacts, and future perspectives. Psychopharmacology (Berl). 239 (3), 663-693 (2022).
- Markov, D. D. Sucrose preference test as a measure of anhedonic behavior in a chronic unpredictable mild stress model of depression: Outstanding issues. Brain Sci. 12 (10), 1287 (2022).
- Czéh, B., Fuchs, E., Wiborg, O., Simon, M. Animal models of major depression and their clinical implications. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 64, 293-310 (2016).
- Gururajan, A., Reif, A., Cryan, J. F., Slattery, D. A. The future of rodent models in depression research. Nat Rev Neurosci. 20 (11), 686-701 (2019).
- Markov, D. D., Novosadova, E. V. Chronic unpredictable mild stress model of depression: Possible sources of poor reproducibility and latent variables. Biology (Basel). 11 (11), 1621 (2022).
- Willner, P. The chronic mild stress (cms) model of depression: History, evaluation and usage. Neurobiol Stress. 6, 78-93 (2017).
- Lages, Y. V. M., Rossi, A. D., Krahe, T. E., Landeira-Fernandez, J. Effect of chronic unpredictable mild stress on the expression profile of serotonin receptors in rats and mice: A meta-analysis. Neurosci Biobehav Rev. 124, 78-88 (2021).
- Willner, P., et al. Validation of chronic mild stress in the wistar-kyoto rat as an animal model of treatment-resistant depression. Behavioural Pharmacology. 30 (2 and 3), 239-250 (2019).
- Slattery, D. A., Cryan, J. F. Modelling depression in animals: At the interface of reward and stress pathways. Psychopharmacology (Berl). 234 (9-10), 1451-1465 (2017).
- Sterley, T. L., et al. Social transmission and buffering of synaptic changes after stress. Nat Neurosci. 21 (3), 393-403 (2018).
- Brechbühl, J., et al. Mouse alarm pheromone shares structural similarity with predator scents. Proc Natl Acad Sci U S A. 110 (12), 4762-4767 (2013).
- Beck, R. C., Self, J. L., Carter, D. J. Sucrose preference thresholds for satiated and water-deprived rats. Psychol Rep. 16, 901-905 (1965).
- Hawkins, P., Golledge, H. D. R. The 9 to 5 rodent - time for change? Scientific and animal welfare implications of circadian and light effects on laboratory mice and rats. J Neurosci Methods. 300, 20-25 (2018).
- Daut, R. A., Ravenel, J. R., Watkins, L. R., Maier, S. F., Fonken, L. K. The behavioral and neurochemical effects of an inescapable stressor are time of day dependent. Stress. 23 (4), 405-416 (2020).
- Hu, R. L. B. G., et al. Experimental research on nutmeg wuwei pills against of depression model rats behavior and hippocampus monoamine neurotransmitters. Chinese J Exp Traditional Medical Formulae. 21 (11), 146-149 (2015).
- Hu, R. L. B. G., et al. Effects of Rou kou Wuwei Pill on the learning and memory abilities and the expression of BDNF and TrkB in hippocampus of depression rats. Chinese J Traditional Chines Med Pro. 32 (8), 3797-3800 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon