É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estresse Leve Imprevisível Crônico em Ratos com base na medicina mongol
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve um modelo de estresse leve imprevisível crônico (CUMS) para depressão baseado na teoria médica mongol, juntamente com métodos para validar testes comportamentais.
Resumo
A depressão é um transtorno afetivo prevalente e constitui uma das principais causas de incapacidade global. As limitações das intervenções farmacológicas atuais contribuem para a carga substancial de saúde atribuída a essa condição. Há uma necessidade premente de uma compreensão mais profunda dos mecanismos subjacentes da depressão, tornando os modelos pré-clínicos com potencial translacional altamente valiosos. A medicina mongol, um subconjunto da medicina tradicional, postula que a ocorrência de doenças está intimamente ligada ao equilíbrio do vento, bile e catarro. Neste estudo, apresentamos um protocolo para o método de estresse leve imprevisível crônico (CUMS) em ratos. Dentro dessa estrutura, os ratos são submetidos a uma série de estressores leves e flutuantes para induzir um fenótipo semelhante à depressão, imitando a patogênese da depressão humana. Os ensaios comportamentais empregados neste protocolo incluem o teste de preferência por sacarose (SPT), indicativo de anedonia - um sintoma central da depressão; o teste de campo aberto (OFT), que mede os níveis de ansiedade; e o teste do labirinto aquático de Morris (MWM), que avalia a memória espacial e as habilidades de aprendizagem. O método CUMS demonstra a capacidade de induzir anedonia e causar déficits comportamentais de longo prazo. Além disso, este protocolo está mais alinhado com a teoria médica mongol do que outros modelos animais projetados para provocar comportamento semelhante à depressão. O desenvolvimento deste modelo animal e pesquisas subsequentes fornecem uma base robusta para futuros estudos inovadores no campo da medicina mongol.
Introdução
O transtorno depressivo maior (TDM) é uma doença mental prevalente, classificada como a terceira principal causa de incapacidade em todo o mundo e afetando mais de 300 milhões de pessoas1,2,3. Notavelmente, estima-se que pelo menos metade dos indivíduos afetados não receba tratamento adequado4. Diante dessa lacuna, os modelos animais servem como uma ferramenta crucial para investigar a etiologia da depressão. Até o momento, existem mais de 20 modelos animais diferentes para depressão5. Dentre estes, o modelo de estresse leve imprevisível crônico (CUMS), refinado por Paul Winer em 1987, é o mais utilizado6. O modelo CUMS opera com base na premissa de que expor roedores a uma gama diversificada de estressores socioambientais leva a sintomas semelhantes a ansiedade, tensão e depressão. A metodologia envolve a exposição dos animais a vários estressores leves ao longo de várias semanas, culminando em uma série de alterações comportamentais, incluindo anedonia e comportamentos depressivos7,8. Essas mudanças são acompanhadas por mudanças nos perfis endócrinos e de neurotransmissores, como uma redução no 5-HT9,10. Esses resultados refletem de perto aqueles observados em humanos diagnosticados com TDM, validando assim a utilidade do modelo. O modelo CUMS é particularmente valorizado por sua eficácia na avaliação de antidepressivos, manifestando altos níveis de validade superficial, estrutural e preditiva11,12. Ao contrário de outros modelos, a CUMS é sensível aos efeitos da administração crônica de antidepressivos monoaminérgicos. Por exemplo, inibidores seletivos da recaptação da serotonina (ISRSs), como citalopram, paroxetina e fluoxetina, demonstraram prevenir e reverter a anedonia em condições de estresse crônico12,13. Além disso, novos antidepressivos de ação rápida, como a cetamina, também demonstraram eficácia nesse modelo14,15. Em contraste, outros testes, como o teste de nado forçado (FST) e o teste de suspensão da cauda (TST), são menos confiáveis para modelar mudanças comportamentais de longo prazo, muitas vezes refletindo adaptações ao estresse agudo, em vez de sintomas duradouros de depressão16. Essas características ressaltam a validade robusta do modelo CUMS na pesquisa sobre depressão. Uma das características mais salientes do modelo CUMS, reconhecido por sua alta confiabilidade nos estudos clássicos, é a anedonia - a incapacidade de sentir prazer ou interesse nas atividades cotidianas17,18. Esse fenômeno é comumente avaliado usando testes de preferência por sacarose, e muitos antidepressivos demonstraram reverter o consumo reduzido de sacarose. Várias outras métricas também são comumente empregadas na literatura do CUMS, incluindo o teste de campo aberto (OFT), que avalia o comportamento motor voluntário, tendências exploratórias e tensão, medindo assim a gravidade da depressão19. Outros testes, como o labirinto em cruz elevado (EPM), avaliam comportamentos semelhantes à ansiedade, o teste do labirinto aquático de Morris (MWM) examina o funcionamento cognitivo20, e o FST avalia a suscetibilidade a emoções negativas e desespero comportamental20. Além disso, a maioria dos estressores que afetam os humanos são de natureza social. Indivíduos com relações sociais abaixo do ideal, caracterizadas por atividades sociais, redes e apoio limitados, correm um risco elevado de várias doenças21,22. Isso também é relevante no caso de roedores, que são animais sociais que vivem em grupos. Por exemplo, ratos alojados em isolamento exibem características do que é chamado de síndrome de isolamento, que induz estresse social e acelera o início da depressão23.
A medicina mongol, um ramo significativo da medicina chinesa, postula que o início da doença é uma interação complexa entre fatores intrínsecos e externos. Esses fatores externos, chamados de quatro condições auxiliares, abrangem mudanças climáticas, dieta, estilo de vida e eventos repentinos, como infecções, incidentes surpreendentes e distúrbios psicológicos. O processo de doença é conceituado como uma interação contínua entre três elementos - referidos como os três tipos de homors - e os Sete Constituintes Corporais em conjunto com as quatro condições auxiliares24. A medicina mongol sustenta que o corpo humano funciona como uma entidade integrada, mantida por um equilíbrio relativo entre os três homos. Uma ruptura nesse equilíbrio é considerada precursora da doença24. Dado o papel central da experimentação animal na ponte entre a medicina tradicional e moderna, é crucial desenvolver modelos animais que sejam relevantes para a pesquisa no campo da medicina mongol. Assim, empregamos uma metodologia de isolamento de 28 dias juntamente com CUMS para simular esses estressores fisiológicos e psicológicos. Selecionamos nove estressores imprevisíveis específicos e procuramos sustentar esse método de modelagem por meio da teoria dos Três Homors da medicina mongol. Estabelecer um modelo animal robusto é fundamental para o avanço da pesquisa básica na medicina mongol e contribuirá significativamente para seus estudos fundamentais.
Protocolo
Os protocolos experimentais receberam aprovação do Comitê de Ética em Cuidados com Experimentos Animais da Universidade Médica da Mongólia Interior (YKD202301172) e aderiram às diretrizes do National Institutes of Health para cuidados e ética animal. O número de licença do nosso centro de animais é NO.110324230102364187. Vinte e quatro ratos Sprague-Dawley (SD) machos, cada um com 8 semanas de idade (200 g ± 20 g), foram adquiridos e alojados em ambiente controlado com temperatura de 22°C ± 2°C e umidade de 55% ± 15%. Alimente os ratos com uma dieta de manutenção de roedores e água pura com espigas de milho como cama. Os ratos foram submetidos a um ciclo claro/escuro de 12 h/12 h por 1 semana antes da experimentação.
1. Estabelecimento do modelo de rato CUMS
- Agrupamento
- Divida os 24 ratos aleatoriamente em 2 grupos: o grupo controle (CON), que não será exposto a isolamento ou estresse, e o grupo modelo (MOD). Cada grupo contém 12 ratos.
- Alojar os ratos em gaiolas padrão medindo 55 cm x 40 cm x 20 cm, com 6 ratos por gaiola. Manter a atribuição da gaiola durante todo o período de aclimatação, salvo indicação em contrário.
- Encha cada gaiola de criação com cama nova e substitua-a duas vezes por semana.
- Realize um período de aclimatação de 1 semana. Permita que os ratos tenham acesso irrestrito a comida e água, exceto durante a aplicação do estressor CUMS. Mantenha um ambiente constante com temperatura de 22°C ± 2°C, umidade de 55% ± 15% e um ciclo claro/escuro de 12 h/12 h das 08:00 às 20:00, salvo indicação em contrário.
- Antes de iniciar o experimento, manuseie os ratos diariamente para aclimatá-los ao pesquisador e minimizar o estresse adicional durante a fase experimental.
- Isolamento com estresse leve imprevisível crônico
- Coloque simultaneamente os grupos MOD e CON em salas separadas. Alojar os ratos do grupo MOD individualmente, enquanto mantém os ratos do grupo CON juntos. Mantenha todas as outras condições constantes.
- Implemente um regime de estressor de 28 dias25. Para evitar a habituação e garantir a imprevisibilidade do estressor, administre um estressor aleatório por dia, evitando o uso do mesmo estressor em dias consecutivos.
- Aplique aleatoriamente um dos nove estressores a seguir 26,27 em dias diferentes: 24 h de privação de água, 24 h de privação de comida, enchimento úmido, inclinação da gaiola, inversão do ciclo claro/escuro, exposição ao frio a 4 °C, exposição ao calor a 45 °C, 1 min de pinçamento da cauda ou 15 min de agitação a 160 rpm. O desenho específico é descrito na Tabela 1.
- Durante a aplicação do estressor, restrinja o acesso a alimentos e água ao grupo MOD até que o estresse termine, exceto durante a inversão do ciclo claro/escuro. O grupo CON não foi obrigado a restringir a água e a dieta.
- Métodos de estresse
- Inicie o experimento aplicando estímulos de depressão em conjunto com isolamento de 28 dias em todos os ratos, excluindo o grupo controle. Alojar esses ratos em gaiolas individuais. Consulte a Tabela 2 para condições relacionadas a estímulos de depressão.
- Para executar o método de fixação da cauda, prenda a cauda de um rato do grupo MOD prendendo a cauda com um clipe de papel padrão a uma distância de 1-2 cm da raiz da cauda do rato. Meça o tempo de fixação por uma duração de 1 min (n = 12).
- No método de privação de água, retenha a água de um rato do grupo MOD removendo sua garrafa de água e registre por 24 h.
NOTA: A hora de início da privação de água foi registrada para que a hora de término pudesse ser calculada com precisão; O comportamento dos ratos durante este período foi observado, incluindo atividade, apetite e estado mental. - No método de privação alimentar, reter comida de um rato do grupo MOD e registar durante 24 h.
NOTA: Registre a hora em que a privação de alimentos começa para que a hora de término possa ser calculada com precisão; Assegurar que os ratos estejam adequadamente hidratados durante este período; e observar o comportamento dos ratos durante este período, incluindo atividade e estado mental, etc. - Para estimulação fria a 4 °C, coloque um rato do grupo MOD em um balde de água fria e registre por 5 min. Certifique-se de que a temperatura da água permaneça consistente durante todo o teste. Na conclusão do experimento, seque o rato com um soprador e devolva-o à sua gaiola original.
NOTA: Mantenha a temperatura da água fria a 4 °C usando um termômetro e cubos de gelo para regular a temperatura da água quando ela subir. A água deve ser trocada regularmente para garantir que a qualidade da água seja limpa e a temperatura constante. Ao nadar, todos os membros e troncos dos ratos devem ser imersos em água fria, exceto a cabeça. A profundidade da água deve ser maior que o comprimento do corpo do rato para evitar que o rato pule para fora da água devido ao contato com o fundo do balde. - Para administrar estresse térmico de 45 °C, coloque um rato do grupo MOD em uma incubadora e registre por 5 min, garantindo que a temperatura permaneça estável durante todo o teste.
- Na inversão do ciclo claro-escuro, envolva a gaiola em um pano preto por 1 h para simular a escuridão diurna. Em seguida, ilumine a gaiola por 12 h durante a noite para imitar a luz do dia. Registre o comportamento do rato, a ingestão de comida e água e os padrões de sono por 24 horas.
- Para o experimento de preenchimento úmido, introduza 200 mL de água em uma gaiola contendo 100 g de acolchoamento. Alojar um rato do grupo MOD na gaiola molhada e registrar o comportamento dos ratos sob estresse da cama úmida, incluindo atividade, apetite, ingestão de água, etc. Observe se há comportamentos anormais ou reações desconfortáveis, como a condição da pele e do cabelo dos ratos, que podem ser causados pelo acolchoamento úmido, e registre-os a tempo para análise subsequente por 24 horas. Após o teste, seque o rato com um soprador e coloque-o de volta em uma gaiola com aparas de madeira frescas.
- No método de inclinação da gaiola, coloque um rato do grupo MOD em uma gaiola inclinada em um ângulo de 45° contra uma parede e registre por 24 h. Use a estrutura da estrutura da gaiola para ajustar o ângulo e prender a gaiola no lugar.
NOTA: Calcule o tempo do início ao fim e observe o comportamento dos ratos durante o período de inclinação da gaiola, incluindo atividade, apetite e estado mental, e certifique-se de que o ângulo da gaiola inclinada esteja definido corretamente e permaneça estável para garantir a precisão e reprodutibilidade do experimento. - Para agitação em alta velocidade, coloque um rato do grupo MOD em um agitador mecânico ajustado para 160 rpm e registre o rato por 15 min. Métodos de teste comportamental são posteriormente utilizados para avaliar o estabelecimento bem-sucedido do modelo.
- Depois de aplicar estressores, reposicione as gaiolas do grupo MOD da sala CUMS de volta para a sala de alojamento. Durante o período de exposição ao estresse de 4 semanas, mantenha o grupo CON em suas gaiolas domésticas situadas na sala de alojamento.
- Precauções durante os experimentos
- Transfira as gaiolas do grupo MOD de volta para a sala de alojamento geral após a aplicação do estressor na sala CUMS.
- Monitoramento animal durante a modelagem CUMS
- Durante o clampeamento da cauda, é provável que o animal lute devido à estimulação induzida. Durante todo esse período, monitore continuamente o clamp. Se ele se soltar, pause o cronômetro, reaplique o clamp e retome o cronômetro por 1 min.
- Não imponha privação de água e estressores de cama molhada simultaneamente.
NOTA: Evitar a imposição simultânea de acolchoamento úmido e privação de água ajuda a manter a integridade experimental, reduz variáveis de confusão e promove o bem-estar animal. - A temperatura corporal do animal e a temperatura ambiente podem aumentar a temperatura da água durante a natação em água fria. Portanto, ajuste adicionando água gelada ou cubos de gelo para manter uma temperatura constante da água.
- Observe os ratos em intervalos de 30 min durante a aplicação dos estressores, exceto durante a reversão diurna. Preste atenção especial aos sinais de angústia incomum, como tremores, letargia ou falta de movimento. Se tais sintomas forem observados - particularmente hipotermia potencial durante natação em água fria a 4 ° C e cama molhada - remova imediatamente o rato do estressor.
NOTA: Remova os animais experimentais do estudo quando eles tiverem problemas de saúde, como infecção, trauma grave, comportamentos agressivos, mobilidade anormal, etc., As condições para remover os animais do estudo geralmente giram em torno de proteger sua saúde e segurança, garantindo a integridade dos resultados experimentais. - Realize inspeções diárias em busca de feridas ou outras anormalidades físicas ou comportamentais em cada rato. Se forem observadas anomalias, consultar o veterinário do laboratório para determinar se o rato deve ser excluído da experiência.
- Pese cada rato a cada 3 dias. Se um animal perder mais de 20% do seu peso corporal basal antes da alimentação, deve ser excluído da experiência.
2. Testes comportamentais
- Para começar, administre os estímulos de depressão em conjunto com o isolamento por 28 dias a todos os ratos, excluindo o grupo controle. Alojar os ratos em gaiolas individuais. Consulte a Tabela 2 para obter detalhes sobre as condições dos estímulos de depressão.
- Para o teste de campo aberto, divida uma caixa preta em 25 seções quadradas de área igual. Instale um sistema de análise de rastreamento de vídeo na caixa. Coloque o rato no quadrado central e monitore suas atividades horizontais e verticais por um período de 5 min.
NOTA: As dimensões da caixa são 500 mm x 500 mm x 300 mm. Os dados de atividade serão coletados usando o sistema de rastreamento de vídeo para avaliar comportamentos relacionados à ansiedade nos roedores quando expostos a um novo ambiente. - Posteriormente, contabilize o número de quadrados percorridos pelo rato, usando todas as patas, para quantificar a atividade horizontal. Conte os casos de ficar em pé e se arrumar como indicadores de atividade vertical. Após cada teste, higienize a caixa usando álcool 75% para eliminar quaisquer odores residuais de ratos para testes subsequentes.
- Em seguida, a anedonia é avaliada por meio do teste de preferência por sacarose. Coloque duas garrafas na tampa da gaiola: a garrafa A contém água pura, enquanto a garrafa B contém solução de sacarose a 1%. Permita acesso ad libitum a ambas as soluções para o rato. Pese as garrafas antes e depois do consumo para calcular as taxas de preferência de sacarose de 60 min nos dias 0, 7, 14, 21 e 28. A fórmula é a seguinte:
Consumo de sacarose =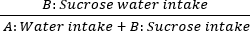 × 100%
× 100% - Para medir a memória espacial e as habilidades de aprendizagem, empregue o teste do labirinto aquático de Morris. Divida a piscina em quatro quadrantes, numerando-os de um a quatro. Coloque uma plataforma de repouso submersa 1 cm abaixo da superfície da água no terceiro quadrante.
- Introduzir leite na piscina para aumentar a opacidade da água e manter uma temperatura da água de aproximadamente 23 °C durante todo o procedimento experimental.
- Coloque cada rato em vários quadrantes do labirinto, permitindo-lhes 120 s para localizar a plataforma oculta. Os ratos devem confiar na memória espacial e nas habilidades de aprendizado para lembrar a localização da plataforma. Depois de descobrir a localização da plataforma, eles podem nadar diretamente para ela. Registre o tempo de latência usando o sistema de rastreamento de vídeo do labirinto aquático Morris.
- Posicione o rato em um local fixo na piscina. Se o sujeito não conseguir localizar a plataforma oculta em 120 s, registre a latência como 120 s.
- Finalmente, remova a plataforma oculta, coloque o rato de volta na água e registre o número de cruzamentos de zona em um período de 120 s.
3. Análise estatística
- Para avaliar diferenças significativas nos parâmetros bioquímicos, empregue a análise de variância (ANOVA) unidirecional seguida pelo teste post hoc de Duncan. Apresente os dados como média ± erro padrão (EP) e considere um valor de p menor que 0,05 como estatisticamente significativo.
Resultados
Resultados dos testes comportamentais no modelo de depressão de ratos induzida por CUMS
Para corroborar a eficácia do procedimento CUMS para induzir comportamentos semelhantes à depressão, foi realizada uma verificação de manipulação. Ratos Sprague-Dawley (SD) machos foram alocados aleatoriamente para o grupo MOD ou CON por um período de 4 semanas, conforme descrito na etapa 1.2.3. Posteriormente, os ratos foram sacrificados e seus hipocampos foram completamente dissecados para avaliação de...
Discussão
A depressão é um transtorno mental caracterizado por sintomas como mau humor, falta de prazer e redução de energia30. No campo da pesquisa sobre depressão, o estabelecimento de um modelo animal confiável é crucial para o avanço das intervenções terapêuticas. Dentre os vários modelos animais, o modelo CUMS é particularmente notável por sua alta confiabilidade, validade e congruência com as características da depressão humana31. É adequado para imitar os efe...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Somos gratos pela instrumentação e laboratório fornecidos por estender nossa gratidão à faculdade de medicina da Mongólia da Universidade Médica da Mongólia Interior, China. Este estudo recebeu apoio financeiro da Fundação Nacional de Ciências Naturais da China (Grant No. 81760762) e), o Projeto da Universidade Médica da Mongólia Interior da China (Grant No. YKD2022MS074), e o Projeto de Pesquisa Científica do Ensino Superior na Mongólia Interior, China (Grant No. NJZY22661) e o Projeto de Fundo Aberto do Laboratório Chave de Medicina Chinesa e Mongol na Região Autônoma da Mongólia Interior, China (Grant No. MYX2023-K07).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tube | service Biotechnology Co., Ltd | EP-150-M | |
| 1000 µL Pipette | service Biotechnology Co., Ltd | IC021198160223 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | IC012395160823 | |
| 10 µL pipette tip | service Biotechnology Co., Ltd | TP-10 | |
| 1250 µL pipette tip | service Biotechnology Co., Ltd | TP-1250 | |
| 2 mL centrifuge tube | service Biotechnology Co., Ltd | EP-200-M | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | TP-200 | |
| 200 µL pipette tip | service Biotechnology Co., Ltd | IC021029160323 | |
| 300 µL Multi-Channel Pipette | service Biotechnology Co., Ltd | IC091006161022 | |
| 50 µL Pipette | service Biotechnology Co., Ltd | DS35110 | |
| Automatic plate washing machine | rayto Life Sciences Co., Ltd | RT-3100 | |
| Benchtop High-Speed Freezing Centrifuge | dalong construction Co., Ltd | D3024R | |
| electronic balance | Mettler Toledo International Trade (Shanghai) Co., Ltd | ME203E/02 | |
| Electrothermal blast drying oven | Labotery Experimental Instrument Equipment Co., Ltd | GEL-70 | |
| Enzyme Label Detector | BioTeK Co., Ltd | Epoch | |
| High Speed Tissue Grinder | service Biotechnology Co., Ltd | KZ- -F -F | |
| Horizontal Freezer | Mellow Group Co., Ltd | BCD-318AT | |
| Laboratory Ultrapure Water Machine | Jinan Aiken Environmental Protection Technology Co., Ltd | AK-RO-C2 | |
| Morris water maze video trail analysing system | Tai Meng Tech Co., Ltd | WMT-200 | |
| Rat 5-HT ELISA Kit | Lian Ke bio Co., Ltd,China | 96T/48T | |
| SPF grade Sprague Dawley (SD) rats | SPF (Beijing) Biotechnology Co | SCXK(JING)2019-0010 | |
| Sprague Dawley rats | Beijing Biotechnology Co., Ltd, China | SCXK (JING) 2019-0010 | |
| Vertical Refrigerated Display Cabinet | Xingx Group Co., Ltd | LSC-316C | |
| video tracking system | Tai Meng Tech Co., Ltd | ZH-ZFT | |
| vortex mixer | Servicebio technology Co., Ltd | MV-100 |
Referências
- Alqurashi, G. K., et al. The impact of chronic unpredictable mild stress-induced depression on spatial, recognition and reference memory tasks in mice: Behavioral and histological study. Behav Sci. 12 (6), 166 (2022).
- Yu, S., Wang, L., Jing, X., Wang, Y., An, C. Features of gut microbiota and short-chain fatty acids in patients with first-episode depression and their relationship with the clinical symptoms. Front Psychol. 14, 1088268 (2023).
- Duda, P., Hajka, D., Wójcicka, O., Rakus, D., Gizak, A. Gsk3β: A master player in depressive disorder pathogenesis and treatment responsiveness. Cells. 9 (3), 727 (2020).
- Correia, A. S., Vale, N. Tryptophan metabolism in depression: A narrative review with a focus on serotonin and kynurenine pathways. Int J Mol Sci. 23 (15), 8493 (2022).
- Hao, Y., Ge, H., Sun, M., Gao, Y. Selecting an appropriate animal model of depression. Int J Mol Sci. 20 (19), 4827 (2019).
- Willner, P., Towell, A., Sampson, D., Sophokleous, S., Muscat, R. Reduction of sucrose preference by chronic unpredictable mild stress, and its restoration by a tricyclic antidepressant. Psychopharmacology (Berl). 93 (3), 358-364 (1987).
- Nakase, S., Kitayama, I., Soya, H., Hamanaka, K., Nomura, J. Increased expression of magnocellular arginine vasopressin mrna in paraventricular nucleus of stress-induced depression-model rats. Life Sci. 63 (1), 23-31 (1998).
- Wu, X., et al. Involvement of kynurenine pathway between inflammation and glutamate in the underlying etiopathology of cums-induced depression mouse model. BMC Neurosci. 23 (1), 62 (2022).
- Zhang, C., et al. Minocycline ameliorates depressive behaviors and neuro-immune dysfunction induced by chronic unpredictable mild stress in the rat. Behav Brain Res. 356, 348-357 (2019).
- Ma, J., Wang, R., Chen, Y., Wang, Z., Dong, Y. 5-HT attenuates chronic stress-induced cognitive impairment in mice through intestinal flora disruption. J Neuroinflammation. 20 (1), 23 (2023).
- Nollet, M. Models of depression: Unpredictable chronic mild stress in mice. Curr Protoc. 1 (8), e208 (2021).
- Becker, M., Pinhasov, A., Ornoy, A. Animal models of depression: What can they teach us about the human disease. Diagnostics (Basel). 11 (1), 123 (2021).
- Petkovic, A., Chaudhury, D. Encore: Behavioural animal models of stress, depression and mood disorders. Front Behav Neurosci. 16, 931964 (2022).
- Okine, T., Shepard, R., Lemanski, E., Coutellier, L. Sex differences in the sustained effects of ketamine on resilience to chronic stress. Front Behav Neurosci. 14, 581360 (2020).
- Fitzgerald, P. J., et al. Sex- and stress-dependent effects of a single injection of ketamine on open field and forced swim behavior. Stress. 24 (6), 857-865 (2021).
- Doron, R., Burstein, O. The unpredictable chronic mild stress protocol for inducing anhedonia in mice. J Vis Exp. (140), e58184 (2018).
- De Vry, J., Schreiber, R. The chronic mild stress depression model: Future developments from a drug discovery perspective. Psychopharmacology (Berl). 134 (4), 349-350 (1997).
- Tong, J., et al. Antidepressant effect of helicid in chronic unpredictable mild stress model in rats. Int Immunopharmacol. 67, 13-21 (2019).
- Liu, H., et al. Tnf signaling pathway-mediated microglial activation in the pfc underlies acute paradoxical sleep deprivation-induced anxiety-like behaviors in mice. Brain Behav Immun. 100, 254-266 (2022).
- He, L. W., et al. Optimization of food deprivation and sucrose preference test in sd rat model undergoing chronic unpredictable mild stress. Animal Model Exp Med. 3 (1), 69-78 (2020).
- Ma, W., Wu, B., Gao, X., Zhong, R. Association between frailty and cognitive function in older chinese people: A moderated mediation of social relationships and depressive symptoms. J Affect Disord. 316, 223-232 (2022).
- Geng, C., et al. Systematic impacts of chronic unpredictable mild stress on metabolomics in rats. Sci Rep. 10 (1), 700 (2020).
- Holmes, T. H., Rahe, R. H. The social readjustment rating scale. J Psychosom Res. 11 (2), 213-218 (1967).
- Zhang, M., et al. Shuxie-1 decoction alleviated cums -induced liver injury via il-6/jak2/stat3 signaling. Front Pharmacol. 13, 848355 (2022).
- Antoniuk, S., Bijata, M., Ponimaskin, E., Wlodarczyk, J. Chronic unpredictable mild stress for modeling depression in rodents: Meta-analysis of model reliability. Neurosci Biobehav Rev. 99, 101-116 (2019).
- Hu, C., et al. Re-evaluation of the interrelationships among the behavioral tests in rats exposed to chronic unpredictable mild stress. PLoS One. 12 (9), e0185129 (2017).
- Li, Y., et al. Increased hippocampal fissure width is a sensitive indicator of rat hippocampal atrophy. Brain Res Bull. 137, 91-97 (2018).
- Hu, R. L. B. G., et al. Effects of the Mongolian medicine Zadi-5 on monoamine neurotransmitters in the brain of rats with chronic stress depression model. Info Traditional Chinese Med. 34 (06), 5-8 (2017).
- Zhou, Y., Cong, Y., Liu, H. Folic acid ameliorates depression-like behaviour in a rat model of chronic unpredictable mild stress. BMC Neurosci. 21 (1), 1 (2020).
- Zhuang, Y., Zeng, R., Liu, X., Yang, L., Chan, Z. Neoagaro-oligosaccharides ameliorate chronic restraint stress-induced depression by increasing 5-ht and bdnf in the brain and remodeling the gut microbiota of mice. Mar Drugs. 20 (11), 725 (2022).
- Socała, K., et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacol Res. 172, 105840 (2021).
- Song, J., Kim, Y. K. Animal models for the study of depressive disorder. CNS Neurosci Ther. 27 (6), 633-642 (2021).
- Abelaira, H. M., Réus, G. Z., Quevedo, J. Animal models as tools to study the pathophysiology of depression. Braz J Psychiatry. 35 Suppl 2, S112-S120 (2013).
- Strekalova, T., et al. Chronic mild stress paradigm as a rat model of depression: Facts, artifacts, and future perspectives. Psychopharmacology (Berl). 239 (3), 663-693 (2022).
- Markov, D. D. Sucrose preference test as a measure of anhedonic behavior in a chronic unpredictable mild stress model of depression: Outstanding issues. Brain Sci. 12 (10), 1287 (2022).
- Czéh, B., Fuchs, E., Wiborg, O., Simon, M. Animal models of major depression and their clinical implications. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 64, 293-310 (2016).
- Gururajan, A., Reif, A., Cryan, J. F., Slattery, D. A. The future of rodent models in depression research. Nat Rev Neurosci. 20 (11), 686-701 (2019).
- Markov, D. D., Novosadova, E. V. Chronic unpredictable mild stress model of depression: Possible sources of poor reproducibility and latent variables. Biology (Basel). 11 (11), 1621 (2022).
- Willner, P. The chronic mild stress (cms) model of depression: History, evaluation and usage. Neurobiol Stress. 6, 78-93 (2017).
- Lages, Y. V. M., Rossi, A. D., Krahe, T. E., Landeira-Fernandez, J. Effect of chronic unpredictable mild stress on the expression profile of serotonin receptors in rats and mice: A meta-analysis. Neurosci Biobehav Rev. 124, 78-88 (2021).
- Willner, P., et al. Validation of chronic mild stress in the wistar-kyoto rat as an animal model of treatment-resistant depression. Behavioural Pharmacology. 30 (2 and 3), 239-250 (2019).
- Slattery, D. A., Cryan, J. F. Modelling depression in animals: At the interface of reward and stress pathways. Psychopharmacology (Berl). 234 (9-10), 1451-1465 (2017).
- Sterley, T. L., et al. Social transmission and buffering of synaptic changes after stress. Nat Neurosci. 21 (3), 393-403 (2018).
- Brechbühl, J., et al. Mouse alarm pheromone shares structural similarity with predator scents. Proc Natl Acad Sci U S A. 110 (12), 4762-4767 (2013).
- Beck, R. C., Self, J. L., Carter, D. J. Sucrose preference thresholds for satiated and water-deprived rats. Psychol Rep. 16, 901-905 (1965).
- Hawkins, P., Golledge, H. D. R. The 9 to 5 rodent - time for change? Scientific and animal welfare implications of circadian and light effects on laboratory mice and rats. J Neurosci Methods. 300, 20-25 (2018).
- Daut, R. A., Ravenel, J. R., Watkins, L. R., Maier, S. F., Fonken, L. K. The behavioral and neurochemical effects of an inescapable stressor are time of day dependent. Stress. 23 (4), 405-416 (2020).
- Hu, R. L. B. G., et al. Experimental research on nutmeg wuwei pills against of depression model rats behavior and hippocampus monoamine neurotransmitters. Chinese J Exp Traditional Medical Formulae. 21 (11), 146-149 (2015).
- Hu, R. L. B. G., et al. Effects of Rou kou Wuwei Pill on the learning and memory abilities and the expression of BDNF and TrkB in hippocampus of depression rats. Chinese J Traditional Chines Med Pro. 32 (8), 3797-3800 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados