A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مراقبة التطور الميكانيكي للأنسجة أثناء إغلاق الأنبوب العصبي لجنين الفرخ
In This Article
Summary
تم تطوير هذا البروتوكول لمراقبة الخصائص الميكانيكية لأنسجة الصفيحة العصبية طوليا أثناء تعصيب جنين الفرخ. يعتمد على دمج مجهر بريلوين ونظام حضانة على خشبة المسرح ، مما يتيح التصوير الميكانيكي الحي لأنسجة الصفيحة العصبية في أجنة الكتاكيت المستزرعة خارج البويضات .
Abstract
إغلاق الأنبوب العصبي (NTC) هو عملية حاسمة أثناء التطور الجنيني. يمكن أن يؤدي الفشل في هذه العملية إلى عيوب الأنبوب العصبي ، مما يسبب تشوهات خلقية أو حتى الوفيات. يتضمن NTC سلسلة من الآليات على المستويات الوراثية والجزيئية والميكانيكية. في حين أن التنظيم الميكانيكي أصبح موضوعا جذابا بشكل متزايد في السنوات الأخيرة ، إلا أنه لا يزال غير مستكشف إلى حد كبير بسبب عدم وجود تقنية مناسبة لإجراء الاختبارات الميكانيكية للأنسجة الجنينية 3D في الموقع. استجابة لذلك ، قمنا بتطوير بروتوكول لتحديد الخواص الميكانيكية للأنسجة الجنينية للدجاج بطريقة غير ملامسة وغير جراحية. يتم تحقيق ذلك من خلال دمج مجهر بريلوين متحد البؤر مع نظام حضانة على المسرح. لفحص ميكانيكا الأنسجة ، يتم جمع جنين مزروع مسبقا ونقله إلى حاضنة على خشبة المسرح لزراعة البويضات السابقة . في الوقت نفسه ، يتم الحصول على الصور الميكانيكية لأنسجة الصفيحة العصبية بواسطة مجهر بريلوين في نقاط زمنية مختلفة أثناء التطوير. يتضمن هذا البروتوكول وصفا مفصلا لإعداد العينات ، وتنفيذ تجارب الفحص المجهري Brillouin ، والمعالجة اللاحقة للبيانات وتحليلها. باتباع هذا البروتوكول ، يمكن للباحثين دراسة التطور الميكانيكي للأنسجة الجنينية أثناء التطور طوليا.
Introduction
عيوب الأنبوب العصبي (NTDs) هي عيوب خلقية شديدة في الجهاز العصبي المركزي ناتجة عن الفشل في إغلاق الأنبوب العصبي (NTC) أثناء التطور الجنيني1. مسببات أمراض المناطق المدارية المهملة معقدة. أظهرت الدراسات أن NTC ينطوي على سلسلة من العمليات المورفولوجية ، بما في ذلك التمديد المتقارب ، وثني الصفيحة العصبية (على سبيل المثال ، الانقباض القمي) ، ورفع الطية العصبية ، وأخيرا التصاق الطية العصبية. وتنظم هذه العمليات آليات جزيئية وجينية متعددة 2,3، وأي خلل في هذه العمليات قد يؤدي إلى أمراض المناطق المدارية المهملة 4,5,6. نظرا لأن الأدلة المتزايدة تشير إلى أن الإشارات الميكانيكية تلعب أيضا أدوارا حاسمة خلال NTC3،7،8،9،10،11 ، وقد تم العثور على علاقات بين الجينات والإشارات الميكانيكية12،13،14 ، يصبح من الضروري التحقيق في الميكانيكا الحيوية للأنسجة أثناء العصبية.
تم تطوير العديد من التقنيات لقياس الخواص الميكانيكية للأنسجة الجنينية ، بما في ذلك الاستئصال بالليزر (LA) 15 ، تشريح الأنسجة وانبساطها (TDR) 16،17 ، شفط الماصة الدقيقة (MA) 18 ، المسافة البادئة النانوية القائمة على مجهر القوة الذرية (AFM)19 ، microindenter (MI) والألواح الدقيقة (MP) 20 ، الريولوجيا الدقيقة (MR) مع ملاقط بصرية / مغناطيسية21،22،23، وأجهزة الاستشعار القائمة على القطيرات24. يمكن للطرق الحالية قياس الخواص الميكانيكية بدقة مكانية تتراوح من المقاييس تحت الخلوية إلى مقاييس الأنسجة. ومع ذلك ، فإن معظم هذه الطرق غازية لأنها تتطلب ملامسة العينة (على سبيل المثال ، MA و AFM و MI و MP) ، أو حقن المواد الخارجية (على سبيل المثال ، أجهزة الاستشعار القائمة على التصوير بالرنين المغناطيسي والقطرات) ، أو تشريح الأنسجة (على سبيل المثال ، LA و TDR). نتيجة لذلك ، من الصعب على الطرق الحالية مراقبة التطور الميكانيكي لأنسجة الصفيحة العصبية في الموقع25. في الآونة الأخيرة ، أظهر التصوير الإلستوجرافي للتماسك البصري الصدى وعدا لرسم الخرائط الميكانيكية غير الملامسة بدقة مكانية عالية26.
الفحص المجهري Brillouin Confocal هو طريقة بصرية ناشئة تتيح القياس الكمي غير المتصل للميكانيكا الحيوية للأنسجة بدقة تحت الخلوية27،28،29،30. يعتمد الفحص المجهري Brillouin على مبدأ تشتت ضوء Brillouin التلقائي ، وهو التفاعل بين ضوء الليزر الساقط والموجة الصوتية الناتجة عن التقلبات الحرارية داخل المادة. وبالتالي ، فإن الضوء المبعثر يتعرض لتحول تردد ، يعرف باسم إزاحة بريلوين ωR ، باتباع المعادلة31:
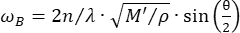 (1)
(1)
هنا ، 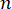 هو معامل الانكسار للمادة ، λ هو الطول الموجي للضوء الساقط ، M ' هو المعامل الطولي ، ρ هي كثافة الكتلة ، و θ هي الزاوية بين الضوء الساقط والضوء المتناثر. بالنسبة لنفس النوع من المواد البيولوجية ، تكون نسبة معامل الانكسار والكثافة
هو معامل الانكسار للمادة ، λ هو الطول الموجي للضوء الساقط ، M ' هو المعامل الطولي ، ρ هي كثافة الكتلة ، و θ هي الزاوية بين الضوء الساقط والضوء المتناثر. بالنسبة لنفس النوع من المواد البيولوجية ، تكون نسبة معامل الانكسار والكثافة 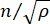 ثابتة تقريبا28،32،33،34،35،36. وبالتالي ، يمكن استخدام تحول بريلوين مباشرة لتقدير التغيرات الميكانيكية النسبية في العمليات الفسيولوجية. تم التحقق من جدوى الفحص المجهري Brillouin في عينات بيولوجية مختلفة29،37،38. في الآونة الأخيرة ، تم عرض التصوير الميكانيكي بفاصل زمني لجنين كتكوت حي من خلال الجمع بين مجهر بريلوين ونظام حضانة على خشبة المسرح39. يوفر هذا البروتوكول وصفا تفصيليا لإعداد العينات وتنفيذ التجربة ومعالجة البيانات وتحليلها بعد المعالجة. نأمل أن يسهل هذا الجهد الاعتماد الواسع النطاق لتقنية Brillouin غير الملامسة لدراسة التنظيم الميكانيكي الحيوي في تطور الجنين والعيوب الخلقية.
ثابتة تقريبا28،32،33،34،35،36. وبالتالي ، يمكن استخدام تحول بريلوين مباشرة لتقدير التغيرات الميكانيكية النسبية في العمليات الفسيولوجية. تم التحقق من جدوى الفحص المجهري Brillouin في عينات بيولوجية مختلفة29،37،38. في الآونة الأخيرة ، تم عرض التصوير الميكانيكي بفاصل زمني لجنين كتكوت حي من خلال الجمع بين مجهر بريلوين ونظام حضانة على خشبة المسرح39. يوفر هذا البروتوكول وصفا تفصيليا لإعداد العينات وتنفيذ التجربة ومعالجة البيانات وتحليلها بعد المعالجة. نأمل أن يسهل هذا الجهد الاعتماد الواسع النطاق لتقنية Brillouin غير الملامسة لدراسة التنظيم الميكانيكي الحيوي في تطور الجنين والعيوب الخلقية.
Protocol
تمت الموافقة على البروتوكول من قبل اللجنة المؤسسية لرعاية واستخدام بجامعة واين ستيت.
1. التحضير التجريبي
- استخدم محلول إيثانول بنسبة 70٪ لتنظيف وتعقيم المقص والملاقط. أيضا ، إعداد ماصات يمكن التخلص منها وحقنة.
- قم بإعداد وسط غسيل بإضافة 3.595 جم من كلوريد الصوديوم إلى 495 مل من الماء منزوع الأيونات. ثم أضف 5 مل من البنسلين والستربتومايسين (5 وحدة / مل) إلى الوسط. املأ طبق بتري 100 مم بوسط الغسيل وقم بتسخينه إلى 37 درجة مئوية.
- قم بإعداد أطباق الاستزراع وفقا للشكل 1 ، الذي يوضح التكوين العام.
- قم بإعداد قطعة من ورق الترشيح ، وقم بتقطيعها إلى شكل مستطيل يبلغ حوالي 17 مم × 20 مم ، وقم بإزالة الزوايا الأربع. قم بإنشاء مركز مجوف في ورق الترشيح ، بحجم 7 مم × 10 مم تقريبا لتأمين الجنين (الشكل 1 ، يسار).
ملاحظة: يتم وصف جمع الأجنة في الخطوة 2. - قم بتوصيل حلقة تجارية متاحة (Φ = 1 بوصة ، انظر جدول المواد) بطبقة فيلم مرنة (أي فيلم البارافين) ، مما يضمن أن الفيلم المرن يحتوي أيضا على مركز مجوف. سيتم استخدام هذه الحلقة مع الفيلم لتثبيت ورقة الترشيح مع الجنين.
- أخيرا ، ضع الحلقة المحضرة في طبق بتري 35 مم (الشكل 1 ، يمين).
ملاحظة: ورق الترشيح مخصص لتأمين الجنين المستخرج وتثبيته عن طريق وضع ورق الترشيح على الغشاء وترك الجنين في المنطقة المجوفة المركزية (والتي سيتم تفصيلها في الخطوة 2). تم قطع الزوايا الأربع لتناسب حجم الحلقة الخارجية (ليس ضروريا إذا كانت مثبتة بالفعل). يتم استخدام طبق استزراع ذو قاع زجاجي 35 مم لتحسين انتشار شعاع الليزر. يحتوي الطبق على بئر داخلي (Φ = 23 مم) ، والذي يمكن ملؤه بالزلال لثقافة البيض السابقة . يجب أن يكون قطر الحلقة أكبر من قطر البئر الداخلي بحيث يمكن تغطية البئر بالفيلم المرن على الحلقة (الشكل 1 ، أقحم). حجم ورق الترشيح غير مقيد ويمكن تعديله وفقا لحجم الحلقة المختارة وطبق الاستزراع. بدلا من ذلك ، يمكن طلاء قاع الطبق مسبقا بطبقة من الأغاروز (سمك: ~ 1 مم). عن طريق إزالة الأغاروز من وسط الطبقة باستخدام شفرة ، يمكن إنشاء بئر ذو شكل مشابه للمركز المجوف للفيلم المرن لتحميل الزلال. إحدى النقاط الحرجة هي أن الجوانب الأربعة لورق الترشيح المجوف يجب أن يكون لها عرض كاف (> 5 مم) لضمان ارتباط الجنين.
- قم بإعداد قطعة من ورق الترشيح ، وقم بتقطيعها إلى شكل مستطيل يبلغ حوالي 17 مم × 20 مم ، وقم بإزالة الزوايا الأربع. قم بإنشاء مركز مجوف في ورق الترشيح ، بحجم 7 مم × 10 مم تقريبا لتأمين الجنين (الشكل 1 ، يسار).
2. استخراج وزراعة البيض من جنين الدجاج
ملاحظة: تم تعديل هذه الخطوة من التقارير المنشورة مسبقا40,41.
- بعد ما قبل الاستزراع ، استرجع البويضة من الحاضنة وضعها على محورها الطويل على صينية كرتون البيض. نظف قشر البيض بنسبة 70٪ من الإيثانول ، مع التأكد من تغطية السطح بالكامل ، ثم اتركه يرتاح لمدة 15 دقيقة.
- امسك البيضة على محورها القصير وكسرها في الأسفل. افتح البيضة على طبق بتري نظيف 100 مم لاستخراج محتوياتها ، كما هو موضح في الشكل 2. تأكد من عدم تدوير البيضة أثناء حملها وتكسيرها.
- باستخدام ماصة ، قم بنقل وجمع ما يقرب من 10 مل من الزلال الرقيق (أي الزلال السائل42) في أنبوب سعة 15 مل لاستخدام زراعة البويضات السابقة . املأ البئر المركزي لطبق الاستزراع بالزلال الرقيق الذي تم جمعه (حوالي 0.9 مل) ، كما هو موضح في الشكل 3. يجب أن تكون عملية التعبئة بطيئة ، وتجنب تكوين أي فقاعات داخل البئر. تأكد من تسخين طبق الاستزراع مع الزلال إلى 37 درجة مئوية.
ملاحظة: سيتم استخدام هذا الطبق لزراعة الجنين خارج البيض. سيتم استخدام أطباق استزراع جديدة مملوءة بوسط الغسيل أثناء تصوير بريلوين (انظر الخطوة 3). - باستخدام المناديل الورقية، أزل الزلال السميك (أي الزلال اللزج) المرتبط بالجنين برفق عن طريق فصل الزلال بعناية عن الغشاء اللاصق، كما هو موضح في الشكل 4. تجنب الاتصال المباشر مع غشاء vitelline.
- بعد إزالة كل الزلال السميك ، قم بتثبيت ورق الترشيح بعناية على غشاء vitelline. تأكد من محاذاة محور جسم الجنين مع المحور الطويل للمستطيل المركزي على ورق الترشيح. استخدم المقص لقطع الغشاء المحيط بورق الترشيح.
- باستخدام الملقط ، اسحب ورق الترشيح المعزول برفق بعيدا عن صفار البيض في اتجاه مائل. اقلب ورقة الترشيح رأسا على عقب لوضع الجنين مع جانبه الظهري لأسفل (لتكوين المجهر المقلوب). اغمر ورق الترشيح بالكامل بعناية من جانب واحد من المحور الطويل في طبق بتري مقاس 100 مم باستخدام وسيط الغسيل بطريقة مائلة.
- اغسل أي صفار متبقي عن طريق رش وسط الغسيل برفق مواز لورق الترشيح باستخدام ماصة نظيفة. تجنب رش وسيط الغسيل مباشرة على الغشاء.
- بعد إزالة كل صفار البيض ، قم بإزالة ورق الترشيح بعناية من وسط الغسيل واستخدم المناديل الورقية لامتصاص أي وسيط زائد من الحواف. بعد ذلك، ضع ورقة الترشيح مع الجنين على طبق المستزرع، مع التأكد من أن الجانب الظهري للجنين متجها لأسفل، كما هو موضح في الشكل 5. للحفاظ على الرطوبة ، ضع مناديل مبللة في الطبق.
- انقل طبق الثقافة إلى الحاضنة على خشبة المسرح لثقافة البيض السابقة .
3. قياس بريلوين للجنين
- تحضير مجموعة أخرى من أطباق الثقافة وملء لهم المتوسطة غسل. تأكد من تسخين وسط الغسيل إلى 37 درجة مئوية.
- عندما يصل الجنين إلى مرحلة النمو المطلوبة ، انقل ورق الترشيح مع الجنين إلى طبق الاستزراع المملوء بوسط الغسيل. ضع طبق الاستزراع في حاضنة مجهر بريلوين على خشبة المسرح (انظر جدول المواد).
- قبل إجراء قياس Brillouin ، احفظ صورة المجال الساطع للجنين بأكمله كمرجع. تم وصف التكوين التفصيلي لمجهر بريلوين سابقا30 وتم تلخيصه في قسم النتائج (الشكل 6).
- قم بقياس إشارة Brillouin للماء والميثانول ، والتي سيتم استخدامها في الخطوة 4 لعملية المعايرة.
- اضبط وقت التعرض للكاميرا لطاقة الليزر الساقطة وجهاز اقتران الشحنة المضاعف للإلكترون (EMCCD، انظر جدول المواد) لتحقيق ما لا يقل عن 10000 عدد من إشارات Brillouin. باستخدام صورة المجال الساطع كدليل، قم بإعداد نطاق المسح الضوئي وحجم الخطوة. الحصول على صورة Brillouin للمنطقة محل الاهتمام عن طريق مسح الجنين باستخدام مرحلة الترجمة 2D.
ملاحظة: يمكن تحديد نطاق المسح الأفقي بناء على صورة المجال الساطع ، ويمكن تحديد نطاق المسح الرأسي (أي العمق) بناء على قوة الإشارة التي تم الحصول عليها من المسح السريع والخشن. لمنع أي تلف ضوئي للجنين ، حدد طاقة الحادث إلى 25 ميجاوات ، واضبط وقت التعرض لكاميرا EMCCD على 50 مللي ثانية. اختر حجم خطوة 2 ميكرومتر في الاتجاه الأفقي و 1 ميكرومتر في الاتجاه الرأسي لتحقيق التوازن بين جودة التصوير ووقت الاستحواذ. - بعد الانتهاء من الفحص ، قم بإزالة ورق الترشيح بعناية مع الجنين واستخدم المناديل الورقية لامتصاص أي وسيط غسيل زائد. بعد ذلك ، ضع ورق الترشيح مرة أخرى في طبق الاستزراع المملوء بالزلال الرقيق للزراعة المستمرة في الحاضنة على المسرح.
- كرر الخطوات 3.2-3.5 على فترات زمنية منتظمة (على سبيل المثال ، 1.5 ساعة) لالتقاط صور بريلوين ذات الفاصل الزمني أثناء نمو الجنين.
- أعد بناء صورة 2D Brillouin باتباع الخطوة 4.
4. إعادة بناء صورة بريلوين
- معايرة مطياف بريلوين باستخدام إشارات بريلوين للماء والميثانول لحساب النطاق الطيفي الحر (FSR) ونسبة تحويل البكسل إلى التردد (PR) لمقياس الطيف30. سيتم استخدام القيم المعايرة ل FSR و PR لحساب إزاحة Brillouin للجنين عند كل بكسل.
ملاحظة: يعرض الشكل 7A طيف بريلوين الخام الذي تم التقاطه بواسطة كاميرا EMCCD. من خلال جمع الطيف عموديا ثم القيام بتركيب لورنتزيان ، يمكن الحصول على مسافة الذروة Δd للنقطتين (الشكل 7B). من خلال الحصول على مسافة الذروة من الماء Δdالماء والميثانول Δdالميثانول ، يمكن حساب FSR و PR بناء على المعادلات30: PR = 2 · (ωالميثانول - ωالماء) / (Δd الماء - Δdالميثانول) ، و FSR = 2 · ωالماء + PR ·Δd الماء ، مع تحول بريلوين المعروف للمياه ωالماء = 6.01 جيجا هرتز والميثانول ωالميثانول = 4.49 جيجا هرتز عند 660 نانومتر. - احصل على مسافة الذروة لإشارة Brillouin عند كل بكسل من العينة. احسب إزاحة بريلوين بناء على FSR و PR المعارين:ω sample = 0.5 (FSR -PR x Δd sample) 30 ، حيث ωالعينة هي إزاحة بريلوين للعينة ،وعينة Δd هي مسافة الذروة لإشارة بريلوين.
- أعد بناء صورة 2D Brillouin بناء على إزاحات Brillouin لجميع وحدات البكسل.
ملاحظة: لإجراء تحليل محلي ، يمكن للمرء اختيار منطقة الاهتمام (على سبيل المثال ، اللوحة العصبية) من صورة Brillouin المكتسبة وتحديد خصائصها الميكانيكية. النهج الشائع هو حساب متوسط تحول بريلوين للمنطقة المختارة.
النتائج
يوضح الشكل 6 الرسم التخطيطي لمجهر بريلوين. يستخدم النظام ليزر 660 نانومتر كمصدر للضوء. يتم وضع عازل مباشرة بعد رأس الليزر لرفض أي ضوء منعكس من الخلف ، ويتم استخدام مرشح الكثافة المحايدة (ND) لضبط طاقة الليزر. يتم استخدام زوج من العدسات ، L1 و L2 ، بأطوال بؤرية f1 = 16 مم و f2 = 100 مم ، عل?...
Discussion
يمكن أن يتأثر التطور المبكر للجنين بسهولة بالاضطرابات الخارجية. لذلك ، يجب توخي أقصى درجات الحذر أثناء استخراج العينة ونقلها. إحدى المشكلات المحتملة هي انفصال الجنين عن ورقة الترشيح ، مما قد يؤدي إلى تقلص غشاء vitelline ويؤدي إلى قطعة أثرية مائلة من اللوحة العصبية في تصوير Brillouin. علاوة على ذلك ...
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
يتم دعم هذا العمل من قبل معهد يونيس كينيدي شرايفر الوطني لصحة الطفل والتنمية البشرية ، المعاهد الوطنية للصحة (K25HD097288 ، R21HD112663).
Materials
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Fisherbrand | FB0875713 | |
| 2D motorized stage | Prior Scientific | H117E2 | |
| 35 mm Petri dish | World Precision Instruments | FD35-100 | |
| Brillouin Microscope with on-stage incubator | N/A | N/A | This is a custom-built Brillouin Microscope system based on Ref. 30 |
| Chicken eggs | University of Connecticut | N/A | |
| CMOS camera | Thorlabs | CS2100M-USB | |
| EMCCD camera | Andor | iXon | |
| Ethanol | Decon Laboratories, Inc. | #2701 | |
| Filter paper | Whatman | 1004-070 | |
| Incubator for in ovo culture | GQF Manufacturing Company Inc. | GQF 1502 | |
| Ring | Thorlabs | SM1RR | |
| Microscope body | Olympus | IX73 | |
| NaCl | Sigma-Aldrich | S9888 | |
| On-stage incubator | Oko labs | OKO-H301-PRIOR-H117 | |
| Parafilm | Bemis | PM-996 | |
| Penicillin-Streptomycin | Gibco | 15070-063 | |
| Pipettes | Fisherbrand | 13-711-6M | |
| Scissors | Artman instruments | N/A | 3pc Micro Scissors 5 |
| Syringe | BD | 305482 | |
| Tissue paper | Kimwipes | N/A | |
| Tube | Corning | 430052 | |
| Tweezers | DR Instruments | N/A | Microdissection Forceps Set |
References
- Greene, N. D. E., Copp, A. J. Neural tube defects. Annual Review of Neuroscience. 37 (1), 221-242 (2014).
- Suzuki, M., Morita, H., Ueno, N. Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Development, Growth & Differentiation. 54 (3), 266-276 (2012).
- Nikolopoulou, E., Galea, G. L., Rolo, A., Greene, N. D. E., Copp, A. J. Neural tube closure: Cellular, molecular and biomechanical mechanisms. Development. 144 (4), 552-566 (2017).
- Juriloff, D. M., Harris, M. J. Mouse models for neural tube closure defects. Human Molecular Genetics. 9 (6), 993-1000 (2000).
- Copp, A. J., Greene, N. D. E. Genetics and development of neural tube defects. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland. 220 (2), 217-230 (2010).
- Wang, M., De Marco, P., Capra, V., Kibar, Z. Update on the role of the non-canonical wnt/planar cell polarity pathway in neural tube defects. Cells. 8 (10), 1198 (2019).
- Galea, G. L., et al. Biomechanical coupling facilitates spinal neural tube closure in mouse embryos. Proceedings of the National Academy of Sciences. 114 (26), E5177-E5186 (2017).
- Moon, L. D., Xiong, F. Mechanics of neural tube morphogenesis. Seminars in Cell & Developmental Biology. 130, 56-69 (2022).
- Christodoulou, N., Skourides, P. A. Distinct spatiotemporal contribution of morphogenetic events and mechanical tissue coupling during xenopus neural tube closure. Development. 149 (13), (2022).
- De Goederen, V., Vetter, R., Mcdole, K., Iber, D. Hinge point emergence in mammalian spinal neurulation. Proceedings of the National Academy of Sciences. 119 (20), 2117075119 (2022).
- Christodoulou, N., Skourides, P. A. Somitic mesoderm morphogenesis is necessary for neural tube closure during xenopus development. Frontiers in Cell and Developmental Biology. 10, 1091629 (2023).
- Nikolopoulou, E., et al. Spinal neural tube closure depends on regulation of surface ectoderm identity and biomechanics by grhl2. Nature Communications. 10 (1), 2487 (2019).
- Nychyk, O., et al. Vangl2-environment interaction causes severe neural tube defects, without abnormal neuroepithelial convergent extension. Disease Models & Mechanisms. 15 (1), 049194 (2022).
- Li, B., Brusman, L., Dahlka, J., Niswander, L. A. Tmem132a ensures mouse caudal neural tube closure and regulates integrin-based mesodermal migration. Development. 149 (17), (2022).
- Zulueta-Coarasa, T., Fernandez-Gonzalez, R. Laser ablation to investigate cell and tissue mechanics in vivo. Integrative Mechanobiology: Micro-and Nano Techniques in Cell Mechanobiology. , 128-147 (2015).
- Wiebe, C., Brodland, G. W. Tensile properties of embryonic epithelia measured using a novel instrument. Journal of Biomechanics. 38 (10), 2087-2094 (2005).
- Luu, O., David, R., Ninomiya, H., Winklbauer, R. Large-scale mechanical properties of xenopus embryonic epithelium. Proceedings of the National Academy of Sciences. 108 (10), 4000-4005 (2011).
- Maître, J. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Zamir, E. A., Srinivasan, V., Perucchio, R., Taber, L. A. Mechanical asymmetry in the embryonic chick heart during looping. Annals of Biomedical Engineering. 31, 1327-1336 (2003).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences. 112 (5), 1416-1421 (2015).
- Savin, T., et al. On the growth and form of the gut. Nature. 476 (7358), 57-62 (2011).
- Almonacid, M., et al. Active diffusion positions the nucleus in mouse oocytes. Nature Cell Biology. 17 (4), 470-479 (2015).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2014).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Christian, Z. D., et al. High-resolution 3D biomechanical mapping of embryos with reverberant optical coherence elastography (Rev-OCE). Proceedings of SPIE. , 123670 (2023).
- Scarcelli, G., Yun, S. H. J. N. P. Confocal brillouin microscopy for three-dimensional mechanical imaging. Nature Photonics. 1 (1), 39-43 (2008).
- Scarcelli, G., et al. Noncontact three-dimensional mapping of intracellular hydromechanical properties by brillouin microscopy. Nature Methods. 12 (12), 1132-1134 (2015).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: An emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Zhang, J., Scarcelli, G. Mapping mechanical properties of biological materials via an add-on brillouin module to confocal microscopes. Nature Protocols. 16 (2), 1251-1275 (2021).
- Boyd, R. W. . Nonlinear optics. , (2020).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by brillouin optical microscopy. Biophysical Journal. 101 (6), 1539-1545 (2011).
- Scarcelli, G., Pineda, R., Yun, S. H. Brillouin optical microscopy for corneal biomechanics. Investigative Ophthalmology & Visual Science. 53 (1), 185-190 (2012).
- Antonacci, G., Braakman, S. Biomechanics of subcellular structures by non-invasive brillouin microscopy. Scientific Reports. 6 (1), 37217 (2016).
- Zhang, J., et al. Tissue biomechanics during cranial neural tube closure measured by brillouin microscopy and optical coherence tomography. Birth Defects Research. 111 (14), 991-998 (2019).
- Zhang, J., et al. Nuclear mechanics within intact cells is regulated by cytoskeletal network and internal nanostructures. Small. 16 (18), 1907688 (2020).
- Elsayad, K., Polakova, S., Gregan, J. Probing mechanical properties in biology using brillouin microscopy. Trends in Cell Biology. 29 (8), 608-611 (2019).
- Poon, C., Chou, J., Cortie, M., Kabakova, I. Brillouin imaging for studies of micromechanics in biology and biomedicine: From current state-of-the-art to future clinical translation. Journal of Physics: Photonics. 3 (1), 012002 (2020).
- Handler, C., Scarcelli, G., Zhang, J. Time-lapse mechanical imaging of neural tube closure in live embryo using brillouin microscopy. Scientific Reports. 13 (1), 263 (2023).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental dynamics: an official publication of the American Association of Anatomists. 220 (3), 284-289 (2001).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A submerged filter paper sandwich for long-term ex ovo time-lapse imaging of early chick embryos. Journal of Visualized Experiments. (118), e54636 (2016).
- Nys, Y., Guyot, N., Nys, Y., Bain, M., VanImmerseel, F. . Improving the safety and quality of eggs and egg products, vol 1: Egg chemistry, production and consumption. , 83-132 (2011).
- Berghaus, K. V., Yun, S. H., Scarcelli, G. High speed sub-ghz spectrometer for brillouin scattering analysis. Journal of Visualized Experiments. (106), e53468 (2015).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Schlüßler, R., et al. Mechanical mapping of spinal cord growth and repair in living zebrafish larvae by brillouin imaging. Biophysical Journal. 115 (5), 911-923 (2018).
- Williams, R. M., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental Dynamics. 220 (3), 284-289 (2001).
- Edrei, E., Scarcelli, G. Adaptive optics in spectroscopy and densely labeled-fluorescence applications. Optics Express. 26 (26), 33865-33877 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved