Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мониторинг механической эволюции тканей при закрытии нервной трубки эмбриона цыпленка
В этой статье
Резюме
Данный протокол был разработан для лонгитюдного мониторинга механических свойств ткани нервной пластинки при нейруляции эмбриона цыпленка. Он основан на интеграции микроскопа Бриллюэна и инкубационной системы на сцене, что позволяет получать механическую визуализацию тканей нервной пластинки в эмбрионах цыплят, культивируемых ex ovo .
Аннотация
Закрытие нервной трубки (NTC) является критически важным процессом во время эмбрионального развития. Сбой в этом процессе может привести к дефектам нервной трубки, вызывая врожденные пороки развития или даже смерть. NTC включает в себя ряд механизмов на генетическом, молекулярном и механическом уровнях. Несмотря на то, что механическое регулирование становится все более привлекательной темой в последние годы, оно остается в значительной степени неизученным из-за отсутствия подходящей технологии для проведения 3D-тестирования эмбриональной ткани in situ. В ответ на это мы разработали протокол количественной оценки механических свойств эмбриональной ткани курицы бесконтактным и неинвазивным способом. Это достигается за счет интеграции конфокального микроскопа Бриллюэна с инкубационной системой на сцене. Для исследования механики тканей предварительно культивируемый эмбрион отбирают и переносят в инкубатор на сцене для культивирования ex ovo . Одновременно с помощью микроскопа Бриллюэна с помощью микроскопа Бриллюэна получаются механические изображения ткани нервной пластинки в разные моменты времени. Этот протокол включает в себя подробное описание пробоподготовки, проведения экспериментов по микроскопии Бриллюэна, а также постобработки и анализа данных. Следуя этому протоколу, исследователи могут изучать механическую эволюцию эмбриональной ткани во время развития в продольном направлении.
Введение
Дефекты нервной трубки (ДНТ) – это тяжелые врожденные дефекты центральной нервной системы, вызванные сбоями в закрытии нервной трубки (NTC) во время эмбрионального развития1. Этиология ДНТ сложна. Исследования показали, что NTC включает в себя последовательность морфогенетических процессов, включая конвергентное расширение, изгиб нервной пластинки (например, апикальное сужение), поднятие нервной складки и, наконец, адгезию нервной складки. Эти процессы регулируются множественными молекулярно-генетическими механизмами 2,3, и любой сбой в этих процессах может привести к ДНТ 4,5,6. Поскольку появляется все больше доказательств того, что механические сигналы также играют решающую роль во время NTC 3,7,8,9,10,11, и были обнаружены взаимосвязи между генами и механическими сигналами 12,13,14, становится необходимым исследовать биомеханику тканей во время нейруляции.
Для измерения механических свойств эмбриональных тканей было разработано несколько методов, в том числе лазерная абляция (LA)15, рассечение и релаксация тканей (TDR)16,17, микропипеточная аспирация (MA)18, наноиндентирование на основе атомно-силовой микроскопии (АСМ)19, микроинденторы (MI) и микропланшеты (MP)20, микрореология (MR) с оптическим/магнитным пинцетом21,22,23и капельно-капельные датчики24. Существующие методы позволяют измерять механические свойства с пространственным разрешением в диапазоне от субклеточного до тканевого масштаба. Тем не менее, большинство этих методов являются инвазивными, поскольку они требуют контакта с образцом (например, МА, АСМ, МИ и МП), внешнего введения материала (например, МРТ и капельных датчиков) или рассечения тканей (например, LA и TDR). В результате, существующие методы затрудняют мониторинг механической эволюции ткани нервной пластины in situ25. В последнее время реверберационная оптическая когерентная эластография показала перспективность для бесконтактного механического картирования с высоким пространственным разрешением26.
Конфокальная микроскопия Бриллюэна является новым оптическим методом, который позволяет бесконтактно количественно оценивать биомеханику тканей с субклеточным разрешением 27,28,29,30. Микроскопия Бриллюэна основана на принципе спонтанного рассеяния света по Бриллюэну, которое представляет собой взаимодействие между падающим лазерным светом и акустической волной, вызванной тепловыми флуктуациями внутри материала. Следовательно, рассеянный свет испытывает сдвиг частоты, известный как сдвиг Бриллюэна ωR, в соответствии с уравнением31:
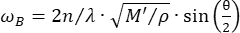 (1)
(1)
Здесь – показатель преломления материала, 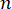 λ – длина волны падающего света, M' – модуль продольного наклона, ρ – плотность массы, θ – угол между падающим и рассеянным светом. Для одного и того же типа биологических материалов отношение показателя преломления и плотности
λ – длина волны падающего света, M' – модуль продольного наклона, ρ – плотность массы, θ – угол между падающим и рассеянным светом. Для одного и того же типа биологических материалов отношение показателя преломления и плотности 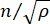 приблизительно постоянно 28,32,33,34,35,36. Таким образом, сдвиг Бриллюэна может быть непосредственно использован для оценки относительных механических изменений в физиологических процессах. Возможность микроскопии Бриллюэна была подтверждена на различных биологических образцах 29,37,38. Недавно была продемонстрирована покадровая механическая визуализация живого эмбриона цыпленка путем объединения микроскопа Бриллюэна с инкубационной системой39 на сцене. Этот протокол содержит подробное описание подготовки образцов, проведения эксперимента, а также постобработки и анализа данных. Мы надеемся, что эти усилия будут способствовать широкому внедрению бесконтактной технологии Бриллюэна для изучения биомеханической регуляции в развитии эмбриона и врожденных дефектов.
приблизительно постоянно 28,32,33,34,35,36. Таким образом, сдвиг Бриллюэна может быть непосредственно использован для оценки относительных механических изменений в физиологических процессах. Возможность микроскопии Бриллюэна была подтверждена на различных биологических образцах 29,37,38. Недавно была продемонстрирована покадровая механическая визуализация живого эмбриона цыпленка путем объединения микроскопа Бриллюэна с инкубационной системой39 на сцене. Этот протокол содержит подробное описание подготовки образцов, проведения эксперимента, а также постобработки и анализа данных. Мы надеемся, что эти усилия будут способствовать широкому внедрению бесконтактной технологии Бриллюэна для изучения биомеханической регуляции в развитии эмбриона и врожденных дефектов.
протокол
Протокол был одобрен Комитетом по уходу за животными и их использованию Государственного университета Уэйна.
1. Подготовка эксперимента
- Используйте 70% раствор этанола для очистки и стерилизации ножниц и пинцета. Также подготовьте одноразовые пипетки и шприц.
- Приготовьте промывное средство, добавив 3,595 г NaCl к 495 мл деионизированной воды. Затем добавьте в среду 5 мл пенициллина-стрептомицина (5 ЕД/мл). Наполните 100-миллиметровую чашку Петри промывочным средством и нагрейте ее до 37 °C.
- Приготовьте культурную посуду в соответствии с рисунком 1, который иллюстрирует общую конфигурацию.
- Подготовьте кусок фильтровальной бумаги, нарежьте его прямоугольной формой примерно 17 мм × 20 мм и удалите четыре угла. Создайте полый центр в фильтровальной бумаге размером примерно 7 мм × 10 мм для фиксации эмбриона (Рисунок 1, слева).
ПРИМЕЧАНИЕ: Сбор эмбрионов описан в шаге 2. - Прикрепите имеющееся в продаже кольцо (Φ = 1 дюйм, см. Таблицу материалов) к слою гибкой пленки (например, парафиновой пленки), убедившись, что гибкая пленка также имеет полый центр. Это кольцо с пленкой будет использоваться для удержания фильтровальной бумаги с эмбрионом.
- Наконец, поместите подготовленное кольцо в чашку Петри диаметром 35 мм (рис. 1, справа).
ПРИМЕЧАНИЕ: Фильтровальная бумага предназначена для фиксации и удержания извлеченного эмбриона, помещая фильтровальную бумагу на мембрану и оставляя эмбрион в центральной полой области (которая будет подробно описана на шаге 2). Четыре угла были обрезаны по размеру наружного кольца (не обязательно, если оно уже установлено). Для лучшего распространения лазерного луча используется чашка для культивирования со стеклянным дном диаметром 35 мм. Блюдо имеет внутреннее отверстие (Φ = 23 мм), которое может быть заполнено белком для культуры ex ovo . Диаметр кольца должен быть больше диаметра внутренней лунки, чтобы лунку можно было покрыть гибкой пленкой на кольце (рисунок 1, вставка). Размер фильтровальной бумаги не ограничен и может быть изменен в зависимости от размера выбранного кольца и чашки для культивирования. В качестве альтернативы дно посуды можно предварительно покрыть агарозным слоем (толщина: ~1 мм). Удаляя агарозу из центра слоя с помощью лопасти, можно создать лунку с формой, аналогичной полому центру гибкой пленки, для загрузки белка. Одним из важных моментов является то, что четыре стороны полой фильтровальной бумаги должны иметь достаточную ширину (> 5 мм), чтобы обеспечить прикрепление эмбриона.
- Подготовьте кусок фильтровальной бумаги, нарежьте его прямоугольной формой примерно 17 мм × 20 мм и удалите четыре угла. Создайте полый центр в фильтровальной бумаге размером примерно 7 мм × 10 мм для фиксации эмбриона (Рисунок 1, слева).
2. Экстракция и ex ovo культивирование куриного эмбриона
ПРИМЕЧАНИЕ: Этот шаг является модификацией ранее опубликованных отчетов40,41.
- После предварительного культивирования извлеките яйцо из инкубатора и поместите его на его длинную ось на лоток для коробки для яиц. Очистите яичную скорлупу 70% этиловым спиртом, покров всю поверхность, а затем дайте ей отдохнуть в течение 15 минут.
- Зажмите яйцо на короткой оси и разбейте его снизу. Откройте яйцо над чистой чашкой Петри диаметром 100 мм, чтобы извлечь его содержимое, как показано на рисунке 2. Следите за тем, чтобы яйцо не вращалось, когда вы держите и разбиваете его.
- С помощью пипетки перелейте и соберите примерно 10 мл жидкого белка (т.е. жидкого белка42) в пробирку объемом 15 мл для использования в культуре ex ovo . Заполните центральную лунку чашки для закваски собранным жидким белком (около 0,9 мл), как показано на рисунке 3. Процесс наполнения должен быть медленным, не допуская образования каких-либо пузырьков внутри лунки. Убедитесь, что чашка для культуры с белком прогрета до 37 °C.
ПРИМЕЧАНИЕ: Эта чашка будет использоваться для культивирования эмбриона ex ovo. Во время визуализации по Бриллюэну будут использоваться новые чашки для культивирования, наполненные промывочным материалом (см. шаг 3). - Используя папиросную бумагу, осторожно удалите густой белок (т.е. вязкий белок), прикрепленный к эмбриону, осторожно отделив белок от вителлиновой мембраны, как показано на рисунке 4. Избегайте прямого контакта с мембраной вителлина.
- Удалив весь густой белок, аккуратно прикрепите фильтровальную бумагу к мембране вителлина. Убедитесь, что ось тела эмбриона совпадает с длинной осью центрального прямоугольника на фильтровальной бумаге. Ножницами разрежьте мембрану, окружающую фильтровальную бумагу.
- С помощью пинцета аккуратно оттяните изолированную фильтровальную бумагу от желтка в косом направлении. Переверните фильтровальную бумагу вверх дном, чтобы расположить эмбрион тыльной стороной вниз (для конфигурации инвертированного микроскопа). Осторожно погрузите всю фильтровальную бумагу с одной стороны длинной оси в чашку Петри диаметром 100 мм с промывочным материалом под наклоном.
- Смойте оставшийся желток, аккуратно распылив промывочную среду параллельно фильтровальной бумаге с помощью чистой пипетки. Избегайте непосредственного распыления промывочного средства на мембрану.
- Очистив весь желток, осторожно снимите фильтровальную бумагу с промывочного средства и используйте папиросную бумагу, чтобы впитать излишки среды с краев. Затем поместите фильтровальную бумагу с эмбрионом на чашку для культивирования, убедившись, что дорсальная сторона эмбриона обращена вниз, как показано на рисунке 5. Для поддержания влажности положите в посуду смоченную папиросную бумагу.
- Перенесите культуральную чашку в инкубатор на сцене для культивирования ex ovo .
3. Измерение эмбриона по Бриллюэну
- Подготовьте еще один набор посуды для закваски и наполните их моющим средством. Убедитесь, что моющее средство нагрето до 37 °C.
- Когда эмбрион достигнет желаемой стадии развития, перенесите фильтровальную бумагу с эмбрионом в чашку для культивирования, наполненную промывочной средой. Поместите чашку для культивирования в инкубатор микроскопа Бриллюэна (см. Таблицу материалов).
- Перед проведением измерения по методу Бриллюэна сохраните яркопольное изображение всего эмбриона для справки. Подробная конфигурация микроскопа Бриллюэна была описанаранее30 и обобщена в разделе «Результаты» (рис. 6).
- Измерьте сигнал Бриллюэна воды и метанола, который будет использоваться на шаге 4 для процесса калибровки.
- Отрегулируйте мощность падающего лазера и время экспозиции камеры с электронно-умножающим зарядом устройства (EMCCD, см. таблицу материалов) для достижения не менее 10 000 отсчетов сигнала Бриллюэна. Используя изображение в светлом поле в качестве ориентира, настройте диапазон сканирования и размер шага. Получите изображение интересующей области по методу Бриллюэна, отсканировав эмбрион с помощью 2D-трансляционного этапа.
ПРИМЕЧАНИЕ: Диапазон горизонтального сканирования может быть определен на основе светлопольного изображения, а вертикальный диапазон (т.е. глубина) сканирования может быть определен на основе уровня сигнала, полученного при быстром и грубом сканировании. Чтобы предотвратить фотоповреждение эмбриона, ограничьте падающую мощность до 25 мВт и установите время экспозиции камеры EMCCD на 50 мс. Выберите размер шага 2 мкм в горизонтальном направлении и 1 мкм в вертикальном направлении, чтобы сбалансировать качество изображения и время съемки. - После завершения сканирования осторожно удалите фильтровальную бумагу с эмбрионом и используйте папиросную бумагу, чтобы впитать излишки промывочного средства. Затем поместите фильтровальную бумагу обратно в чашку для культивирования, наполненную тонким белком, для непрерывного культивирования в инкубаторе на сцене.
- Повторяйте шаги 3.2-3.5 через равные промежутки времени (например, 1,5 часа) для покадровой съемки изображений Бриллюэна по мере развития эмбриона.
- Восстановите 2D-изображение Бриллюэна, выполнив шаг 4.
4. Реконструкция изображения Бриллюэна
- Откалибруйте спектрометр Бриллюэна, используя сигналы воды и метанола Бриллюэна, чтобы рассчитать свободный спектральный диапазон (FSR) и отношение преобразования пикселей в частоту (PR) спектрометра30. Калиброванные значения FSR и PR будут использоваться для вычисления сдвига Бриллюэна эмбриона в каждом пикселе.
ПРИМЕЧАНИЕ: На рисунке 7A показан необработанный спектр Бриллюэна, захваченный камерой EMCCD. Путем вертикального суммирования спектра и последующей подгонки Лоренца можно получить пиковое расстояние Δd двух точек (рис. 7B). Получив пиковое расстояние воды Δdводы и метанола Δdметанола, FSR и PR можно вычислить на основе уравнений30: PR = 2· (ωметанол -ω вода)/(Δdводы - Δdметанол) и FSR = 2·ωвода + PR·Δdвода, с известным сдвигом Бриллюэна воды ωвода = 6,01 ГГц и метанол ωметанол = 4,49 ГГц на длине волны 660 нм. - Получить пиковое расстояние сигнала Бриллюэна в каждом пикселе образца. Рассчитайте сдвиг Бриллюэна на основе калиброванных FSR и PR: ωвыборка = 0,5 (FSR - PR x Δdвыборка)30, гдеω выборка — это сдвиг Бриллюэна выборки, а Δdвыборка — пиковое расстояние сигнала Бриллюэна.
- Реконструируйте 2D-изображение Бриллюэна на основе сдвигов Бриллюэна всех пикселей.
ПРИМЕЧАНИЕ: Для проведения локального анализа можно выбрать интересующую область (например, нервную пластину) из полученного изображения Бриллюэна и количественно оценить ее механические свойства. Распространенным подходом является вычисление среднего сдвига Бриллюэна в выбранном регионе.
Результаты
На рисунке 6 показана схема микроскопа Бриллюэна. В качестве источника света используется лазер с длиной волны 660 нм. Изолятор размещается сразу после лазерной головки, чтобы отклонять любой отраженный назад свет, а фильтр нейтральной плотности (ND) используется для регу?...
Обсуждение
На раннее развитие эмбриона легко могут повлиять внешние нарушения. Поэтому при извлечении и переносе проб требуется предельная осторожность. Одной из потенциальных проблем является отслоение эмбриона от фильтровальной бумаги, что может привести к уменьшению вителлиновой мембраны и...
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Эта работа поддерживается Национальным институтом детского здоровья и развития человека им. Юнис Кеннеди Шрайвер, Национальными институтами здравоохранения (K25HD097288, R21HD112663).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Fisherbrand | FB0875713 | |
| 2D motorized stage | Prior Scientific | H117E2 | |
| 35 mm Petri dish | World Precision Instruments | FD35-100 | |
| Brillouin Microscope with on-stage incubator | N/A | N/A | This is a custom-built Brillouin Microscope system based on Ref. 30 |
| Chicken eggs | University of Connecticut | N/A | |
| CMOS camera | Thorlabs | CS2100M-USB | |
| EMCCD camera | Andor | iXon | |
| Ethanol | Decon Laboratories, Inc. | #2701 | |
| Filter paper | Whatman | 1004-070 | |
| Incubator for in ovo culture | GQF Manufacturing Company Inc. | GQF 1502 | |
| Ring | Thorlabs | SM1RR | |
| Microscope body | Olympus | IX73 | |
| NaCl | Sigma-Aldrich | S9888 | |
| On-stage incubator | Oko labs | OKO-H301-PRIOR-H117 | |
| Parafilm | Bemis | PM-996 | |
| Penicillin-Streptomycin | Gibco | 15070-063 | |
| Pipettes | Fisherbrand | 13-711-6M | |
| Scissors | Artman instruments | N/A | 3pc Micro Scissors 5 |
| Syringe | BD | 305482 | |
| Tissue paper | Kimwipes | N/A | |
| Tube | Corning | 430052 | |
| Tweezers | DR Instruments | N/A | Microdissection Forceps Set |
Ссылки
- Greene, N. D. E., Copp, A. J. Neural tube defects. Annual Review of Neuroscience. 37 (1), 221-242 (2014).
- Suzuki, M., Morita, H., Ueno, N. Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Development, Growth & Differentiation. 54 (3), 266-276 (2012).
- Nikolopoulou, E., Galea, G. L., Rolo, A., Greene, N. D. E., Copp, A. J. Neural tube closure: Cellular, molecular and biomechanical mechanisms. Development. 144 (4), 552-566 (2017).
- Juriloff, D. M., Harris, M. J. Mouse models for neural tube closure defects. Human Molecular Genetics. 9 (6), 993-1000 (2000).
- Copp, A. J., Greene, N. D. E. Genetics and development of neural tube defects. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland. 220 (2), 217-230 (2010).
- Wang, M., De Marco, P., Capra, V., Kibar, Z. Update on the role of the non-canonical wnt/planar cell polarity pathway in neural tube defects. Cells. 8 (10), 1198 (2019).
- Galea, G. L., et al. Biomechanical coupling facilitates spinal neural tube closure in mouse embryos. Proceedings of the National Academy of Sciences. 114 (26), E5177-E5186 (2017).
- Moon, L. D., Xiong, F. Mechanics of neural tube morphogenesis. Seminars in Cell & Developmental Biology. 130, 56-69 (2022).
- Christodoulou, N., Skourides, P. A. Distinct spatiotemporal contribution of morphogenetic events and mechanical tissue coupling during xenopus neural tube closure. Development. 149 (13), (2022).
- De Goederen, V., Vetter, R., Mcdole, K., Iber, D. Hinge point emergence in mammalian spinal neurulation. Proceedings of the National Academy of Sciences. 119 (20), 2117075119 (2022).
- Christodoulou, N., Skourides, P. A. Somitic mesoderm morphogenesis is necessary for neural tube closure during xenopus development. Frontiers in Cell and Developmental Biology. 10, 1091629 (2023).
- Nikolopoulou, E., et al. Spinal neural tube closure depends on regulation of surface ectoderm identity and biomechanics by grhl2. Nature Communications. 10 (1), 2487 (2019).
- Nychyk, O., et al. Vangl2-environment interaction causes severe neural tube defects, without abnormal neuroepithelial convergent extension. Disease Models & Mechanisms. 15 (1), 049194 (2022).
- Li, B., Brusman, L., Dahlka, J., Niswander, L. A. Tmem132a ensures mouse caudal neural tube closure and regulates integrin-based mesodermal migration. Development. 149 (17), (2022).
- Zulueta-Coarasa, T., Fernandez-Gonzalez, R. Laser ablation to investigate cell and tissue mechanics in vivo. Integrative Mechanobiology: Micro-and Nano Techniques in Cell Mechanobiology. , 128-147 (2015).
- Wiebe, C., Brodland, G. W. Tensile properties of embryonic epithelia measured using a novel instrument. Journal of Biomechanics. 38 (10), 2087-2094 (2005).
- Luu, O., David, R., Ninomiya, H., Winklbauer, R. Large-scale mechanical properties of xenopus embryonic epithelium. Proceedings of the National Academy of Sciences. 108 (10), 4000-4005 (2011).
- Maître, J. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Zamir, E. A., Srinivasan, V., Perucchio, R., Taber, L. A. Mechanical asymmetry in the embryonic chick heart during looping. Annals of Biomedical Engineering. 31, 1327-1336 (2003).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences. 112 (5), 1416-1421 (2015).
- Savin, T., et al. On the growth and form of the gut. Nature. 476 (7358), 57-62 (2011).
- Almonacid, M., et al. Active diffusion positions the nucleus in mouse oocytes. Nature Cell Biology. 17 (4), 470-479 (2015).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2014).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Christian, Z. D., et al. High-resolution 3D biomechanical mapping of embryos with reverberant optical coherence elastography (Rev-OCE). Proceedings of SPIE. , 123670 (2023).
- Scarcelli, G., Yun, S. H. J. N. P. Confocal brillouin microscopy for three-dimensional mechanical imaging. Nature Photonics. 1 (1), 39-43 (2008).
- Scarcelli, G., et al. Noncontact three-dimensional mapping of intracellular hydromechanical properties by brillouin microscopy. Nature Methods. 12 (12), 1132-1134 (2015).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: An emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Zhang, J., Scarcelli, G. Mapping mechanical properties of biological materials via an add-on brillouin module to confocal microscopes. Nature Protocols. 16 (2), 1251-1275 (2021).
- Boyd, R. W. . Nonlinear optics. , (2020).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by brillouin optical microscopy. Biophysical Journal. 101 (6), 1539-1545 (2011).
- Scarcelli, G., Pineda, R., Yun, S. H. Brillouin optical microscopy for corneal biomechanics. Investigative Ophthalmology & Visual Science. 53 (1), 185-190 (2012).
- Antonacci, G., Braakman, S. Biomechanics of subcellular structures by non-invasive brillouin microscopy. Scientific Reports. 6 (1), 37217 (2016).
- Zhang, J., et al. Tissue biomechanics during cranial neural tube closure measured by brillouin microscopy and optical coherence tomography. Birth Defects Research. 111 (14), 991-998 (2019).
- Zhang, J., et al. Nuclear mechanics within intact cells is regulated by cytoskeletal network and internal nanostructures. Small. 16 (18), 1907688 (2020).
- Elsayad, K., Polakova, S., Gregan, J. Probing mechanical properties in biology using brillouin microscopy. Trends in Cell Biology. 29 (8), 608-611 (2019).
- Poon, C., Chou, J., Cortie, M., Kabakova, I. Brillouin imaging for studies of micromechanics in biology and biomedicine: From current state-of-the-art to future clinical translation. Journal of Physics: Photonics. 3 (1), 012002 (2020).
- Handler, C., Scarcelli, G., Zhang, J. Time-lapse mechanical imaging of neural tube closure in live embryo using brillouin microscopy. Scientific Reports. 13 (1), 263 (2023).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental dynamics: an official publication of the American Association of Anatomists. 220 (3), 284-289 (2001).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A submerged filter paper sandwich for long-term ex ovo time-lapse imaging of early chick embryos. Journal of Visualized Experiments. (118), e54636 (2016).
- Nys, Y., Guyot, N., Nys, Y., Bain, M., VanImmerseel, F. . Improving the safety and quality of eggs and egg products, vol 1: Egg chemistry, production and consumption. , 83-132 (2011).
- Berghaus, K. V., Yun, S. H., Scarcelli, G. High speed sub-ghz spectrometer for brillouin scattering analysis. Journal of Visualized Experiments. (106), e53468 (2015).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Schlüßler, R., et al. Mechanical mapping of spinal cord growth and repair in living zebrafish larvae by brillouin imaging. Biophysical Journal. 115 (5), 911-923 (2018).
- Williams, R. M., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental Dynamics. 220 (3), 284-289 (2001).
- Edrei, E., Scarcelli, G. Adaptive optics in spectroscopy and densely labeled-fluorescence applications. Optics Express. 26 (26), 33865-33877 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены