JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
병아리 배아의 신경관 폐쇄 중 조직의 기계적 진화 모니터링
요약
이 프로토콜은 병아리 배아 신경 형성 중 신경판 조직의 기계적 특성을 종단적으로 모니터링하기 위해 개발되었습니다. Brillouin 현미경과 무대 배양 시스템의 통합을 기반으로 하며, 배 양된 병아리 배아에서 신경판 조직의 실시간 기계적 이미징을 가능하게 합니다.
초록
신경관 폐쇄(NTC)는 배아 발달 과정에서 중요한 과정입니다. 이 과정에서 실패하면 신경관 결손이 발생하여 선천성 기형 또는 사망에 이를 수 있습니다. NTC는 유전적, 분자적, 기계적 수준에 대한 일련의 메커니즘을 포함합니다. 기계적 조절은 최근 몇 년 동안 점점 더 매력적인 주제가 되었지만, 3D 배아 조직의 현장 기계적 테스트를 수행하는 데 적합한 기술이 부족하기 때문에 대부분 탐구되지 않은 상태로 남아 있습니다. 이에 대응하여 우리는 비접촉 및 비침습적 방식으로 닭 배아 조직의 기계적 특성을 정량화하기 위한 프로토콜을 개발했습니다. 이는 컨포칼 Brillouin 현미경과 무대 배양 시스템을 통합함으로써 달성됩니다. 조직 역학을 조사하기 위해 사전 배양된 배아를 수집하여 난자 배양을 위한 무대 내 인큐베이터로 옮깁니다. 동시에, 신경판 조직의 기계적 이미지는 발달 중 서로 다른 시점에서 Brillouin 현미경에 의해 획득됩니다. 이 프로토콜에는 시료 전처리, Brillouin 현미경 실험 구현, 데이터 후처리 및 분석에 대한 자세한 설명이 포함되어 있습니다. 이 프로토콜을 따름으로써, 연구자들은 발달 중 배아 조직의 기계적 진화를 종단적으로 연구할 수 있습니다.
서문
신경관 결손(NTD)은 배아 발달 중 신경관 폐쇄(NTC)의 실패로 인해 발생하는 중추신경계의 심각한 선천적 결함이다1. NTD의 원인은 복잡합니다. 연구에 따르면 NTC는 수렴 확장, 신경판의 굽힘(예: 정점 수축), 신경주름 상승, 마지막으로 신경주름 유착을 포함한 일련의 형태발생 과정을 포함합니다. 이러한 과정은 여러 분자 및 유전 메커니즘에 의해 조절되며2,3 이러한 과정에서 오작동이 발생하면 NTD 4,5,6이 발생할 수 있습니다. NTC 3,7,8,9,10,11 동안 기계적 단서가 중요한 역할을 한다는 증거가 늘어나고 유전자와 기계적 단서 12,13,14 사이의 관계가 발견됨에 따라, 신경관형성 중 조직 생체역학을 조사하는 것이 필수적이다.
배아 조직의 기계적 특성을 측정하기 위해 레이저 절제(LA)15, 조직 해부 및 이완(TDR)16,17, 마이크로피펫 흡인(MA)18, 원자력 현미경(AFM) 기반 나노인덴테이션(19), 마이크로인덴터(MI) 및 마이크로플레이트(MP)20, 광학/자기 핀셋을 사용한 마이크로 유변학(MR)21,22,23 등 여러 기술이 개발되었습니다및 물방울 기반 센서(24)를 사용할 수 있다. 기존 방법은 세포 하에서 조직 규모에 이르는 공간 분해능에서 기계적 특성을 측정할 수 있습니다. 그러나 이러한 방법의 대부분은 샘플과의 접촉(예: MA, AFM, MI 및 MP), 외부 물질 주입(예: MR 및 액적 기반 센서) 또는 조직 해부(예: LA 및 TDR)가 필요하기 때문에 침습적입니다. 결과적으로, 기존 방법으로는 25번 제자리에서 신경판 조직의 기계적 진화를 모니터링하기가 어렵습니다. 최근에, 잔향 광간섭 엘라스토그래피(reverberant optical coherence elastography)는 높은 공간 분해능(26)을 갖는 비접촉식 기계적 매핑에 대한 가능성을 보여주었다.
Confocal Brillouin 현미경은 세포 내 분해능 27,28,29,30으로 조직 생체 역학의 비접촉 정량화를 가능하게 하는 새로운 광학 양식입니다. Brillouin 현미경은 입사 레이저 광과 재료 내의 열 변동에 의해 유도된 음파 사이의 상호 작용인 자발적 Brillouin 광 산란의 원리를 기반으로 합니다. 결과적으로, 산란광은 방정식31에 따라 Brillouin shift ωR로 알려진 주파수 이동을 경험합니다.
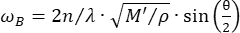 (1)
(1)
여기서, 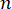 는 물질의 굴절률, λ는 입사광의 파장, M'은 종계수, ρ는 질량 밀도, θ는 입사광과 산란광 사이의 각도입니다. 동일한 유형의 생물학적 물질에 대해 굴절률과 밀도
는 물질의 굴절률, λ는 입사광의 파장, M'은 종계수, ρ는 질량 밀도, θ는 입사광과 산란광 사이의 각도입니다. 동일한 유형의 생물학적 물질에 대해 굴절률과 밀도 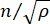 의 비율은 대략 일정합니다 28,32,33,34,35,36. 따라서 Brillouin shift는 생리적 과정의 상대적인 기계적 변화를 추정하는 데 직접 사용할 수 있습니다. Brillouin 현미경의 타당성은 다양한 생물학적 샘플 29,37,38에서 검증되었습니다. 최근에, 살아있는 병아리 배아의 타임랩스 기계적 이미징이 브릴루앙 현미경과 무대 배양 시스템(39)을 결합함으로써 시연되었다. 이 프로토콜은 시료 전처리, 실험 구현, 데이터 후처리 및 분석에 대한 자세한 설명을 제공합니다. 우리는 이러한 노력이 배아 발달 및 선천적 결함의 생체역학적 조절을 연구하기 위한 비접촉식 Brillouin 기술의 광범위한 채택을 촉진하기를 희망합니다.
의 비율은 대략 일정합니다 28,32,33,34,35,36. 따라서 Brillouin shift는 생리적 과정의 상대적인 기계적 변화를 추정하는 데 직접 사용할 수 있습니다. Brillouin 현미경의 타당성은 다양한 생물학적 샘플 29,37,38에서 검증되었습니다. 최근에, 살아있는 병아리 배아의 타임랩스 기계적 이미징이 브릴루앙 현미경과 무대 배양 시스템(39)을 결합함으로써 시연되었다. 이 프로토콜은 시료 전처리, 실험 구현, 데이터 후처리 및 분석에 대한 자세한 설명을 제공합니다. 우리는 이러한 노력이 배아 발달 및 선천적 결함의 생체역학적 조절을 연구하기 위한 비접촉식 Brillouin 기술의 광범위한 채택을 촉진하기를 희망합니다.
프로토콜
이 프로토콜은 Wayne State University의 Institutional Animal Care and Use Committee의 승인을 받았습니다.
1. 실험 준비
- 70% 에탄올 용액을 사용하여 가위와 핀셋을 청소하고 살균하십시오. 또한 일회용 피펫과 주사기를 준비하십시오.
- 탈이온수 495mL에 NaCl 3.595g을 첨가하여 세척액을 준비합니다. 그런 다음 페니실린-스트렙토마이신 5ml(5U/mL)를 배지에 추가합니다. 100mm 페트리 접시에 세척제를 채우고 37°C로 데웁니다.
- 전체 구성을 보여주는 그림 1에 따라 배양 접시를 준비합니다.
- 여과지를 준비하여 약 17mm에서 20mm의 직사각형 모양으로 자르고 네 모서리를 제거합니다×. 배아를 고정하기 위해 여과지에 약 7mm × 10mm 크기의 빈 중심을 만듭니다(그림 1, 왼쪽).
참고: 배아 수집은 2단계에 설명되어 있습니다. - 시중에서 판매되는 링(Φ = 1인치, 재료 표 참조)을 플렉시블 필름(즉, 파라핀 필름) 층과 함께 부착하여 플렉시블 필름의 중심이 비어 있는지 확인합니다. 필름이 있는 이 링은 배아와 함께 여과지를 고정하는 데 사용됩니다.
- 마지막으로 준비된 링을 35mm 페트리 접시에 넣습니다(그림 1, 오른쪽).
알림: 여과지는 여과지를 멤브레인에 놓고 배아를 중앙 중공 영역에 남겨 두어 추출된 배아를 고정하고 고정하기 위한 것입니다(2단계에서 자세히 설명). 네 모서리는 외부 링의 크기에 맞게 절단되었습니다(이미 장착된 경우 필요하지 않음). 더 나은 레이저 빔 전파를 위해 35mm 유리 바닥 배양 접시가 사용됩니다. 접시에는 내부 웰(Φ = 23mm)이 있으며, 이 웰은 외향 배양을 위해 알부민으로 채울 수 있습니다. 링의 직경은 내부 웰의 직경보다 커야 웰이 링의 유연한 필름으로 덮일 수 있습니다(그림 1, 삽입물). 여과지의 크기는 제한되지 않으며 선택한 링과 배양 접시의 크기에 따라 수정할 수 있습니다. 또는 접시 바닥을 아가로스 층(두께: ~1mm)으로 미리 코팅할 수 있습니다. 블레이드를 이용하여 층의 중심으로부터 아가로스를 제거함으로써, 알부민을 로딩하기 위한 플렉시블 필름의 중공 중심과 유사한 형상의 웰을 생성할 수 있다. 한 가지 중요한 점은 중공 여과지의 4면이 배아의 부착을 보장하기 위해 충분한 너비(> 5mm)를 가져야 한다는 것입니다.
- 여과지를 준비하여 약 17mm에서 20mm의 직사각형 모양으로 자르고 네 모서리를 제거합니다×. 배아를 고정하기 위해 여과지에 약 7mm × 10mm 크기의 빈 중심을 만듭니다(그림 1, 왼쪽).
2. 닭 배아의 추출 및 외향 배양
참고: 이 단계는 이전에 게시된 보고서40,41에서 수정되었습니다.
- 사전 배양 후 인큐베이터에서 계란을 꺼내 계란 상자 트레이의 긴 축에 놓습니다. 달걀 껍질을 70% 에탄올로 세척하고 전체 표면을 덮은 다음 15분 동안 그대로 둡니다.
- 계란을 짧은 축으로 잡고 바닥에서 깨뜨립니다. 그림 100과 같이 깨끗한 2mm 페트리 접시 위에 계란을 열어 내용물을 추출합니다. 계란을 잡고 깨는 동안 계란을 회전시키지 마십시오.
- 피펫을 사용하여 약 10mL의 얇은 알부민(즉, 액체 알부민42)을 ex-ovo 배양 사용을 위해 15mL 튜브에 옮기고 수집합니다. 그림 3과 같이 배양 접시의 중앙 웰을 수집된 얇은 알부민(약 0.9mL)으로 채웁니다. 충전 과정은 우물 내부에 기포가 형성되지 않도록 느리게 이루어져야 합니다. 알부민이 포함된 배양 접시가 37°C로 예열되었는지 확인합니다.
알림: 이 접시는 배아 ex ovo를 배양하는 데 사용됩니다. 세척 배지로 채워진 새로운 배양 접시는 Brillouin 이미징 중에 사용됩니다(3단계 참조). - 티슈 페이퍼를 사용하여 그림 4와 같이 유리체 막에서 알부민을 조심스럽게 분리하여 배아에 부착된 두꺼운 알부민(즉, 점성 알부민)을 부드럽게 제거합니다. vitelline 멤브레인과의 직접적인 접촉을 피하십시오.
- 두꺼운 알부민을 모두 제거한 후 여과지를 유리막에 조심스럽게 부착합니다. 배아의 몸체 축이 여과지의 중앙 직사각형의 긴 축과 정렬되는지 확인합니다. 가위를 사용하여 여과지를 둘러싼 멤브레인을 자릅니다.
- 핀셋을 사용하여 분리된 여과지를 노른자에서 비스듬한 방향으로 부드럽게 잡아당깁니다. 여과지를 거꾸로 뒤집어 배아의 등쪽이 아래로 향하도록 배치합니다(도립 현미경 구성의 경우). 장축의 한쪽에서 전체 여과지를 세척 매체와 함께 비스듬히 100mm 페트리 접시에 조심스럽게 담급니다.
- 깨끗한 피펫을 사용하여 세척제를 여과지와 평행하게 부드럽게 분사하여 남아 있는 노른자를 씻어냅니다. 세척 매체를 멤브레인에 직접 뿌리지 마십시오.
- 노른자를 모두 제거한 후 세척제에서 여과지를 조심스럽게 제거하고 티슈 페이퍼를 사용하여 가장자리에서 여분의 매체를 흡수합니다. 그런 다음 배아가 있는 여과지를 배양 접시에 놓고 그림 5와 같이 배아의 등쪽이 아래를 향하도록 합니다. 습도를 유지하려면 물에 적신 티슈 페이퍼를 접시에 넣으십시오.
- 배양 접시를 ex ovo 배양을 위해 무대 위 인큐베이터로 옮깁니다.
3. 배아의 Brillouin 측정
- 다른 배양 접시 세트를 준비하고 세척 매체로 채웁니다. 세척 매체가 37°C로 예열되었는지 확인합니다.
- 배아가 원하는 발달 단계에 도달하면 배아가 있는 여과지를 세척액으로 채워진 배양 접시로 옮깁니다. 배양 접시를 무대 위 s에 놓습니다.tage Brillouin 현미경의 인큐베이터( 재료 표 참조).
- Brillouin 측정을 수행하기 전에 참조용으로 전체 배아의 명시야 이미지를 저장하십시오. Brillouin 현미경의 세부 구성은 이전에 설명되었으며30 결과 섹션에 요약되어 있습니다(그림 6).
- 물과 메탄올의 Brillouin 신호를 측정하며, 이는 교정 프로세스를 위해 4단계에서 사용됩니다.
- 입사 레이저 출력 및 전자 곱셈 전하 결합 장치(EMCCD, 재료 표 참조) 카메라 노출 시간을 조정하여 최소 10,000카운트의 Brillouin 신호를 달성합니다. 명시야 이미지를 가이드로 사용하여 스캔 범위와 단계 크기를 설정합니다. 2D 병진 단계를 사용하여 배아를 스캔하여 관심 영역의 Brillouin 이미지를 획득합니다.
참고: 수평 스캐닝 범위는 명시야 이미지를 기반으로 결정할 수 있으며, 수직(즉, 깊이) 스캐닝 범위는 빠르고 거친 스캔에서 얻은 신호 강도를 기반으로 결정할 수 있습니다. 배아의 광손상을 방지하려면 입사 전력을 25mW로 제한하고 EMCCD 카메라의 노출 시간을 50ms로 설정합니다. 수평 방향으로 2 μm, 수직 방향으로 1 μm의 단계 크기를 선택하여 이미징 품질과 획득 시간의 균형을 맞출 수 있습니다. - 스캔을 완료한 후 배아와 함께 여과지를 조심스럽게 제거하고 티슈 페이퍼를 사용하여 과도한 세척액을 흡수합니다. 그런 다음 여과지를 얇은 알부민으로 채워진 배양 접시에 다시 넣어 온스테이지 인큐베이터에서 연속 배양합니다.
- 일정한 시간 간격(예: 1.5시간)으로 3.2-3.5단계를 반복하여 배아가 발달함에 따라 타임랩스 Brillouin 이미지를 캡처합니다.
- 4단계에 따라 2D Brillouin 이미지를 재구성합니다.
4. Brillouin 이미지 재구성
- 분광계(30)의 자유 스펙트럼 범위(FSR) 및 픽셀-대 주파수 변환비(PR)를 계산하기 위해 물 및 메탄올의 Brillouin 신호를 사용하여 Brillouin 분광계를 교정한다. FSR 및 PR의 보정된 값은 각 픽셀에서 배아의 Brillouin 이동을 계산하는 데 사용됩니다.
참고: 그림 7A 는 EMCCD 카메라로 캡처한 원시 Brillouin 스펙트럼을 보여줍니다. 스펙트럼을 수직으로 합산한 다음 로렌츠 피팅을 수행하면 두 점의 피크 거리 Δd를 얻을 수 있습니다(그림 7B). 물 Δd물과 메탄올 Δd메탄올의 피크 거리를 구함으로써 FSR 및 PR은 방정식30에 따라 계산할 수 있습니다. PR = 2· (ω메탄올-ω물)/(Δd물-Δd메탄올), FSR = 2·ω물 + PR·Δd물, 660nm에서 물 ω물 = 6.01GHz 및 메탄올 ω메탄올 = 4.49GHz의 알려진 브릴루인 이동. - 샘플의 각 픽셀에서 Brillouin 신호의 피크 거리를 구합니다. 보정된 FSR 및 PR을 기반으로 Brillouin 이동을 계산합니다: ω샘플 = 0.5 (FSR - PR x Δd샘플)30, 여기서 ω샘플 은 샘플의 브릴루인 이동이고 Δd샘플 은 Brillouin 신호의 피크 거리입니다.
- 모든 픽셀의 Brillouin 이동을 기반으로 2D Brillouin 이미지를 재구성합니다.
참고: 국소 분석을 수행하기 위해 획득한 Brillouin 이미지에서 관심 영역(예: 신경판)을 선택하고 기계적 특성을 정량화할 수 있습니다. 일반적인 접근 방식은 선택한 영역의 평균 브릴루앙 이동을 계산하는 것입니다.
결과
그림 6 은 Brillouin 현미경의 개략도를 보여줍니다. 이 시스템은 660nm 레이저를 광원으로 사용합니다. 아이솔레이터는 레이저 헤드 바로 뒤에 배치되어 역반사광을 차단하고 중성 밀도(ND) 필터를 사용하여 레이저 출력을 조정합니다. 초점 거리가 각각 f1 = 16mm 및 f2 = 100mm인 한 쌍의 렌즈 L1 및 L2가 레이저 빔을 확장하는 데 사용됩니다. 반파장판(HWP)과 선형 편광판(편광판 1)을 사...
토론
배아의 초기 발달은 외부 교란에 의해 쉽게 영향을 받을 수 있습니다. 따라서 시료 추출 및 이송 시 각별한 주의가 필요합니다. 한 가지 잠재적인 문제는 여과지에서 배아가 분리되는 것인데, 이로 인해 비텔린 막이 수축되어 Brillouin 이미징에서 신경판의 기울어진 아티팩트가 발생할 수 있습니다. 더욱이, 이러한 수축은 배아의 발달을 중단시킬 수 있습니다. 분리를 방지하기 위해 몇 가지 중요한 ...
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 유니스 케네디 슈라이버 국립 아동 보건 및 인간 발달 연구소(Eunice Kennedy Shriver National Institute of Child Health and Human Development), 미국 국립보건원(National Institutes of Health, K25HD097288, R21HD112663)의 지원을 받습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Fisherbrand | FB0875713 | |
| 2D motorized stage | Prior Scientific | H117E2 | |
| 35 mm Petri dish | World Precision Instruments | FD35-100 | |
| Brillouin Microscope with on-stage incubator | N/A | N/A | This is a custom-built Brillouin Microscope system based on Ref. 30 |
| Chicken eggs | University of Connecticut | N/A | |
| CMOS camera | Thorlabs | CS2100M-USB | |
| EMCCD camera | Andor | iXon | |
| Ethanol | Decon Laboratories, Inc. | #2701 | |
| Filter paper | Whatman | 1004-070 | |
| Incubator for in ovo culture | GQF Manufacturing Company Inc. | GQF 1502 | |
| Ring | Thorlabs | SM1RR | |
| Microscope body | Olympus | IX73 | |
| NaCl | Sigma-Aldrich | S9888 | |
| On-stage incubator | Oko labs | OKO-H301-PRIOR-H117 | |
| Parafilm | Bemis | PM-996 | |
| Penicillin-Streptomycin | Gibco | 15070-063 | |
| Pipettes | Fisherbrand | 13-711-6M | |
| Scissors | Artman instruments | N/A | 3pc Micro Scissors 5 |
| Syringe | BD | 305482 | |
| Tissue paper | Kimwipes | N/A | |
| Tube | Corning | 430052 | |
| Tweezers | DR Instruments | N/A | Microdissection Forceps Set |
참고문헌
- Greene, N. D. E., Copp, A. J. Neural tube defects. Annual Review of Neuroscience. 37 (1), 221-242 (2014).
- Suzuki, M., Morita, H., Ueno, N. Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Development, Growth & Differentiation. 54 (3), 266-276 (2012).
- Nikolopoulou, E., Galea, G. L., Rolo, A., Greene, N. D. E., Copp, A. J. Neural tube closure: Cellular, molecular and biomechanical mechanisms. Development. 144 (4), 552-566 (2017).
- Juriloff, D. M., Harris, M. J. Mouse models for neural tube closure defects. Human Molecular Genetics. 9 (6), 993-1000 (2000).
- Copp, A. J., Greene, N. D. E. Genetics and development of neural tube defects. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland. 220 (2), 217-230 (2010).
- Wang, M., De Marco, P., Capra, V., Kibar, Z. Update on the role of the non-canonical wnt/planar cell polarity pathway in neural tube defects. Cells. 8 (10), 1198 (2019).
- Galea, G. L., et al. Biomechanical coupling facilitates spinal neural tube closure in mouse embryos. Proceedings of the National Academy of Sciences. 114 (26), E5177-E5186 (2017).
- Moon, L. D., Xiong, F. Mechanics of neural tube morphogenesis. Seminars in Cell & Developmental Biology. 130, 56-69 (2022).
- Christodoulou, N., Skourides, P. A. Distinct spatiotemporal contribution of morphogenetic events and mechanical tissue coupling during xenopus neural tube closure. Development. 149 (13), (2022).
- De Goederen, V., Vetter, R., Mcdole, K., Iber, D. Hinge point emergence in mammalian spinal neurulation. Proceedings of the National Academy of Sciences. 119 (20), 2117075119 (2022).
- Christodoulou, N., Skourides, P. A. Somitic mesoderm morphogenesis is necessary for neural tube closure during xenopus development. Frontiers in Cell and Developmental Biology. 10, 1091629 (2023).
- Nikolopoulou, E., et al. Spinal neural tube closure depends on regulation of surface ectoderm identity and biomechanics by grhl2. Nature Communications. 10 (1), 2487 (2019).
- Nychyk, O., et al. Vangl2-environment interaction causes severe neural tube defects, without abnormal neuroepithelial convergent extension. Disease Models & Mechanisms. 15 (1), 049194 (2022).
- Li, B., Brusman, L., Dahlka, J., Niswander, L. A. Tmem132a ensures mouse caudal neural tube closure and regulates integrin-based mesodermal migration. Development. 149 (17), (2022).
- Zulueta-Coarasa, T., Fernandez-Gonzalez, R. Laser ablation to investigate cell and tissue mechanics in vivo. Integrative Mechanobiology: Micro-and Nano Techniques in Cell Mechanobiology. , 128-147 (2015).
- Wiebe, C., Brodland, G. W. Tensile properties of embryonic epithelia measured using a novel instrument. Journal of Biomechanics. 38 (10), 2087-2094 (2005).
- Luu, O., David, R., Ninomiya, H., Winklbauer, R. Large-scale mechanical properties of xenopus embryonic epithelium. Proceedings of the National Academy of Sciences. 108 (10), 4000-4005 (2011).
- Maître, J. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Zamir, E. A., Srinivasan, V., Perucchio, R., Taber, L. A. Mechanical asymmetry in the embryonic chick heart during looping. Annals of Biomedical Engineering. 31, 1327-1336 (2003).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences. 112 (5), 1416-1421 (2015).
- Savin, T., et al. On the growth and form of the gut. Nature. 476 (7358), 57-62 (2011).
- Almonacid, M., et al. Active diffusion positions the nucleus in mouse oocytes. Nature Cell Biology. 17 (4), 470-479 (2015).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2014).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Christian, Z. D., et al. High-resolution 3D biomechanical mapping of embryos with reverberant optical coherence elastography (Rev-OCE). Proceedings of SPIE. , 123670 (2023).
- Scarcelli, G., Yun, S. H. J. N. P. Confocal brillouin microscopy for three-dimensional mechanical imaging. Nature Photonics. 1 (1), 39-43 (2008).
- Scarcelli, G., et al. Noncontact three-dimensional mapping of intracellular hydromechanical properties by brillouin microscopy. Nature Methods. 12 (12), 1132-1134 (2015).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: An emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Zhang, J., Scarcelli, G. Mapping mechanical properties of biological materials via an add-on brillouin module to confocal microscopes. Nature Protocols. 16 (2), 1251-1275 (2021).
- Boyd, R. W. . Nonlinear optics. , (2020).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by brillouin optical microscopy. Biophysical Journal. 101 (6), 1539-1545 (2011).
- Scarcelli, G., Pineda, R., Yun, S. H. Brillouin optical microscopy for corneal biomechanics. Investigative Ophthalmology & Visual Science. 53 (1), 185-190 (2012).
- Antonacci, G., Braakman, S. Biomechanics of subcellular structures by non-invasive brillouin microscopy. Scientific Reports. 6 (1), 37217 (2016).
- Zhang, J., et al. Tissue biomechanics during cranial neural tube closure measured by brillouin microscopy and optical coherence tomography. Birth Defects Research. 111 (14), 991-998 (2019).
- Zhang, J., et al. Nuclear mechanics within intact cells is regulated by cytoskeletal network and internal nanostructures. Small. 16 (18), 1907688 (2020).
- Elsayad, K., Polakova, S., Gregan, J. Probing mechanical properties in biology using brillouin microscopy. Trends in Cell Biology. 29 (8), 608-611 (2019).
- Poon, C., Chou, J., Cortie, M., Kabakova, I. Brillouin imaging for studies of micromechanics in biology and biomedicine: From current state-of-the-art to future clinical translation. Journal of Physics: Photonics. 3 (1), 012002 (2020).
- Handler, C., Scarcelli, G., Zhang, J. Time-lapse mechanical imaging of neural tube closure in live embryo using brillouin microscopy. Scientific Reports. 13 (1), 263 (2023).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental dynamics: an official publication of the American Association of Anatomists. 220 (3), 284-289 (2001).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A submerged filter paper sandwich for long-term ex ovo time-lapse imaging of early chick embryos. Journal of Visualized Experiments. (118), e54636 (2016).
- Nys, Y., Guyot, N., Nys, Y., Bain, M., VanImmerseel, F. . Improving the safety and quality of eggs and egg products, vol 1: Egg chemistry, production and consumption. , 83-132 (2011).
- Berghaus, K. V., Yun, S. H., Scarcelli, G. High speed sub-ghz spectrometer for brillouin scattering analysis. Journal of Visualized Experiments. (106), e53468 (2015).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Schlüßler, R., et al. Mechanical mapping of spinal cord growth and repair in living zebrafish larvae by brillouin imaging. Biophysical Journal. 115 (5), 911-923 (2018).
- Williams, R. M., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental Dynamics. 220 (3), 284-289 (2001).
- Edrei, E., Scarcelli, G. Adaptive optics in spectroscopy and densely labeled-fluorescence applications. Optics Express. 26 (26), 33865-33877 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유