需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
监测雏鸡胚胎神经管闭合过程中组织的机械进化
摘要
该协议旨在纵向监测雏鸡胚胎神经形成过程中神经板组织的机械性能。它基于布里渊显微镜和载物台孵化系统的集成,能够对 卵 培养雏鸡胚胎中的神经板组织进行实时机械成像。
摘要
神经管闭合(NTC)是胚胎发育过程中的关键过程。这一过程的失败会导致神经管缺陷,导致先天性畸形甚至死亡。NTC涉及遗传、分子和机械水平的一系列机制。虽然近年来机械调节已成为一个越来越有吸引力的话题,但由于缺乏合适的技术来 对原位进行 3D 胚胎组织的机械测试,它在很大程度上仍未得到探索。作为回应,我们开发了一种以非接触式和非侵入性方式量化鸡胚胎组织的机械性能的方案。这是通过将共聚焦布里渊显微镜与载物台孵育系统集成来实现的。为了探究组织力学,收集预培养的胚胎并将其转移到载物台培养箱中进行 卵外 培养。同时,布里渊显微镜在发育过程中的不同时间点采集神经板组织的机械图像。该协议包括样品制备的详细说明、布里渊显微镜实验的实施以及数据后处理和分析。通过遵循该协议,研究人员可以纵向研究胚胎组织在发育过程中的机械进化。
引言
神经管缺陷 (NTD) 是胚胎发育过程中神经管闭合 (NTC) 失败引起的严重中枢神经系统出生缺陷1。被忽视的热带病的病因很复杂。研究表明,NTC 涉及一系列形态发生过程,包括收敛延伸、神经板弯曲(例如,顶端收缩)、神经皱襞抬高以及最终神经襞的粘附。这些过程受多种分子和遗传机制的调节2,3,这些过程中的任何故障都可能导致NTDs4,5,6。随着越来越多的证据表明,机械线索在 NTC3、7、8、9、10、11 中也起着至关重要的作用,并且已经发现了基因和机械线索之间的关系 12,13,14,因此研究神经形成过程中的组织生物力学变得势在必行。
已经开发了几种用于测量胚胎组织机械性能的技术,包括激光消融 (LA)15、组织解剖和松弛 (TDR)16,17、微量移液器抽吸 (MA)18、基于原子力显微镜 (AFM) 的纳米压痕19、微压痕器 (MI) 和微孔板 (MP)20、使用光学/磁镊的微流变学 (MR)21、22、23和基于液滴的传感器24.现有方法可以在从亚细胞到组织尺度的空间分辨率下测量机械性能。然而,这些方法大多是侵入性的,因为它们需要与样品接触(例如,MA、AFM、MI 和 MP)、外部材料注射(例如,MR 和基于液滴的传感器)或组织解剖(例如,LA 和 TDR)。因此,现有方法在原位监测神经板组织的机械演化具有挑战性25。最近,混响光学相干弹性成像在具有高空间分辨率的非接触式机械映射方面显示出前景26。
共聚焦布里渊显微镜是一种新兴的光学模式,能够以27、28、29、30 亚细胞分辨率对组织生物力学进行非接触式定量。布里渊显微镜基于自发布里渊光散射原理,即入射激光与材料内部热波动引起的声波之间的相互作用。因此,散射光会经历频率偏移,称为布里渊频移 ωR,公式为31:
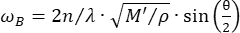 (1)
(1)
这里,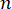 是材料的折射率,λ是入射光的波长,M'是纵向模量,ρ是质量密度,θ是入射光与散射光之间的角度。对于同类型的生物材料,折射率和密度
是材料的折射率,λ是入射光的波长,M'是纵向模量,ρ是质量密度,θ是入射光与散射光之间的角度。对于同类型的生物材料,折射率和密度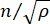 之比近似恒定28,32,33,34,35,36。因此,布里渊位移可以直接用于估计生理过程中的相对机械变化。布里渊显微镜的可行性已在各种生物样品中得到验证29,37,38。最近,通过将布里渊显微镜与载物台孵化系统相结合,演示了活雏鸡胚胎的延时机械成像39。该协议提供了样品制备、实验实施以及数据后处理和分析的详细说明。我们希望这项工作将促进非接触式布里渊技术的广泛采用,以研究胚胎发育和出生缺陷中的生物力学调节。
之比近似恒定28,32,33,34,35,36。因此,布里渊位移可以直接用于估计生理过程中的相对机械变化。布里渊显微镜的可行性已在各种生物样品中得到验证29,37,38。最近,通过将布里渊显微镜与载物台孵化系统相结合,演示了活雏鸡胚胎的延时机械成像39。该协议提供了样品制备、实验实施以及数据后处理和分析的详细说明。我们希望这项工作将促进非接触式布里渊技术的广泛采用,以研究胚胎发育和出生缺陷中的生物力学调节。
研究方案
该协议已获得韦恩州立大学机构动物护理和使用委员会的批准。
1.实验准备
- 使用70%乙醇溶液清洁和消毒剪刀和镊子。此外,准备一次性移液器和注射器。
- 通过向 495 mL 去离子水中加入 3.595 g NaCl 来制备洗涤介质。然后,向培养基中加入5ml青霉素 - 链霉素(5U / mL)。用洗涤介质填充100毫米培养皿并将其加热至37°C。
- 根据 图 1 准备培养皿,图 1 说明了整体配置。
- 准备一张滤纸,将其切成大约 17 毫米× 20 毫米的矩形,然后去掉四个角。在滤纸上创建一个中空中心,大小约为7毫米×10毫米,用于固定胚胎(图1,左)。
注意:胚胎的收集在步骤2中描述。 - 将市售环(Φ = 1 英寸,参见 材料表)与柔性薄膜(即石蜡薄膜)层连接,确保柔性薄膜也具有空心。这个带有薄膜的环将用于固定带有胚胎的滤纸。
- 最后,将准备好的环放入35毫米培养皿中(图1,右)。
注意:滤纸用于通过将滤纸放在膜上并将胚胎留在中心空心区域(将在步骤 2 中详细介绍)来固定和保持提取的胚胎。四个角被切割成适合外环的尺寸(如果已经安装,则不需要)。35 mm 玻璃底培养皿用于更好的激光束传播。培养皿有一个内孔 (Φ = 23 mm),可以填充蛋白进行 卵外 培养。环的直径必须大于内孔的直径,以便孔可以被环上的柔性薄膜覆盖(图1,插图)。滤纸的尺寸不受限制,可以根据所选环和培养皿的尺寸进行修改。或者,培养皿的底部可以预涂琼脂糖层(厚度:~1mm)。通过使用刀片从层中心去除琼脂糖,可以创建一个与柔性薄膜的空心中心形状相似的孔,用于装载蛋白。一个关键点是空心滤纸的四个侧面需要有足够的宽度(> 5 毫米)以确保胚胎的附着。
- 准备一张滤纸,将其切成大约 17 毫米× 20 毫米的矩形,然后去掉四个角。在滤纸上创建一个中空中心,大小约为7毫米×10毫米,用于固定胚胎(图1,左)。
2.鸡胚的提取和卵培养
注:此步骤是从以前发布的报告40,41修改而来的。
- 预培养后,从孵化器中取出鸡蛋并将其放在鸡蛋纸盒托盘上的长轴上。用70%乙醇清洗蛋壳,确保覆盖整个表面,然后静置15分钟。
- 将鸡蛋放在短轴上,然后在底部打碎。在干净的 100 毫米培养皿上打开鸡蛋以提取其内容物,如 图 2 所示。确保在握住和打开鸡蛋时不要旋转鸡蛋。
- 使用移液管,转移并收集约10mL稀蛋白(即液体蛋白42)到15mL管中,用于 卵外 培养。用收集的稀蛋白(约0.9mL)填充培养皿的中心孔,如 图3所示。填充过程应缓慢,避免在井内形成任何气泡。确保将含有蛋白的培养皿加热至37°C。
注意:这道菜将用于 培养胚胎。在布里渊成像期间,将使用充满洗涤介质的新培养皿(参见步骤 3)。 - 使用薄纸,通过小心地将蛋白与卵黄膜分离,轻轻地去除附着在胚胎上的浓稠蛋白(即粘性蛋白),如 图4所示。避免直接接触卵黄膜。
- 去除所有浓稠的蛋白后,小心地将滤纸贴在卵黄膜上。确保胚胎的身体轴与滤纸上中心矩形的长轴对齐。用剪刀剪开滤纸周围的膜。
- 用镊子轻轻地将分离的滤纸倾斜地从蛋黄上拉开。将滤纸倒置,使胚胎背面朝下(用于倒置显微镜配置)。小心地将整个滤纸从长轴的一侧浸入100毫米培养皿中,并用洗涤介质以倾斜的方式浸入培养皿中。
- 使用干净的移液管将洗涤介质平行于滤纸轻轻喷洒,洗掉任何残留的蛋黄。避免将洗涤介质直接喷洒到膜上。
- 清除所有蛋黄后,小心地从洗涤介质中取出滤纸,并用薄纸吸收边缘多余的培养基。然后,将装有胚胎的滤纸放在培养皿上,确保胚胎的背面朝下,如 图5所示。为了保持湿度,请在盘子中放一张湿纸巾。
- 将培养皿转移到舞台上的培养箱中进行 卵外 培养。
3. 胚胎的布里渊测量
- 准备另一套培养皿并用洗涤介质填充它们。确保洗涤介质加热至37°C。
- 当胚胎达到所需的发育阶段时,将带有胚胎的滤纸转移到装有洗涤介质的培养皿中。将培养皿放入布里渊显微镜的载物台培养箱中(参见 材料表)。
- 在进行布里渊测量之前,保存整个胚胎的明场图像以供参考。布里渊显微镜的详细配置在前面已经描述过30 ,并在结果部分进行了总结(图6)。
- 测量水和甲醇的布里渊信号,该信号将用于步骤4的校准过程。
- 调整入射激光功率和电子倍增电荷耦合器件(EMCCD,见 材料表)相机曝光时间,以实现至少 10,000 次布里渊信号计数。以明场图像为指导,设置扫描范围和步长。通过使用 2D 翻译阶段扫描胚胎来获取感兴趣区域的布里渊图像。
注意:水平扫描范围可以根据明场图像确定,垂直(即深度)扫描范围可以根据快速粗略扫描获得的信号强度确定。为防止对胚胎造成任何光损伤,请将入射功率限制为 25 mW,并将 EMCCD 相机的曝光时间设置为 50 ms。在水平方向上选择 2 μm 的步长,在垂直方向上选择 1 μm 的步长,以平衡成像质量和采集时间。 - 完成扫描后,小心地取出带有胚胎的滤纸,并用薄纸吸收多余的洗涤介质。然后,将滤纸放回装有稀蛋白的培养皿中,以便在载物台培养箱中连续培养。
- 以固定的时间间隔(例如,1.5小时)重复步骤3.2-3.5,以在胚胎发育时捕获延时布里渊图像。
- 按照步骤 4 重建 2D 布里渊图像。
4. 布里渊图像重建
- 使用水和甲醇的布里渊信号校准布里渊光谱仪,计算光谱仪30 的自由光谱范围 (FSR) 和像素频率转换比 (PR)。FSR 和 PR 的校准值将用于计算胚胎在每个像素处的布里渊位移。
注: 图7A 显示了EMCCD相机捕获的原始布里渊光谱。通过对光谱进行垂直求和,然后进行洛伦兹拟合,可以得到两个点的峰距离Δd(图7B)。通过得到水Δd水 和甲醇Δd甲醇的峰距离,可以根据方程30计算FSR和PR:PR = 2·(ω甲醇-ω 水)/(Δd水 - Δd甲醇),FSR = 2·ω水 + PR·Δd水,已知水 ω水 = 6.01 GHz 和甲醇 ω甲醇 = 4.49 GHz 在 660 nm 处的布里渊位移。 - 获得样品每个像素处布里渊信号的峰距离。根据校准的 FSR 和 PR 计算布里渊位移:ω样本 = 0.5 (FSR - PR x Δd样本)30,其中 ω样本 是样品的布里渊位移,Δd样本 是布里渊信号的峰距离。
- 根据所有像素的布里渊位移重建二维布里渊图像。
注意:要进行局部分析,可以从采集的布里渊图像中选择感兴趣的区域(例如,神经板)并量化其机械性能。一种常用的方法是计算所选区域的平均布里渊位移。
结果
图6 显示了布里渊显微镜的原理图。该系统采用660nm激光作为光源。在激光头的正后放置一个隔离器以抑制任何背向反射光,并使用中性密度 (ND) 滤光片来调节激光功率。一对焦距分别为 f1 = 16 mm 和 f2 = 100 mm 的透镜 L1 和 L2 用于扩展激光束。在偏振分束器(PBS)之后,使用半波板(HWP)和线性偏振器(偏振器1)来调节照射在样品或校准材料(即水和甲醇)上的光束功率。?...
讨论
胚胎的早期发育很容易受到外界干扰的影响。因此,在样品提取和转移过程中需要格外小心。一个潜在的问题是胚胎从滤纸上脱落,这可能导致卵黄膜收缩,并导致布里渊成像中神经板的倾斜伪影。此外,这种收缩可能会阻止胚胎的发育。应注意防止分离的几个关键步骤。首先,在步骤2.4中,确保从膜表面彻底去除蛋白至关重要。任何残留的蛋白都会阻碍膜与滤纸46,47
披露声明
作者声明他们没有利益冲突。
致谢
这项工作得到了美国国立卫生研究院(K25HD097288,R21HD112663)尤尼斯·肯尼迪·施莱弗国家儿童健康与人类发展研究所的支持。
材料
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Fisherbrand | FB0875713 | |
| 2D motorized stage | Prior Scientific | H117E2 | |
| 35 mm Petri dish | World Precision Instruments | FD35-100 | |
| Brillouin Microscope with on-stage incubator | N/A | N/A | This is a custom-built Brillouin Microscope system based on Ref. 30 |
| Chicken eggs | University of Connecticut | N/A | |
| CMOS camera | Thorlabs | CS2100M-USB | |
| EMCCD camera | Andor | iXon | |
| Ethanol | Decon Laboratories, Inc. | #2701 | |
| Filter paper | Whatman | 1004-070 | |
| Incubator for in ovo culture | GQF Manufacturing Company Inc. | GQF 1502 | |
| Ring | Thorlabs | SM1RR | |
| Microscope body | Olympus | IX73 | |
| NaCl | Sigma-Aldrich | S9888 | |
| On-stage incubator | Oko labs | OKO-H301-PRIOR-H117 | |
| Parafilm | Bemis | PM-996 | |
| Penicillin-Streptomycin | Gibco | 15070-063 | |
| Pipettes | Fisherbrand | 13-711-6M | |
| Scissors | Artman instruments | N/A | 3pc Micro Scissors 5 |
| Syringe | BD | 305482 | |
| Tissue paper | Kimwipes | N/A | |
| Tube | Corning | 430052 | |
| Tweezers | DR Instruments | N/A | Microdissection Forceps Set |
参考文献
- Greene, N. D. E., Copp, A. J. Neural tube defects. Annual Review of Neuroscience. 37 (1), 221-242 (2014).
- Suzuki, M., Morita, H., Ueno, N. Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Development, Growth & Differentiation. 54 (3), 266-276 (2012).
- Nikolopoulou, E., Galea, G. L., Rolo, A., Greene, N. D. E., Copp, A. J. Neural tube closure: Cellular, molecular and biomechanical mechanisms. Development. 144 (4), 552-566 (2017).
- Juriloff, D. M., Harris, M. J. Mouse models for neural tube closure defects. Human Molecular Genetics. 9 (6), 993-1000 (2000).
- Copp, A. J., Greene, N. D. E. Genetics and development of neural tube defects. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland. 220 (2), 217-230 (2010).
- Wang, M., De Marco, P., Capra, V., Kibar, Z. Update on the role of the non-canonical wnt/planar cell polarity pathway in neural tube defects. Cells. 8 (10), 1198 (2019).
- Galea, G. L., et al. Biomechanical coupling facilitates spinal neural tube closure in mouse embryos. Proceedings of the National Academy of Sciences. 114 (26), E5177-E5186 (2017).
- Moon, L. D., Xiong, F. Mechanics of neural tube morphogenesis. Seminars in Cell & Developmental Biology. 130, 56-69 (2022).
- Christodoulou, N., Skourides, P. A. Distinct spatiotemporal contribution of morphogenetic events and mechanical tissue coupling during xenopus neural tube closure. Development. 149 (13), (2022).
- De Goederen, V., Vetter, R., Mcdole, K., Iber, D. Hinge point emergence in mammalian spinal neurulation. Proceedings of the National Academy of Sciences. 119 (20), 2117075119 (2022).
- Christodoulou, N., Skourides, P. A. Somitic mesoderm morphogenesis is necessary for neural tube closure during xenopus development. Frontiers in Cell and Developmental Biology. 10, 1091629 (2023).
- Nikolopoulou, E., et al. Spinal neural tube closure depends on regulation of surface ectoderm identity and biomechanics by grhl2. Nature Communications. 10 (1), 2487 (2019).
- Nychyk, O., et al. Vangl2-environment interaction causes severe neural tube defects, without abnormal neuroepithelial convergent extension. Disease Models & Mechanisms. 15 (1), 049194 (2022).
- Li, B., Brusman, L., Dahlka, J., Niswander, L. A. Tmem132a ensures mouse caudal neural tube closure and regulates integrin-based mesodermal migration. Development. 149 (17), (2022).
- Zulueta-Coarasa, T., Fernandez-Gonzalez, R. Laser ablation to investigate cell and tissue mechanics in vivo. Integrative Mechanobiology: Micro-and Nano Techniques in Cell Mechanobiology. , 128-147 (2015).
- Wiebe, C., Brodland, G. W. Tensile properties of embryonic epithelia measured using a novel instrument. Journal of Biomechanics. 38 (10), 2087-2094 (2005).
- Luu, O., David, R., Ninomiya, H., Winklbauer, R. Large-scale mechanical properties of xenopus embryonic epithelium. Proceedings of the National Academy of Sciences. 108 (10), 4000-4005 (2011).
- Maître, J. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Zamir, E. A., Srinivasan, V., Perucchio, R., Taber, L. A. Mechanical asymmetry in the embryonic chick heart during looping. Annals of Biomedical Engineering. 31, 1327-1336 (2003).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences. 112 (5), 1416-1421 (2015).
- Savin, T., et al. On the growth and form of the gut. Nature. 476 (7358), 57-62 (2011).
- Almonacid, M., et al. Active diffusion positions the nucleus in mouse oocytes. Nature Cell Biology. 17 (4), 470-479 (2015).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2014).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Christian, Z. D., et al. High-resolution 3D biomechanical mapping of embryos with reverberant optical coherence elastography (Rev-OCE). Proceedings of SPIE. , 123670 (2023).
- Scarcelli, G., Yun, S. H. J. N. P. Confocal brillouin microscopy for three-dimensional mechanical imaging. Nature Photonics. 1 (1), 39-43 (2008).
- Scarcelli, G., et al. Noncontact three-dimensional mapping of intracellular hydromechanical properties by brillouin microscopy. Nature Methods. 12 (12), 1132-1134 (2015).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: An emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Zhang, J., Scarcelli, G. Mapping mechanical properties of biological materials via an add-on brillouin module to confocal microscopes. Nature Protocols. 16 (2), 1251-1275 (2021).
- Boyd, R. W. . Nonlinear optics. , (2020).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by brillouin optical microscopy. Biophysical Journal. 101 (6), 1539-1545 (2011).
- Scarcelli, G., Pineda, R., Yun, S. H. Brillouin optical microscopy for corneal biomechanics. Investigative Ophthalmology & Visual Science. 53 (1), 185-190 (2012).
- Antonacci, G., Braakman, S. Biomechanics of subcellular structures by non-invasive brillouin microscopy. Scientific Reports. 6 (1), 37217 (2016).
- Zhang, J., et al. Tissue biomechanics during cranial neural tube closure measured by brillouin microscopy and optical coherence tomography. Birth Defects Research. 111 (14), 991-998 (2019).
- Zhang, J., et al. Nuclear mechanics within intact cells is regulated by cytoskeletal network and internal nanostructures. Small. 16 (18), 1907688 (2020).
- Elsayad, K., Polakova, S., Gregan, J. Probing mechanical properties in biology using brillouin microscopy. Trends in Cell Biology. 29 (8), 608-611 (2019).
- Poon, C., Chou, J., Cortie, M., Kabakova, I. Brillouin imaging for studies of micromechanics in biology and biomedicine: From current state-of-the-art to future clinical translation. Journal of Physics: Photonics. 3 (1), 012002 (2020).
- Handler, C., Scarcelli, G., Zhang, J. Time-lapse mechanical imaging of neural tube closure in live embryo using brillouin microscopy. Scientific Reports. 13 (1), 263 (2023).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental dynamics: an official publication of the American Association of Anatomists. 220 (3), 284-289 (2001).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A submerged filter paper sandwich for long-term ex ovo time-lapse imaging of early chick embryos. Journal of Visualized Experiments. (118), e54636 (2016).
- Nys, Y., Guyot, N., Nys, Y., Bain, M., VanImmerseel, F. . Improving the safety and quality of eggs and egg products, vol 1: Egg chemistry, production and consumption. , 83-132 (2011).
- Berghaus, K. V., Yun, S. H., Scarcelli, G. High speed sub-ghz spectrometer for brillouin scattering analysis. Journal of Visualized Experiments. (106), e53468 (2015).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Schlüßler, R., et al. Mechanical mapping of spinal cord growth and repair in living zebrafish larvae by brillouin imaging. Biophysical Journal. 115 (5), 911-923 (2018).
- Williams, R. M., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental Dynamics. 220 (3), 284-289 (2001).
- Edrei, E., Scarcelli, G. Adaptive optics in spectroscopy and densely labeled-fluorescence applications. Optics Express. 26 (26), 33865-33877 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。