Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Civciv Embriyosunun Nöral Tüp Kapanması Sırasında Dokunun Mekanik Gelişiminin İzlenmesi
Bu Makalede
Özet
Bu protokol, civciv embriyo nörülasyonu sırasında nöral plak dokusunun mekanik özelliklerini uzunlamasına izlemek için geliştirilmiştir. Bir Brillouin mikroskobu ve bir sahne inkübasyon sisteminin entegrasyonuna dayanır ve ex ovo kültürlenmiş civciv embriyolarında nöral plaka dokusunun canlı mekanik görüntülemesini sağlar.
Özet
Nöral tüp kapanması (NTC), embriyonik gelişim sırasında kritik bir süreçtir. Bu süreçteki başarısızlık, nöral tüp defektlerine yol açarak konjenital malformasyonlara ve hatta mortaliteye neden olabilir. NTC, genetik, moleküler ve mekanik seviyelerde bir dizi mekanizma içerir. Mekanik düzenleme son yıllarda giderek daha çekici bir konu haline gelse de, 3D embriyonik dokunun yerinde mekanik testini yapmak için uygun teknolojinin bulunmaması nedeniyle büyük ölçüde keşfedilmemiş durumda. Buna cevaben, tavuk embriyonik dokusunun mekanik özelliklerini temassız ve invaziv olmayan bir şekilde ölçmek için bir protokol geliştirdik. Bu, konfokal bir Brillouin mikroskobunun sahnede bir inkübasyon sistemi ile entegre edilmesiyle elde edilir. Doku mekaniğini araştırmak için, önceden kültürlenmiş bir embriyo toplanır ve ex ovo kültür için sahnedeki bir inkübatöre aktarılır. Eşzamanlı olarak, nöral plak dokusunun mekanik görüntüleri, gelişim sırasında farklı zaman noktalarında Brillouin mikroskobu tarafından elde edilir. Bu protokol, numune hazırlama, Brillouin mikroskobu deneylerinin uygulanması ve veri işleme sonrası ve analizinin ayrıntılı açıklamalarını içerir. Bu protokolü izleyerek, araştırmacılar gelişim sırasında embriyonik dokunun mekanik evrimini uzunlamasına inceleyebilirler.
Giriş
Nöral tüp defektleri (NTD'ler), embriyonik gelişim sırasında nöral tüp kapanmasındaki (NTC) başarısızlıkların neden olduğu merkezi sinir sisteminin ciddi doğum kusurlarıdır1. NTD'lerin etiyolojisi karmaşıktır. Çalışmalar, NTC'nin yakınsak uzantı, nöral plakanın bükülmesi (örneğin, apikal daralma), nöral kıvrımın yükseltilmesi ve son olarak nöral kıvrımın yapışması dahil olmak üzere bir dizi morfogenetik süreci içerdiğini göstermiştir. Bu süreçler çoklu moleküler ve genetik mekanizmalar 2,3 tarafından düzenlenir ve bu süreçlerdeki herhangi bir arıza NTD'lere 4,5,6 neden olabilir. Artan kanıtlar, NTC 3,7,8,9,10,11 sırasında mekanik ipuçlarının da çok önemli roller oynadığını ve genler ile mekanik ipuçları 12,13,14 arasında ilişkiler bulunduğunu gösterdiğinden, nörülasyon sırasında doku biyomekaniğinin araştırılması zorunlu hale gelir.
Embriyonik dokuların mekanik özelliklerini ölçmek için lazer ablasyon (LA)15, doku diseksiyonu ve gevşemesi (TDR)16,17, mikropipet aspirasyonu (MA)18, Atomik Kuvvet Mikroskobu (AFM) tabanlı nanoindentasyon19, mikroindenterler (MI) ve mikroplakalar (MP)20, optik/manyetik cımbızlı mikro reoloji (MR) 21,22,23 dahil olmak üzere çeşitli teknikler geliştirilmiştirve damlacık tabanlı sensörler24. Mevcut yöntemler, hücre altından doku ölçeklerine kadar değişen uzamsal çözünürlüklerde mekanik özellikleri ölçebilir. Bununla birlikte, bu yöntemlerin çoğu invazivdir, çünkü numune ile temas (örneğin, MA, AFM, MI ve MP), harici malzeme enjeksiyonu (örneğin, MR ve damlacık tabanlı sensörler) veya doku diseksiyonu (örneğin, LA ve TDR). Sonuç olarak, mevcut yöntemlerin nöral plak dokusunun mekanik gelişimini in situ25 izlemesi zordur. Son zamanlarda, yankılanan optik koherens elastografi, yüksek uzamsal çözünürlüğe sahip temassız mekanik haritalama için umut vaat etmektedir26.
Konfokal Brillouin mikroskobu, subselüler çözünürlük 27,28,29,30 ile doku biyomekaniğinin temassız kantitalitesini sağlayan yeni bir optik modalitedir. Brillouin mikroskobu, gelen lazer ışığı ile malzeme içindeki termal dalgalanmaların neden olduğu akustik dalga arasındaki etkileşim olan spontan Brillouin ışık saçılımı ilkesine dayanır. Sonuç olarak, saçılan ışık, denklem31'i takiben Brillouin kayması ωR olarak bilinen bir frekans kayması yaşar:
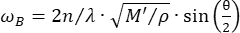 (1)
(1)
Burada, 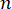 malzemenin kırılma indisi, λ gelen ışığın dalga boyu, M' uzunlamasına modül, ρ kütle yoğunluğu ve θ gelen ışık ile saçılan ışık arasındaki açıdır. Aynı tip biyolojik materyaller için kırılma indisi ve yoğunluk
malzemenin kırılma indisi, λ gelen ışığın dalga boyu, M' uzunlamasına modül, ρ kütle yoğunluğu ve θ gelen ışık ile saçılan ışık arasındaki açıdır. Aynı tip biyolojik materyaller için kırılma indisi ve yoğunluk 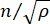 oranı yaklaşık olaraksabittir 28,32,33,34,35,36. Bu nedenle, Brillouin kayması, fizyolojik süreçlerdeki göreceli mekanik değişiklikleri tahmin etmek için doğrudan kullanılabilir. Brillouin mikroskobunun fizibilitesi çeşitli biyolojik örneklerde doğrulanmıştır 29,37,38. Son zamanlarda, canlı bir civciv embriyosunun hızlandırılmış mekanik görüntülemesi, bir Brillouin mikroskobu ile sahnede bir inkübasyon sistemi39 birleştirilerek gösterildi. Bu protokol, numune hazırlama, deney uygulaması ve veri işleme ve analizi hakkında ayrıntılı açıklamalar sağlar. Bu çabanın, embriyo gelişimi ve doğum kusurlarında biyomekanik düzenlemeyi incelemek için temassız Brillouin teknolojisinin yaygın olarak benimsenmesini kolaylaştıracağını umuyoruz.
oranı yaklaşık olaraksabittir 28,32,33,34,35,36. Bu nedenle, Brillouin kayması, fizyolojik süreçlerdeki göreceli mekanik değişiklikleri tahmin etmek için doğrudan kullanılabilir. Brillouin mikroskobunun fizibilitesi çeşitli biyolojik örneklerde doğrulanmıştır 29,37,38. Son zamanlarda, canlı bir civciv embriyosunun hızlandırılmış mekanik görüntülemesi, bir Brillouin mikroskobu ile sahnede bir inkübasyon sistemi39 birleştirilerek gösterildi. Bu protokol, numune hazırlama, deney uygulaması ve veri işleme ve analizi hakkında ayrıntılı açıklamalar sağlar. Bu çabanın, embriyo gelişimi ve doğum kusurlarında biyomekanik düzenlemeyi incelemek için temassız Brillouin teknolojisinin yaygın olarak benimsenmesini kolaylaştıracağını umuyoruz.
Protokol
Protokol, Wayne State Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylandı.
1. Deneysel hazırlık
- Makas ve cımbızı temizlemek ve sterilize etmek için %70 etanol solüsyonu kullanın. Ayrıca, tek kullanımlık pipetler ve bir şırınga hazırlayın.
- 495 mL deiyonize suya 3.595 g NaCl ekleyerek bir yıkama ortamı hazırlayın. Daha sonra ortama 5 ml Penisilin-Streptomisin (5 U/mL) ekleyin. 100 mm'lik bir Petri kabını yıkama ortamıyla doldurun ve 37 °C'ye ısıtın.
- Genel konfigürasyonu gösteren Şekil 1'e göre kültür kapları hazırlayın.
- Bir parça filtre kağıdı hazırlayın, yaklaşık 17 mm × 20 mm dikdörtgen şeklinde kesin ve dört köşesini çıkarın. Embriyoyu sabitlemek için filtre kağıdında yaklaşık 7 mm × 10 mm boyutlarında içi boş bir merkez oluşturun (Şekil 1, solda).
NOT: Embriyoların toplanması 2. adımda açıklanmıştır. - Esnek bir film (yani parafin filmi) tabakası ile piyasada bulunan bir halkayı (Φ = 1 inç, Malzeme Tablosuna bakın) takın ve esnek filmin de içi boş bir merkeze sahip olduğundan emin olun. Filmli bu halka, filtre kağıdını embriyo ile tutmak için kullanılacaktır.
- Son olarak, hazırlanan halkayı 35 mm'lik bir Petri kabına yerleştirin (Şekil 1, sağda).
NOT: Filtre kağıdı, filtre kağıdını zarın üzerine yerleştirerek ve embriyoyu ortadaki oyuk alanda bırakarak (2. adımda detaylandırılacaktır) ekstrakte edilen embriyoyu sabitlemek ve tutmak içindir. Dört köşe, dış halkanın boyutuna uyacak şekilde kesilmiştir (önceden takılıysa gerekli değildir). Daha iyi lazer ışını yayılımı için 35 mm'lik bir cam tabanlı kültür kabı kullanılır. Çanak, ex ovo kültür için albümin ile doldurulabilen bir iç kuyuya (Φ = 23 mm) sahiptir. Halkanın çapı, iç kuyunun çapından daha büyük olmalıdır, böylece kuyu halka üzerindeki esnek film ile kaplanabilir (Şekil 1, ek). Filtre kağıdının boyutu sınırlı değildir ve seçilen halkanın ve kültür kabının boyutuna göre değiştirilebilir. Alternatif olarak, çanağın tabanı bir agaroz tabakası (kalınlık: ~1 mm) ile önceden kaplanabilir. Bir bıçak kullanarak tabakanın merkezinden agarozu çıkararak, albümin yüklemek için esnek filmin içi boş merkezine benzer bir şekle sahip bir kuyu oluşturulabilir. Kritik bir nokta, içi boş filtre kağıdının dört tarafının, embriyonun tutunmasını sağlamak için yeterli genişliğe (> 5 mm) sahip olması gerektiğidir.
- Bir parça filtre kağıdı hazırlayın, yaklaşık 17 mm × 20 mm dikdörtgen şeklinde kesin ve dört köşesini çıkarın. Embriyoyu sabitlemek için filtre kağıdında yaklaşık 7 mm × 10 mm boyutlarında içi boş bir merkez oluşturun (Şekil 1, solda).
2. Tavuk embriyosunun ekstraksiyonu ve ex ovo kültürü
NOT: Bu adım, daha önce yayınlanmış40,41 raporlarından değiştirilmiştir.
- Ön kültürden sonra, yumurtayı kuluçka makinesinden alın ve yumurta kartonu tepsisine uzun ekseni üzerine yerleştirin. Yumurta kabuğunu %70 etanol ile temizleyin, tüm yüzeyi kaplayacak şekilde temizleyin ve ardından 15 dakika dinlendirin.
- Yumurtayı kısa ekseninde tutun ve dibinden kırın. Şekil 2'de gösterildiği gibi, içeriğini çıkarmak için yumurtayı 100 mm'lik temiz bir Petri kabının üzerinde açın. Yumurtayı tutarken ve kırarken döndürmemeye dikkat edin.
- Bir pipet kullanarak, yaklaşık 10 mL ince albümini (yani sıvı albümin42) ex ovo kültür kullanımı için 15 mL'lik bir tüpe aktarın ve toplayın. Kültür kabının orta kuyusunu, Şekil 3'te gösterildiği gibi toplanan ince albümin (yaklaşık 0.9 mL) ile doldurun. Doldurma işlemi yavaş olmalı ve kuyu içinde herhangi bir kabarcık oluşmasını önlemelidir. Albüminli kültür kabının 37 °C'ye ısıtıldığından emin olun.
NOT: Bu çanak embriyoyu ex ovo kültürlemek için kullanılacaktır. Brillouin görüntüleme sırasında yıkama ortamı ile doldurulmuş yeni kültür kapları kullanılacaktır (bkz. adım 3). - Kağıt mendil kullanarak, Şekil 4'te gösterildiği gibi, albümini vitellin zarından dikkatlice ayırarak embriyoya bağlı kalın albümini (yani viskoz albümini) nazikçe çıkarın. Vitellin membranı ile doğrudan temastan kaçının.
- Tüm kalın albümini çıkardıktan sonra, filtre kağıdını vitellin membranına dikkatlice yapıştırın. Embriyonun gövde ekseninin, filtre kağıdındaki merkez dikdörtgenin uzun ekseni ile hizalandığından emin olun. Filtre kağıdını çevreleyen zarı kesmek için makas kullanın.
- Cımbız kullanarak, izole edilmiş filtre kağıdını yumurta sarısından eğik bir yönde yavaşça çekin. Embriyoyu sırt tarafı aşağı bakacak şekilde konumlandırmak için filtre kağıdını ters çevirin (ters mikroskop konfigürasyonu için). Tüm filtre kağıdını uzun eksenin bir tarafından dikkatlice 100 mm'lik Petri kabına yıkama ortamı eğik bir şekilde daldırın.
- Temiz bir pipet kullanarak yıkama ortamını filtre kağıdına paralel olarak hafifçe püskürterek kalan sarıyı yıkayın. Yıkama ortamını doğrudan membranın üzerine püskürtmekten kaçının.
- Tüm sarıyı temizledikten sonra, filtre kağıdını yıkama ortamından dikkatlice çıkarın ve kenarlardaki fazla ortamı emmek için kağıt mendil kullanın. Ardından, Şekil 5'te gösterildiği gibi, embriyonun sırt tarafının aşağı baktığından emin olarak embriyo ile birlikte filtre kağıdını kültür kabına yerleştirin. Nemi korumak için, tabağa nemli bir kağıt mendil yerleştirin.
- Kültür kabını ex ovo kültür için sahnedeki inkübatöre aktarın.
3. Embriyonun Brillouin ölçümü
- Başka bir kültür kabı seti hazırlayın ve bunları yıkama ortamıyla doldurun. Yıkama ortamının 37 °C'ye ısıtıldığından emin olun.
- Embriyo istenen gelişim aşamasına ulaştığında, filtre kağıdını embriyo ile birlikte yıkama ortamı ile doldurulmuş kültür kabına aktarın. Kültür çanağını Brillouin mikroskobunun sahnedeki inkübatörüne yerleştirin (Malzeme Tablosuna bakın).
- Brillouin ölçümünü yapmadan önce, referans için tüm embriyonun parlak alan görüntüsünü kaydedin. Brillouin mikroskobunun ayrıntılı konfigürasyonu daha önce30 açıklanmıştır ve Sonuçlar bölümünde özetlenmiştir (Şekil 6).
- Kalibrasyon işlemi için 4. adımda kullanılacak olan su ve metanolün Brillouin sinyalini ölçün.
- En az 10.000 Brillouin sinyali sayısı elde etmek için gelen lazer gücünü ve elektron çarpan şarj bağlantılı cihaz (EMCCD, Malzeme Tablosuna bakın) kamera pozlama süresini ayarlayın. Parlak alan görüntüsünü kılavuz olarak kullanarak, tarama aralığını ve adım boyutunu ayarlayın. 2D translasyon aşaması kullanarak embriyoyu tarayarak ilgilenilen bölgenin bir Brillouin görüntüsünü elde edin.
NOT: Yatay tarama aralığı, parlak alan görüntüsüne göre belirlenebilir ve dikey (yani derinlik) tarama aralığı, hızlı ve kaba bir taramadan elde edilen sinyal gücüne göre belirlenebilir. Embriyoya herhangi bir foto hasarı önlemek için, gelen gücü 25 mW ile sınırlayın ve EMCCD kameranın pozlama süresini 50 ms olarak ayarlayın. Görüntüleme kalitesini ve çekim süresini dengelemek için yatay yönde 2 μm ve dikey yönde 1 μm'lik bir adım boyutu seçin. - Taramayı tamamladıktan sonra, filtre kağıdını embriyo ile dikkatlice çıkarın ve fazla yıkama ortamını emmek için kağıt mendil kullanın. Ardından, filtre kağıdını, sahnedeki inkübatörde sürekli kültürleme için ince albüminle dolu kültür kabına geri yerleştirin.
- Embriyo geliştikçe hızlandırılmış Brillouin görüntülerini yakalamak için düzenli zaman aralıklarında (örneğin, 1,5 saat) 3.2-3.5 adımlarını tekrarlayın.
- 4. adımı izleyerek 2D Brillouin görüntüsünü yeniden oluşturun.
4. Brillouin görüntü rekonstrüksiyonu
- Spektrometre30'un serbest spektral aralığını (FSR) ve piksel-frekans dönüşüm oranını (PR) hesaplamak için Brillouin su ve metanol sinyallerini kullanarak Brillouin spektrometresini kalibre edin. FSR ve PR'nin kalibre edilmiş değerleri, her pikselde embriyonun Brillouin kaymasını hesaplamak için kullanılacaktır.
NOT: Şekil 7A , EMCCD kamera tarafından yakalanan ham Brillouin spektrumunu gösterir. Spektrumu dikey olarak toplayarak ve daha sonra bir Lorentz uydurması yaparak, iki noktanın tepe mesafesi Δd elde edilebilir (Şekil 7B). Su Δdsu ve metanol Δdmetanolün tepe mesafesini alarak, FSR ve PR denklemlere göre hesaplanabilir30: PR = 2· (ωmetanol-ω su)/(Δdsu- Δdmetanol) ve FSR = 2·ωsu + PR·Δdsu, suyun bilinen Brillouin kayması ile ωsu = 6.01 GHz ve metanol ωmetanol = 4.49 GHz, 660 nm'de. - Numunenin her pikselinde Brillouin sinyalinin tepe mesafesini elde edin. Kalibre edilmiş FSR ve PR'ye dayalı olarak Brillouin kaymasını hesaplayın: ωnumune = 0.5 (FSR - PR x Δdnumunesi)30, burada ωnumune , numunenin Brillouin kaymasıdır ve Δdnumunesi , Brillouin sinyalinin tepe mesafesidir.
- 2B Brillouin görüntüsünü, tüm piksellerin Brillouin kaymalarına göre yeniden oluşturun.
NOT: Yerel analiz yapmak için, elde edilen Brillouin görüntüsünden ilgilenilen bir bölge (örneğin, nöral plaka) seçilebilir ve mekanik özellikleri ölçülebilir. Yaygın bir yaklaşım, seçilen bölgenin ortalama Brillouin kaymasını hesaplamaktır.
Sonuçlar
Şekil 6 , Brillouin mikroskobunun şemasını göstermektedir. Sistem, ışık kaynağı olarak 660 nm'lik bir lazer kullanır. Geri yansıyan ışığı reddetmek için lazer kafasının hemen arkasına bir izolatör yerleştirilir ve lazer gücünü ayarlamak için bir nötr yoğunluk (ND) filtresi kullanılır. Lazer ışınını genişletmek için odak uzaklığı sırasıyla f1 = 16 mm ve f2 = 100 mm olan bir çift lens, L1 ve L2 kullanılır. Polarize ışın ayırıcıdan (PBS) sonra...
Tartışmalar
Embriyonun erken gelişimi dış rahatsızlıklardan kolayca etkilenebilir. Bu nedenle, numune ekstraksiyonu ve transferi sırasında çok dikkatli olunmalıdır. Potansiyel bir sorun, embriyonun filtre kağıdından ayrılmasıdır, bu da vitellin zarının büzülmesine yol açabilir ve Brillouin görüntülemede nöral plakanın eğik bir artefaktına neden olabilir. Ayrıca, bu küçülme embriyonun gelişimini durdurabilir. Ayrılmayı önlemek için birkaç kritik adıma dikkat edilmelidir. İlk olarak, adım 2.4't...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma Eunice Kennedy Shriver Ulusal Çocuk Sağlığı ve İnsani Gelişme Enstitüsü, Ulusal Sağlık Enstitüleri (K25HD097288, R21HD112663) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Fisherbrand | FB0875713 | |
| 2D motorized stage | Prior Scientific | H117E2 | |
| 35 mm Petri dish | World Precision Instruments | FD35-100 | |
| Brillouin Microscope with on-stage incubator | N/A | N/A | This is a custom-built Brillouin Microscope system based on Ref. 30 |
| Chicken eggs | University of Connecticut | N/A | |
| CMOS camera | Thorlabs | CS2100M-USB | |
| EMCCD camera | Andor | iXon | |
| Ethanol | Decon Laboratories, Inc. | #2701 | |
| Filter paper | Whatman | 1004-070 | |
| Incubator for in ovo culture | GQF Manufacturing Company Inc. | GQF 1502 | |
| Ring | Thorlabs | SM1RR | |
| Microscope body | Olympus | IX73 | |
| NaCl | Sigma-Aldrich | S9888 | |
| On-stage incubator | Oko labs | OKO-H301-PRIOR-H117 | |
| Parafilm | Bemis | PM-996 | |
| Penicillin-Streptomycin | Gibco | 15070-063 | |
| Pipettes | Fisherbrand | 13-711-6M | |
| Scissors | Artman instruments | N/A | 3pc Micro Scissors 5 |
| Syringe | BD | 305482 | |
| Tissue paper | Kimwipes | N/A | |
| Tube | Corning | 430052 | |
| Tweezers | DR Instruments | N/A | Microdissection Forceps Set |
Referanslar
- Greene, N. D. E., Copp, A. J. Neural tube defects. Annual Review of Neuroscience. 37 (1), 221-242 (2014).
- Suzuki, M., Morita, H., Ueno, N. Molecular mechanisms of cell shape changes that contribute to vertebrate neural tube closure. Development, Growth & Differentiation. 54 (3), 266-276 (2012).
- Nikolopoulou, E., Galea, G. L., Rolo, A., Greene, N. D. E., Copp, A. J. Neural tube closure: Cellular, molecular and biomechanical mechanisms. Development. 144 (4), 552-566 (2017).
- Juriloff, D. M., Harris, M. J. Mouse models for neural tube closure defects. Human Molecular Genetics. 9 (6), 993-1000 (2000).
- Copp, A. J., Greene, N. D. E. Genetics and development of neural tube defects. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland. 220 (2), 217-230 (2010).
- Wang, M., De Marco, P., Capra, V., Kibar, Z. Update on the role of the non-canonical wnt/planar cell polarity pathway in neural tube defects. Cells. 8 (10), 1198 (2019).
- Galea, G. L., et al. Biomechanical coupling facilitates spinal neural tube closure in mouse embryos. Proceedings of the National Academy of Sciences. 114 (26), E5177-E5186 (2017).
- Moon, L. D., Xiong, F. Mechanics of neural tube morphogenesis. Seminars in Cell & Developmental Biology. 130, 56-69 (2022).
- Christodoulou, N., Skourides, P. A. Distinct spatiotemporal contribution of morphogenetic events and mechanical tissue coupling during xenopus neural tube closure. Development. 149 (13), (2022).
- De Goederen, V., Vetter, R., Mcdole, K., Iber, D. Hinge point emergence in mammalian spinal neurulation. Proceedings of the National Academy of Sciences. 119 (20), 2117075119 (2022).
- Christodoulou, N., Skourides, P. A. Somitic mesoderm morphogenesis is necessary for neural tube closure during xenopus development. Frontiers in Cell and Developmental Biology. 10, 1091629 (2023).
- Nikolopoulou, E., et al. Spinal neural tube closure depends on regulation of surface ectoderm identity and biomechanics by grhl2. Nature Communications. 10 (1), 2487 (2019).
- Nychyk, O., et al. Vangl2-environment interaction causes severe neural tube defects, without abnormal neuroepithelial convergent extension. Disease Models & Mechanisms. 15 (1), 049194 (2022).
- Li, B., Brusman, L., Dahlka, J., Niswander, L. A. Tmem132a ensures mouse caudal neural tube closure and regulates integrin-based mesodermal migration. Development. 149 (17), (2022).
- Zulueta-Coarasa, T., Fernandez-Gonzalez, R. Laser ablation to investigate cell and tissue mechanics in vivo. Integrative Mechanobiology: Micro-and Nano Techniques in Cell Mechanobiology. , 128-147 (2015).
- Wiebe, C., Brodland, G. W. Tensile properties of embryonic epithelia measured using a novel instrument. Journal of Biomechanics. 38 (10), 2087-2094 (2005).
- Luu, O., David, R., Ninomiya, H., Winklbauer, R. Large-scale mechanical properties of xenopus embryonic epithelium. Proceedings of the National Academy of Sciences. 108 (10), 4000-4005 (2011).
- Maître, J. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Zamir, E. A., Srinivasan, V., Perucchio, R., Taber, L. A. Mechanical asymmetry in the embryonic chick heart during looping. Annals of Biomedical Engineering. 31, 1327-1336 (2003).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences. 112 (5), 1416-1421 (2015).
- Savin, T., et al. On the growth and form of the gut. Nature. 476 (7358), 57-62 (2011).
- Almonacid, M., et al. Active diffusion positions the nucleus in mouse oocytes. Nature Cell Biology. 17 (4), 470-479 (2015).
- Campàs, O., et al. Quantifying cell-generated mechanical forces within living embryonic tissues. Nature Methods. 11 (2), 183-189 (2014).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Christian, Z. D., et al. High-resolution 3D biomechanical mapping of embryos with reverberant optical coherence elastography (Rev-OCE). Proceedings of SPIE. , 123670 (2023).
- Scarcelli, G., Yun, S. H. J. N. P. Confocal brillouin microscopy for three-dimensional mechanical imaging. Nature Photonics. 1 (1), 39-43 (2008).
- Scarcelli, G., et al. Noncontact three-dimensional mapping of intracellular hydromechanical properties by brillouin microscopy. Nature Methods. 12 (12), 1132-1134 (2015).
- Prevedel, R., Diz-Muñoz, A., Ruocco, G., Antonacci, G. Brillouin microscopy: An emerging tool for mechanobiology. Nature Methods. 16 (10), 969-977 (2019).
- Zhang, J., Scarcelli, G. Mapping mechanical properties of biological materials via an add-on brillouin module to confocal microscopes. Nature Protocols. 16 (2), 1251-1275 (2021).
- Boyd, R. W. . Nonlinear optics. , (2020).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by brillouin optical microscopy. Biophysical Journal. 101 (6), 1539-1545 (2011).
- Scarcelli, G., Pineda, R., Yun, S. H. Brillouin optical microscopy for corneal biomechanics. Investigative Ophthalmology & Visual Science. 53 (1), 185-190 (2012).
- Antonacci, G., Braakman, S. Biomechanics of subcellular structures by non-invasive brillouin microscopy. Scientific Reports. 6 (1), 37217 (2016).
- Zhang, J., et al. Tissue biomechanics during cranial neural tube closure measured by brillouin microscopy and optical coherence tomography. Birth Defects Research. 111 (14), 991-998 (2019).
- Zhang, J., et al. Nuclear mechanics within intact cells is regulated by cytoskeletal network and internal nanostructures. Small. 16 (18), 1907688 (2020).
- Elsayad, K., Polakova, S., Gregan, J. Probing mechanical properties in biology using brillouin microscopy. Trends in Cell Biology. 29 (8), 608-611 (2019).
- Poon, C., Chou, J., Cortie, M., Kabakova, I. Brillouin imaging for studies of micromechanics in biology and biomedicine: From current state-of-the-art to future clinical translation. Journal of Physics: Photonics. 3 (1), 012002 (2020).
- Handler, C., Scarcelli, G., Zhang, J. Time-lapse mechanical imaging of neural tube closure in live embryo using brillouin microscopy. Scientific Reports. 13 (1), 263 (2023).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental dynamics: an official publication of the American Association of Anatomists. 220 (3), 284-289 (2001).
- Schmitz, M., Nelemans, B. K. A., Smit, T. H. A submerged filter paper sandwich for long-term ex ovo time-lapse imaging of early chick embryos. Journal of Visualized Experiments. (118), e54636 (2016).
- Nys, Y., Guyot, N., Nys, Y., Bain, M., VanImmerseel, F. . Improving the safety and quality of eggs and egg products, vol 1: Egg chemistry, production and consumption. , 83-132 (2011).
- Berghaus, K. V., Yun, S. H., Scarcelli, G. High speed sub-ghz spectrometer for brillouin scattering analysis. Journal of Visualized Experiments. (106), e53468 (2015).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Schlüßler, R., et al. Mechanical mapping of spinal cord growth and repair in living zebrafish larvae by brillouin imaging. Biophysical Journal. 115 (5), 911-923 (2018).
- Williams, R. M., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Chapman, S. C., Collignon, J., Schoenwolf, G. C., Lumsden, A. Improved method for chick whole-embryo culture using a filter paper carrier. Developmental Dynamics. 220 (3), 284-289 (2001).
- Edrei, E., Scarcelli, G. Adaptive optics in spectroscopy and densely labeled-fluorescence applications. Optics Express. 26 (26), 33865-33877 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır