A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التوليف الأخضر ، والتوصيف ، والتغليف ، وقياس إمكانات إطلاق جزيئات اللجنين القلوية الدقيقة / دون الميكرونية الجديدة
In This Article
Summary
نحن نصف منهجيات جديدة وبسيطة لتوليف وتوصيف جزيئات اللجنين الدقيقة ودون الميكرونية المتوافقة حيويا. توفر هذه التركيبات نهجا سهلا لاستخدام البوليمر غير المتجانس ، بالإضافة إلى بديل للتصميم العقلاني للمصفوفات الحاملة متعددة الوظائف مع إمكانية التطبيق في الطب الحيوي والتكنولوجيا الصيدلانية وصناعة الأغذية.
Abstract
إن قابلية تطبيق تقنية البوليمر الحيوي الدقيقة / النانوية في تكنولوجيا الإنسان والطب البيطري والأدوية والغذاء تنمو بسرعة بسبب الإمكانات الكبيرة للجسيمات القائمة على البوليمر الحيوي كأنظمة حاملة فعالة. يسمح استخدام اللجنين كمصفوفة حيوية أساسية للبوليمر غير المتجانس لتصميم تركيبات مبتكرة دقيقة / دون ميكرون بتحقيق توافق حيوي متزايد ويوفر مجموعات وظيفية نشطة مختلفة توفر فرصا لتخصيص الخصائص الفيزيائية والكيميائية والأنشطة الحيوية للتركيبات لتطبيقات متنوعة. وكان الهدف من هذه الدراسة هو وضع منهجية بسيطة وصديقة للبيئة لتخليق جسيمات اللجنين ذات الحجم الجزئي ودون الميكروني؛ لتقييم خصائصها الفيزيائية والكيميائية والطيفية والهيكلية ؛ وفحص قدرتها على تغليف الجزيئات النشطة بيولوجيا وإمكانية إطلاق البيوفلافونويدس في المختبر في وسائط الجهاز الهضمي المحاكاة. تطبق المنهجيات المقدمة مذيبات رخيصة وخضراء. عمليات سهلة ومباشرة وسريعة وحساسة تتطلب القليل من المعدات والمواد غير السامة وطرق بسيطة لتوصيفها ، وتحديد قدرة التغليف تجاه المركبات النشطة بيولوجيا ضعيفة الذوبان في الماء مورين وكيرسيتين ، وإمكانية الإطلاق في المختبر لمصفوفات اللجنين.
Introduction
في الوقت الحاضر ، زاد الميل نحو البوليمرات الحيوية مثل السليلوز والشيتوزان والكولاجين والدكستران والجيلاتين واللجنين كسلائف لتصميم ناقلات ميكرو / دون ميكرون ذات حجم قابل للتخصيص ، وخصائص فيزيائية كيميائية ، ووظائف حيوية في الصناعات الطبية الحيوية والصيدلانية وتكنولوجيا الأغذية بسبب قابليتها للتطبيق في هندسة الأنسجة ، والطباعة الحيوية 3D ، في المختبر منصات نمذجة الأمراض ، صناعة التعبئة والتغليف ، تحضير المستحلب ، وتسليم المغذيات من بين أمور أخرى1،2،3.
تسلط الدراسات الجديدة الضوء على جوانب الهلاميات المائية القائمة على اللجنين وكذلك التركيبات الدقيقة والنانوية4 كمركبات مفيدة تستخدم لمواد تغليف المواد الغذائية5 ، تخزين الطاقة6 ، مستحضرات التجميل7 ، مثبتات حرارية / ضوئية ، مواد معززة ، ومصفوفات حاملة للأدوية8 لتوصيل الجزيئات الكارهة للماء ، وتحسين حواجز الأشعة فوق البنفسجية9، كعوامل تقوية في المركبات النانوية ، وكبديل للجسيمات النانوية غير العضوية بسبب بعض قضايا السلامة الأخيرة10،11،12. السبب وراء هذا الاتجاه هو التوافق الحيوي ، والتحلل البيولوجي ، وعدم سمية البوليمر الحيوي الطبيعي غير المغاير ، بالإضافة إلى أنشطته الحيوية المثبتة لإمكانات مضادات الأكسدة اللجنين وأنشطة الكسح الجذرية والمضادة للتكاثر ومضادات الميكروبات13،14،15،16،17.
تشير الأدبيات العلمية إلى طرق مختلفة للتخليق (التجميع الذاتي ، والترسيب المضاد للمذيبات ، والترسيب الحمضي ، وتحويل المذيبات)18 وتوصيف التركيبات الدقيقة / النانوية القائمة على اللجنين ، بما في ذلك تطبيق المذيبات باهظة الثمن أو الضارة مثل رباعي هيدروفوران (THF) ، ثنائي ميثيل سلفوكسيد (DMSO) ، N ، N-dimethylformamide (DMF) ، والأسيتون ، والعمليات المعقدة وغير المباشرة والمملة التي تستخدم الكثير من المعدات والمواد السامة12، 19,20.
للتغلب على العيوب الأخيرة ، تقدم البروتوكولات التالية منهجيات جديدة لتخليق الجسيمات الدقيقة / دون الميكرونية القائمة على اللجنين باستخدام مذيبات رخيصة وخضراء. عمليات سهلة ومباشرة وسريعة وحساسة تتطلب القليل من المعدات والمواد غير السامة وطرق بسيطة لتوصيفها وتحديد قدرة التغليف نحو المركبات النشطة بيولوجيا ضعيفة الذوبان في الماء وإمكانية الإطلاق في المختبر لمصفوفات اللجنين. تعد طرق الإنتاج المقدمة على نطاق المختبر مفيدة لتصنيع ناقلات اللجنين الوظيفية ذات الأحجام القابلة للضبط ، وقدرة التغليف العالية ، وسلوك الإطلاق المستدام في المختبر باستخدام إجراءات توصيف بسيطة ومواد كيميائية صديقة للبيئة يمكن أن تجد تطبيقا في مختلف مجالات العلوم الطبية الحيوية وتكنولوجيا الأغذية. تم تطبيق اثنين من مركبات الفلافونويد كجزيئات مستهدفة مغلفة في جزيئات اللجنين: مورين في الجسيمات الدقيقة ، وكيرسيتين في جزيئات تحت الميكرون. الفرق في هياكل كل من مركبات الفلافونويد هو فقط موضع المجموعة الثانية -OH في الحلقة العطرية B: المجموعة -OH في الموضع 2 'في مورين وعلى موضع 3' في كيرسيتين ، وبالتالي فإن كلا المركبين العضويين هما أيزومرات موضعية. تفترض الحقيقة الأخيرة سلوكا مشابها لكل من المركبات الطبيعية النشطة بيولوجيا في عمليات التغليف و / أو الإطلاق.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. تخليق الجسيمات الدقيقة اللجنين
- تحضير محلول مائي من اللجنين القلوي سعة 50 ملغم / مل عن طريق إذابة 2.5 جم من اللجنين القلوي في 50 مل من الماء عالي النقاء على محرك مغناطيسي.
- قم بإعداد محلول Tween 80 بنسبة 1٪ عن طريق إذابة 1 مل من Tween 80 في 100 مل من الماء عالي النقاء.
- قم بإعداد محلول 2 M من HNO3 عن طريق تخفيف 6.65 مل من 67٪ HNO3 (الكثافة = 1.413 جم / مل) بماء عالي النقاء إلى حجم نهائي قدره 50 مل.
- أضف ببطء 15 مل من محلول Tween 80 1٪ إلى 50 مل من محلول اللجنين القلوي 50 مجم / مل.
- حرك الخليط على محرك مغناطيسي عند 500 دورة في الدقيقة لمدة 10 دقائق حتى يصبح الفاعل بالسطح مشتتا جيدا.
- أضف 20 مل من 2 M HNO3 بالتنقيط مع حقنة بمعدل تدفق حوالي 150 ميكرولتر / ثانية إلى الخليط.
- استمر في تحريك الخليط لمدة 30 دقيقة عندما يتحول المحلول البني الداكن إلى تعليق بني فاتح للجسيمات الدقيقة.
- انقل التعليق إلى أنابيب اختبار 1.5-2 مل وأجهزة طرد مركزي لمدة 30 دقيقة عند 15000 × جم في جهاز طرد مركزي فائق عند 10 درجات مئوية.
- اجمع المادة الطافية لمزيد من التحليلات واشطف الجسيمات الدقيقة بماء فائق النقاء.
- كرر إجراءات الشطف / الطرد المركزي الفائق 3x.
- اغمس الحاوية مع الجسيمات الدقيقة في حمام جليدي قبل التجانس بالموجات فوق الصوتية.
- تجانس الجسيمات الدقيقة لمدة 4 دقائق بكثافة 93٪ على الخالط بالموجات فوق الصوتية.
- قم بتجفيف الجسيمات الدقيقة عند درجة حرارة -64 درجة مئوية في مجفف تجميد وتخزينها في جهاز إكسيكاتور لاستخدامها مرة أخرى.
2. تخليق جزيئات اللجنين تحت الميكرون
- تحضير محلول مائي من اللجنين القلوي 5 ملغم / مل عن طريق إذابة 125 ملغ من اللجنين القلوي في 25 مل من الماء عالي النقاء على محرك مغناطيسي.
- أضف ببطء 1 مل من 96٪ EtOH إلى محلول اللجنين القلوي.
- حرك الخليط على محرك مغناطيسي عند 500 دورة في الدقيقة لمدة 3 دقائق.
- تحضير 50 مل من محلول 1٪ من حامض الستريك عن طريق إذابة 0.5 غرام من حامض الستريك في ماء عالي النقاء إلى حجم نهائي قدره 50 مل.
- أضف 7 مل من حمض الستريك 1٪ بالتنقيط مع حقنة بمعدل تدفق حوالي 4 مل / دقيقة إلى الخليط.
- استمر في تقليب الخليط لمدة 10 دقائق عندما يتحول المحلول البني الصافي إلى تعليق بني فاتح غائم لجزيئات دون الميكرون.
- نقل التعليق إلى أنابيب الاختبار وأجهزة الطرد المركزي لمدة 30 دقيقة عند 15000 × غرام في جهاز طرد مركزي فائق عند 10 درجات مئوية.
- اجمع المادة الطافية لمزيد من التحليلات واشطف الجسيمات الدقيقة بماء فائق النقاء.
- كرر إجراءات الشطف / الطرد المركزي الفائق 3x.
- اغمس الحاوية مع الجسيمات الدقيقة في حمام جليدي قبل التجانس بالموجات فوق الصوتية.
- تجانس الجسيمات الدقيقة بالموجات فوق الصوتية لمدة دورتين مدة كل منهما 4 دقائق بكثافة 96٪ في الخالط بالموجات فوق الصوتية.
- تبريد الحاويات لمدة 1 دقيقة بعد الدورة الأولى.
- قم بتجفيف الجسيمات الدقيقة عند درجة حرارة -64 درجة مئوية في مجفف تجميد وتخزينها في جهاز إكسيكاتور لاستخدامها مرة أخرى.
3. تخليق جزيئات اللجنين الطبيعية المغلفة بالفلافونويد الدقيقة / دون الميكرون
- كرر الخطوات 1.1-1.5 للجسيمات الدقيقة.
- تزن 0.08 غرام من مورين ، تذوب في 1 مل من EtOH ، وتضاف هذا المحلول الإيثانولي إلى الخليط.
- حرك الخليط على محرك مغناطيسي عند 500 دورة في الدقيقة لمدة 20 دقيقة.
- أضف 20 مل من 2 N HNO3 بالتنقيط مع حقنة بمعدل تدفق حوالي 150 ميكرولتر / ثانية إلى الخليط.
- استمر في تحريك الخليط لمدة 60 دقيقة.
- كرر الخطوات 1.8-1.13.
- كرر الخطوة 2.1 للجسيمات دون الميكرونية.
- وزن 0.04 غرام من كيرسيتين ، قم بحله في 1 مل EtOH وأضف هذا المحلول الإيثانولي إلى محلول اللجنين المائي القلوي.
- حرك الخليط على محرك مغناطيسي عند 500 دورة في الدقيقة لمدة 10 دقائق.
- كرر الخطوات 2.4-2.13.
4. تحديد كفاءة تغليف جزيئات اللجنين الدقيقة / sumicro
- احسب محتوى المادة النشطة بيولوجيا المضافة أثناء إجراء تخليق كلا النوعين من جزيئات اللجنين المغلفة بالفلافونويد.
- تحديد قياس طيفي امتصاص الفلافونويد في المادة الطافية التي تم الحصول عليها خلال الخطوتين 1.9 و 2.8 بعد تخفيفه بنسبة 96٪ EtOH.
- احسب تركيز مورين / كيرسيتين غير المحاصر باستخدام منحنيات معايرة مركبات الفلافونويد.
- احسب كفاءة التغليف (EE ، ٪) لجسيمات اللجنين الدقيقة تجاه مركبات الفلافونويد الطبيعية باستخدام المعادلة (1):
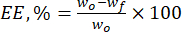 (1)
(1)
حيث wo هي الكمية الإجمالية للمادة النشطة بيولوجيا المضافة (mg) و wf هي كمية الفلافونويد الحر غير المحبوس (mg). - احسب سعة تحميل الدواء (DLC ، ٪) - معلمة مهمة تمثل كمية الدواء في الجسيمات لكل وحدة وزن للنظام الحامل - باستخدام مكافئ (2):
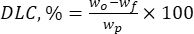 (2)
(2)
حيث wp هي الكمية الإجمالية (العائد) لجزيئات اللجنين الدقيقة / دون الميكرونية التي تم الحصول عليها بعد التجفيد (ملغ).
5. توصيف جزيئات اللجنين الدقيقة ودون الميكرونية
- تحديد عدد الجسيمات وحجمها وتوزيع الحجم
- قم بتقييم حجم الجسيمات وتوزيع حجم الجسيمات للعينات باستخدام عداد خلية أوتوماتيكي مع خيار عدد الخرزات. أضف مع ماصة دقيقة 1 ميكرولتر من تعليق جزيئات اللجنين / الفلافونويد الدقيقة / دون الميكرون في ماء عالي النقاء في بئر شريحة العد المطلوبة للعملية.
- انتظر حتى يظهر عدد الجسيمات في 1 مل من التعليق ، وكذلك عددها وتوزيعها حسب الحجم في شاشة عداد الخلية التلقائي.
ملاحظة: يسمح الجهاز بتخزين البيانات على فلاش USB. يسمح البرنامج الخاص لعداد الخلايا الأوتوماتيكي بمزيد من المعالجة للملفات الرقمية والصور المحفوظة.
- تحديد محتوى المجموعات السطحية الحمضية/القاعدية لجسيمات اللجنين عن طريق معايرة الجهد
- الوزن 0.04 جم من جزيئات اللجنين المغلفة بالفلافونويد / المفرغة.
- انقلها إلى دورق Erlenmeyer ، وأضف 10 مل من 0.1 M HCl ، وضع القارورة على محرك مغناطيسي عند 250 دورة في الدقيقة.
- املأ سحاحة سعة 50 مل بمحلول قياسي 0.1 M من محلول محلول المعايرة NaOH .
- قم بقياس الرقم الهيدروجيني الأولي للمحلول في دورق Erlenmeyer باستخدام مقياس الأس الهيدروجيني على مقاعد البدلاء قبل بدء المعايرة.
- ابدأ المعايرة بالتحليل الحجمي وقم بقياس الأس الهيدروجيني للمحلول المحلل بعد كل 0.5 مل مضاف جزء من محلول المعايرة.
- قم بتخزين البيانات التجريبية في جدول يحتوي على حجم محلول المعايرة المطبق والقيمة المقابلة للأس الهيدروجيني.
- أوقف المعايرة عند الوصول إلى قيمة ثابتة تقريبا للأس الهيدروجيني عن طريق زيادة حجم محلول المعايرة.
- ارسم البيانات التجريبية في شكل منحنيات معايرة تفاضلية صفرية ومشتقة أولا وثانيا.
- أوجد النقاط المكافئة والأحجام المناظرة لمقايرات المعايرة المستخدمة.
- احسب محتويات المجموعتين الأساسيتين الحمضيتين Aa و Abعلى سطح جسيمات اللجنين غير المحملة والفلافونويد باستخدام المعادلتين (3) و (4):
 ، MGEQ / ز (3)
، MGEQ / ز (3)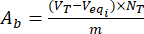 مجيك / ز (4)
مجيك / ز (4)
حيث Veqi هو الحجم المكافئ (مل) ؛ NT الحالة الطبيعية لمحلول المعايرة (mgeqv / mL) ؛ VT حجم محلول المعايرة المستخدم في إجراء التحديد (مل) ؛ م وزن العينة التي تم تحليلها (جم).
- تحديد نقطة الأس الهيدروجيني للشحنة الصفرية (pHPZC) للجسيمات القائمة على اللجنين بطريقة الإضافة الصلبة.
- تحضير 60 مل من محلول مائي 0.1 M من كلوريد الصوديوم.
- أضف 9 مل من محلول كلوريد الصوديوم 0.1 M في كل من القوارير المخروطية الخمس المتقطعة واضبط الأس الهيدروجيني على الرقم الهيدروجينيi = 2 و 4 و 7 و 10 و 12 (حيث i = 1-5 تدل على رقم المحلول المقابل) ، على التوالي عن طريق إضافة 0.1 M HCl أو 0.1 M NaOH. اضبط الحجم الكلي للمحلول في كل قارورة على 10 مل بالضبط عن طريق إضافة محلول كلوريد الصوديوم بنفس القوة.
- أضف 40 مجم من جزيئات اللجنين الجافة (ميكرون / تحت ميكرون غير محملة بالفلافونويد) إلى كل قارورة وقم بتغطية القوارير بإحكام.
- ثبت القوارير في وضع مستقيم على شاكر مداري واحتفظ بها تهتز لمدة 24 ساعة.
- اسمح بالتوازن لمدة 30 دقيقة ثم قم بقياس الرقم الهيدروجيني النهائي (pHf) للطاف في كل قارورة.
- ارسم قيم الأس الهيدروجينيf مقابل قيم الأس الهيدروجيني الأولية المقابلة (pHi).
- يتم تعريف نقطة الشحنة الصفرية (pHPZC) على أنها قيمة الأس الهيدروجيني التي يتقاطع عندها المنحنى ΔpH مقابل pHi مع الخط المستقيم مع الإحداثيات (pHi ؛ pHi).
- تحديد المحتوى الفينولي الكلي (TPC) لجزيئات اللجنين
ملاحظة: يتم تحديد المحتوى الفينولي الكلي (TPC) لجسيمات اللجنين الدقيقة / دون الميكرونية عبر طريقة قياس الألوان Folin-Ciocalteu المعدلة.- امزج 200 ميكرولتر من معلق مائي للجسيمات بتركيز 500 ميكروغرام / مل مع 600 ميكرولتر من الماء عالي النقاء و 200 ميكرولتر من كاشف Folin-Ciocalteu (1: 1 ، v / v).
- بعد 5 دقائق ، أضف 1.0 مل من 8٪ Na2CO3 و 1.0 مل من ماء Milli-Q إلى الخليط واحتضانه في الظلام عند 40 درجة مئوية لمدة 30 دقيقة في حمام مائي مع تحريض متقطع.
- أجهزة الطرد المركزي التعليق في 5300 × غرام لمدة 2 دقيقة.
- تحضير فراغ لا يحتوي على جزيئات.
- نقل 3.5 مل من المادة الطافية في كوفيت كوارتز 10 مم وقياس الامتصاص على مقياس الطيف الضوئي للأشعة المرئية وفوق البنفسجية في المنطقة المرئية عند 760 نانومتر مقابل الفراغ.
- تحضير منحنى معايرة لحمض الغال القياسي باتباع الخطوات 5.3.1-5.3.5 ؛ فقط بدلا من 200 ميكرولتر من معلق جسيمات اللجنين ، استخدم المحلول الإيثانولي لحمض الغال بتركيزات أولية 10 و 20 و 30 و 40 و 50 و 60 و 70 و 80 و 90 و 100 و 150 و 200 ميكروغرام / مل.
- التعبير عن البيانات التجريبية للجسيمات الدقيقة على أنها ملغ من مكافئات حمض الغال بالملليغرام لكل جرام من العينة الجافة (mg GAE / g).
- احسب TPC باستخدام المعادلة (5):
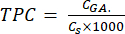 ملغ GAE / ز (5)
ملغ GAE / ز (5)
حيث CGA هو تركيز العينة المكافئ لتركيز حمض الغال القياسي الذي تم الحصول عليه من مخطط معايرة الحمض (μg GA / mL) ؛ Cs هو تركيز العينة ، والذي يساوي كتلة العينة الجافة مقسومة على حجم المذيب (ميكروغرام / مل).
6. تحديد قدرة إطلاق جزيئات اللجنين في المختبر
- قم بإعداد 250 مل من وسط المعدة الخالي من الإنزيم عن طريق ضبط الرقم الهيدروجيني لمحلول PBS القياسي مع 0.1 M HCl إلى pH = 1.2.
- تحضير 250 مل من كل من محلولي السوائل المعوية المحاكيين عن طريق ضبط الرقم الهيدروجيني لمحلول PBS القياسي مع 0.1 M NaOH / 0.1 M HCl إلى الرقم الهيدروجيني = 6.8 و 7.4 ، على التوالي.
- أضف 25 مجم من الجسيمات الدقيقة / تحت الميكرون المغلفة بالفلافونويد إلى 50 مل من وسط المعدة المحاكي الخالي من الإنزيم في مفاعل دفعة زجاجية مزود بمحرك ميكانيكي وضعه في حمام مائي حراري عند درجة حرارة ثابتة T = 37 ± 0.2 درجةمئوية.
- اغمس المحرك على عمق 2/3 من حجم السائل لضمان الخلط الكامل للمرحلتين الصلبة والسائلة وضمان أقصى نقل للكتلة دون مناطق راكدة.
- أخرج 1 مل من العينة من المفاعل كل 10 دقائق حتى 90دقيقة وعلى الفور ماصة 1 مل من محلول سائل محاكاة جديد في المفاعل لمنع تغيير الحجم الكلي ولضمان ظروف الحوض.
- كرر نفس الإجراء بما في ذلك الخطوات 6.3-6.6 مع كل من محاليل السوائل المعوية المحاكية مع درجة الحموضة = 6.8 و 7.4 ، على التوالي ، لمدة 200 دقيقة.
- إجراء تجارب مماثلة مع جزيئات اللجنين غير المحملة في الوسائط المحاكاة الثلاثة واستخدام العينات كفراغات لتصفير مقياس الطيف الضوئي.
- تحديد امتصاص العينات طيفيا بعد ترشيح العينات وتخفيفها بنسبة 96٪ EtOH مقابل العينات الفارغة من الخطوة 6.7 وحساب تركيز الفلافونويد المقابل باستخدام منحنيات المعايرة المقابلة للمورين التي تم الحصول عليها عند الرقم الهيدروجيني = 1.2 و 6.8 و 7.4 على التوالي.
- احسب الإطلاق التراكمي (CR) للبيوفلافونويدس باستخدام المعادلة (6) بالميكروغرام / مل ونسبة الإطلاق التراكمي (CRP) بالمعادلة (7):
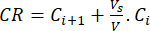 (6)
(6)
حيث Ci و Ci + 1 هي تركيزات مورين / كيرسيتين في العينات ith و (i + 1) th (ميكروغرام / مل) ؛ Vs حجم العينة المأخوذة من مفاعل الدفعات (مل) ؛ V الحجم الكلي للوسائط المحاكاة (مل).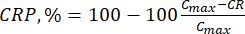 (7)
(7)
حيث Cmax هو أقصى تركيز للمركب النشط بيولوجيا في الناقل (ميكروغرام / مل).
7. التحليلات الإحصائية
- التعبير عن البيانات التجريبية كمتوسط ± الانحرافات المعيارية (SD) لثلاثة قياسات مستقلة.
- تحديد الدلالة الإحصائية للنتائج التجريبية عن طريق إجراء اختبار ANOVA كاختبار لاحق. ضع في اعتبارك قيمة p < 0.05 ذات دلالة إحصائية.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم تنفيذ تقنية الترسيب المضادة للمذيبات لإنتاج جزيئات اللجنين القلوية الدقيقة / دون الميكرونية. تم تشتيت محلول مائي من حمض النيتريك غير العضوي المخفف / حمض الستريك العضوي في محلول مائي من اللجنين القلوي ، المخصب بخافض للتوتر السطحي / الإيثانول الصديق للبيئة ، مما أدى إلى الترسيب التدريجي ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
من بين القضايا الحاسمة الرئيسية لمنهجيات التوليف الحديثة لتصميم تركيبات حاملة للأدوية على أساس البوليمرات الحيوية هو تطبيق الكواشف العضوية الخطرة - المذيبات المتطايرة والقابلة للاشتعال ، مثل رباعي هيدروفوران ، الأسيتون ، الميثانول ، وحتى DMSO بتركيزات عالية - مما يحد من قابليتها للتطبيق ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل الصندوق العلمي البلغاري بموجب العقد رقم KΠ-06 H59/3 والمشروع العلمي رقم 07/2023 FVM ، جامعة تراكيا.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
References
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved