Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Síntesis, caracterización, encapsulación y medición del potencial de liberación de nuevas partículas micro/submicrónicas de lignina alcalina
En este artículo
Resumen
Describimos metodologías novedosas y sencillas de síntesis y caracterización de micro y submicrónicas de lignina biocompatibles. Estas formulaciones proporcionan un enfoque fácil para la utilización del heteropolímero, así como una alternativa para el diseño racional de matrices portadoras multifuncionales con potencial aplicabilidad en biomedicina, tecnología farmacéutica e industria alimentaria.
Resumen
La aplicabilidad de la micro y nanotecnología de biopolímeros en la tecnología humana, veterinaria, farmacéutica y alimentaria está creciendo rápidamente debido al gran potencial de las partículas basadas en biopolímeros como sistemas portadores eficaces. El uso de la lignina como biomatriz básica de heteropolímeros para el diseño de formulaciones micro / submicrónicas innovadoras permite el logro de una mayor biocompatibilidad y ofrece varios grupos funcionales activos que presentan oportunidades para la personalización de las propiedades fisicoquímicas y bioactividades de las formulaciones para diversas aplicaciones. El objetivo del presente estudio fue desarrollar una metodología simple y ecológica para la síntesis de partículas de lignina con tamaño micro y submicrónico; evaluar sus características fisicoquímicas, espectrales y estructurales; y examinar su capacidad para la encapsulación de moléculas biológicamente activas y su potencial para la liberación in vitro de bioflavonoides en medios gastrointestinales simulados. Las metodologías presentadas aplican solventes baratos y verdes; Procesos fáciles, sencillos, rápidos y sensibles que requieren poco equipo, sustancias no tóxicas y métodos sencillos para su caracterización, la determinación de la capacidad de encapsulación hacia los compuestos bioactivos poco solubles en agua morina y quercetina, y el potencial de liberación in vitro de las matrices de lignina.
Introducción
Hoy en día, la inclinación hacia biopolímeros como la celulosa, el quitosano, el colágeno, el dextrano, la gelatina y la lignina como precursores para el diseño de portadores micro/submicrónicos con tamaño, propiedades fisicoquímicas y biofuncionalidades personalizables ha aumentado en las industrias biomédica, farmacéutica y de tecnología alimentaria debido a su aplicabilidad en ingeniería de tejidos, bioimpresión 3D, in vitro plataformas de modelado de enfermedades, industria de empaque, preparación de emulsiones y entrega de nutrientes, entre otros 1,2,3.
Los nuevos estudios destacan los aspectos de los hidrogeles a base de lignina, así como de las micro y nanoformulaciones4 como vehículos ventajosos utilizados para los materiales de envasado de alimentos5, el almacenamiento de energía6, los cosméticos7, los estabilizadores térmicos/ligeros, los materiales reforzados y las matrices portadoras de fármacos8 para la administración de moléculas hidrofóbicas, la mejora de las barreras UV9, como agentes de refuerzo en nanocompuestos, y como alternativa a las nanopartículas inorgánicas debido a algunos problemas de seguridad recientes 10,11,12. La razón detrás de esta tendencia es la biocompatibilidad, biodegradabilidad y no toxicidad del heterobiopolímero natural, así como sus bioactividades comprobadas de potencial antioxidante de lignina y actividades antiproliferativas y antimicrobianas 13,14,15,16,17.
La literatura científica reporta varios métodos para la síntesis (autoensamblaje, precipitación anti-solvente, precipitación ácida y cambio de solvente)18 y la caracterización de formulaciones a micro / nano escala basadas en lignina, incluida la aplicación de solventes costosos o dañinos como tetrahidrofurano (THF), dimetilsulfóxido (DMSO), N,N-dimetilformamida (DMF) y acetona, y procesos complicados, indirectos y tediosos que utilizan una gran cantidad de equipos y sustancias tóxicas 12,19,20.
Para superar estas últimas desventajas, los siguientes protocolos presentan metodologías novedosas para la síntesis de partículas micro/submicrónicas basadas en lignina utilizando disolventes baratos y ecológicos; Procesos fáciles, sencillos, rápidos y sensibles que requieren poco equipo, sustancias no tóxicas y métodos sencillos para su caracterización y la determinación de la capacidad de encapsulación hacia compuestos bioactivos poco solubles en agua y el potencial de liberación in vitro de las matrices de lignina. Los métodos de producción a escala de laboratorio presentados son ventajosos para la fabricación de portadores de lignina funcionales con tamaños ajustables, alta capacidad de encapsulación y comportamiento de liberación in vitro sostenible utilizando procedimientos de caracterización simples y productos químicos ecológicos que pueden encontrar aplicación en diversas áreas de las ciencias biomédicas y la tecnología de los alimentos. Se aplicaron dos flavonoides como moléculas diana encapsuladas en las partículas de lignina: morina, en las micropartículas, y quercetina, en las partículas submicrónicas. La diferencia en las estructuras de ambos flavonoides es solo la posición del segundo grupo -OH en el anillo aromático B: el grupo -OH está en la posición 2' en morina y en la posición 3' en quercetina, por lo que ambos compuestos orgánicos son isómeros posicionales. Este último hecho supone un comportamiento similar de ambos compuestos naturales bioactivos en los procesos de encapsulación y/o liberación.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Síntesis de micropartículas de lignina
- Prepare una solución acuosa de lignina alcalina de 50 mg/ml disolviendo 2,5 g de lignina alcalina en 50 ml de agua ultrapura en un agitador magnético.
- Prepare la solución de Tween 80 al 1% disolviendo 1 mL de Tween 80 en 100 mL de agua ultrapura.
- Prepare una solución 2 M deHNO3 diluyendo 6,65 mL deHNO3 al 67% (densidad = 1,413 g/mL) con agua ultrapura hasta un volumen final de 50 mL.
- Agregue lentamente 15 mL de la solución de Tween 80 al 1% a 50 mL de la solución de lignina alcalina de 50 mg/mL.
- Agite la mezcla en un agitador magnético a 500 rpm durante 10 minutos para que el tensioactivo se disperse bien.
- Añadir 20 mL de 2 M de HNO3 gota a gota con una jeringa a un caudal de aproximadamente 150 μL/s a la mezcla.
- Continúe revolviendo la mezcla durante 30 minutos cuando la solución de color marrón oscuro se transforme en una suspensión de micropartículas de color marrón claro.
- Transfiera la suspensión a tubos de ensayo de 1,5-2 ml y centrifuga durante 30 minutos a 15.000 × g en una ultracentrífuga a 10 °C.
- Recoja el sobrenadante para posteriores análisis y enjuague las micropartículas con agua ultrapura.
- Repita los procedimientos de enjuague/ultracentrifugación 3 veces.
- Sumerja el recipiente con las micropartículas en un baño de hielo antes de la homogeneización ultrasónica.
- Homogeneizar las micropartículas durante 4 min a una intensidad del 93% en un homogeneizador de ultrasonidos.
- Liofilizar las micropartículas a una temperatura de -64 °C en un liofilizador y almacenarlas en un exicador para su uso posterior.
2. Síntesis de partículas submicrónicas de lignina
- Prepare una solución acuosa de lignina alcalina de 5 mg/ml disolviendo 125 mg de lignina alcalina en 25 ml de agua ultrapura en un agitador magnético.
- Agregue lentamente 1 mL de EtOH al 96% a la solución de lignina alcalina.
- Agite la mezcla en un agitador magnético a 500 rpm durante 3 min.
- Prepare 50 mL de una solución al 1% de ácido cítrico disolviendo 0,5 g de ácido cítrico en agua ultrapura hasta un volumen final de 50 mL.
- Añadir 7 mL de ácido cítrico al 1% gota a gota con una jeringa a un caudal de aproximadamente 4 mL/min a la mezcla.
- Continúe revolviendo la mezcla durante 10 minutos cuando la solución marrón clara se transforme en una suspensión turbia de partículas submicrónicas de color marrón claro.
- Transfiera la suspensión a tubos de ensayo y centrifuga durante 30 min a 15.000 × g en una ultracentrífuga a 10 °C.
- Recoja el sobrenadante para posteriores análisis y enjuague las micropartículas con agua ultrapura.
- Repita los procedimientos de enjuague/ultracentrifugación 3 veces.
- Sumerja el recipiente con las micropartículas en un baño de hielo antes de la homogeneización ultrasónica.
- Homogeneizar las micropartículas por ultrasonidos durante dos ciclos de 4 min cada uno a una intensidad del 96% en un homogeneizador de ultrasonidos.
- Enfríe los recipientes durante 1 minuto después del primer ciclo.
- Liofilizar las micropartículas a una temperatura de -64 °C en un liofilizador y almacenarlas en un exicador para su uso posterior.
3. Síntesis de partículas micro/submicrónicas de lignina encapsuladas en flavonoides naturales
- Repita los pasos 1.1-1.5 para las micropartículas.
- Pesar 0,08 g de morina, disolverlo en 1 mL de EtOH y añadir esta solución etanólica a la mezcla.
- Agite la mezcla en un agitador magnético a 500 rpm durante 20 min.
- Añadir 20 mL de 2 N HNO3 gota a gota con una jeringa a un caudal de aproximadamente 150 μL/s a la mezcla.
- Continúa revolviendo la mezcla durante 60 min.
- Repita los pasos 1.8-1.13.
- Repita el paso 2.1 para las partículas submicrónicas.
- Peso 0,04 g de quercetina, disolverla en 1 mL de EtOH y añadir esta solución etanólica a la solución acuosa de lignina alcalina.
- Agite la mezcla en un agitador magnético a 500 rpm durante 10 min.
- Repita los pasos 2.4-2.13.
4. Determinación de la eficiencia de encapsulación de micro-/sumicro-partículas de lignina
- Calcular el contenido de la sustancia bioactiva añadida durante el procedimiento de síntesis de ambos tipos de partículas de lignina encapsuladas en flavonoides.
- Determinar espectrofotométricamente la absorción del flavonoide en el sobrenadante obtenido durante los pasos 1.9 y 2.8 después de diluirlo con EtOH al 96%.
- Calcular la concentración de la morina/quercetina no atrapada utilizando las curvas de calibración de los flavonoides.
- Calcule la eficiencia de encapsulación (EE, %) de las micropartículas de lignina hacia los flavonoides naturales utilizando la ecuación (1):
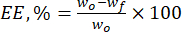 (1)
(1)
Donde wo es la cantidad total de la sustancia bioactiva añadida (mg) y wf es la cantidad de flavonoide libre no atrapado (mg). - Calcule la capacidad de carga del fármaco (DLC, %), un parámetro importante que representa la cantidad de fármaco en las partículas por unidad de peso del sistema portador, utilizando la ec. (2):
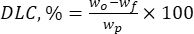 (2)
(2)
Donde wp es la cantidad total (rendimiento) de partículas micro/submicrónicas de lignina obtenidas después de la liofilización (mg).
5. Caracterización de partículas micro y submicrónicas de lignina
- Determinación del número de partículas, tamaño y distribución de tamaño
- Evalúe el tamaño de partícula y la distribución del tamaño de partícula de las muestras utilizando un contador de celdas automático con la opción de recuento de cuentas. Añadir con una micropipeta 1 μL de la suspensión de partículas micro/submicrónicas de lignina/flavonoide en agua ultrapura en el pocillo del portaobjetos de recuento necesario para la operación.
- Espere a que el número de partículas en 1 mL de la suspensión, así como su número y distribución por tamaño se muestren en la pantalla del contador automático de celdas.
NOTA: El aparato permite el almacenamiento de los datos en una memoria flash USB. El software especial de contador automático de células permite el procesamiento posterior de los archivos digitales y fotográficos guardados.
- Determinación del contenido de grupos ácidos/básicos superficiales de partículas de lignina mediante valoración potenciométrica
- Peso: 0,04 g de partículas de lignina descargadas/encapsuladas en flavonoides.
- Transfiéralos a un matraz Erlenmeyer, agregue 10 mL de HCl 0,1 M y coloque el matraz en un agitador magnético a 250 rpm.
- Llene una bureta de 50 mL con una solución estándar de 0,1 M del valorante NaOH.
- Mida el pH inicial de la solución en el matraz Erlenmeyer con un medidor de pH de banco antes de comenzar la valoración.
- Inicie la valoración y mida el pH de la solución analizada después de cada porción añadida de 0,5 mL del valorante.
- Almacene los datos experimentales en una tabla que contenga el volumen del valorante aplicado y el valor correspondiente de pH.
- Detenga la valoración cuando se alcance un valor aproximadamente constante del pH aumentando el volumen de la solución valorante.
- Trace los datos experimentales en forma de curvas de valoración diferencial de cero, primera y segunda derivada.
- Determine los puntos equivalentes y los volúmenes equivalentes correspondientes de los valorantes utilizados.
- Calcule el contenido de los grupos básicos ácidos A,ay A, ben la superficie de las partículas de lignina descargadas y cargadas de flavonoides utilizando las ecuaciones (3) y (4):
 , mgeq/g (3)
, mgeq/g (3)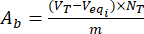 mgeq/g (4)
mgeq/g (4)
Donde Veqi es el volumen equivalente (mL); NT la normalidad del valorante (mgeqv/mL); VT el volumen del valorante utilizado para el procedimiento de determinación (mL); m el peso de la muestra analizada (g).
- Determinación del punto de pH de carga cero (pHPZC) de partículas basadas en lignina por el método de adición de sólidos.
- Prepare 60 mL de solución acuosa 0,1 M de NaCl.
- Añadir 9 mL de la solución de NaCl 0,1 M en cada uno de los cinco matraces cónicos tapados y ajustar el pH a pHi = 2, 4, 7, 10 y 12 (donde i = 1-5 denota el número de la solución correspondiente), respectivamente mediante la adición de 0,1 M de HCl o 0,1 M de NaOH. Ajuste el volumen total de la solución en cada matraz a 10 mL exactamente agregando una solución de NaCl de la misma concentración.
- Añadir 40 mg de partículas secas de lignina (micro/submicrónicas sin carga, cargadas con flavonoides) a cada matraz y tapar los matraces de forma segura.
- Fije los matraces en posición vertical sobre un agitador orbital y manténgalos agitados durante 24 horas.
- Dejar el equilibrio durante 30 min y posteriormente medir el pH final (pHf) de los sobrenadantes de cada matraz.
- Trace los valoresde pH f con los valores de pH iniciales correspondientes (pHi).
- El punto de carga cero (pHPZC) se define como el valor de pH en el que la curva ΔpH frente a pHi cruza la línea recta con coordenadas (pHi; pHi).
- Determinación del contenido fenólico total (TPC) de las partículas de lignina
NOTA: El contenido fenólico total (TPC) de las partículas de lignina micro/submicrónicas se determina mediante un método colorimétrico de Folin-Ciocalteu modificado.- Mezclar 200 μL de una suspensión acuosa de partículas con una concentración de 500 μg/mL con 600 μL de agua ultrapura y 200 μL de reactivo Folin-Ciocalteu (1:1, v/v).
- Después de 5 min, agregue 1,0 mL de 8% Na2CO3 y 1,0 mL de agua Milli-Q a la mezcla e incube en la oscuridad a 40 °C durante 30 min en un baño de agua con agitación intermitente.
- Centrifugar la suspensión a 5.300 × g durante 2 min.
- Prepare un blanco que no contenga partículas.
- Transfiera 3,5 mL del sobrenadante en una cubeta de cuarzo de 10 mm y mida la absorbancia en un espectrofotómetro UV/Vis en la región visible a 760 nm contra el blanco.
- Prepare una curva de calibración del ácido gálico patrón siguiendo los pasos 5.3.1-5.3.5; solo que en lugar de 200 μL de la suspensión de partículas de lignina, utilice la solución etanólica de ácido gálico con concentraciones iniciales de 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 y 200 μg/mL.
- Expresar los datos experimentales de las micropartículas como mg de equivalentes de ácido gálico en miligramos por gramo de muestra seca (mg GAE/g).
- Calcule el TPC usando la ecuación (5):
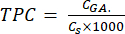 mg GAE/g (5)
mg GAE/g (5)
Donde CGA es la concentración de la muestra equivalente a la concentración del ácido gálico patrón obtenida de la gráfica de calibración del ácido (μg GA/mL); Cs es la concentración de la muestra, que es igual a la masa de la muestra seca dividida por el volumen del disolvente (μg/mL).
6. Determinación de la capacidad de liberación in vitro de las partículas de lignina
- Prepare 250 mL de medio gástrico simulado libre de enzimas ajustando el pH de la solución estándar de PBS con 0,1 M de HCl a pH = 1,2.
- Prepare 250 mL de cada una de las dos soluciones de fluido intestinal simuladas ajustando el pH de la solución estándar de PBS con 0,1 M de NaOH/0,1 M de HCl a pH = 6,8 y 7,4, respectivamente.
- Añadir 25 mg de partículas micro/submicrónicas encapsuladas en flavonoides a 50 mL del medio gástrico libre de enzimas simulado en un reactor discontinuo de vidrio provisto de un agitador mecánico y colocarlo en un baño de agua termal a una temperatura constante de T = 37 ± 0,2 oC.
- Sumerja el agitador a una profundidad de 2/3 del volumen de líquido para asegurar una mezcla completa de las fases sólida y líquida y garantizar la máxima transferencia de masa sin zonas estancadas.
- Extraiga 1 mL de muestra del reactor cada 10 min hasta elminuto 90 e inmediatamente pipetee 1 mL de solución de fluido simulado fresco en el reactor para evitar cambios en el volumen total y garantizar las condiciones de hundimiento.
- Repita el mismo procedimiento incluyendo los pasos 6.3-6.6 con ambas soluciones de fluido intestinal simuladas con pH = 6.8 y 7.4, respectivamente, durante 200 min.
- Realice experimentos análogos con partículas de lignina descargadas en los tres medios simulados y utilice las muestras como blancos para poner a cero el espectrofotómetro.
- Determine la absorción de las muestras espectrofotométricamente después de filtrar las muestras y diluirlas con EtOH al 96% frente a las muestras en blanco del paso 6.7 y calcule la concentración de flavonoides correspondiente utilizando las curvas de calibración correspondientes de morin obtenidas a pH = 1.2, 6.8 y 7.4, respectivamente.
- Calcular la liberación acumulada (RC) de los bioflavonoides utilizando la ecuación (6) en μg/mL y el porcentaje de liberación acumulada (PCR) mediante la ecuación (7):
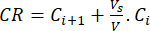 (6)
(6)
Donde Ci y Ci+1 son las concentraciones de morina/quercetina en las muestras iésima y (i+1)ésima (μg/mL); Vs el volumen de muestra tomado del reactor discontinuo (mL); V el volumen total de los medios simulados (mL).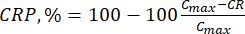 (7)
(7)
Donde Cmax es la concentración máxima del compuesto biológicamente activo en el portador (μg/mL).
7. Análisis estadísticos
- Expresar los datos experimentales como medias ± desviaciones estándar (DE) de tres mediciones independientes.
- Determinar la significación estadística de los resultados experimentales mediante la realización de la prueba de ANOVA como prueba post hoc. Considere un valor de p < 0,05 estadísticamente significativo.
Access restricted. Please log in or start a trial to view this content.
Resultados
Se ejecutó una técnica de precipitación anti-solvente para producir partículas micro y submicrónicas de lignina alcalina. Una solución acuosa de ácido inorgánico-ácido nítrico/ácido orgánico-ácido cítrico diluido se dispersó en una solución acuosa de lignina alcalina, enriquecida con un tensioactivo/etanol respetuoso con el medio ambiente, lo que dio lugar a la precipitación gradual del soluto biopolímero y, tras la sonicación, se produjo finalmente una suspensión de partículas compactas micro/submic...
Access restricted. Please log in or start a trial to view this content.
Discusión
Entre los principales aspectos críticos de las metodologías modernas de síntesis para el diseño de formulaciones de fármacos portadores basados en biopolímeros se encuentra la aplicación de reactivos orgánicos peligrosos -disolventes volátiles e inflamables, como el tetrahidrofurano, la acetona, el metanol e incluso el DMSO en altas concentraciones- lo que limita su aplicabilidad en biomedicina, industria farmacéutica y tecnología alimentaria debido a la manifestación de posibles efectos tóxicos
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este estudio contó con el apoyo del Fondo Científico Búlgaro en virtud del contrato n.º KΠ-06 H59/3 y del proyecto científico n.º 07/2023 FVM, Universidad de Trakia.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Referencias
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados