A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סינתזה ירוקה, אפיון, אנקפסולציה ומדידה של פוטנציאל השחרור של חלקיקי מיקרו-/תת-מיקרון אלקליים ליגנין חדשים
In This Article
Summary
אנו מתארים מתודולוגיות חדשניות ופשוטות של סינתזה ואפיון של חלקיקי ליגנין מיקרו ותת-מיקרון תואמים ביולוגית. ניסוחים אלה מספקים גישה קלה לשימוש בהטרופולימר, כמו גם חלופה לתכנון רציונלי של מטריצות נשא רב תכליתיות עם ישימות פוטנציאלית בביו-רפואה, טכנולוגיה פרמצבטית ותעשיית המזון.
Abstract
הישימות של מיקרו-/ ננו-טכנולוגיה ביופולימרית ברפואה אנושית, וטרינרית, פרמצבטית וטכנולוגיית מזון גדלה במהירות בשל הפוטנציאל הגדול של חלקיקים מבוססי ביופולימרים כמערכות נשא יעילות. השימוש בליגנין כביומטריצה הטרופולימרית בסיסית לתכנון פורמולציות מיקרו/תת-מיקרון חדשניות מאפשר השגת תאימות ביולוגית מוגברת ומציע לקבוצות פונקציונליות פעילות שונות המציגות הזדמנויות להתאמה אישית של התכונות הפיזיקוכימיות והביו-פעילויות של הפורמולציות ליישומים מגוונים. מטרת המחקר הנוכחי הייתה לפתח מתודולוגיה פשוטה וידידותית לסביבה לסינתזה של חלקיקי ליגנין בגודל מיקרו ותת-מיקרון; להעריך את המאפיינים הפיזיקוכימיים, הספקטרליים והמבניים שלהם; ולבחון את יכולתם לאנקפסולציה של מולקולות פעילות ביולוגית ואת הפוטנציאל לשחרור חוץ גופי של ביופלבנואידים במדיה מדומה של מערכת העיכול. המתודולוגיות המוצגות מיישמות ממיסים זולים וירוקים; תהליכים קלים, פשוטים, מהירים ורגישים הדורשים מעט ציוד, חומרים לא רעילים ושיטות פשוטות לאפיונם, קביעת יכולת האנקפסולציה כלפי התרכובות הביו-אקטיביות המסיסות במים מורין וקוורצטין, ופוטנציאל השחרור במבחנה של מטריצות הליגנין.
Introduction
כיום הנטייה לביופולימרים כגון תאית, צ'יטוזן, קולגן, דקסטרן, ג'לטין וליגנין כמבשרי תכנון של נשאי מיקרו/תת-מיקרון בעלי גודל, תכונות פיסיקוכימיות ופונקציות ביולוגיות הניתנים להתאמה אישית גדלה בתעשיות הביו-רפואיות, התרופות וטכנולוגיית המזון בשל יישומם בהנדסת רקמות, הדפסה ביולוגית תלת-ממדית, במבחנה פלטפורמות מידול מחלות, תעשיית אריזות, הכנת תחליב ואספקת חומרים מזינים בין היתר 1,2,3.
מחקרים חדשניים מדגישים את ההיבטים של הידרוג'לים מבוססי ליגנין, כמו גם מיקרו וננו-פורמולציות4 ככלי יתרון המשמשים לחומרי אריזה למזון5, אחסון אנרגיה6, קוסמטיקה7, מייצבי חום/אור, חומרים מחוזקים ומטריצות נושאות תרופות8 להעברת מולקולות הידרופוביות, שיפור מחסומי UV9כחומרים מחזקים בננו-מרוכבים, וכחלופה לננו-חלקיקים אנאורגניים עקב כמה בעיות בטיחות אחרונות 10,11,12., הסיבה מאחורי נטייה זו היא התאימות הביולוגית, יכולת ההתכלות הביולוגית ואי-הרעילות של הביופולימר ההטרו הטבעי, כמו גם הפעילות הביולוגית המוכחת שלו של פוטנציאל נוגד חמצון ליגנין ופעילות רדיקלית, אנטי-שגשוגית ואנטי-מיקרוביאלית 13,14,15,16,17.
הספרות המדעית מדווחת על שיטות שונות לסינתזה (הרכבה עצמית, משקעים נגד ממסים, משקעים חומציים והסטת ממסים)18 ואפיון של פורמולציות מיקרו/ננו-בקנה מידה מבוססות ליגנין, כולל יישום של ממסים יקרים או מזיקים כגון טטרהידרופורן (THF), דימתיל סולפוקסיד (DMSO), N,N-דימתילפורממיד (DMF) ואצטון, ותהליכים מסובכים, עקיפים ומייגעים המשתמשים בציוד רב ובחומרים רעילים 12,19,20.
כדי להתגבר על החסרונות האחרונים, הפרוטוקולים הבאים מציגים מתודולוגיות חדשניות לסינתזה של חלקיקי מיקרו/תת-מיקרון מבוססי ליגנין באמצעות ממיסים זולים וירוקים; תהליכים קלים, פשוטים, מהירים ורגישים הדורשים מעט ציוד, חומרים לא רעילים ושיטות פשוטות לאפיונם ולקביעת יכולת האנקפסולציה של תרכובות ביו-אקטיביות המסיסות במים ופוטנציאל שחרור במבחנה של מטריצות הליגנין. שיטות הייצור המוצגות בקנה מידה מעבדתי מהוות יתרון לייצור נשאי ליגנין פונקציונליים בעלי גדלי כוונון, יכולת אנקפסולציה גבוהה והתנהגות שחרור חוץ גופית בת קיימא תוך שימוש בהליכי אפיון פשוטים וכימיקלים ידידותיים לסביבה שיכולים למצוא יישום בתחומים שונים של מדעים ביו-רפואיים וטכנולוגיית מזון. שני פלבנואידים יושמו כמולקולות מטרה העטופות בחלקיקי הליגנין: מורין - לתוך המיקרו-חלקיקים, וקוורצטין - לתוך החלקיקים התת-מיקרוניים. ההבדל במבנים של שני הפלבנואידים הוא רק המיקום של קבוצת -OH השנייה בטבעת הארומטית B: קבוצת -OH נמצאת במיקום 2' במורין ובמיקום 3' בקוורצטין, ולכן שתי התרכובות האורגניות הן איזומרים מיקום. העובדה האחרונה מניחה התנהגות דומה של שתי התרכובות הטבעיות הביו-אקטיביות בתהליכי האנקפסולציה ו/או השחרור.
Protocol
1. סינתזה של מיקרו-חלקיקי ליגנין
- הכינו תמיסה מימית של ליגנין אלקלי במינון 50 מ"ג/מ"ל על ידי המסת 2.5 גרם ליגנין אלקלי ב-50 מ"ל מים אולטרה-טהורים על מערבל מגנטי.
- הכן תמיסת טווין 80 1% על ידי המסת 1 מ"ל של טווין 80 ב 100 מ"ל של מים טהורים במיוחד.
- הכינו תמיסה של 2 M של HNO3 על ידי דילול 6.65 מ"ל של 67% HNO3 (צפיפות = 1.413 גרם / מ"ל) עם מים טהורים במיוחד לנפח סופי של 50 מ"ל.
- הוסף באיטיות 15 מ"ל של תמיסת 1% Tween 80 ל- 50 מ"ל של תמיסת ליגנין אלקלית 50 מ"ג/מ"ל.
- מערבבים את התערובת על מערבל מגנטי במהירות 500 סל"ד למשך 10 דקות, כך שחומר פעילי השטח מתפזר היטב.
- מוסיפים 20 מ"ל של 2 M HNO3 טיפה עם מזרק בקצב זרימה של כ 150 μL/s לתערובת.
- המשיכו לערבב את התערובת במשך 30 דקות כאשר התמיסה החומה הכהה הופכת לתרחיף חום בהיר של מיקרו-חלקיקים.
- מעבירים את המתלה למבחנות 1.5-2 מ"ל וצנטריפוגה למשך 30 דקות ב-15,000 × גרם באולטרה-צנטריפוגה ב-10°C.
- אספו את הסופרנאטנט לניתוחים נוספים ושטפו את המיקרו-חלקיקים במים טהורים במיוחד.
- חזור על הליכי השטיפה/אולטרה-צנטריפוגה 3x.
- טבלו את המיכל עם המיקרו-חלקיקים באמבט קרח לפני ההומוגניזציה העל-קולית.
- הומוגניזציה של המיקרו-חלקיקים למשך 4 דקות בעוצמה של 93% על הומוגנייזר אולטרסאונד.
- Lyophilize microparticles בטמפרטורה של -64 ° C במייבש להקפיא ולאחסן אותם exicator לשימוש נוסף.
2. סינתזה של חלקיקי ליגנין תת-מיקרון
- הכינו תמיסה מימית של ליגנין אלקלי במינון 5 מ"ג/מ"ל על ידי המסת 125 מ"ג ליגנין אלקלי ב-25 מ"ל מים אולטרה-טהורים על מערבל מגנטי.
- הוסף באיטיות 1 מ"ל של 96% EtOH לתמיסת ליגנין אלקלי.
- מערבבים את התערובת על מערבל מגנטי במהירות 500 סל"ד למשך 3 דקות.
- להכין 50 מ"ל של תמיסה 1% של חומצת לימון על ידי המסת 0.5 גרם של חומצת לימון במים טהורים במיוחד לנפח הסופי של 50 מ"ל.
- מוסיפים לתערובת 7 מ"ל של חומצת לימון 1% עם מזרק בקצב זרימה של כ-4 מ"ל/דקה.
- ממשיכים לערבב את התערובת במשך 10 דקות כאשר התמיסה השחומה והצלולה תהפוך לתרחיף חום בהיר עכור של חלקיקים תת-מיקרוניים.
- העבירו את המתלה למבחנות ולצנטריפוגות למשך 30 דקות בטמפרטורה של 15,000 × גרם באולטרה-צנטריפוגה בטמפרטורה של 10°C.
- אספו את הסופרנאטנט לניתוחים נוספים ושטפו את המיקרו-חלקיקים במים טהורים במיוחד.
- חזור על הליכי השטיפה/אולטרה-צנטריפוגה 3x.
- טבלו את המיכל עם המיקרו-חלקיקים באמבט קרח לפני ההומוגניזציה העל-קולית.
- הומוגניזציה של המיקרו-חלקיקים באופן אולטרה-סאונד במשך שני מחזורים של 4 דקות כל אחד בעוצמה של 96% בהומוגנייזר אולטרסאונד.
- מצננים את המיכלים למשך דקה לאחר המחזור הראשון.
- Lyophilize microparticles בטמפרטורה של -64 ° C במייבש להקפיא ולאחסן אותם exicator לשימוש נוסף.
3. סינתזה של חלקיקי מיקרו-/תת-מיקרון טבעיים של ליגנין עטוף פלבונואידים
- חזור על שלבים 1.1-1.5 עבור המיקרו-חלקיקים.
- שוקלים 0.08 גרם של מורין, ממיסים אותו ב 1 מ"ל של EtOH, ומוסיפים תמיסה אתנולית זו לתערובת.
- מערבבים את התערובת על מערבל מגנטי במהירות 500 סל"ד למשך 20 דקות.
- מוסיפים לתערובת 20 מ"ל של 2 N HNO3 עם מזרק בקצב זרימה של כ-150 מיקרוליטר/שנייה.
- ממשיכים לערבב את התערובת במשך 60 דקות.
- חזור על שלבים 1.8-1.13.
- חזור על שלב 2.1 עבור החלקיקים התת-מיקרוניים.
- משקל 0.04 גרם של קוורצטין, להמיס אותו ב 1 מ"ל EtOH ולהוסיף תמיסה אתנולית זו לתמיסה מימית ליגנין אלקלי.
- מערבבים את התערובת על מערבל מגנטי במהירות 500 סל"ד למשך 10 דקות.
- חזור על שלבים 2.4-2.13.
4. קביעת יעילות האנקפסולציה של חלקיקי ליגנין מיקרו/סומיקרו
- חשב את התוכן של החומר הביו-אקטיבי שנוסף במהלך הליך הסינתזה של שני סוגי חלקיקי ליגנין עטופים בפלבונואידים.
- לקבוע ספקטרופוטומטרית את ספיגת הפלבנואיד בסופרנאטנט המתקבל במהלך שלבים 1.9 ו-2.8 לאחר דילול שלו עם 96% EtOH.
- חשב את ריכוז המורין/קוורצטין הלא כלוא באמצעות עקומות הכיול של הפלבנואידים.
- חשב את יעילות האנקפסולציה (EE, %) של חלקיקי הליגנין כלפי הפלבנואידים הטבעיים באמצעות משוואה (1):
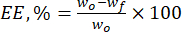 (1)
(1)
כאשר wo היא הכמות הכוללת של החומר הביו-אקטיבי שנוסף (mg) ו-wf היא כמות הפלבנואיד החופשי שאינו כלוא (mg). - חשב את קיבולת טעינת התרופה (DLC, %) - פרמטר חשוב המייצג את כמות התרופה בחלקיקים ליחידת משקל של מערכת המוביל - באמצעות eq. (2):
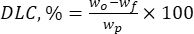 (2)
(2)
כאשר wp היא הכמות הכוללת (התשואה) של חלקיקי ליגנין מיקרו-/תת-מיקרון המתקבלים לאחר ליופיליזציה (mg).
5. אפיון חלקיקי ליגנין מיקרו ותת-מיקרון
- קביעת מספר חלקיקים, גודל והתפלגות גודל
- הערך את גודל החלקיקים ואת התפלגות גודל החלקיקים של הדגימות באמצעות מונה תאים אוטומטי עם אפשרות לספירת חרוזים. יש להוסיף עם מיקרופיפטה 1 μL של חלקיקי ליגנין/פלבנואיד מיקרו-/תת-מיקרון המתרחפים במים אולטרה-טהורים בבאר של שקופית הספירה הנדרשת לפעולה.
- המתן למספר החלקיקים ב -1 מ"ל של ההשעיה, כמו גם מספרם והתפלגותם לפי גודל שיוצגו בתצוגה של מונה התא האוטומטי.
הערה: המנגנון מאפשר אחסון הנתונים על הבזק USB. מונה התא האוטומטי תוכנה מיוחדת מאפשרת עיבוד נוסף של הקבצים הדיגיטליים והתמונות שנשמרו.
- קביעת התוכן של קבוצות חומציות/בסיסיות של חלקיקי ליגנין על ידי טיטרציה פוטנציומטרית
- משקל: 0.04 גרם של חלקיקי ליגנין לא טעונים/עטופים בפלבונואידים.
- מעבירים אותם לצלוחית ארלנמאייר, מוסיפים 10 מ"ל של 0.1 M HCl, ומניחים את הבקבוק על מערבל מגנטי ב-250 סל"ד.
- מלאו בורט 50 מ"ל בתמיסה סטנדרטית של 0.1 מ' של הטיטרנט NaOH.
- למדוד את ה- pH הראשוני של התמיסה בבקבוק Erlenmeyer עם מד pH ספסל לפני תחילת הטיטרציה.
- התחל את הטיטרציה ומדוד את ה- pH של התמיסה המנותחת לאחר כל תוספת של 0.5 מ"ל חלק מהטיטראנט.
- אחסן את נתוני הניסוי בטבלה המכילה את נפח הטיטרנט שהוחל ואת הערך המתאים של pH.
- עצור את הטיטרציה כאשר מגיעים לערך קבוע בקירוב של ה- pH על ידי הגדלת נפח תמיסת הטיטרנט.
- התווה את נתוני הניסוי בצורה של עקומות טיטרציה דיפרנציאליות אפס, ראשונה ושנייה.
- קבע את הנקודות השקוות ואת הנפחים המקבילים המתאימים של הטיטראנטים שבהם נעשה שימוש.
- חשב את התוכן של הקבוצות הבסיסיות החומציות A, aו - Abעל פני השטח של חלקיקי ליגנין פרוקים וטעונים בפלבונואידים באמצעות משוואות (3) ו- (4):
 MGEQ/גרם (3),
MGEQ/גרם (3),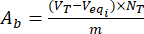 מגק/גרם (4)
מגק/גרם (4)
כאשר Veqi הוא הנפח המקביל (mL); NT את הנורמליות של titrant (mgeqv / mL); VT נפח הטיטרנט המשמש להליך הקביעה (מ"ל); מ משקל המדגם המנותח (G).
- קביעת נקודת ה-pH של מטען אפס (pHPZC) של חלקיקים מבוססי ליגנין בשיטת החיבור המוצק.
- להכין 60 מ"ל של 0.1 M תמיסה מימית של NaCl.
- הוסף 9 מ"ל של תמיסת 0.1 M NaCl בכל אחת מחמש צלוחיות חרוטיות עצורות והתאם את ה- pH ל- pHi = 2, 4, 7, 10 ו- 12 (כאשר i = 1-5 מציין את מספר התמיסה המתאימה), בהתאמה על ידי תוספת של 0.1 M HCl או 0.1 M NaOH. התאם את הנפח הכולל של התמיסה בכל בקבוק ל -10 מ"ל בדיוק על ידי הוספת תמיסת NaCl באותו כוח.
- הוסיפו 40 מ"ג של חלקיקי ליגנין יבשים (מיקרו-/תת-מיקרון טעונים בפלבונואיד) לכל בקבוק וסגרו היטב את הצלוחיות.
- אבטחו את הצלוחיות זקופות על שייקר מסלולי, והשאירו אותן רועדות במשך 24 שעות.
- אפשר שיווי משקל למשך 30 דקות ולאחר מכן מדוד את ה- pH הסופי (pHf) של הסופרנאטנטים בכל בקבוק.
- התווה ערכי pHf כנגד ערכי ה- pH הראשוניים המתאימים (pHi).
- נקודת האפס (pHPZC) מוגדרת כערך ה-pH שבו העקומה ΔpH לעומת pHi חותכת את הקו הישר עם קואורדינטות (pHi; pHi).
- קביעת התוכן הפנולי הכולל (TPC) של חלקיקי ליגנין
הערה: התוכן הפנולי הכולל (TPC) של חלקיקי ליגנין מיקרו-/תת-מיקרון נקבע באמצעות שיטה קולורימטרית Folin-Ciocalteu שונה.- מערבבים 200 μL של תרחיף מימי של חלקיקים עם ריכוז של 500 מיקרוגרם / מ"ל עם 600 μL של מים טהורים במיוחד ו 200 μL של מגיב Folin-Ciocalteu (1: 1, v/v).
- לאחר 5 דקות, הוסיפו 1.0 מ"ל של 8% Na2CO3 ו-1.0 מ"ל של מי מילי-Q לתערובת ודגרו עליהם בחושך ב-40°C למשך 30 דקות באמבט מים עם תסיסה לסירוגין.
- צנטריפוגה את המתלים ב 5,300 × גרם למשך 2 דקות.
- הכינו ריק שאינו מכיל חלקיקים.
- מעבירים 3.5 מ"ל של הסופרנאטנט בקובט קוורץ 10 מ"מ ומודדים את הספיגה בספקטרופוטומטר UV/Vis באזור הנראה ב-760 ננומטר כנגד החסר.
- הכינו עקומת כיול של החומצה הגאלית הסטנדרטית לפי השלבים 5.3.1-5.3.5; רק במקום 200 μL של השעיית חלקיקי ליגנין, השתמש בתמיסה אתנולית של חומצה גאלית עם ריכוזים התחלתיים של 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 ו 200 מיקרוגרם / מ"ל.
- בטא את נתוני הניסוי של המיקרו-חלקיקים כ-mg של חומצה גאלית שווה ערך במיליגרם לגרם של דגימה יבשה (mg GAE/g).
- חישוב TPC באמצעות משוואה (5):
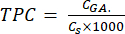 מ"ג GAE/גרם (5)
מ"ג GAE/גרם (5)
כאשר CGA הוא ריכוז הדגימה שווה ערך לריכוז החומצה הגאלית הסטנדרטית המתקבלת מחלקת הכיול של החומצה (μg GA/mL); Cs הוא ריכוז הדגימה, השווה למסת הדגימה היבשה חלקי נפח הממס (מק"ג/מ"ל).
6. קביעת יכולת השחרור במבחנה של חלקיקי ליגנין
- הכן 250 מ"ל של מדיום קיבה מדומה ללא אנזימים על ידי התאמת ה- pH של תמיסת PBS סטנדרטית עם 0.1 M HCl ל- pH = 1.2.
- הכן 250 מ"ל של כל אחת משתי תמיסות נוזלי המעי המדומות על ידי התאמת ה- pH של תמיסת PBS סטנדרטית עם 0.1 M NaOH / 0.1 M HCl ל- pH = 6.8 ו- 7.4, בהתאמה.
- הוסף 25 מ"ג של חלקיקי מיקרו-/תת-מיקרון בעטוף פלבונואיד ל-50 מ"ל של תווך קיבה מדומה נטול אנזימים בכור אצווה מזכוכית המסופק עם מערבל מכני והכנס אותו לאמבט מים תרמיים בטמפרטורה קבועה של T = 37 ± 0.2 oC.
- טובלים את המערבל לעומק של 2/3 מנפח הנוזל כדי להבטיח ערבוב מלא של הפאזה המוצקה והנוזלית ולהבטיח העברת מסה מקסימלית ללא אזורים עומדים.
- הוציאו 1 מ"ל דגימה מהכור כל 10 דקות עד לדקהה-90 ומיד פיפטה 1 מ"ל של תמיסת נוזלים מדומה טרייה לתוך הכור כדי למנוע שינוי בנפח הכולל ולהבטיח תנאי כיור.
- חזור על אותו הליך כולל שלבים 6.3-6.6 עם שתי תמיסות נוזל המעי המדומות עם pH = 6.8 ו- 7.4, בהתאמה, למשך 200 דקות.
- בצע ניסויים מקבילים עם חלקיקי ליגנין שנפרקו בשלושת המדיות המדומות והשתמש בדגימות כריקות לאפס את הספקטרופוטומטר.
- קבע את ספיגת הדגימות באופן ספקטרופוטומטרי לאחר סינון הדגימות ודילולן עם 96% EtOH כנגד הדגימות הריקות משלב 6.7 וחשב את ריכוז הפלבנואידים המתאים באמצעות עקומות הכיול המתאימות של מורין המתקבלות ב- pH = 1.2, 6.8 ו- 7.4, בהתאמה.
- חשב את השחרור המצטבר (CR) של הביופלבנואידים באמצעות משוואה (6) במק"ג/מ"ל ואחוז השחרור המצטבר (CRP) לפי משוואה (7):
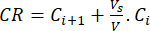 (6)
(6)
כאשר Ci ו- Ci+1 הם ריכוזי מורין/קוורצטין בדגימות ith ו- (i+1)th (μg/mL); Vs נפח הדגימה שנלקח מכור האצווה (מ"ל); V הנפח הכולל של המדיה המדומה (mL).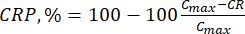 (7)
(7)
כאשר Cmax הוא הריכוז המרבי של החומר הפעיל ביולוגית בנשא (מיקרוגרם / מ"ל).
7. ניתוחים סטטיסטיים
- לבטא את נתוני הניסוי כאמצעי ± סטיות תקן (SD) של שלוש מדידות בלתי תלויות.
- לקבוע את המובהקות הסטטיסטית של תוצאות הניסוי על ידי ביצוע מבחן ANOVA כמבחן פוסט-הוק. שקול ערך של p < 0.05 מובהק סטטיסטית.
תוצאות
טכניקה נגד משקעים ממסים בוצעה כדי לייצר חלקיקי מיקרו / תת-מיקרון ליגנין אלקליים. תמיסה מימית של חומצה אנאורגנית-חומצה חנקתית/חומצה אורגנית-חומצת לימון פוזרה לתמיסה מימית של ליגנין אלקלי, מועשרת בסורפקטנט/אתנול ידידותי לסביבה, מה שהביא למשקעים הדרגתיים של המומס הביופולימרי, ולאחר סוניקצי?...
Discussion
בין הנושאים הקריטיים העיקריים של מתודולוגיות סינתזה מודרניות לתכנון פורמולציות נושאות תרופות המבוססות על ביופולימרים הוא יישום ריאגנטים אורגניים מסוכנים - ממיסים נדיפים ודליקים, כגון טטרהידרופורן, אצטון, מתנול ואפילו DMSO בריכוזים גבוהים - המגביל את תחולתם בביו-רפואה, בתעשיית התרופות ובט...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
מחקר זה נתמך על ידי הקרן המדעית הבולגרית תחת חוזה מספר KΠ-06 H59/3 ועל ידי פרויקט מדעי מס '07/2023 FVM, אוניברסיטת טרקיה.
Materials
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
References
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -. A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041 (2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -. T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592 (2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573 (2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070 (2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793 (2023).
- Gala Morena, A., Tzanov, T. z. Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705 (2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067 (2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650 (2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -. L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487 (2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), 2471 (2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367 (2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52 (2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31 (2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031 (2020).
- Yaneva, Z., Georgieva, N., Grumezescu, A. M. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. , 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved