このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
新規アルカリリグニンマイクロ/サブミクロン粒子のグリーン合成、特性評価、カプセル化、および放出電位の測定
要約
生体適合性のあるリグニンマイクロおよびサブミクロン粒子の合成と特性評価の新しい簡単な方法について説明します。これらの製剤は、ヘテロポリマーを利用するための容易なアプローチを提供するだけでなく、生物医学、製薬技術、および食品産業への適用性が期待できる多機能キャリアマトリックスの合理的な設計の代替手段を提供します。
要約
ヒト、獣医学、製薬、および食品技術におけるバイオポリマーマイクロ/ナノテクノロジーの適用可能性は、効果的なキャリアシステムとしてのバイオポリマーベースの粒子の大きな可能性により急速に成長しています。革新的なマイクロ/サブミクロン製剤の設計のための基本的なヘテロポリマーバイオマトリックスとしてリグニンを使用することで、生体適合性の向上を達成でき、さまざまな活性官能基を提供し、さまざまな用途向けに製剤の物理化学的特性と生物活性をカスタマイズする機会を提供します。本研究の目的は、マイクロミクロンおよびサブミクロンサイズのリグニン粒子を合成するためのシンプルで環境に優しい方法論を開発することでした。それらの物理化学的、スペクトル的、および構造的特性を評価すること。また、生物学的に活性な分子をカプセル化する能力と、シミュレートされた胃腸培地でのバイオフラボノイドの in vitro 放出の可能性を調べること。提示された方法論は、安価で環境に優しい溶媒を適用します。簡単な、わかりやすい、迅速で感度の高いプロセスで、わずかな機器、無毒の物質、およびそれらの特性評価、難水溶性の生理活性化合物であるモリンとケルセチンに対するカプセル化能力の決定、リグニンマトリックスの in vitro 放出の可能性など、簡単な方法が必要です。
概要
今日では、セルロース、キトサン、コラーゲン、デキストラン、ゼラチン、リグニンなどの生体高分子が、カスタマイズ可能なサイズ、物理化学的特性、および生体機能性を備えたマイクロ/サブミクロン担体を設計するための前駆体として、組織工学、3Dバイオプリンティング、in vitroでの適用性により、生物医学、製薬、および食品技術業界で増加しています疾患モデリングプラットフォーム、包装産業、エマルジョン調製、栄養素送達など1,2,3.
新しい研究は、食品包装材料5、エネルギー貯蔵6、化粧品7、疎水性分子の送達のための熱/光安定剤、強化材料、および薬物担体マトリックス8、UVバリアの改善9に使用される有利な媒体として、リグニンベースのハイドロゲルおよびマイクロおよびナノ製剤4の側面を強調しています、ナノ複合材料の強化剤として、および最近のいくつかの安全性の問題による無機ナノ粒子の代替として10,11,12。この傾向の背後にある理由は、天然ヘテロ生体高分子の生体適合性、生分解性、および非毒性、ならびにリグニン-抗酸化能およびラジカル捕捉活性、抗増殖活性、および抗菌活性の証明された生物活性である13,14,15,16,17。
科学文献では、テトラヒドロフラン(THF)、ジメチルスルホキシド(DMSO)、N、N-ジメチルホルムアミド(DMF)、アセトンなどの高価で有害な溶媒の適用、および多くの機器と有毒物質を使用する複雑で間接的で退屈なプロセスを含む、リグニンベースのマイクロ/ナノスケール製剤の特性評価のためのさまざまな方法(自己組織化、抗溶媒沈殿、酸沈殿、溶媒シフト)18、およびリグニンベースのマイクロ/ナノスケール製剤の特性評価が報告されています12、19,20。
後者の欠点を克服するために、以下のプロトコルは、安価でグリーンな溶媒を使用してリグニンベースのマイクロ/サブミクロン粒子を合成するための新しい方法論を提示します。簡単な、わかりやすく、迅速で、敏感なプロセスで、わずかな機器、無毒の物質、およびそれらの特性評価と、難水溶性の生理活性化合物に対するカプセル化能力とリグニンマトリックスの in vitro 放出電位の決定のための簡単な方法が必要です。提示されたラボスケールの製造方法は、生物医科学や食品技術のさまざまな分野で応用できる簡単な特性評価手順と環境に優しい化学物質を利用して、調整可能なサイズ、高いカプセル化能力、および持続可能な in vitro 放出挙動を備えた機能性リグニン担体の製造に有利です。リグニン粒子にカプセル化された標的分子として、モリンを微粒子に、ケルセチンをサブミクロン粒子に、2つのフラボノイドを適用しました。両方のフラボノイドの構造の違い B-芳香族環の2番目の-OH基の位置だけです:-OH基はモリンの2'位とケルセチンの3'位にあるため、両方の有機化合物は位置異性体です。後者の事実は、カプセル化および/または放出の過程における両方の生理活性天然化合物の同様の挙動を推定する。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. リグニン微粒子の合成
- マグネチックスターラーで50 mLの超純水に2.5 gのアルカリリグニンを溶解し、50 mg/mLのアルカリリグニン水溶液を調製します。
- 1 mLのTween 80を100 mLの超純水に溶解して、1%Tween 80溶液を調製します。
- 6.65 mLの67% HNO3(密度= 1.413 g/mL)を超純水で希釈し、最終容量50 mLまで希釈して、HNO3の2 M溶液を調製します。
- 1% Tween 80溶液15 mLを50 mg/mLアルカリリグニン溶液50 mLにゆっくりと加えます。
- 界面活性剤が十分に分散するように、500rpmで10分間マグネチックスターラーで混合物を攪拌します。
- 20 mLの2 M HNO3 をシリンジで約150 μL/sの流速で滴下して混合物に加えます。
- 暗褐色の溶液が微粒子の薄茶色の懸濁液に変換されるときに、混合物を30分間攪拌し続けます。
- 懸濁液を1.5〜2mLの試験管に移し、10°Cの超遠心分離機で15,000× g で30分間遠心分離します。
- さらなる分析のために上清を収集し、微粒子を超純水ですすいでください。
- すすぎ/超遠心分離手順を3回繰り返します。
- 超音波均質化の前に、微粒子を含む容器を氷浴に浸します。
- 超音波ホモジナイザーで93%の強度で4分間微粒子をホモジナイズします。
- 微粒子を凍結乾燥機で-64°Cの温度で凍結乾燥し、さらに使用するためにエキシケーターに保管します。
2. リグニンサブミクロン粒子の合成
- マグネチックスターラーでアルカリリグニン125mgを超純水25mLに溶解し、5mg/mLのアルカリリグニン水溶液を調製します。
- アルカリリグニン溶液に96%EtOH1mLをゆっくりと加えます。
- マグネチックスターラーで500rpmで3分間攪拌します。
- クエン酸0.5gを超純水に溶解し、最終容量50mLまでクエン酸1%溶液50mLを調製します。
- 7 mLの1%クエン酸をシリンジで約4 mL / minの流速で滴下して混合物に加えます。.
- 茶色の透明な溶液がサブミクロン粒子の濁った薄茶色の懸濁液に変わるまで、混合物を10分間攪拌し続けます。
- 懸濁液を試験管に移し、10°Cの超遠心分離機で15,000 × g で30分間遠心分離します。
- さらなる分析のために上清を収集し、微粒子を超純水ですすいでください。
- すすぎ/超遠心分離手順を3回繰り返します。
- 超音波均質化の前に、微粒子を含む容器を氷浴に浸します。
- 超音波ホモジナイザーで96%の強度でそれぞれ4分間の2サイクルでマイクロ粒子を超音波でホモジナイズする。
- 最初のサイクルの後、容器を1分間冷却します。
- 微粒子を凍結乾燥機で-64°Cの温度で凍結乾燥し、さらに使用するためにエキシケーターに保管します。
3. 天然フラボノイド内包リグニンマイクロ/サブミクロン粒子の合成
- 微粒子について手順1.1〜1.5を繰り返します。
- 0.08gのモリンを秤量し、1mLのEtOHに溶解し、このエタノール溶液を混合物に加える。
- マグネチックスターラーで500rpmで20分間混合液を撹拌します。
- 20 mLの2 N HNO3 をシリンジで約150 μL/sの流速で滴下します。
- 混合物を60分間攪拌し続けます。
- 手順1.8〜1.13を繰り返します。
- サブミクロン粒子について手順2.1を繰り返します。
- ケルセチン0.04gを重量で、1mLのEtOHに溶解し、このエタノール溶液をアルカリリグニン水溶液に加える。
- マグネチックスターラーで500rpmで10分間混合物を攪拌します。
- 手順2.4〜2.13を繰り返します。
4. リグニン微小・超微粒子の内包効率の決定
- 両方のタイプのフラボノイドカプセル化リグニン粒子の合成手順中に添加された生理活性物質の含有量を計算します。
- 96%EtOHで希釈した後、ステップ1.9および2.8で得られた上清中のフラボノイドの吸収を分光光度法で測定します。
- フラボノイドの検量線を用いて、非捕捉モラン/ケルセチンの濃度を計算します。
- 式(1)を使用して、天然フラボノイドに対するリグニン微粒子のカプセル化効率(EE、%)を計算します。
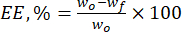 (1)
(1)
ここで、wo は添加された生理活性物質の総量(mg)であり、wf は遊離非捕捉フラボノイドの量(mg)である。 - 式(2)を使用して、薬物負荷容量(DLC、%)-担体系の単位重量あたりの粒子中の薬物の量を表す重要なパラメーター-を計算します。
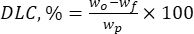 (2)
(2)
ここで、wp は凍結乾燥後に得られるリグニンマイクロ/サブミクロン粒子の総量(収率)(mg)です。
5. リグニンマイクロおよびサブミクロン粒子の特性評価
- 粒子数、サイズ、サイズ分布の決定
- ビーズカウントのオプションを備えた自動セルカウンターを使用して、サンプルの粒子サイズと粒子サイズ分布を評価します。マイクロピペットで、操作に必要な計数スライドのウェル内の超純水中にリグニン/フラボノイドマイクロ/サブミクロン粒子懸濁液1μLを加えます。
- 懸濁液1mL中の粒子数、およびそれらの数とサイズごとの分布が自動セルカウンターのディスプレイに表示されるのを待ちます。
注意: この装置では、USBフラッシュにデータを保存できます。自動セルカウンター専用ソフトウェアにより、保存されたデジタルファイルや写真ファイルをさらに処理することができます。
- 電位差滴定によるリグニン粒子の表面酸性/塩基基の含有量の測定
- 重量:0.04 gの無負荷/フラボノイドカプセル化リグニン粒子。
- それらを三角フラスコに移し、0.1 M HClを10 mL加え、フラスコを250 rpmのマグネチックスターラーに置きます。
- 50 mLビュレットに滴定剤NaOHの0.1 M標準溶液を充填します。
- 滴定を開始する前に、ベンチpHメーターで三角フラスコ内の溶液の初期pHを測定します。
- 滴定を開始し、滴定液を0.5 mL添加するごとに分析溶液のpHを測定します。
- 実験データは、適用された滴定液の量と対応するpHの値を含む表に保存されます。
- 滴定液の量を増やして、pHがほぼ一定になったら滴定を中止します。
- 実験データをゼロ、1次、2次導関数の微分滴定曲線の形式でプロットします。
- 使用する滴定液の等価点と対応する等価量を決定します。
- 式(3)と(4)を使用して、無負荷およびフラボノイドを担持したリグニン粒子の表面上の酸性AaおよびAb塩基の含有量を計算します。
 , MGEQ/G (3)
, MGEQ/G (3)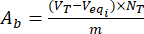 MGEQ/G (4)
MGEQ/G (4)
ここで、Veqi は等価体積(mL)です。NT 滴定液の正規性 (mgeqv/mL);VT 測定手順に使用した滴定液の容量(mL);m 分析したサンプルの重量(g)。
- 固体添加法によるリグニン系粒子のゼロチャージのpH点(pHPZC)の決定。
- NaClの0.1M水溶液60mLを調製します。
- 5つの栓付き円錐フラスコのそれぞれに0.1 M NaCl溶液9 mLを加え、0.1 M HClまたは0.1 M NaOHのいずれかを添加して、pHをpHi = 2、4、7、10、および12(ここで、i = 1〜5は対応する溶液の数を示す)にそれぞれ調整します。同じ強度のNaCl溶液を添加して、各フラスコ内の溶液の総量を10mLに正確に調整します。
- 各フラスコに40mgの乾燥リグニン粒子(無負荷、フラボノイドを充填したマイクロ/サブミクロン)を加え、フラスコにしっかりと蓋をします。
- フラスコをオービタルシェーカーに直立させて固定し、24時間振とうし続けます。
- 30分間平衡化し、その後、各フラスコの上清の最終pH(pHf)を測定します。
- 対応する初期pH値(pHi)に対してpHf値をプロットします。
- 電荷がゼロの点(pHPZC)は、曲線ΔpH対pHi が座標(pHi; pHi)と直線と交差するpH値として定義されます。
- リグニン粒子の総フェノール含有量(TPC)の測定
注:マイクロ/サブミクロンリグニン粒子の総フェノール含有量(TPC)は、修正されたFolin-Ciocalteu比色法によって決定されます。- 濃度500 μg/mLの粒子水懸濁液200 μLを、600 μLの超純水および200 μLのFolin-Ciocalteu試薬(1:1、v/v)と混合します。
- 5分後、1.0 mLの8% Na2CO3 と1.0 mLのMilli-Q水を加え、断続的に攪拌しながら水浴中で40°Cの暗所で30分間インキュベートします。
- 懸濁液を5,300 × g で2分間遠心分離します。
- パーティクルを含まないブランクを準備します。
- 10mmの石英キュベットに3.5mLの上清を移し、ブランクに対して760nmの可視領域でUV/Vis分光光度計で吸光度を測定します。
- 手順5.3.1〜5.3.5に従って、標準没食子酸の検量線を調製します。リグニン粒子懸濁液の200μLの代わりにのみ、初期濃度10、20、30、40、50、60、70、80、90、100、150、および200μg / mLの没食子酸のエタノール溶液を使用してください。
- 微粒子の実験データを没食子酸当量mgとして、乾燥サンプルのグラム当たりミリグラム(mg GAE / g)で表します。
- 式 (5) を使用して TPC を計算します。
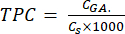 mgGAE/g(5)
mgGAE/g(5)
ここで、CGA は、酸のキャリブレーションプロットから得られた標準没食子酸の濃度に相当するサンプルの濃度です(μg GA / mL)。Cs はサンプルの濃度で、乾燥サンプルの質量を溶媒の容量(μg/mL)で割った値に等しくなります。
6. リグニン粒子のin vitro放出能の測定
- 0.1 M HCl を含む標準 PBS 溶液の pH を pH = 1.2 に調整して、250 mL のシミュレートされた酵素を含まない胃培地を調製します。
- 標準PBS溶液のpHを0.1 M NaOH/0.1 M HClでそれぞれpH = 6.8および7.4に調整することにより、2つの模擬腸液溶液をそれぞれ250 mL調製します。
- 機械式攪拌機が付属するガラスバッチリアクター内のシミュレートされた酵素を含まない胃媒体50mLに25mgのフラボノイドカプセル化マイクロ/サブミクロン粒子を加え、T = 37 ± 0.2 °Cの一定温度の温泉水浴に入れます。
- 攪拌機を液量の2/3の深さに浸して、固相と液相が完全に混合されるようにし、停滞ゾーンなしで最大の物質移動を確保します。
- 10分ごとに90分まで リアクターから1mLのサンプルを取り出し、すぐに1mLの新鮮な模擬流体溶液をリアクターにピペットで入れて、総量の変化を防ぎ、シンクの状態を確保します。
- pH = 6.8と7.4の両方のシミュレートされた腸液溶液で、それぞれ200分間、ステップ6.3〜6.6を含む同じ手順を繰り返します。
- 3つのシミュレートされた媒体で無負荷のリグニン粒子を使用して同様の実験を行い、サンプルを分光光度計をゼロにするためのブランクとして使用します。
- ステップ6.7のブランクサンプルに対してサンプルをろ過し、96%EtOHで希釈した後、サンプルの吸収を分光光度法で決定し、pH = 1.2、6.8、および7.4でそれぞれ得られたモリンの対応する検量線を使用して、対応するフラボノイド濃度を計算します。
- 式(6)を使用してバイオフラボノイドの累積放出(CR)をμg/mLで計算し、累積放出率(CRP)を式(7)で計算します。
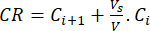 (6)
(6)
ここで、Ci および Ci+1 は、i番目 と (i+1) 番目の サンプル中のモリン/ケルセチンの濃度 (μg/mL) です。Vs バッチリアクターから採取したサンプル量(mL);V シミュレートされた培地の総容量(mL)。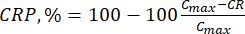 (7)
(7)
ここで、Cmax は担体中の生物学的に活性な化合物の最大濃度(μg/mL)です。
7. 統計解析
- 実験データを、3つの独立した測定値の平均±標準偏差(SD)として表します。
- 事後検定として分散分析検定を実行することにより、実験結果の統計的有意性を決定します。pの値は、0.05<統計的に有意であると考えてください。
Access restricted. Please log in or start a trial to view this content.
結果
抗溶媒沈殿技術を実行して、アルカリリグニンマイクロ/サブミクロン粒子を生成しました。希釈無機酸 - 硝酸/有機酸 - クエン酸の水溶液を、環境に優しい界面活性剤/エタノールで濃縮したアルカリリグニン水溶液に分散させ、その結果、生体高分子溶質が徐々に沈殿し、超音波処理後、コンパクトなマイクロ/サブミクロン粒子の懸濁液が最終的に生成された(図1)。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
生体高分子に基づく薬物担体製剤の設計のための現代の合成方法論の主な重要な問題の中には、有害な有機試薬 - テトラヒドロフラン、アセトン、メタノール、さらには高濃度のDMSOなどの揮発性および可燃性溶媒 - の適用であり、毒性作用の発現の可能性により、生物医学、製薬産業、および食品技術への適用が制限される20。21、
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、契約番号 KΠ-06 H59/3 に基づくブルガリア科学基金と、トラキア大学の科学プロジェクト No. 07/2023 FVM の支援を受けました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
参考文献
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved