Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Зеленый синтез, характеризация, инкапсуляция и измерение потенциала высвобождения новых микро-/субмикронных частиц щелочного лигнина
В этой статье
Резюме
Описаны новые, простые методики синтеза и характеристики биосовместимых микро- и субмикронных частиц лигнина. Эти составы обеспечивают простой подход к использованию гетерополимера, а также альтернативу для рационального проектирования многофункциональных матриц носителей с потенциальной применимостью в биомедицине, фармацевтической технологии и пищевой промышленности.
Аннотация
Применение биополимерных микро-/нанотехнологий в человеческой, ветеринарной, фармацевтической и пищевой технике быстро растет в связи с большим потенциалом частиц на основе биополимеров в качестве эффективных систем-носителей. Использование лигнина в качестве основной гетерополимерной биоматрицы для разработки инновационных микро-/субмикронных составов позволяет достичь повышенной биосовместимости и предлагает различные активные функциональные группы, представляющие возможности для индивидуализации физико-химических свойств и биологической активности составов для различных применений. Целью настоящего исследования явилась разработка простой и экологичной методики синтеза частиц лигнина микро- и субмикронного размера; оценить их физико-химические, спектральные и структурные характеристики; и изучить их способность к инкапсуляции биологически активных молекул и потенциал высвобождения биофлавоноидов in vitro в смоделированных желудочно-кишечных средах. В представленных методиках применяются дешевые и экологически чистые растворители; Простые, простые, быстрые и чувствительные процессы, требующие небольшого количества оборудования, нетоксичных веществ и простых методов для их характеристики, определения инкапсуляционной способности к плохо растворимым в воде биологически активных соединений морина и кверцетина, а также потенциала высвобождения лигниновых матриц in vitro .
Введение
В настоящее время склонность к биополимерам, таким как целлюлоза, хитозан, коллаген, декстран, желатин и лигнин, в качестве прекурсоров для разработки микро- и субмикронных носителей с настраиваемым размером, физико-химическими свойствами и биофункциональностью, возросла в биомедицинской, фармацевтической и пищевой промышленности из-за их применимости в тканевой инженерии, 3D-биопечати, in vitro платформы моделирования заболеваний, упаковочная промышленность, приготовление эмульсий и доставка питательных веществ, среди прочего 1,2,3.
Новые исследования подчеркивают аспекты гидрогелей на основе лигнина, а также микро- и наносоставов4 как предпочтительных носителей, используемых для упаковочных материалов для пищевых продуктов5, накопителей энергии6, косметики7, термостабилизаторов/светостабилизаторов, армированных материалов и матриц носителей лекарств8 для доставки гидрофобных молекул, улучшения УФ-барьеров9, в качестве армирующих агентов в нанокомпозитах, а также в качестве альтернативы неорганическим наночастицам в связи с некоторыми недавними проблемами безопасности 10,11,12. Причиной этой тенденции является биосовместимость, биоразлагаемость и нетоксичность природного гетеробиополимера, а также его доказанная биологическая активность лигнин-антиоксидантного потенциала и поглощения радикалов, антипролиферативная и антимикробная активность 13,14,15,16,17.
В научной литературе описываются различные методы синтеза (самосборка, осаждение против растворителей, кислотное осаждение и сдвиг растворителя)18 и характеристика микро-/наноразмерных составов на основе лигнина, включая применение дорогостоящих или вредных растворителей, таких как тетрагидрофуран (ТГФ), диметилсульфоксид (ДМСО), N,N-диметилформамид (ДМФА) и ацетон, а также сложные, непрямые и утомительные процессы, в которых используется много оборудования и токсичных веществ.,19,20.
Для преодоления последних недостатков в следующих протоколах представлены новые методики синтеза микро- и субмикронных частиц на основе лигнина с использованием дешевых и экологически чистых растворителей; простые, простые, быстрые и чувствительные процессы, требующие небольшого количества оборудования, нетоксичных веществ и простых методов для их характеризации и определения инкапсуляционной способности к плохо растворимым в воде биологически активным соединениям и потенциала высвобождения лигниновых матриц in vitro . Представленные лабораторные методы производства выгодны для производства функциональных носителей лигнина с перестраиваемыми размерами, высокой инкапсулирующей способностью и устойчивым поведением высвобождения in vitro с использованием простых процедур определения характеристик и экологически чистых химических веществ, которые могут найти применение в различных областях биомедицинских наук и пищевых технологий. Два флавоноида применялись в качестве молекул-мишеней, инкапсулированных в частицы лигнина: морин — в микрочастицы, а кверцетин — в субмикронные частицы. Различие в структурах обоих флавоноидов заключается только в положении второй -OH-группы в В-ароматическом кольце: -ОН-группа находится в 2'-положении в морине и в 3'-положении в кверцетине, таким образом, оба органических соединения являются позиционными изомерами. Последний факт предполагает сходное поведение обоих биологически активных природных соединений в процессах инкапсуляции и/или высвобождения.
Access restricted. Please log in or start a trial to view this content.
протокол
1. Синтез микрочастиц лигнина
- Приготовьте водный раствор щелочного лигнина 50 мг/мл, растворив 2,5 г щелочного лигнина в 50 мл сверхчистой воды на магнитной мешалке.
- Приготовьте 1% раствор Tween 80, растворив 1 мл Tween 80 в 100 мл сверхчистой воды.
- Приготовьте 2 М раствор HNO3 путем разбавления 6,65 мл 67% HNO3 (плотность = 1,413 г/мл) со сверхчистой водой до конечного объема 50 мл.
- Медленно добавьте 15 мл 1% раствора Tween 80 к 50 мл раствора щелочного лигнина 50 мг/мл.
- Перемешивайте смесь на магнитной мешалке при 500 об/мин в течение 10 мин, чтобы поверхностно-активное вещество хорошо диспергировалось.
- Добавьте в смесь 20 мл 2 М HNO3 по каплям с помощью шприца со скоростью потока примерно 150 мкл/с.
- Продолжайте помешивать смесь в течение 30 минут, пока темно-коричневый раствор не превратится в светло-коричневую суспензию микрочастиц.
- Перенесите суспензию в пробирки объемом 1,5-2 мл и центрифугируйте в течение 30 мин при 15 000 × г в ультрацентрифуге при 10 °C.
- Соберите надосадочную жидкость для дальнейших анализов и промойте микрочастицы сверхчистой водой.
- Повторите процедуры ополаскивания/ультрацентрифугирования 3 раза.
- Перед ультразвуковой гомогенизацией емкость с микрочастицами опустить на ледяную баню.
- Гомогенизировать микрочастицы в течение 4 мин с интенсивностью 93% на ультразвуковом гомогенизаторе.
- Лиофилизируйте микрочастицы при температуре -64 °C в сублимационной сушилке и храните их в эксикаторе для дальнейшего использования.
2. Синтез субмикронных частиц лигнина
- Приготовьте водный раствор щелочного лигнина 5 мг/мл, растворив 125 мг щелочного лигнина в 25 мл сверхчистой воды на магнитной мешалке.
- Медленно добавьте 1 мл 96% EtOH в раствор щелочного лигнина.
- Перемешивайте смесь на магнитной мешалке при 500 об/мин в течение 3 мин.
- Приготовьте 50 мл 1% раствора лимонной кислоты, растворив 0,5 г лимонной кислоты в сверхчистой воде до конечного объема 50 мл.
- Добавьте в смесь 7 мл 1% лимонной кислоты по каплям с помощью шприца со скоростью потока примерно 4 мл/мин.
- Продолжайте помешивать смесь в течение 10 минут, когда коричневый прозрачный раствор превратится в мутную светло-коричневую суспензию субмикронных частиц.
- Перенесите суспензию в пробирки и центрифугуйте в течение 30 мин при 15 000 × g в ультрацентрифуге при 10 °C.
- Соберите надосадочную жидкость для дальнейших анализов и промойте микрочастицы сверхчистой водой.
- Повторите процедуры ополаскивания/ультрацентрифугирования 3 раза.
- Перед ультразвуковой гомогенизацией емкость с микрочастицами опустить на ледяную баню.
- Гомогенизируйте микрочастицы ультразвуком в течение двух циклов по 4 мин каждый с интенсивностью 96% в ультразвуковом гомогенизаторе.
- Охладите емкости в течение 1 минуты после первого цикла.
- Лиофилизируйте микрочастицы при температуре -64 °C в сублимационной сушилке и храните их в эксикаторе для дальнейшего использования.
3. Синтез микро-/субмикронных частиц лигнина, инкапсулированных флавоноидами
- Повторите шаги 1.1-1.5 для микрочастиц.
- Взвесьте 0,08 г морина, растворите его в 1 мл EtOH и добавьте этот этаноловый раствор в смесь.
- Перемешивайте смесь на магнитной мешалке при 500 об/мин в течение 20 мин.
- Добавьте в смесь 20 мл 2 Н HNO3 по каплям с помощью шприца со скоростью потока примерно 150 мкл/с.
- Продолжайте помешивать смесь в течение 60 минут.
- Повторите шаги 1.8-1.13.
- Повторите шаг 2.1 для субмикронных частиц.
- Масса 0,04 г кверцетина, растворите его в 1 мл этанола и добавьте этот этанольный раствор в щелочной водный раствор лигнина.
- Перемешивайте смесь на магнитной мешалке при 500 об/мин в течение 10 мин.
- Повторите шаги 2.4-2.13.
4. Определение эффективности инкапсуляции микро-/сумикрочастиц лигнина
- Рассчитать содержание добавляемого биологически активного вещества в ходе процедуры синтеза обоих типов инкапсулированных флавоноидами частиц лигнина.
- Спектрофотометрически определяют поглощение флавоноида в надосадочной жидкости, полученной на этапах 1.9 и 2.8 после разбавления его 96% EtOH.
- Рассчитайте концентрацию незахваченного морина/кверцетина, используя калибровочные кривые флавоноидов.
- Рассчитать эффективность инкапсуляции (EE, %) микрочастиц лигнина по отношению к природным флавоноидам с помощью уравнения (1):
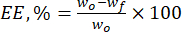 (1)
(1)
где wo – общее количество добавленного биологически активного вещества (мг), а wf – количество свободного незахваченного флавоноида (мг). - Рассчитайте загрузочную способность лекарственного средства (DLC, %) — важный параметр, представляющий количество лекарственного препарата в частицах на единицу веса несущей системы — с помощью уравнения (2):
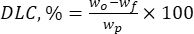 (2)
(2)
где wp – общее количество (выход) микро-/субмикронных частиц лигнина, полученных после лиофилизации (мг).
5. Характеристика микро- и субмикронных частиц лигнина
- Определение количества, размера и распределения частиц по размерам
- Оцените размер частиц и распределение частиц в образцах с помощью автоматического счетчика ячеек с возможностью подсчета гранул. Добавьте с помощью микропипетки 1 мкл суспензии микро-/субмикронных частиц лигнина/флавоноидов в сверхчистую воду в лунку счетного стекла, необходимую для операции.
- Дождитесь, пока количество частиц в 1 мл суспензии, а также их количество и распределение по размерам отобразятся на дисплее автоматического счетчика клеток.
ПРИМЕЧАНИЕ: Устройство позволяет хранить данные на флэш-памяти USB. Специальное программное обеспечение автоматического счетчика ячеек позволяет осуществлять дальнейшую обработку сохраненных цифровых и фотофайлов.
- Определение содержания поверхностных кислотно-основных групп частиц лигнина методом потенциометрического титрования
- Масса 0,04 г незагруженных/инкапсулированных флавоноидами частиц лигнина.
- Переложите их в колбу Эрленмейера, добавьте 10 мл 0,1 М HCl и поместите колбу на магнитную мешалку при 250 об/мин.
- Наполните 50 мл бюретки 0,1 М стандартным раствором титранта NaOH.
- Перед началом титрования измерьте исходный pH раствора в колбе Эрленмейера настольным рН-метром.
- Начните титрование и измерьте рН анализируемого раствора после каждых 0,5 мл добавленной порции титранта.
- Сохраните экспериментальные данные в таблице, содержащей объем примененного титранта и соответствующее значение pH.
- Прекратите титрование при достижении приблизительно постоянного значения рН, увеличив объем раствора титранта.
- Построение экспериментальных данных в виде кривых дифференциального титрования с нулевыми, первыми и вторыми производными.
- Определите эквивалентные точки и соответствующие эквивалентные объемы используемых титрантов.
- Рассчитать содержание кислотных основных групп А, аи А, bна поверхности незагруженных и загруженных флавоноидами частиц лигнина с помощью уравнений (3) и (4):
 , мгэкв/г (3)
, мгэкв/г (3)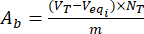 мгэкв/г (4)
мгэкв/г (4)
где Veqi — эквивалентный объем (мл); NT нормальность титранта (мгекв/мл); V T объем титранта, используемого для процедуры определения (мл); m вес анализируемого образца (г).
- Определение точки нулевого заряда (рНPZC) частиц на основе лигнина методом добавления твердых веществ.
- Приготовьте 60 мл 0,1 М водного раствора NaCl.
- Добавьте 9 мл 0,1 М раствора NaCl в каждую из пяти конических колб с пробками и отрегулируйте рН до рНi = 2, 4, 7, 10 и 12 (где i = 1-5 обозначают номер соответствующего раствора), соответственно путем добавления 0,1 М HCl или 0,1 М NaOH. Общий объем раствора в каждой колбе довести до 10 мл точно, добавив раствор NaCl той же крепости.
- Добавьте 40 мг сухих частиц лигнина (разгруженных, наполненных флавоноидами микро/субмикронов) в каждую колбу и надежно закройте колбы.
- Закрепите колбы вертикально на орбитальном вибростенде и удерживайте их в течение 24 часов.
- Дайте уравновеситься в течение 30 минут и затем измерьте конечный pH (pHf) надосадочной жидкости в каждой колбе.
- Сравните значения pHf с соответствующими начальными значениями pH (pHi).
- Точка нулевого заряда (pHPZC) определяется как значение pH, при котором кривая ΔpH в зависимости от pHi пересекает прямую с координатами (pHi; pHi).
- Определение общего содержания фенольных соединений (ТФК) частиц лигнина
ПРИМЕЧАНИЕ: Общее содержание фенольных соединений (TPC) микро-/субмикронных частиц лигнина определяется модифицированным колориметрическим методом Фолина-Чокальтеу.- Смешать 200 мкл водной суспензии частиц с концентрацией 500 мкг/мл с 600 мкл сверхчистой воды и 200 мкл реагента Фолина-Чокальтеу (1:1, v/v).
- Через 5 мин добавить в смесь 1,0 мл 8%Na2CO3 и 1,0 мл воды Milli-Q и инкубировать ее в темноте при 40 °C в течение 30 мин на водяной бане с прерывистым перемешиванием.
- Центрифугируйте суспензию при 5 300 × г в течение 2 мин.
- Подготовьте заготовку, не содержащую частиц.
- Перенесите 3,5 мл надосадочной жидкости в кварцевую кювету толщиной 10 мм и измерьте поглощение на УФ/ВИД спектрофотометре в видимой области на длине волны 760 нм относительно бланка.
- Подготовить калибровочную кривую стандартной галловой кислоты в соответствии с этапами 5.3.1-5.3.5; только вместо 200 мкл суспензии частиц лигнина используют этанольный раствор галловой кислоты с исходными концентрациями 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 и 200 мкг/мл.
- Выразите экспериментальные данные микрочастиц в мг эквивалента галловой кислоты в миллиграммах на грамм сухого образца (мг ГАЕ/г).
- Рассчитайте TPC с помощью уравнения (5):
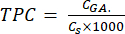 мг ГАЕ/г (5)
мг ГАЕ/г (5)
где CGA - концентрация образца, эквивалентная концентрации стандартной галловой кислоты, полученной на калибровочном графике кислоты (μг GA/мл); Cs — концентрация образца, равная массе сухого образца, деленной на объем растворителя (μг/мл).
6. Определение способности частиц лигнина к высвобождению in vitro
- Приготовьте 250 мл смоделированной бесферментной желудочной среды, регулируя рН стандартного раствора PBS с 0,1 М HCl до рН = 1,2.
- Приготовьте по 250 мл каждого из двух смоделированных растворов кишечной жидкости, регулируя рН стандартного раствора PBS с 0,1 М NaOH/0,1 М HCl до рН = 6,8 и 7,4 соответственно.
- Добавить 25 мг инкапсулированных флавоноидами микро-/субмикронных частиц к 50 мл имитируемой бесферментной желудочной среды в стеклянном реакторе, снабженном механической мешалкой, и поместить его в водяную баню при постоянной температуре T = 37 ± 0,2 °С.
- Опустите мешалку на глубину 2/3 объема жидкости, чтобы обеспечить полное смешивание твердой и жидкой фаз и обеспечить максимальный массоперенос без застойных зон.
- Вынимайте 1 мл пробы из реактора каждые 10 мин до90-й минуты и немедленно пипетируйте 1 мл свежего раствора моделируемой жидкости в реактор, чтобы предотвратить изменение общего объема и обеспечить условия погружения.
- Повторите ту же процедуру, включая шаги 6.3-6.6, с обоими смоделированными растворами кишечной жидкости с рН = 6,8 и 7,4 соответственно в течение 200 мин.
- Провести аналогичные эксперименты с незагруженными частицами лигнина в трех имитируемых средах и использовать образцы в качестве заготовок для обнуления спектрофотометра.
- Определить поглощение образцов спектрофотометрическим путем после фильтрации образцов и разбавления их 96% EtOH по сравнению с холостыми образцами из шага 6.7 и рассчитать соответствующую концентрацию флавоноидов с использованием соответствующих калибровочных кривых морина, полученных при рН = 1,2, 6,8 и 7,4 соответственно.
- Рассчитать кумулятивное высвобождение (CR) биофлавоноидов с помощью уравнения (6) в μг/мл и процент кумулятивного высвобождения (CRP) по уравнению (7):
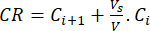 (6)
(6)
где Ci и Ci+1 – концентрации морина/кверцетинав i и (i+1)м образцах (μг/мл); Vs объем пробы, отобранной из реактора периодического действия (мл); V общий объем моделируемой среды (мл).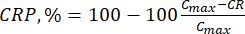 (7)
(7)
ГдеCmax — максимальная концентрация биологически активного соединения в носителе (μг/мл).
7. Статистический анализ
- Выразите экспериментальные данные в виде средств ± стандартных отклонений (SD) трех независимых измерений.
- Определите статистическую значимость экспериментальных результатов, выполнив тест ANOVA в качестве апостериорного теста. Рассмотрим значение p < 0,05 статистически значимым.
Access restricted. Please log in or start a trial to view this content.
Результаты
Для получения микро-/субмикронных частиц щелочного лигнина был применен метод осаждения против растворителей. Водный раствор разбавленной неорганической кислоты-азотной кислоты/органической кислоты-лимонной кислоты диспергировали в водный раствор щелочного лигнина, обогащенный эк...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
К числу основных критических вопросов современных методик синтеза для разработки лекарственных препаратов-носителей на основе биополимеров относится применение опасных органических реагентов – летучих и легковоспламеняющихся растворителей, таких как тетрагидрофуран, ацетон, мета...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование было поддержано Болгарским научным фондом по контракту No KΠ-06 H59/3 и научным проектом No 07/2023 FVM, Университет Тракия.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Ссылки
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены