Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yeni Alkali Lignin Mikro-/Submikron Partiküllerinin Yeşil Sentezi, Karakterizasyonu, Kapsüllenmesi ve Salınım Potansiyelinin Ölçülmesi
Bu Makalede
Özet
Biyouyumlu lignin mikro ve mikron altı partiküllerin sentezi ve karakterizasyonu için yeni, basit metodolojileri açıklıyoruz. Bu formülasyonlar, heteropolimerin kullanımı için kolay bir yaklaşımın yanı sıra biyotıp, farmasötik teknoloji ve gıda endüstrisinde potansiyel uygulanabilirliği olan çok işlevli taşıyıcı matrislerin rasyonel tasarımı için bir alternatif sağlar.
Özet
Biyopolimer mikro/nano teknolojinin insan, veterinerlik, ilaç ve gıda teknolojisinde uygulanabilirliği, biyopolimer bazlı partiküllerin etkili taşıyıcı sistemler olarak büyük potansiyeli nedeniyle hızla artmaktadır. Yenilikçi mikro-/mikron altı formülasyonların tasarımı için ligninin temel bir heteropolimer biyomatris olarak kullanılması, artan biyouyumluluğun elde edilmesini sağlar ve çeşitli uygulamalar için formülasyonların fizikokimyasal özelliklerinin ve biyoaktivitelerinin özelleştirilmesi için fırsatlar sunan çeşitli aktif fonksiyonel gruplar sunar. Bu çalışmanın amacı, mikro ve mikron altı boyuta sahip lignin parçacıklarının sentezi için basit ve çevre dostu bir metodoloji geliştirmekti; fizikokimyasal, spektral ve yapısal özelliklerini değerlendirmek; ve biyolojik olarak aktif moleküllerin kapsüllenme kapasitelerini ve simüle edilmiş gastrointestinal ortamlarda biyoflavonoidlerin in vitro salınım potansiyellerini incelemek. Sunulan metodolojiler ucuz ve yeşil çözücüler uygular; Az ekipman, toksik olmayan maddeler ve bunların karakterizasyonu için basit yöntemler gerektiren kolay, anlaşılır, hızlı ve hassas süreçler, suda az çözünür biyoaktif bileşikler morin ve kersetine karşı kapsülleme kapasitesinin belirlenmesi ve lignin matrislerinin in vitro salım potansiyeli.
Giriş
Günümüzde, doku mühendisliği, 3D biyo-printing, in vitro olarak uygulanabilirlikleri nedeniyle biyomedikal, farmasötik ve gıda teknolojisi endüstrilerinde özelleştirilebilir boyut, fizikokimyasal özellikler ve biyoişlevselliklere sahip mikro/mikron altı taşıyıcıların tasarımının öncüsü olarak selüloz, kitosan, kollajen, dekstran, jelatin ve lignin gibi biyopolimerlere olan eğilim artmıştır Hastalık modelleme platformları, ambalaj endüstrisi, emülsiyon hazırlama ve diğerleri arasında besin dağıtımı 1,2,3.
Yeni çalışmalar, lignin bazlı hidrojellerin yanı sıra mikro ve nano formülasyonların4 gıda ambalaj malzemeleri5, enerji depolama6, kozmetik7, termal/ışık stabilizatörleri, güçlendirilmiş malzemeler ve ilaç taşıyıcı matrisler8 için hidrofobik moleküllerin verilmesi, UV bariyerlerinin iyileştirilmesi için kullanılan avantajlı araçlar olarak yönlerini vurgulamaktadır9, nanokompozitlerde takviye maddeleri olarak ve bazı yeni güvenlik sorunları nedeniyle inorganik nanopartiküllere alternatif olarak 10,11,12. Bu eğilimin arkasındaki neden, doğal hetero biyopolimerin biyouyumluluğu, biyolojik olarak parçalanabilirliği ve toksik olmamasının yanı sıra lignin-antioksidan potansiyeli ve radikal süpürücü, anti-proliferatif ve antimikrobiyal aktivitelerin kanıtlanmış biyoaktiviteleridir 13,14,15,16,17.
Bilimsel literatür, tetrahidrofuran (THF), dimetil sülfoksit (DMSO), N, N-dimetilformamid (DMF) ve aseton gibi pahalı veya zararlı çözücülerin uygulanması ve çok sayıda ekipman ve toksik madde kullanan karmaşık, dolaylı ve sıkıcı süreçler dahil olmak üzere lignin bazlı mikro/nano ölçekli formülasyonların sentezi (kendi kendine montaj, anti-çözücü çökeltme, asit çökeltme ve çözücü kaydırma)18 ve lignin bazlı mikro/nano ölçekli formülasyonların karakterizasyonu için çeşitli yöntemler bildirmektedir,19,20.
İkinci dezavantajların üstesinden gelmek için, aşağıdaki protokoller, ucuz ve yeşil çözücüler kullanılarak lignin bazlı mikro-/mikron altı parçacıkların sentezi için yeni metodolojiler sunar; Az ekipman, toksik olmayan maddeler ve bunların karakterizasyonu ve suda az çözünür biyoaktif bileşiklere doğru kapsülleme kapasitesinin belirlenmesi ve lignin matrislerinin in vitro salım potansiyeli için basit yöntemler gerektiren kolay, anlaşılır, hızlı ve hassas işlemler. Sunulan laboratuvar ölçekli üretim yöntemleri, biyomedikal bilimlerin ve gıda teknolojisinin çeşitli alanlarında uygulama bulabilen basit karakterizasyon prosedürleri ve çevre dostu kimyasallar kullanılarak ayarlanabilir boyutlara, yüksek kapsülleme kapasitesine ve sürdürülebilir in vitro salım davranışına sahip fonksiyonel lignin taşıyıcılarının üretimi için avantajlıdır. Lignin parçacıklarına kapsüllenmiş hedef moleküller olarak iki flavonoid uygulandı: mikropartiküllere morin ve mikron altı partiküllere quercetin. Her iki flavonoidin yapılarındaki fark, yalnızca B-aromatik halkadaki ikinci -OH grubunun konumudur: -OH grubu, morinde 2' konumunda ve quercetin'de 3' konumundadır, bu nedenle her iki organik bileşik de konumsal izomerlerdir. İkinci gerçek, her iki biyoaktif doğal bileşiğin kapsülleme ve/veya salma süreçlerinde benzer davranışlarını varsayar.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Lignin mikropartiküllerinin sentezi
- 2.5 g alkali lignini manyetik bir karıştırıcı üzerinde 50 mL ultra saf su içinde çözerek 50 mg / mL alkali lignin sulu çözeltisi hazırlayın.
- 1 mL Tween 80'i 100 mL ultra saf suda çözerek %1 Tween 80 solüsyonu hazırlayın.
- 6.65 mL% 67 HNO3'ü (yoğunluk = 1.413 g / mL) ultra saf su ile 50 mL'lik bir nihai hacme seyrelterek 2 M'lik birHNO3 çözeltisi hazırlayın.
- % 1 Tween 80 çözeltisinin 15 mL'sini 50 mg / mL alkali lignin çözeltisinin 50 mL'sine yavaşça ekleyin.
- Karışımı, yüzey aktif maddenin iyi dağılması için 500 rpm'de 10 dakika boyunca manyetik bir karıştırıcı üzerinde çalkalayın.
- Karışıma yaklaşık 150 μL/s akış hızında bir şırınga ile damla damla 20 mL 2 M HNO3 ekleyin.
- Koyu kahverengi çözelti açık kahverengi bir mikropartikül süspansiyonuna dönüştüğünde karışımı 30 dakika karıştırmaya devam edin.
- Süspansiyonu 1.5-2 mL test tüplerine aktarın ve 10 ° C'de bir ultrasantrifüjde 15.000 × g'da 30 dakika santrifüjleyin.
- Daha fazla analiz için süpernatanı toplayın ve mikropartikülleri ultra saf suyla durulayın.
- Durulama/ultrasantrifüj prosedürlerini 3 kez tekrarlayın.
- Ultrasonik homojenizasyondan önce kabı mikropartiküllerle birlikte bir buz banyosuna batırın.
- Mikropartikülleri bir ultrason homojenizatöründe %93 yoğunlukta 4 dakika boyunca homojenize edin.
- Mikropartikülleri bir dondurarak kurutucuda -64 °C sıcaklıkta liyofilize edin ve daha sonra kullanmak üzere bir ekzolatörde saklayın.
2. Lignin mikron altı parçacıklarının sentezi
- 125 mg alkali lignini manyetik bir karıştırıcı üzerinde 25 mL ultra saf suda çözerek 5 mg / mL alkali lignin sulu çözeltisi hazırlayın.
- Alkali lignin çözeltisine yavaşça 1 mL %96 EtOH ekleyin.
- Karışımı manyetik bir karıştırıcıda 500 rpm'de 3 dakika çalkalayın.
- 0.5 g sitrik asidi ultra saf suda 50 mL'lik bir nihai hacme kadar çözerek 50 mL'lik %1'lik bir sitrik asit çözeltisi hazırlayın.
- Karışıma yaklaşık 4 mL / dak akış hızında bir şırınga ile damla damla 7 mL %1 sitrik asit ekleyin.
- Kahverengi berrak çözelti, mikron altı parçacıkların bulanık açık kahverengi bir süspansiyonuna dönüşeceği zaman karışımı 10 dakika karıştırmaya devam edin.
- Süspansiyonu test tüplerine aktarın ve 10 ° C'de bir ultrasantrifüjde 15.000 × g'da 30 dakika santrifüjleyin.
- Daha fazla analiz için süpernatanı toplayın ve mikropartikülleri ultra saf suyla durulayın.
- Durulama/ultrasantrifüj prosedürlerini 3 kez tekrarlayın.
- Ultrasonik homojenizasyondan önce kabı mikropartiküllerle birlikte bir buz banyosuna batırın.
- Mikropartikülleri bir ultrason homojenizatöründe her biri %96 yoğunlukta 4 dakikalık iki döngü boyunca ultrasonik olarak homojenize edin.
- İlk döngüden sonra kapları 1 dakika soğutun.
- Mikropartikülleri bir dondurarak kurutucuda -64 °C sıcaklıkta liyofilize edin ve daha sonra kullanmak üzere bir ekzolatörde saklayın.
3. Doğal flavonoid kapsüllü lignin mikro-/mikron altı partiküllerinin sentezi
- Mikropartiküller için 1.1-1.5 adımlarını tekrarlayın.
- 0.08 g morin tartın, 1 mL EtOH içinde çözün ve bu etanolik çözeltiyi karışıma ekleyin.
- Karışımı manyetik bir karıştırıcıda 500 rpm'de 20 dakika çalkalayın.
- Karışıma yaklaşık 150 μL/s akış hızında bir şırınga ile damla damla 2 NHNO3 ilave edin.
- Karışımı 60 dakika karıştırmaya devam edin.
- 1.8-1.13 adımlarını tekrarlayın.
- Mikron altı parçacıklar için adım 2.1'i tekrarlayın.
- Ağırlık 0.04 g quercetin, 1 mL EtOH içinde çözün ve bu etanolik çözeltiyi alkali lignin sulu çözeltisine ekleyin.
- Karışımı manyetik bir karıştırıcıda 500 rpm'de 10 dakika çalkalayın.
- 2.4-2.13 adımlarını tekrarlayın.
4. Lignin mikro-/sumikro- partiküllerinin kapsülleme verimliliğinin belirlenmesi
- Her iki tip flavonoid kapsüllenmiş lignin partikülünün sentezi için prosedür sırasında eklenen biyoaktif maddenin içeriğini hesaplayın.
- % 96 EtOH ile seyreltildikten sonra 1.9 ve 2.8 adımları sırasında elde edilen süpernatanttaki flavonoidin emilimini spektrofotometrik olarak belirleyin.
- Flavonoidlerin kalibrasyon eğrilerini kullanarak hapsedilmemiş morin / quercetin konsantrasyonunu hesaplayın.
- Denklem (1)'i kullanarak lignin mikropartiküllerinin doğal flavonoidlere doğru kapsülleme verimliliğini (EE, %) hesaplayın:
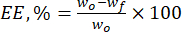 (1)
(1)
Buradawo , eklenen biyoaktif maddenin toplam miktarıdır (mg) ve wf , serbest hapsedilmemiş flavonoidin (mg) miktarıdır. - Taşıyıcı sistemin birim ağırlığı başına partiküllerdeki ilaç miktarını temsil eden önemli bir parametre olan ilaç yükleme kapasitesini (DLC, %) denklem (2) kullanarak hesaplayın:
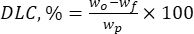 (2)
(2)
Burada wp , liyofilizasyondan (mg) sonra elde edilen lignin mikro-/mikron altı partiküllerinin toplam miktarıdır (verim).
5. Lignin mikro ve mikron altı partiküllerin karakterizasyonu
- Partikül sayısı, boyutu ve boyut dağılımının belirlenmesi
- Boncuk sayımı seçeneğine sahip otomatik hücre sayacı kullanarak numunelerin partikül boyutunu ve partikül boyutu dağılımını değerlendirin. İşlem için gerekli sayma slaytının kuyusuna ultra saf su içinde 1 μL lignin/flavonoid mikro-/mikron altı partikül süspansiyonunu bir mikropipet ile ekleyin.
- Süspansiyonun 1 mL'sindeki partikül sayısının yanı sıra boyuta göre sayılarının ve dağılımlarının otomatik hücre sayacının ekranında gösterilmesini bekleyin.
NOT: Cihaz, verilerin bir USB flaşta saklanmasına izin verir. Otomatik hücre sayacı özel yazılımı, kaydedilen dijital ve fotoğraf dosyalarının daha fazla işlenmesine izin verir.
- Potansiyometrik titrasyon ile lignin partiküllerinin yüzey asidik/bazik gruplarının içeriğinin belirlenmesi
- Ağırlık 0.04 g yüksüz / flavonoid kapsüllenmiş lignin parçacıkları.
- Bunları bir Erlenmeyer şişesine aktarın, 10 mL 0.1 M HCl ekleyin ve şişeyi 250 rpm'de manyetik bir karıştırıcıya yerleştirin.
- 50 mL'lik bir büreti 0,1 M'lik standart bir NaOH titrantı çözeltisiyle doldurun.
- Titrasyona başlamadan önce Erlenmeyer şişesindeki çözeltinin ilk pH'ını bir tezgah pH metre ile ölçün.
- Titrasyonu başlatın ve titrantın eklenen her 0,5 mL kısmından sonra analiz edilen çözeltinin pH değerini ölçün.
- Deneysel verileri, uygulanan titrasyon çözeltisinin hacmini ve karşılık gelen pH değerini içeren bir tabloda saklayın.
- Titrant çözeltisinin hacmi artırılarak yaklaşık olarak sabit bir pH değerine ulaşıldığında titrasyonu durdurun.
- Deneysel verileri sıfır, birinci ve ikinci türev diferansiyel titrasyon eğrileri şeklinde çizin.
- Kullanılan titrantların eşdeğer noktalarını ve karşılık gelen eşdeğer hacimlerini belirleyin.
- Denklem (3) ve (4)'ü kullanarak yüksüz ve flavonoid yüklü lignin parçacıklarının yüzeyindeki asidik A,ave Abbazik gruplarının içeriğini hesaplayın:
 , MGEQ/G (3)
, MGEQ/G (3)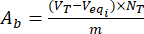 MGEQ/G (4)
MGEQ/G (4)
Veqi eşdeğer hacim (mL) olduğunda; NT titrantın normalliği (mgeqv/mL); VT : belirleme prosedürü için kullanılan titrasyon çözeltisinin hacmi (mL); m Analiz edilen numunenin ağırlığı (g).
- Lignin bazlı partiküllerin sıfır yükünün (pHPZC) pH noktasının katı ekleme yöntemi ile belirlenmesi.
- 60 mL 0.1 M sulu NaCl çözeltisi hazırlayın.
- Beş durduruculu erlenin her birine 9 mL 0.1 M NaCl çözeltisi ekleyin ve pH'ı pHi = 2, 4, 7, 10 ve 12'ye ayarlayın (burada i = 1-5 karşılık gelen çözeltinin sayısını gösterir), sırasıyla 0.1 M HCl veya 0.1 M NaOH ilavesiyle. Her bir şişedeki çözeltinin toplam hacmini, aynı kuvvette NaCl çözeltisi ekleyerek tam olarak 10 mL'ye ayarlayın.
- Her şişeye 40 mg kuru lignin parçacığı (yüksüz, flavonoid yüklü mikro- / mikron) ekleyin ve şişeleri güvenli bir şekilde kapatın.
- Şişeleri bir orbital çalkalayıcıya dik olarak sabitleyin ve 24 saat boyunca sallayın.
- 30 dakika dengeye izin verin ve ardından her şişedeki süpernatanların son pH'ını (pHf) ölçün.
- pHf değerlerini, karşılık gelen başlangıç pH değerlerine (pHi) göre çizin.
- Sıfır yük noktası (pHPZC), pHi'ye karşı ΔpH eğrisinin düz çizgiyi koordinatlarla (pHi; pHi) kestiği pH değeri olarak tanımlanır.
- Lignin partiküllerinin toplam fenolik içeriğinin (TPC) belirlenmesi
NOT: Mikro-/mikron altı lignin partiküllerinin toplam fenolik içeriği (TPC), modifiye edilmiş bir Folin-Ciocalteu kolorimetrik yöntemi ile belirlenir.- 500 μg/mL konsantrasyonda 200 μL sulu partikül süspansiyonunu 600 μL ultra saf su ve 200 μL Folin-Ciocalteu reaktifi (1:1, h/v) ile karıştırın.
- 5 dakika sonra, karışıma 1.0 mL% 8 Na2CO3 ve 1.0 mL Milli-Q su ekleyin ve aralıklı çalkalama ile bir su banyosunda 30 dakika boyunca karanlıkta 40 ° C'de inkübe edin.
- Süspansiyonu 5.300 × g'da 2 dakika santrifüjleyin.
- Parçacık içermeyen bir boşluk hazırlayın.
- Süpernatanın 3,5 mL'sini 10 mm'lik bir kuvars küvete aktarın ve görünür bölgedeki bir UV/Vis spektrofotometresinde boşluğa karşı 760 nm'de absorbansı ölçün.
- 5.3.1-5.3.5 adımlarını izleyerek standart gallik asidin bir kalibrasyon eğrisini hazırlayın; sadece 200 μL lignin partikül süspansiyonu yerine, başlangıç konsantrasyonları 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 ve 200 μg/mL olan etanolik gallik asit çözeltisini kullanın.
- Mikropartiküllerin deneysel verilerini, kuru numunenin gramı başına miligram (mg GAE/g) cinsinden mg gallik asit eşdeğeri olarak ifade edin.
- Denklem (5) kullanarak TPC'yi hesaplayın:
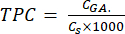 mg GAE/g (5)
mg GAE/g (5)
CGA , asidin kalibrasyon grafiğinden (μg GA/mL) elde edilen standart gallik asit konsantrasyonuna eşdeğer numune konsantrasyonudur; CS, kuru numune kütlesinin çözücünün hacmine (μg/mL) bölünmesine eşit olan numunenin konsantrasyonudur.
6. Lignin partiküllerinin in vitro salım kapasitesinin belirlenmesi
- Standart PBS çözeltisinin pH'ını 0.1 M HCl ile pH = 1.2'ye ayarlayarak 250 mL simüle edilmiş enzim içermeyen mide ortamı hazırlayın.
- Standart PBS çözeltisinin pH'ını 0.1 M NaOH / 0.1 M HCl ile sırasıyla pH = 6.8 ve 7.4'e ayarlayarak simüle edilmiş iki bağırsak sıvısı çözeltisinin her birinden 250 mL hazırlayın.
- Mekanik bir karıştırıcı ile donatılmış bir cam kesikli reaktörde simüle edilmiş enzim içermeyen mide ortamının 50 mL'sine 25 mg flavonoid kapsüllü mikro-/mikron altı partikül ekleyin ve T = 37 ± 0.2 oC sabit bir sıcaklıkta bir termal su banyosuna yerleştirin.
- Katı ve sıvı fazların tam olarak karışmasını sağlamak ve durgun bölgeler olmadan maksimum kütle transferini sağlamak için karıştırıcıyı sıvı hacminin 2/3'ü kadar bir derinliğe daldırın.
- 90. dakikaya kadar her 10 dakikada bir reaktörden 1 mL numune alın ve toplam hacmin değişmesini önlemek ve lavabo koşullarını sağlamak için hemen 1 mL taze simüle edilmiş sıvı çözeltisini reaktöre pipetleyin.
- 6.3-6.6 adımlarını içeren aynı prosedürü, sırasıyla pH = 6.8 ve 7.4 olan simüle edilmiş bağırsak sıvısı çözeltileri ile 200 dakika boyunca tekrarlayın.
- Simüle edilmiş üç ortamda yüksüz lignin parçacıkları ile benzer deneyler yapın ve numuneleri spektrofotometreyi sıfırlamak için boşluklar olarak kullanın.
- Numuneleri filtreledikten ve adım 6.7'deki boş numunelere karşı %96 EtOH ile seyrelttikten sonra numunelerin absorpsiyonunu spektrofotometrik olarak belirleyin ve sırasıyla pH = 1.2, 6.8 ve 7.4'te elde edilen morinin karşılık gelen kalibrasyon eğrilerini kullanarak karşılık gelen flavonoid konsantrasyonunu hesaplayın.
- μg/mL cinsinden denklem (6) kullanarak biyoflavonoidlerin kümülatif salınımını (CR) ve denklem (7) ile kümülatif salım yüzdesini (CRP) hesaplayın:
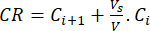 (6)
(6)
Burada Ci ve Ci+1 , iinci ve (i+1)inci numunelerdeki (μg/mL) morin/quercetin konsantrasyonlarıdır; Kesikli reaktörden alınan numune hacmi (mL); V Simüle edilmiş ortamın toplam hacmi (mL).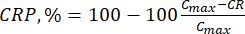 (7)
(7)
BuradaC maks , taşıyıcıdaki biyolojik olarak aktif bileşiğin maksimum konsantrasyonudur (μg/mL).
7. İstatistiksel analizler
- Deneysel verileri, üç bağımsız ölçümün standart sapmaları (SD) ± ortalamaları olarak ifade edin.
- ANOVA testini post hoc test olarak gerçekleştirerek deneysel sonuçların istatistiksel anlamlılığını belirleyin. İstatistiksel olarak anlamlı bir p < 0.05 değerini düşünün.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Alkali lignin mikro-/mikron altı parçacıkları üretmek için bir anti-solvent çökeltme tekniği uygulandı. Seyreltilmiş inorganik asit-nitrik asit/organik asit-sitrik asitten oluşan sulu bir çözelti, çevre dostu bir yüzey aktif madde/etanol ile zenginleştirilmiş bir alkali lignin sulu çözeltisine dağıtıldı, bu da biyopolimer çözünen maddenin kademeli olarak çökelmesine neden oldu ve sonikasyondan sonra, kompakt mikro-/mikron altı parçacıkların bir süspansiyonu nihayet üretildi (
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Biyopolimerlere dayalı ilaç taşıyıcı formülasyonların tasarımı için modern sentez metodolojilerinin ana kritik konuları arasında, tehlikeli organik reaktiflerin - tetrahidrofuran, aseton, metanol ve hatta yüksek konsantrasyonlarda DMSO gibi uçucu ve yanıcı çözücülerin - olası toksik etkilerin tezahürü nedeniyle biyotıp, ilaç endüstrisi ve gıda teknolojisinde uygulanabilirliklerini sınırlayan uygulamalar yer almaktadır20, 21,22,23,2...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, KΠ-06 H59/3 Sözleşme No'lu Bulgaristan Bilim Fonu ve Trakya Üniversitesi 07/2023 FVM Bilimsel Proje No'lu tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Referanslar
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır