Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse, caractérisation, encapsulation et mesure vertes du potentiel de libération de nouvelles particules microscopiques et submicroniques de lignine alcaline
Dans cet article
Résumé
Nous décrivons des méthodologies nouvelles et simples de synthèse et de caractérisation de particules micro- et submicroniques de lignine biocompatibles. Ces formulations offrent une approche facile pour l’utilisation de l’hétéropolymère, ainsi qu’une alternative pour la conception rationnelle de matrices de support multifonctionnelles avec une applicabilité potentielle en biomédecine, en technologie pharmaceutique et dans l’industrie alimentaire.
Résumé
L’applicabilité de la micro/nanotechnologie des biopolymères dans la médecine humaine, vétérinaire, pharmaceutique et alimentaire augmente rapidement en raison du grand potentiel des particules à base de biopolymères en tant que systèmes porteurs efficaces. L’utilisation de la lignine en tant que biomatrice hétéropolymère de base pour la conception de formulations micro- / submicroniques innovantes permet d’obtenir une biocompatibilité accrue et offre divers groupes fonctionnels actifs présentant des possibilités de personnalisation des propriétés physicochimiques et des bioactivités des formulations pour diverses applications. L’objectif de la présente étude était de développer une méthodologie simple et respectueuse de l’environnement pour la synthèse de particules de lignine de taille micro- et submicronique ; évaluer leurs caractéristiques physico-chimiques, spectrales et structurales ; et d’examiner leur capacité d’encapsulation de molécules biologiquement actives et leur potentiel de libération in vitro de bioflavonoïdes dans des milieux gastro-intestinaux simulés. Les méthodologies présentées utilisent des solvants bon marché et verts ; Procédés simples, directs, rapides et sensibles nécessitant peu d’équipement, des substances non toxiques et des méthodes simples pour leur caractérisation, la détermination de la capacité d’encapsulation envers les composés bioactifs peu solubles dans l’eau Morin et Quercetin, et le potentiel de libération in vitro des matrices de lignine.
Introduction
De nos jours, l’inclination vers les biopolymères tels que la cellulose, le chitosane, le collagène, le dextran, la gélatine et la lignine en tant que précurseurs pour la conception de supports micro-/submicroniques avec une taille, des propriétés physicochimiques et des biofonctionnalités personnalisables a augmenté dans les industries biomédicales, pharmaceutiques et de la technologie alimentaire en raison de leur applicabilité en ingénierie tissulaire, en bio-impression 3D, in vitro les plateformes de modélisation des maladies, l’industrie de l’emballage, la préparation d’émulsions et l’administration de nutriments, entre autres, 1,2,3.
De nouvelles études mettent en évidence les aspects des hydrogels à base de lignine ainsi que des micro- et nanoformulations4 en tant que véhicules avantageux utilisés pour les matériaux d’emballage alimentaire5, le stockage d’énergie6, les cosmétiques7, les stabilisants thermiques/légers, les matériaux renforcés et les matrices de support de médicament8 pour l’administration de molécules hydrophobes, l’amélioration des barrières UV9, en tant qu’agents de renforcement dans les nanocomposites et en tant qu’alternative aux nanoparticules inorganiques en raison de certains problèmes de sécurité récents 10,11,12. La raison de cette tendance est la biocompatibilité, la biodégradabilité et la non-toxicité de l’hétéropolymère naturel, ainsi que ses bioactivités prouvées de potentiel antioxydant de lignine et de piégeage radicalaire, anti-proliférative et antimicrobienne 13,14,15,16,17.
La littérature scientifique fait état de diverses méthodes de synthèse (auto-assemblage, précipitation anti-solvant, précipitation acide et déplacement de solvant)18 et de caractérisation de formulations à base de lignine à l’échelle micro/nanométrique, y compris l’application de solvants coûteux ou nocifs tels que le tétrahydrofurane (THF), le diméthylsulfoxyde (DMSO), le N,N-diméthylformamide (DMF) et l’acétone, ainsi que des processus compliqués, indirects et fastidieux qui utilisent beaucoup d’équipements et de substances toxiques 12,19,20.
Pour pallier ces derniers inconvénients, les protocoles suivants présentent de nouvelles méthodologies pour la synthèse de particules micro-/submicroniques à base de lignine à l’aide de solvants bon marché et verts ; Des procédés simples, directs, rapides et sensibles nécessitant peu d’équipement, des substances non toxiques et des méthodes simples pour leur caractérisation et la détermination de la capacité d’encapsulation vers des composés bioactifs peu solubles dans l’eau et du potentiel de libération in vitro des matrices de lignine. Les méthodes de production à l’échelle du laboratoire présentées sont avantageuses pour la fabrication de supports de lignine fonctionnels avec des tailles réglables, une capacité d’encapsulation élevée et un comportement de libération in vitro durable en utilisant des procédures de caractérisation simples et des produits chimiques respectueux de l’environnement qui peuvent trouver des applications dans divers domaines des sciences biomédicales et de la technologie alimentaire. Deux flavonoïdes ont été appliqués comme molécules cibles encapsulées dans les particules de lignine : la morine dans les microparticules et la quercétine dans les particules submicroniques. La différence dans les structures des deux flavonoïdes n’est que la position du deuxième groupe -OH dans le cycle aromatique B : le groupe -OH est sur la position 2' dans Morin et sur la position 3' dans la quercétine, donc les deux composés organiques sont des isomères de position. Ce dernier fait suppose un comportement similaire des deux composés naturels bioactifs dans les processus d’encapsulation et/ou de libération.
Protocole
1. Synthèse de microparticules de lignine
- Préparez une solution aqueuse de lignine alcaline à 50 mg/mL en dissolvant 2,5 g de lignine alcaline dans 50 mL d’eau ultrapure à l’aide d’un agitateur magnétique.
- Préparez une solution à 1 % de Tween 80 en dissolvant 1 mL de Tween 80 dans 100 mL d’eau ultrapure.
- Préparez une solution de 2 M de HNO3 en diluant 6,65 mL de HNO3 à 67 % (densité = 1,413 g/mL) avec de l’eau ultrapure jusqu’à ce qu’il atteigne un volume final de 50 mL.
- Ajouter lentement 15 mL de la solution à 1 % de Tween 80 à 50 mL de solution de lignine alcaline à 50 mg/mL.
- Agitez le mélange sur un agitateur magnétique à 500 tr/min pendant 10 min afin que le tensioactif se disperse bien.
- Ajouter 20 mL de 2 M HNO3 goutte à goutte à l’aide d’une seringue à un débit d’environ 150 μL/s au mélange.
- Continuez à remuer le mélange pendant 30 minutes lorsque la solution brun foncé se transforme en une suspension brun clair de microparticules.
- Transférez la suspension dans des tubes à essai de 1,5 à 2 ml et centrifugez-les pendant 30 minutes à 15 000 × g dans une ultracentrifugeuse à 10 °C.
- Récupérez le surnageant pour des analyses plus approfondies et rincez les microparticules avec de l’eau ultra-pure.
- Répétez les procédures de rinçage/ultracentrifugation 3 fois.
- Trempez le récipient avec les microparticules dans un bain de glace avant l’homogénéisation par ultrasons.
- Homogénéiser les microparticules pendant 4 min à une intensité de 93% sur un homogénéisateur à ultrasons.
- Lyophilisez les microparticules à une température de -64 °C dans un lyophilisateur et stockez-les dans un exicateur pour une utilisation ultérieure.
2. Synthèse de particules submicroniques de lignine
- Préparez une solution aqueuse de lignine alcaline à 5 mg/mL en dissolvant 125 mg de lignine alcaline dans 25 mL d’eau ultrapure sur un agitateur magnétique.
- Ajouter lentement 1 ml d’EtOH à 96 % à la solution de lignine alcaline.
- Agitez le mélange sur un agitateur magnétique à 500 tr/min pendant 3 min.
- Préparez 50 ml d’une solution à 1 % d’acide citrique en dissolvant 0,5 g d’acide citrique dans de l’eau ultrapure jusqu’à un volume final de 50 mL.
- Ajouter 7 mL d’acide citrique à 1 % goutte à goutte à l’aide d’une seringue à un débit d’environ 4 mL/min au mélange.
- Continuez à remuer le mélange pendant 10 minutes lorsque la solution brune claire se transformera en une suspension trouble brun clair de particules submicroniques.
- Transvaser la suspension dans des tubes à essai et centrifuger pendant 30 min à 15 000 × g dans une ultracentrifugeuse à 10 °C.
- Récupérez le surnageant pour des analyses plus approfondies et rincez les microparticules avec de l’eau ultra-pure.
- Répétez les procédures de rinçage/ultracentrifugation 3 fois.
- Trempez le récipient avec les microparticules dans un bain de glace avant l’homogénéisation par ultrasons.
- Homogénéiser les microparticules par ultrasons pendant deux cycles de 4 min chacun à une intensité de 96% dans un homogénéisateur à ultrasons.
- Refroidissez les récipients pendant 1 min après le premier cycle.
- Lyophilisez les microparticules à une température de -64 °C dans un lyophilisateur et stockez-les dans un exicateur pour une utilisation ultérieure.
3. Synthèse de particules micro-/submicroniques de lignine encapsulées dans des flavonoïdes naturels
- Répétez les étapes 1.1 à 1.5 pour les microparticules.
- Peser 0,08 g de morin, le dissoudre dans 1 mL d’EtOH et ajouter cette solution éthanolique au mélange.
- Agitez le mélange sur un agitateur magnétique à 500 tr/min pendant 20 min.
- Ajouter 20 mL de 2 N HNO3 goutte à goutte à l’aide d’une seringue à un débit d’environ 150 μL/s au mélange.
- Continuez à remuer le mélange pendant 60 min.
- Répétez les étapes 1.8-1.13.
- Répétez l’étape 2.1 pour les particules submicroniques.
- Poids 0,04 g de quercétine, dissoudre dans 1 mL d’EtOH et ajouter cette solution éthanolique à la solution aqueuse de lignine alcaline.
- Agiter le mélange sur un agitateur magnétique à 500 tr/min pendant 10 min.
- Répétez les étapes 2.4 à 2.13.
4. Détermination de l’efficacité d’encapsulation des microparticules de lignine
- Calculer la teneur de la substance bioactive ajoutée au cours de la procédure de synthèse des deux types de particules de lignine encapsulées dans des flavonoïdes.
- Déterminer spectrophotométriquement l’absorption du flavonoïde dans le surnageant obtenu lors des étapes 1.9 et 2.8 après l’avoir dilué avec 96% d’EtOH.
- Calculer la concentration de morin/quercétine non piégée à l’aide des courbes d’étalonnage des flavonoïdes.
- Calculer l’efficacité d’encapsulation (EE, %) des microparticules de lignine vis-à-vis des flavonoïdes naturels à l’aide de l’équation (1) :
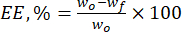 (1)
(1)
Où wo est la quantité totale de substance bioactive ajoutée (mg) et wf est la quantité de flavonoïde libre non piégé (mg). - Calculez la capacité de charge du médicament (DLC, %) - un paramètre important représentant la quantité de médicament dans les particules par unité de poids du système porteur - en utilisant l’équation (2) :
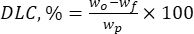 (2)
(2)
Où wp est la quantité totale (rendement) de particules micro-/submicroniques de lignine obtenues après lyophilisation (mg).
5. Caractérisation des particules micro- et submicroniques de lignine
- Détermination du nombre, de la taille et de la distribution granulométrique des particules
- Évaluez la taille et la distribution granulométrique des échantillons à l’aide d’un compteur automatique de cellules avec l’option de comptage des billes. Ajouter à l’aide d’une micropipette 1 μL de particules micro-/submicroniques de lignine/flavonoïde en suspension dans de l’eau ultrapure dans le puits de la lame de comptage nécessaire à l’opération.
- Attendez que le nombre de particules dans 1 mL de la suspension, ainsi que leur nombre et leur répartition par taille soient affichés sur l’écran du compteur automatique de cellules.
REMARQUE : L’appareil permet le stockage des données sur une clé USB. Le logiciel spécial de comptage automatique de cellules permet un traitement ultérieur des fichiers numériques et photo enregistrés.
- Détermination de la teneur en groupes acides/basiques de surface des particules de lignine par titrage potentiométrique
- Poids 0,04 g de particules de lignine non chargées/encapsulées dans des flavonoïdes.
- Transférez-les dans un erlenmeyer, ajoutez 10 ml de HCl 0,1 M et placez le ballon sur un agitateur magnétique à 250 tr/min.
- Remplissez une burette de 50 mL avec une solution étalon de 0,1 M de titrant NaOH.
- Mesurez le pH initial de la solution dans l’erlenmeyer à l’aide d’un pH-mètre de paillasse avant de commencer le titrage.
- Démarrez le titrage et mesurez le pH de la solution analysée après chaque portion ajoutée de 0,5 mL du titrant.
- Stockez les données expérimentales dans un tableau contenant le volume du titrant appliqué et la valeur correspondante du pH.
- Arrêtez le titrage lorsqu’une valeur approximativement constante du pH est atteinte en augmentant le volume de la solution titrante.
- Tracez les données expérimentales sous la forme de courbes de titrage différentielles de dérivée zéro, première et dérivée seconde.
- Déterminer les points équivalents et les volumes équivalents correspondants des titrants utilisés.
- Calculer le contenu des groupes basiques acides Aaet Abà la surface des particules de lignine déchargées et chargées en flavonoïdes à l’aide des équations (3) et (4) :
 , mgeq/g (3)
, mgeq/g (3)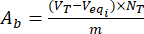 mgeq/g (4)
mgeq/g (4)
où Veqi est le volume équivalent (mL) ; NT la normalité du titrant (mgeqv/mL) ; VT le volume du titrant utilisé pour la procédure de détermination (mL) ; m le poids de l’échantillon analysé (g).
- Détermination du point de charge zéro (pHPZC) des particules à base de lignine par la méthode de l’addition solide.
- Préparez 60 mL de solution aqueuse de NaCl à 0,1 M.
- Ajouter 9 mL de la solution de NaCl 0,1 M dans chacun des cinq fioles coniques bouchées et ajuster le pHà pH i = 2, 4, 7, 10 et 12 (où i = 1-5 désigne le numéro de la solution correspondante), respectivement par l’ajout de 0,1 M de HCl ou de 0,1 M de NaOH. Ajuster le volume total de la solution dans chaque fiole à 10 mL exactement en ajoutant une solution de NaCl de même concentration.
- Ajouter 40 mg de particules de lignine sèches (micro/submicroniques non chargées en flavonoïdes) dans chaque fiole et boucher les flacons en toute sécurité.
- Fixer les flacons à la verticale sur un agitateur orbital et les maintenir en mouvement pendant 24 h.
- Laisser l’équilibre pendant 30 minutes et mesurer ensuite le pH final (pHf) des surnageants dans chaque flacon.
- Tracer les valeurs de pHf par rapport aux valeurs de pH initiales correspondantes (pHi).
- Le point de charge nulle (pHPZC) est défini comme la valeur du pH à laquelle la courbe ΔpH en fonction du pHi coupe la droite avec les coordonnées (pHi ; pHi).
- Détermination de la teneur phénolique totale (TPC) des particules de lignine
REMARQUE : La teneur phénolique totale (TPC) des particules de lignine micro-/submicroniques est déterminée par une méthode colorimétrique Folin-Ciocalteu modifiée.- Mélanger 200 μL d’une suspension aqueuse de particules d’une concentration de 500 μg/mL avec 600 μL d’eau ultrapure et 200 μL de réactif Folin-Ciocalteu (1:1, v/v).
- Après 5 min, ajoutez 1,0 mL de Na2CO3 à 8 % et 1,0 mL d’eau Milli-Q au mélange et incubez-le dans l’obscurité à 40 °C pendant 30 min dans un bain-marie à agitation intermittente.
- Centrifuger la suspension à 5 300 × g pendant 2 min.
- Préparez un blanc sans particules.
- Transférez 3,5 mL du surnageant dans une cuvette en quartz de 10 mm et mesurez l’absorbance sur un spectrophotomètre UV/Vis dans la région visible à 760 nm contre le blanc.
- Préparer une courbe d’étalonnage de l’acide gallique étalon en suivant les étapes 5.3.1 à 5.3.5 ; seulement, au lieu de 200 μL de suspension de particules de lignine, utilisez la solution éthanolique d’acide gallique avec des concentrations initiales de 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 et 200 μg/mL.
- Exprimer les données expérimentales des microparticules en mg d’équivalents d’acide gallique en milligrammes par gramme d’échantillon sec (mg GAE/g).
- Calculer le TPC à l’aide de l’équation (5) :
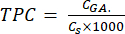 mg GAE/g (5)
mg GAE/g (5)
où CGA est la concentration de l’échantillon équivalente à la concentration d’acide gallique étalon obtenue à partir de la courbe d’étalonnage de l’acide (μg GA/mL) ; Cs est la concentration de l’échantillon, qui est égale à la masse de l’échantillon sec divisée par le volume du solvant (μg/mL).
6. Détermination de la capacité de libération in vitro des particules de lignine
- Préparez 250 mL de milieu gastrique exempt d’enzymes simulé en ajustant le pH d’une solution étalon de PBS avec 0,1 M HCl à pH = 1,2.
- Préparez 250 mL de chacune des deux solutions de liquide intestinal simulé en ajustant le pH de la solution étalon de PBS avec 0,1 M de NaOH/0,1 M HCl à pH = 6,8 et 7,4, respectivement.
- Ajouter 25 mg de particules microscopiques ou submicroniques encapsulées dans des flavonoïdes à 50 ml de milieu gastrique exempt d’enzymes simulé dans un réacteur discontinu en verre équipé d’un agitateur mécanique et le placer dans un bain d’eau thermale à une température constante de T = 37 ± 0,2 °C.
- Trempez l’agitateur à une profondeur de 2/3 du volume de liquide pour assurer un mélange complet des phases solide et liquide et assurer un transfert de masse maximal sans zones stagnantes.
- Prélever 1 mL d’échantillon du réacteur toutes les 10 min jusqu’à la 90e minute et pipeter immédiatement 1 mL de solution de fluide simulé fraîche dans le réacteur pour éviter toute modification du volume total et pour assurer les conditions de l’évier.
- Répétez la même procédure, y compris les étapes 6.3 à 6.6 avec les deux solutions de liquide intestinal simulé avec un pH = 6,8 et 7,4, respectivement, pendant 200 min.
- Effectuez des expériences analogues avec des particules de lignine déchargées dans les trois milieux simulés et utilisez les échantillons comme blancs pour la mise à zéro du spectrophotomètre.
- Déterminer l’absorption des échantillons par spectrophotométrie après les avoir filtrés et dilués avec de l’EtOH à 96 % contre les échantillons blancs de l’étape 6.7 et calculer la concentration correspondante de flavonoïdes à l’aide des courbes d’étalonnage correspondantes de morin obtenues à pH = 1,2, 6,8 et 7,4, respectivement.
- Calculer le rejet cumulatif (CR) des bioflavonoïdes à l’aide de l’équation (6) en μg/mL et le pourcentage de rejet cumulatif (CRP) à l’aide de l’équation (7) :
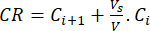 (6)
(6)
où Ci et Ci+1 sont les concentrations de morin/quercétine dans les ième et (i+1) ème échantillons (μg/mL) ; Vs le volume de l’échantillon prélevé dans le réacteur discontinu (mL) ; V : le volume total du support simulé (mL).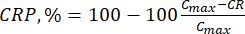 (7)
(7)
où Cmax est la concentration maximale du composé biologiquement actif dans le support (μg/mL).
7. Analyses statistiques
- Exprimer les données expérimentales en moyennes ±écarts-types (ET) de trois mesures indépendantes.
- Déterminez la signification statistique des résultats expérimentaux en effectuant le test ANOVA comme test post-hoc. Considérons une valeur de p < 0,05 statistiquement significative.
Résultats
Une technique de précipitation anti-solvant a été exécutée pour produire des particules de lignine alcaline micro-/submicroniques. Une solution aqueuse d’acide inorganique dilué-acide nitrique/acide organique-acide citrique a été dispersée dans une solution aqueuse de lignine alcaline, enrichie d’un tensioactif/éthanol écologique, ce qui a entraîné la précipitation progressive du soluté biopolymère et, après sonication, une suspension de particules compactes micro/submicroniques a finalement été pr...
Discussion
Parmi les principaux problèmes critiques des méthodologies de synthèse modernes pour la conception de formulations de supports de médicaments à base de biopolymères figure l’application de réactifs organiques dangereux - solvants volatils et inflammables, tels que le tétrahydrofurane, l’acétone, le méthanol et même le DMSO à des concentrations élevées - ce qui limite leur applicabilité dans la biomédecine, l’industrie pharmaceutique et la technologie alimentaire en raison de la manifestation d’eff...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été soutenue par le Fonds scientifique bulgare dans le cadre du contrat n° KΠ-06 H59/3 et par le projet scientifique n° 07/2023 FVM, Université Trakia.
matériels
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Références
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -. A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041 (2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -. T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592 (2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573 (2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070 (2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793 (2023).
- Gala Morena, A., Tzanov, T. z. Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705 (2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067 (2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650 (2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -. L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487 (2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), 2471 (2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367 (2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52 (2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31 (2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031 (2020).
- Yaneva, Z., Georgieva, N., Grumezescu, A. M. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. , 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon