É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese Verde, Caracterização, Encapsulamento e Medição do Potencial de Liberação de Novas Partículas Micro/Submicrônicas de Lignina Alcalina
Neste Artigo
Resumo
Descrevemos novas metodologias simples de síntese e caracterização de partículas micro e submicrônicas de lignina biocompatíveis. Essas formulações fornecem uma abordagem fácil para a utilização do heteropolímero, bem como uma alternativa para o projeto racional de matrizes carreadoras multifuncionais com potencial aplicabilidade em biomedicina, tecnologia farmacêutica e indústria alimentícia.
Resumo
A aplicabilidade da micro/nanotecnologia de biopolímeros em medicina humana, veterinária, farmacêutica e alimentícia está crescendo rapidamente devido ao grande potencial das partículas baseadas em biopolímeros como sistemas de transporte eficazes. O uso da lignina como biomatriz heteropolimérica básica para o projeto de formulações micro/submicrométricas inovadoras permite a obtenção de maior biocompatibilidade e oferece vários grupos funcionais ativos apresentando oportunidades para personalização das propriedades físico-químicas e bioatividades das formulações para diversas aplicações. O objetivo do presente estudo foi desenvolver uma metodologia simples e ecologicamente correta para a síntese de partículas de lignina com tamanho micro e submicrométrico; avaliar suas características físico-químicas, espectrais e estruturais; e examinar sua capacidade de encapsulamento de moléculas biologicamente ativas e potencial de liberação in vitro de bioflavonóides em meios gastrointestinais simulados. As metodologias apresentadas aplicam solventes baratos e verdes; processos fáceis, diretos, rápidos e sensíveis que requerem pouco equipamento, substâncias não tóxicas e métodos simples para sua caracterização, a determinação da capacidade de encapsulação dos compostos bioativos pouco solúveis em água morin e quercetina, e o potencial de liberação in vitro das matrizes de lignina.
Introdução
Atualmente, a inclinação para biopolímeros como celulose, quitosana, colágeno, dextrana, gelatina e lignina como precursores para o projeto de transportadores micro/submicrométricos com tamanho, propriedades físico-químicas e biofuncionalidades personalizáveis aumentou nas indústrias biomédica, farmacêutica e de tecnologia de alimentos devido à sua aplicabilidade em engenharia de tecidos, bioimpressão 3D, in vitro plataformas de modelagem de doenças, indústria de embalagens, preparação de emulsões e entrega de nutrientes, entre outros 1,2,3.
Novos estudos destacam os aspectos dos hidrogéis à base de lignina, bem como das micro e nanoformulações4 como veículos vantajosos usados para materiais de embalagem de alimentos5, armazenamento de energia6, cosméticos7, estabilizadores térmicos/leves, materiais reforçados e matrizes transportadoras de medicamentos8 para a entrega de moléculas hidrofóbicas, melhoria das barreiras UV9, como agentes de reforço em nanocompósitos, e como alternativa às nanopartículas inorgânicas devido a alguns problemas de segurança recentes 10,11,12. A razão por trás dessa tendência é a biocompatibilidade, biodegradabilidade e não toxicidade do heterobiopolímero natural, bem como suas bioatividades comprovadas de potencial antioxidante de lignina e atividades antiproliferativas e antimicrobianas 13,14,15,16,17.
A literatura científica relata vários métodos de síntese (automontagem, precipitação anti-solvente, precipitação ácida e deslocamento de solvente)18 e caracterização de formulações à base de lignina em escala micro/nano, incluindo a aplicação de solventes caros ou prejudiciais, como tetrahidrofurano (THF), dimetilsulfóxido (DMSO), N,N-dimetilformamida (DMF) e acetona, e processos complicados, indiretos e tediosos que usam muitos equipamentos e substâncias tóxicas 12,19,20.
Para superar as últimas desvantagens, os seguintes protocolos apresentam novas metodologias para a síntese de partículas micro/submicrônicas à base de lignina usando solventes baratos e verdes; Processos fáceis, diretos, rápidos e sensíveis, exigindo poucos equipamentos, substâncias não tóxicas e métodos simples para sua caracterização e determinação da capacidade de encapsulação de compostos bioativos pouco solúveis em água e potencial de liberação in vitro das matrizes de lignina. Os métodos de produção em escala laboratorial apresentados são vantajosos para a fabricação de carreadores de lignina funcionais com tamanhos ajustáveis, alta capacidade de encapsulação e comportamento de liberação in vitro sustentável, utilizando procedimentos simples de caracterização e produtos químicos ecologicamente corretos que podem encontrar aplicação em várias áreas das ciências biomédicas e tecnologia de alimentos. Dois flavonóides foram aplicados como moléculas-alvo encapsuladas nas partículas de lignina: morina-nas micropartículas e quercetina-nas partículas submicrônicas. A diferença nas estruturas de ambos os flavonóides é apenas a posição do segundo grupo -OH no anel B-aromático: o grupo -OH está na posição 2' na morina e na posição 3' na quercetina, portanto, ambos os compostos orgânicos são isômeros posicionais. Este último fato pressupõe comportamento semelhante de ambos os compostos naturais bioativos nos processos de encapsulamento e/ou liberação.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Síntese de micropartículas de lignina
- Preparar uma solução aquosa de lignina alcalina a 50 mg/ml dissolvendo 2,5 g de lignina alcalina em 50 ml de água ultrapura num agitador magnético.
- Prepare a solução de Tween 80 a 1% dissolvendo 1 mL de Tween 80 em 100 mL de água ultrapura.
- Prepare uma solução 2 M de HNO3 diluindo 6,65 mL de 67% de HNO3 (densidade = 1,413 g / mL) com água ultrapura até um volume final de 50 mL.
- Adicione lentamente 15 mL da solução Tween 80 a 1% a 50 mL da solução alcalina de lignina a 50 mg / mL.
- Agitar a mistura num agitador magnético a 500 rpm durante 10 min para que o tensioactivo fique bem disperso.
- Adicione 20 mL de 2 M HNO3 gota a gota com uma seringa a uma taxa de fluxo de aproximadamente 150 μL / s à mistura.
- Continue mexendo a mistura por 30 min quando a solução marrom escura for transformada em uma suspensão marrom clara de micropartículas.
- Transfira a suspensão para tubos de ensaio de 1,5-2 mL e centrifugue por 30 min a 15.000 × g em uma ultracentrífuga a 10 °C.
- Recolha o sobrenadante para análises posteriores e lave as micropartículas com água ultrapura.
- Repita os procedimentos de enxágue/ultracentrifugação 3x.
- Mergulhe o recipiente com as micropartículas em um banho de gelo antes da homogeneização ultrassônica.
- Homogeneizar as micropartículas por 4 min a uma intensidade de 93% em um homogeneizador de ultrassom.
- Liofilize as micropartículas a uma temperatura de -64 °C em um liofilizador e armazene-as em um exicador para uso posterior.
2. Síntese de partículas submicrônicas de lignina
- Preparar uma solução aquosa de lignina alcalina a 5 mg/ml dissolvendo 125 mg de lignina alcalina em 25 ml de água ultrapura num agitador magnético.
- Adicione lentamente 1 mL de EtOH a 96% à solução alcalina de lignina.
- Agite a mistura em um agitador magnético a 500 rpm por 3 min.
- Prepare 50 mL de uma solução de ácido cítrico a 1% dissolvendo 0,5 g de ácido cítrico em água ultrapura até um volume final de 50 mL.
- Adicione 7 mL de ácido cítrico a 1% gota a gota com uma seringa a uma taxa de fluxo de aproximadamente 4 mL / min à mistura.
- Continue mexendo a mistura por 10 minutos quando a solução marrom clara se transformar em uma suspensão marrom clara turva de partículas submicrônicas.
- Transferir a suspensão para tubos de ensaio e centrifugar durante 30 min a 15.000 × g numa ultracentrífuga a 10 °C.
- Recolha o sobrenadante para análises posteriores e lave as micropartículas com água ultrapura.
- Repita os procedimentos de enxágue/ultracentrifugação 3x.
- Mergulhe o recipiente com as micropartículas em um banho de gelo antes da homogeneização ultrassônica.
- Homogeneizar as micropartículas por ultrassom por dois ciclos de 4 min cada a uma intensidade de 96% em um homogeneizador de ultrassom.
- Resfrie os recipientes por 1 min após o primeiro ciclo.
- Liofilize as micropartículas a uma temperatura de -64 °C em um liofilizador e armazene-as em um exicador para uso posterior.
3. Síntese de partículas micro/submicrônicas de lignina encapsuladas em flavonóides naturais
- Repita as etapas 1.1-1.5 para as micropartículas.
- Pesar 0,08 g de morin, dissolver em 1 ml de EtOH e adicionar esta solução etanólica à mistura.
- Agite a mistura em um agitador magnético a 500 rpm por 20 min.
- Adicione 20 mL de 2 N HNO3 gota a gota com uma seringa a uma taxa de fluxo de aproximadamente 150 μL / s à mistura.
- Continue mexendo a mistura por 60 min.
- Repita as etapas 1.8-1.13.
- Repita a etapa 2.1 para as partículas submicrônicas.
- Pesar 0,04 g de quercetina, dissolver em 1 mL de EtOH e adicionar esta solução etanólica à solução aquosa de lignina alcalina.
- Agite a mistura em um agitador magnético a 500 rpm por 10 min.
- Repita as etapas 2.4-2.13.
4. Determinação da eficiência de encapsulação de micro / sumicropartículas de lignina
- Calcular o teor da substância bioactiva adicionada durante o procedimento de síntese de ambos os tipos de partículas de lignina encapsuladas em flavonóides.
- Determinar espectrofotometricamente a absorção do flavonóide no sobrenadante obtido durante as etapas 1.9 e 2.8 após diluição com EtOH a 96%.
- Calcular a concentração da morina/quercetina não aprisionada utilizando as curvas de calibração dos flavonóides.
- Calcular a eficiência de encapsulação (EE, %) das micropartículas de lignina em relação aos flavonóides naturais utilizando a equação (1):
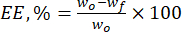 Características (1)
Características (1)
Em que wo é a quantidade total da substância bioativa adicionada (mg) e wf é a quantidade de flavonóide (mg) livre não aprisionado. - Calcule a capacidade de carga de medicamentos (DLC, %) - um parâmetro importante que representa a quantidade de medicamentos nas partículas por unidade de peso do sistema transportador - usando a eq. (2):
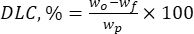 (2)
(2)
Onde wp é a quantidade total (rendimento) de partículas de lignina micro/submicrônica obtidas após liofilização (mg).
5. Caracterização de partículas micro e submicrônicas de lignina
- Determinação do número de partículas, tamanho e distribuição de tamanho
- Avalie o tamanho das partículas e a distribuição do tamanho das partículas das amostras usando um contador automático de células com a opção de contagem de contas. Adicionar com uma micropipeta 1 μL da suspensão de partículas micro/submicrônicas de lignina/flavonóide em água ultrapura no poço da lâmina de contagem necessária para a operação.
- Aguarde até que o número de partículas em 1 mL da suspensão, bem como seu número e distribuição por tamanho sejam mostrados no display do contador automático de células.
NOTA: O aparelho permite o armazenamento dos dados em um flash USB. O software especial do contador automático de células permite o processamento adicional dos arquivos digitais e fotográficos salvos.
- Determinação do teor de grupos ácidos/básicos de superfície de partículas de lignina por titulação potenciométrica
- Peso 0,04 g de partículas de lignina não carregadas/encapsuladas em flavonóides.
- Transferi-los para um Erlenmeyer, adicionar 10 ml de HCl 0,1 M e colocar o balão num agitador magnético a 250 rpm.
- Encha uma bureta de 50 mL com uma solução-padrão 0,1 M do titulante NaOH.
- Medir o pH inicial da solução no erlenmeyer com um medidor de pH de bancada antes de iniciar a titulação.
- Inicie a titulação e meça o pH da solução analisada após cada porção adicionada de 0,5 mL do titulante.
- Armazene os dados experimentais em uma tabela contendo o volume do titulante aplicado e o valor correspondente de pH.
- Pare a titulação quando um valor aproximadamente constante do pH for atingido aumentando o volume da solução titulante.
- Traçar os dados experimentais sob a forma de curvas de titulação diferenciais zero, primeira e segunda derivadas.
- Determinar os pontos equivalentes e os volumes equivalentes correspondentes dos titulantes utilizados.
- Calcule o conteúdo dos grupos básicos ácidos A, ae Abna superfície de partículas de lignina carregadas e carregadas com flavonóides usando as equações (3) e (4):
 , mgeq/g (3)
, mgeq/g (3)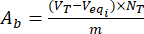 mgeq/g (4)
mgeq/g (4)
Onde Veqi é o volume equivalente (mL); NT a normalidade do titulante (mgeqv/mL); VT o volume do titulante utilizado para o procedimento de determinação (ml); m peso da amostra analisada (g).
- Determinação do ponto de pH de carga zero (pHPZC) de partículas à base de lignina pelo método de adição sólida.
- Prepare 60 mL de solução aquosa 0,1 M de NaCl.
- Adicionar 9 ml da solução de NaCl 0,1 M em cada um dos cinco frascos cónicos tapados e ajustar o pH para pHi = 2, 4, 7, 10 e 12 (em que i = 1-5 indica o número da solução correspondente), respectivamente pela adição de HCl 0,1 M ou NaOH 0,1 M. Ajustar o volume total da solução em cada balão para 10 ml exactamente, adicionando solução de NaCl com a mesma dosagem.
- Adicionar 40 mg de partículas de lignina secas (micro/submicrônicas carregadas de flavonóides sem carga) a cada balão e tampar bem os frascos.
- Fixar os frascos na posição vertical num agitador orbital e mantê-los agitados durante 24 h.
- Deixar o equilíbrio durante 30 minutos e, em seguida, medir o pH final (pHf) dos sobrenadantes em cada balão.
- Representar graficamente os valores de pHf em relação aos valores de pH iniciais correspondentes (pHi).
- O ponto de carga zero (pHPZC) é definido como o valor do pH no qual a curva ΔpH versus pHi cruza a linha reta com coordenadas (pHi; pHi).
- Determinação do teor de fenólicos totais (TPC) de partículas de lignina
NOTA: O conteúdo fenólico total (TPC) das partículas de lignina micro/submicrônica é determinado por meio de um método colorimétrico de Folin-Ciocalteu modificado.- Misturar 200 μL de uma suspensão aquosa de partículas com uma concentração de 500 μg/ml com 600 μL de água ultrapura e 200 μL de reagente Folin-Ciocalteu (1:1, v/v).
- Após 5 min, adicione 1,0 mL de 8% de Na2CO3 e 1,0 mL de água Milli-Q à mistura e incube-a no escuro a 40 °C por 30 min em banho-maria com agitação intermitente.
- Centrifugue a suspensão a 5.300 × g por 2 min.
- Prepare um espaço em branco sem partículas.
- Transferir 3,5 ml do sobrenadante para uma cubeta de quartzo de 10 mm e medir a absorvância num espectrofotómetro UV/Vis na região visível a 760 nm em relação ao branco.
- Preparar uma curva de calibração do ácido gálico padrão seguindo os passos 5.3.1-5.3.5; apenas em vez de 200 μL da suspensão de partículas de lignina, usar a solução etanólica de ácido gálico com concentrações iniciais de 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 e 200 μg/mL.
- Expresse os dados experimentais das micropartículas em mg de equivalentes de ácido gálico em miligramas por grama de amostra seca (mg GAE/g).
- Calcular o TPC utilizando a equação (5):
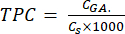 mg GAE/g (5)
mg GAE/g (5)
Em que CGA é a concentração da amostra equivalente à concentração do ácido gálico padrão obtida a partir do gráfico de calibração do ácido (μg GA/ml); Cs é a concentração da amostra, que é igual à massa da amostra seca dividida pelo volume do solvente (μg/ml).
6. Determinação da capacidade de libertação in vitro de partículas de lignina
- Prepare 250 mL de meio gástrico livre de enzimas simulado ajustando o pH da solução padrão de PBS com HCl 0,1 M para pH = 1,2.
- Prepare 250 mL de cada uma das duas soluções de fluido intestinal simuladas, ajustando o pH da solução padrão de PBS com 0,1 M NaOH / 0,1 M HCl para pH = 6,8 e 7,4, respectivamente.
- Adicionar 25 mg de partículas micro/submicrônicas encapsuladas em flavonóides a 50 ml do meio gástrico sem enzimas simulado num reator de vidro fornecido com um agitador mecânico e colocá-lo em banho-maria termal a uma temperatura constante de T = 37 ± 0,2 oC.
- Mergulhe o agitador a uma profundidade de 2/3 do volume do líquido para garantir a mistura completa das fases sólida e líquida e garantir a transferência máxima de massa sem zonas estagnadas.
- Retire 1 mL de amostra do reator a cada 10 min até o90º min e pipete imediatamente 1 mL de solução fluida simulada fresca no reator para evitar a alteração do volume total e para garantir as condições de afundamento.
- Repita o mesmo procedimento, incluindo as etapas 6.3-6.6, com ambas as soluções de fluido intestinal simuladas com pH = 6.8 e 7.4, respectivamente, por 200 min.
- Realizar experimentos análogos com partículas de lignina descarregadas nos três meios simulados e usar as amostras como espaços em branco para zerar o espectrofotômetro.
- Determinar espectrofotometricamente a absorção das amostras após filtrá-las e diluí-las com EtOH a 96% em relação às amostras em branco da etapa 6.7 e calcular a concentração de flavonóides correspondente usando as curvas de calibração correspondentes de morin obtidas em pH = 1,2, 6,8 e 7,4, respectivamente.
- Calcular a libertação cumulativa (CR) dos bioflavonóides utilizando a equação (6) em μg/ml e a percentagem de libertação cumulativa (PCR) pela equação (7):
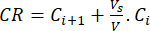 (6)
(6)
Em que Ci e Ci+1 são as concentrações de morina/quercetina nasi-ésima e (i+1)ésima amostras (μg/ml); Vs o volume de amostra retirado do reator em batelada (mL); V o volume total do meio simulado (mL).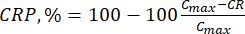 (7)
(7)
Onde Cmax é a concentração máxima do composto biologicamente ativo no transportador (μg/mL).
7. Análises estatísticas
- Expresse os dados experimentais como médias ± desvios padrão (DP) de três medições independentes.
- Determine a significância estatística dos resultados experimentais realizando o teste ANOVA como teste post hoc. Considere-se um valor de p < 0,05 estatisticamente significativo.
Access restricted. Please log in or start a trial to view this content.
Resultados
Uma técnica de precipitação anti-solvente foi executada para produzir partículas alcalinas de lignina micro/submicrônica. Uma solução aquosa de ácido inorgânico diluído-ácido nítrico/ácido orgânico-ácido cítrico foi dispersa em uma solução aquosa de lignina alcalina, enriquecida com um surfactante/etanol ecologicamente correto, o que resultou na precipitação gradual do soluto do biopolímero e, após a sonicação, uma suspensão de partículas compactas de micro/submícron foi finalmente produzida (<...
Access restricted. Please log in or start a trial to view this content.
Discussão
Entre as principais questões críticas das modernas metodologias de síntese para o projeto de formulações de carreadores de fármacos à base de biopolímeros está a aplicação de reagentes orgânicos perigosos - solventes voláteis e inflamáveis, como tetrahidrofurano, acetona, metanol e até DMSO em altas concentrações - o que limita sua aplicabilidade na biomedicina, indústria farmacêutica e tecnologia de alimentos devido à manifestação de possíveis efeitos tóxicos20,
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este estudo foi apoiado pelo Fundo Científico da Bulgária sob o Contrato nº KΠ-06 H59/3 e pelo Projeto Científico nº 07/2023 FVM, Universidade de Trakia.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Referências
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados