JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Green Synthesis, Characterization, Encapsulation, and Measurement of the Release Potential of Novel Alkali Lignin Micro-/Submicron Particles(새로운 알칼리 리그닌 마이크로/서브미크론 입자의 방출 가능성 측정)
요약
우리는 생체 적합성 리그닌 마이크로 및 서브미크론 입자의 합성 및 특성 분석을 위한 새롭고 간단한 방법론을 설명합니다. 이러한 제형은 헤테로폴리머의 활용을 위한 용이한 접근 방식을 제공할 뿐만 아니라 생물 의학, 제약 기술 및 식품 산업에서 잠재적으로 적용 가능한 다기능 캐리어 매트릭스의 합리적인 설계를 위한 대안을 제공합니다.
초록
인간, 수의학, 제약 및 식품 기술에서 생체 고분자 마이크로/나노 기술의 적용 가능성은 효과적인 운반 시스템으로서 생체 고분자 기반 입자의 큰 잠재력으로 인해 빠르게 성장하고 있습니다. 리그닌을 혁신적인 마이크로/서브미크론 제형의 설계를 위한 기본 헤테로폴리머 생체 매트릭스로 사용하면 생체 적합성을 높일 수 있으며 다양한 활성 작용기를 제공하여 다양한 응용 분야에 대한 제형의 물리화학적 특성 및 생체 활성을 맞춤화할 수 있는 기회를 제공합니다. 본 연구의 목적은 마이크로 및 서브미크론 크기의 리그닌 입자를 합성하기 위한 간단하고 친환경적인 방법론을 개발하는 것이었습니다. 그들의 물리화학적, 스펙트럼적, 구조적 특성을 평가하기 위해; 그리고 생물학적으로 활성 분자를 캡슐화할 수 있는 능력과 시뮬레이션된 위장 매체에서 바이오플라보노이드의 체외 방출 가능성을 조사합니다. 제시된 방법론은 저렴하고 친환경적인 용매를 적용합니다. 적은 장비, 무독성 물질, 간단한 특성 분석 방법, 수용성이 낮은 생체 활성 화합물인 모린 및 퀘르세틴에 대한 캡슐화 용량 측정, 리그닌 매트릭스의 체외 방출 잠재력이 필요한 쉽고 간단하며 빠르고 민감한 공정.
서문
오늘날 셀룰로오스, 키토산, 콜라겐, 덱스트란, 젤라틴 및 리그닌과 같은 바이오 폴리머에 대한 경향은 조직 공학, 3D 바이오프린팅, 체외에서의 적용 가능성으로 인해 생물 의학, 제약 및 식품 기술 산업에서 맞춤형 크기, 물리화학적 특성 및 생체 기능을 갖춘 마이크로/서브미크론 캐리어 설계의 전구체로 증가하고 있습니다 질병 모델링 플랫폼, 포장 산업, 에멀젼 준비 및 영양소 전달 등 1,2,3.
새로운 연구에서는 리그닌 기반 하이드로겔과 마이크로 및 나노 제형4이 식품포장재5, 에너지 저장6, 화장품7, 열/광 안정제, 강화 재료 및 소수성 분자 전달, UV 장벽개선9을 위한 약물 전달 매트릭스8에 사용되는 유리한 수단으로서의 측면을 강조합니다, 나노 복합 재료의 강화제로, 그리고 최근의 안전 문제로 인해 무기 나노 입자의 대안으로 사용됩니다 10,11,12. 이러한 경향의 원인은 천연 헤테로 바이오 폴리머의 생체 적합성, 생분해성 및 무독성뿐만 아니라 리그닌 항산화 잠재력 및 라디칼 소거, 항증식 및 항균 활성의 입증 된 생체 활성입니다 13,14,15,16,17.
과학 문헌에 따르면 테트라하이드로푸란(THF), 디메틸 설폭사이드(DMSO), N,N-디메틸포름아미드(DMF) 및 아세톤과 같은 비싸거나 유해한 용매의 적용을 포함하여 리그닌 기반 마이크로/나노 스케일 제형의 다양한 합성 방법(자체 조립, 반용매 침전, 산 침전 및 용매 이동)18 및 특성 분석, 많은 장비와 독성 물질을 사용하는 복잡하고 간접적이며 지루한 공정을 포함합니다12,19,20.
후자의 단점을 극복하기 위해 다음 프로토콜은 저렴하고 친환경적인 용매를 사용하여 리그닌 기반 마이크로/서브미크론 입자를 합성하기 위한 새로운 방법론을 제시합니다. 쉽고 간단하며 빠르고 민감한 공정으로 적은 장비, 무독성 물질, 특성 분석 및 수용성이 낮은 생체 활성 화합물에 대한 캡슐화 용량 및 리그닌 매트릭스의 체외 방출 가능성 측정을 위한 간단한 방법을 필요로 합니다. 제시된 실험실 규모의 생산 방법은 생물 의학 및 식품 기술의 다양한 분야에서 응용할 수 있는 간단한 특성 분석 절차와 친환경 화학 물질을 활용하여 조정 가능한 크기, 높은 캡슐화 용량 및 지속 가능한 체외 방출 거동을 가진 기능성 리그닌 운반체의 제조에 유리합니다. 두 개의 플라보노이드를 리그닌 입자에 캡슐화된 표적 분자로 적용했습니다: 모린-미립자로, 퀘르세틴-서브미크론 입자로. 두 플라보노이드의 구조에 있는 다름은 B 방향족 반지에 있는 두번째 -OH 그룹의 위치만 입니다: -OH 그룹은 모린에 있는 2' 위치와 퀘르세틴에 있는 3' 위치에 있습니다, 따라서 두 유기 화합물 다 위치 이성질체입니다. 후자의 사실은 캡슐화 및/또는 방출 과정에서 두 생체 활성 천연 화합물의 유사한 행동을 가정합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 리그닌 미세입자의 합성
- 자기 교반기에 50mL의 초순수에 알칼리 리그닌 2.5g을 용해시켜 50mg/mL 알칼리 리그닌 수용액을 준비합니다.
- 1mL의 Tween 80을 1mL의 초순수에 100mL를 용해시켜 80% Tween 80 용액을 준비합니다.
- 6.65mL의 67% HNO3(밀도 = 1.413g/mL) 6.65mL를 초순수로 희석하여 최종 부피 50mL로 HNO3 2M 용액을 준비합니다.
- 1% Tween 80 용액 15mL를 50mg/mL 알칼리 리그닌 용액 50mL에 천천히 추가합니다.
- 계면활성제가 잘 분산되도록 500rpm에서 자성 교반기에서 혼합물을 10분 동안 교반합니다.
- 약 150 μL/s의 유속으로 주사기로 20 mL의 2 M HNO3 를 적가합니다.
- 짙은 갈색 용액이 미립자의 밝은 갈색 현탁액으로 변할 때 혼합물을 30분 동안 계속 저어줍니다.
- 현탁액을 1.5-2mL 시험관으로 옮기고 10°C의 초원심분리기에서 15,000× g 으로 30분 동안 원심분리합니다.
- 추가 분석을 위해 상층액을 수집하고 초순수로 미세입자를 헹굽니다.
- 헹굼/초원심분리 절차를 3번 반복합니다.
- 초음파 균질화 전에 미세 입자가 담긴 용기를 얼음 욕조에 담그십시오.
- 초음파 균질화기에서 93% 강도로 4분 동안 미세입자를 균질화합니다.
- 동결 건조기에서 -64 °C의 온도에서 미세 입자를 동결 건조하고 나중에 사용할 수 있도록 엑시케이터에 보관합니다.
2. 리그닌 서브미크론 입자의 합성
- 자기 교반기에 25mL의 초순수에 125mg의 알칼리 리그닌을 용해시켜 5mg/mL 알칼리 리그닌 수용액을 준비합니다.
- 알칼리 리그닌 용액에 96% EtOH 1mL를 천천히 첨가합니다.
- 500rpm의 자기 교반기에서 혼합물을 3분 동안 교반합니다.
- 구연산 0.5g을 초순수에 50mL의 최종 부피로 녹여 50mL의 구연산 1% 용액 50mL를 준비합니다.
- 약 4mL/분의 유속으로 주사기로 7mL의 1% 구연산을 적가합니다.
- 갈색의 맑은 용액이 미크론 이하의 입자의 흐린 밝은 갈색 현탁액으로 변할 때 혼합물을 10분 동안 계속 저어줍니다.
- 현탁액을 시험관과 원심분리기로 옮기고 10°C의 초원심분리기에서 15,000× g 에서 30분 동안 원심분리합니다.
- 추가 분석을 위해 상층액을 수집하고 초순수로 미세입자를 헹굽니다.
- 헹굼/초원심분리 절차를 3번 반복합니다.
- 초음파 균질화 전에 미세 입자가 담긴 용기를 얼음 욕조에 담그십시오.
- 초음파 균질화기에서 96%의 강도로 각각 4분씩 두 주기 동안 미세입자를 초음파로 균질화합니다.
- 첫 번째 주기 후 1분 동안 용기를 식힙니다.
- 동결 건조기에서 -64 °C의 온도에서 미세 입자를 동결 건조하고 나중에 사용할 수 있도록 엑시케이터에 보관합니다.
3. 천연 플라보노이드 캡슐화 리그닌 마이크로/서브미크론 입자의 합성
- 미세 입자에 대해 1.1-1.5단계를 반복합니다.
- 0.08g의 모린을 칭량하고 EtOH 1mL에 용해시킨 다음 이 에탄올 용액을 혼합물에 첨가합니다.
- 500rpm의 자기 교반기에서 혼합물을 20분 동안 교반합니다.
- 약 150 μL/s의 유속으로 주사기로 2 N HNO3 20 mL를 적가시킵니다.
- 혼합물을 60분 동안 계속 저어줍니다.
- 1.8-1.13단계를 반복합니다.
- 서브미크론 입자에 대해 2.1단계를 반복합니다.
- 퀘르세틴 0.04g을 무게화하고 1mL EtOH에 용해시키고 이 에탄올 용액을 알칼리 리그닌 수용액에 첨가합니다.
- 500rpm의 자기 교반기에서 혼합물을 10분 동안 교반합니다.
- 2.4-2.13단계를 반복합니다.
4. 리그닌 마이크로/수마이크로 입자의 캡슐화 효율 측정
- 두 가지 유형의 플라보노이드 캡슐화된 리그닌 입자의 합성 절차 중에 첨가된 생체 활성 물질의 함량을 계산합니다.
- 96% EtOH로 희석한 후 1.9 및 2.8단계에서 얻은 상층액에서 플라보노이드의 흡수를 분광 광도계로 결정합니다.
- 플라보노이드의 보정 곡선을 사용하여 포획되지 않은 모린/퀘르세틴의 농도를 계산합니다.
- 방정식 (1)을 사용하여 천연 플라보노이드에 대한 리그닌 미세입자의 캡슐화 효율(EE, %)을 계산합니다.
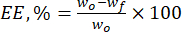 (1)
(1)
여기서 w는 첨가된 생리활성물질의 총량(mg)이고,wf 는 유리, 비포획 플라보노이드(mg)의 양이다. - 식 (2)를 사용하여 운반체 시스템의 단위 중량당 입자 내 약물의 양을 나타내는 중요한 매개변수인 약물 적재 용량(DLC, %)을 계산합니다.
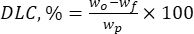 (2)
(2)
여기서wp 는 동결건조(mg) 후 얻어진 리그닌 마이크로/서브미크론 입자의 총량(수율)입니다.
5. 리그닌 미세론 및 서브미크론 입자의 특성 분석
- 입자 수, 크기 및 크기 분포 결정
- 비드 계수 옵션이 있는 자동 셀 카운터를 사용하여 시료의 입자 크기 및 입자 크기 분포를 평가합니다. 마이크로피펫으로 리그닌/플라보노이드 마이크로/서브미크론 입자 현탁액 1μL를 작업에 필요한 계수 슬라이드의 웰에 있는 초순수에 추가합니다.
- 현탁액 1mL에 있는 입자의 수와 입자의 수 및 크기별 분포가 자동 셀 카운터의 디스플레이에 표시될 때까지 기다립니다.
알림: 이 장치를 사용하면 USB 플래시에 데이터를 저장할 수 있습니다. 자동 셀 카운터 특수 소프트웨어를 사용하면 저장된 디지털 및 사진 파일을 추가로 처리할 수 있습니다.
- 전위차 적정에 의한 리그닌 입자의 표면 산성/염기성 그룹의 함량 측정
- 무게: 0.04g의 언로드/플라보노이드 캡슐화된 리그닌 입자.
- 삼각 플라스크에 옮기고 0.1M HCl 10mL를 넣은 다음 플라스크를 250rpm의 자석 교반기에 놓습니다.
- 50mL 뷰렛에 적정제 NaOH 0.1M 표준 용액을 채웁니다.
- 적정을 시작하기 전에 벤치 pH 측정기로 Erlenmeyer 플라스크에 있는 용액의 초기 pH를 측정하십시오.
- 적정을 시작하고 적정제의 각 0.5mL 첨가 부분 후에 분석된 용액의 pH를 측정합니다.
- 적용된 적정제의 부피와 해당 pH 값이 포함된 표에 실험 데이터를 저장합니다.
- 적정제 용액의 부피를 증가시켜 pH의 대략 일정한 값에 도달하면 적정을 중지하십시오.
- 실험 데이터를 0, 1차 및 2차 미분 차이 적정 곡선의 형태로 플로팅합니다.
- 사용된 적정제의 등가점과 해당 등가량을 측정합니다.
- 방정식 (3) 및 (4)를 사용하여 무부하 및 플라보노이드 부하 리그닌 입자의 표면에 있는 산성 Aa및 Ab염기성의 함량을 계산합니다.
 , MGEQ/G (3)
, MGEQ/G (3)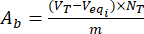 엠게크/지 (4)
엠게크/지 (4)
여기서 Veqi 는 당량 부피(mL)이고; NT 적정제의 정규성(mgeqv/mL); VT: 측정 절차에 사용되는 적정제의 부피(mL); m 분석된 샘플(g)의 무게입니다.
- 고체 첨가법에 의한 리그닌 기반 입자의 pHPZC(pH Point of Zero Charge) 측정.
- NaCl 0.1M 수용액 60mL를 준비합니다.
- 5개의 마개가 있는 원추형 플라스크 각각에 9mL의 0.1M NaCl 용액을 첨가하고 pH를 pHi = 2, 4, 7, 10 및 12(여기서 i = 1-5는 해당 용액의 수를 나타냄)로 각각 0.1M HCl 또는 0.1M NaOH를 첨가합니다. 동일한 강도의 NaCl 용액을 첨가하여 각 플라스크에 있는 용액의 총 부피를 정확히 10mL로 조정합니다.
- 각 플라스크에 40mg의 건조 리그닌 입자(무부하, 플라보노이드 로딩 마이크로/서브미크론)를 추가하고 플라스크 뚜껑을 단단히 닫습니다.
- 플라스크를 오비탈 셰이커에 똑바로 세우고 24시간 동안 흔들어 둡니다.
- 30분 동안 평형을 유지한 후 각 플라스크에 있는 상층액의 최종 pH(pHf)를 측정합니다.
- 해당 초기 pH 값(pHi)에 대해 pHf 값을 플로팅합니다.
- 제로 충전 지점(pHPZC)은 곡선 ΔpH 대 pHi 가 좌표(pHi, pHi)와 직선을 교차하는 pH 값으로 정의됩니다.
- 리그닌 입자의 총 페놀 함량(TPC) 측정
참고: 마이크로/서브미크론 리그닌 입자의 총 페놀 함량(TPC)은 수정된 Folin-Ciocalteu 비색법을 통해 측정됩니다.- 농도가 500μg/mL인 입자 수성 현탁액 200μL를 초순수 600μL 및 Folin-Ciocalteu 시약 200μL(1:1, v/v)와 혼합합니다.
- 5분 후 혼합물에 8% Na2CO3 1.0mL와 Milli-Q 물 1.0mL를 넣고 40°C의 어두운 곳에서 간헐적 교반으로 수조에서 30분 동안 배양합니다.
- 5,300× g 에서 2분 동안 현탁액을 원심분리합니다.
- 입자가 없는 블랭크를 준비합니다.
- 10mm 석영 큐벳에서 3.5mL의 상층액을 전사하고 블랭크에 대해 760nm의 가시 영역에서 UV/Vis 분광광도계에서 흡광도를 측정합니다.
- 5.3.1-5.3.5 단계에 따라 표준 갈산의 보정 곡선을 준비합니다. 리그닌 입자 현탁액 200μL 대신 초기 농도가 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 및 200μg/mL인 갈산의 에탄올 용액을 사용하십시오.
- 미세 입자의 실험 데이터를 건조 시료 그램당 밀리그램 단위의 갈산 등가물 mg(mg GAE/g)으로 표현합니다.
- 방정식 (5)를 사용하여 TPC를 계산합니다.
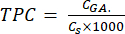 mg GAE/g (5)
mg GAE/g (5)
여기서, C, GA 는 산의 보정 플롯으로부터 수득된 표준 갈산의 농도와 동등한 샘플의 농도이고(μg, GA/mL); CSS 는 샘플의 농도로, 건조 샘플 질량을 용매의 부피(μg/mL)로 나눈 값과 같습니다.
6. 리그닌 입자의 시험관 내 방출 능력 측정
- 0.1M HCl을 사용한 표준 PBS 용액의 pH를 pH = 1.2로 조정하여 시뮬레이션된 무효소 위 배지 250mL를 준비합니다.
- 0.1M NaOH/0.1M HCl인 표준 PBS 용액의 pH를 각각 pH = 6.8 및 7.4로 조정하여 시뮬레이션된 두 개의 장액 용액 각각을 250mL를 준비합니다.
- 기계식 교반기가 함께 제공되는 유리 배치 반응기에서 시뮬레이션된 효소가 없는 위 배지 50mL에 플라보노이드 캡슐화된 마이크로/서브미크론 입자 25mg을 추가하고 T = 37 ± 0.2 oC의 일정한 온도에서 열수조에 넣습니다.
- 교반기를 액체 부피의 2/3 깊이로 담궈 고체상과 액체상의 완전한 혼합을 보장하고 정체 영역 없이 최대 질량 전달을 보장합니다.
- 반응기에서 10분마다 최대 90분까지 1mL의 샘플을 꺼내고 즉시 1mL의 신선한 시뮬레이션 유체 용액을 반응기에 피펫팅하여 총 부피의 변화를 방지하고 싱크 상태를 확인합니다.
- pH = 6.3 및 6.4인 시뮬레이션된 두 장액 용액을 각각 6.3분 동안 6.8-7.4단계로 포함하여 동일한 절차를 반복합니다.
- 3개의 시뮬레이션된 미디어에서 로드되지 않은 리그닌 입자에 대해 유사한 실험을 수행하고 샘플을 분광 광도계를 영점 조정하기 위한 블랭크로 사용합니다.
- 샘플을 여과하고 단계 6.7의 블랭크 샘플에 대해 96% EtOH로 희석한 후 샘플의 흡수를 분광광도계로 측정하고 pH = 1.2, 6.8 및 7.4에서 각각 얻은 모린의 해당 보정 곡선을 사용하여 해당 플라보노이드 농도를 계산합니다.
- 식 (6)을 사용하여 바이오플라보노이드의 누적 방출량(CR)을 μg/mL 단위로 계산하고 식 (7)으로 누적 방출률(CRP)을 계산합니다.
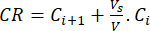 (6)
(6)
여기서, C, i 및 C, i+1 은 i번째 및 (i+1)번째 샘플(μg/mL)의 모린/퀘르세틴 농도입니다. VS배치 반응기(mL)에서 취한 샘플 부피; V 시뮬레이션된 미디어(mL)의 총 부피입니다.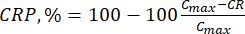 (7)
(7)
여기서 Cmax 는 담체 내 생물학적 활성 화합물의 최대 농도(μg/mL)입니다.
7. 통계 분석
- 실험 데이터를 세 개의 독립적인 측정± 표준 편차(SD)의 평균으로 표현합니다.
- 사후 검정으로 ANOVA 검정을 수행하여 실험 결과의 통계적 유의성을 결정합니다. p < 0.05의 값을 통계적으로 유의하다고 가정합니다.
Access restricted. Please log in or start a trial to view this content.
결과
알칼리 리그닌 마이크로/서브미크론 입자를 생성하기 위해 용매 방지 침전 기법이 실행되었습니다. 희석 된 무기산-질산 / 유기산-구연산의 수용액을 친환경 계면 활성제 / 에탄올이 풍부한 알칼리 리그닌 수용액에 분산시켜 생체 고분자 용질의 점진적인 침전을 초래했으며, 초음파 처리 후 최종적으로 소형 마이크로 / 서브 미크론 입자의 현탁액이 생성되었습니다 (그림 1)....
Access restricted. Please log in or start a trial to view this content.
토론
생체 고분자를 기반으로 한 약물 전달체 제형의 설계를 위한 현대 합성 방법론의 주요 중요한 문제 중 하나는 테트라하이드로푸란, 아세톤, 메탄올 및 심지어 고농도의 DMSO와 같은 휘발성 및 가연성 용매와 같은 유해 유기 시약의 적용이며, 이는 가능한 독성 효과의 징후로 인해 생물 의학, 제약 산업 및 식품 기술에서의 적용을 제한합니다20, 21,22,23,24.<...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 계약 번호 KΠ-06 H59/3에 따라 불가리아 과학 기금(Bulgarian Scientific Fund)과 트라키아 대학교(Trakia University)의 과학 프로젝트 번호 07/2023 FVM의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
참고문헌
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041(2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592(2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573(2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070(2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793(2023).
- Gala Morena, A., Tzanov, T. z Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705(2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067(2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650(2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487(2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), Basel. 2471(2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367(2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52(2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31(2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031(2020).
- Yaneva, Z., Georgieva, N. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. Grumezescu, A. M. , William Andrew Publishing. 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유