Method Article
تنميط حوائط البروتين السطحي على الجسيمات الفيروسية من خلال استراتيجية المراسل المزدوج المتعدد
In This Article
Summary
هنا ، نصف مقايسة مناعية فلورية متعددة الإرسال تم تطويرها حديثا تستخدم نظام قياس خلوي مزدوج التدفق للكشف بشكل متزامن عن اثنين من حواجز بروتين سبايك الفريدة على الجسيمات الفيروسية السليمة لفيروس كورونا 2 (SARS-CoV-2) المسبب للإنزيم المحول للأنجيوتنسين والتي تم التقاطها بواسطة الكريات المجهرية المغناطيسية المقترنة بالإنزيم المحول للأنجيوتنسين.
Abstract
تلعب البروتينات الغشائية على الفيروسات المغلفة دورا مهما في العديد من الوظائف البيولوجية التي تنطوي على ارتباط الفيروس بمستقبلات الخلايا المستهدفة ، واندماج الجسيمات الفيروسية في الخلايا المضيفة ، وتفاعلات الفيروس المضيف ، والتسبب في المرض. علاوة على ذلك ، أثبتت بروتينات الغشاء الفيروسي على جزيئات الفيروس والمقدمة على أسطح الخلايا المضيفة أنها أهداف ممتازة لمضادات الفيروسات واللقاحات. هنا ، نصف بروتوكولا للتحقيق في البروتينات السطحية على جزيئات فيروس كورونا 2 المسبب للمتلازمة التنفسية الحادة الوخيمة (SARS-CoV-2) باستخدام نظام القياس الخلوي للتدفق المزدوج المراسل. يستغل الفحص تقنية تعدد الإرسال للحصول على اكتشاف ثلاثي للجزيئات الفيروسية من خلال ثلاثة تفاعلات تقارب مستقلة. تم استخدام حبات مغناطيسية مقترنة بالإنزيم البشري المحول للأنجيوتنسين -2 (ACE2) لالتقاط الجسيمات الفيروسية من طاف الخلايا المصابة بفيروس SARS-CoV-2. بعد ذلك ، تم تطبيق اثنين من كواشف الكشف الموسومة ب R-phycoerythrin (PE) أو Brilliant Violet 421 (BV421) في وقت واحد. كدليل على المفهوم ، تم استخدام شظايا الأجسام المضادة التي تستهدف حوامل مختلفة من البروتين السطحي SARS-CoV-2 Spike (S1). يوفر اكتشاف الجسيمات الفيروسية من خلال ثلاثة تفاعلات تقارب مستقلة خصوصية قوية ويؤكد التقاط جزيئات الفيروس السليمة. تم إنشاء منحنيات الاعتماد على الجرعة لطاف الخلايا المصابة بفيروس SARS-CoV-2 مع فروق معامل التكرار (المتوسط / SD) ˂14٪. أكد أداء الفحص الجيد في كلتا القناتين أنه يمكن اكتشاف اثنين من حواشي البروتين المستهدف على سطح الفيروس بالتوازي. ويمكن تطبيق البروتوكول الموصوف هنا على (أ) التنميط العالي المتعدد والإنتاجية العالية للبروتينات السطحية المعبر عنها على الفيروسات المغلفة؛ و (ب) التنميط العالي الإرسال والإنتاجية العالية للبروتينات السطحية المعبر عنها على الفيروسات المغلفة؛ و (ب) التنميط العالي الإرسال والإنتاجية العالية للبروتينات السطحية المعبر عنها على الفيروسات المغلفة؛ و (ب) التنميط العالي الإرسال و ب) الكشف عن الجسيمات الفيروسية السليمة النشطة ؛ و (ج) تقييم خصوصية وتقارب الأجسام المضادة والأدوية المضادة للفيروسات للحواتم السطحية للمستضدات الفيروسية. يمكن أن يمتد التطبيق إلى أي نوع من الحويصلات والجسيمات الحيوية خارج الخلية ، مما يعرض المستضدات السطحية في سوائل الجسم أو المصفوفات السائلة الأخرى.
Introduction
الفيروسات المسببة للأمراض الأكثر شيوعا ، مثل الأنفلونزا وفيروس نقص المناعة البشرية والفيروس المضخم للخلايا البشرية وسلالات SARS-CoV ، هي فيروسات مغلفة. تتطلب عدوى الخلايا بالفيروسات المغلفة اندماج أغشية الخلايا الفيروسية والمضيفة ، مما يؤدي إلى إطلاق الجينوم الفيروسي في السيتوبلازم. سيتكاثر الحمض النووي الريبي الفيروسي بعد ذلك قبل تعبئته في جسيم فيروسي جديد 1,2. خلال هذه العمليات ، لا يمكن دمج البروتينات الفيروسية فحسب ، بل أيضا بروتينات الغشاء المضيف في الغلاف ، لتصبح جزءا لا يتجزأ من الجسيم الفيروسي الجديد. قد تسهل بروتينات غشاء الخلية المضيفة المدمجة في غلاف الفيروس دخول الفيروس إلى خلية مضيفة جديدة ، مستغلة آليات تفاعلات الخلايا الخلوية ، والتوجيه ، وهروب الجهاز المناعي 3,4.
على الرغم من أهمية التحقيق في البروتينات المرتبطة بالفيروس ، فإن معظم التقنيات المتاحة حاليا لتحليل الفيروس5 لا تدعم توصيف عالي الإنتاجية وعالي التعدد لمستضد سطح الفيروس. كما أنها ليست قادرة على اكتشاف الجسيمات الفيروسية الفردية أو التمييز بين جزيئات الفيروس السليمة المعدية ، والحمض النووي الريبي غير المعدي ، والبروتينات الفيروسية ، والمجموعات الفرعية للفيروسات التي تعبر عن مستضدات مختلفة. في الآونة الأخيرة ، تم تعديل قياس التدفق الخلوي وتكييفه في طريقة جديدة لتحليل الجسيمات الفيروسية ، وهي قياس تدفق الفيروس. يسمح قياس التدفق الفيروسي بالتحقيق في الجسيمات الفيروسية المفردة ومستضداتها السطحية. ومع ذلك ، فإن القيود بما في ذلك الإنتاجية المنخفضة ، والقدرة المنخفضة على تعدد الإرسال ، والإعداد التجريبي المعقد وتحليل البيانات ، وإمكانية الكشف المحدودة للجسيمات الفيروسية صغيرة الحجم لا تزال 6,7.
يعد القياس الكمي المتعدد القائم على المجهر للبروتينات والحمض النووي تقنية راسخة لها العديد من التطبيقات التي تتراوح من القياس الكمي للبروتين في سوائل الجسم ، ودراسات تفاعل البروتين والبروتين ، وتشخيص الالتهابات الفيروسية8،9،10،11،12،13. تتميز أداة تحليل التدفق التي تم تقديمها مؤخرا بقناة مراسل مزدوجة ، مما يسمح بقياس جزيئين مراسلين فلورسنت في نفس بئر التفاعل. وقد أثبتت هذه القدرة الجديدة أنها مفيدة بشكل خاص للتنميط المتوازي لمختلف الأنماط المتماثلة للغلوبولين المناعي14. هنا ، يتم وصف كيف يمكن استخدام نظام المراسل المزدوج للكشف عن الجسيمات الفيروسية السليمة ، واستهداف مستضدات سطحية متعددة بالتوازي.
كدليل على المفهوم ، يفصل هذا التقرير تطوير نظام الكشف الثلاثي لجزيئات فيروس SARS-CoV-2. يتكون SARS-CoV-2 من أربعة بروتينات رئيسية ، أحدها هو بروتين سبايك (S) ، والذي يتكون من وحدتين فرعيتين. الوحدة الفرعية الأولى ، S1 ، تصنع الارتباط الأساسي ب ACE2 معبرا عنه في أغشية الخلايا البشرية. تسهل الوحدة الفرعية الثانية ، S2 ، الدخول إلى الخلية المستهدفة عن طريق ببتيد الاندماج ، مما يخلق مسام في غشاء الخلية المستهدفة يمكن أن يدخلها الفيريون من خلال15. اللبنات الأساسية الثلاثة المتبقية ل SARS-CoV-2 هي nucleocapsid (N) ، والبروتين الغشائي (M) ، وبروتين الغلاف (E). النيوكليوكابسيد مسؤول عن تعبئة الجينوم الفيروسي عن طريق تكوين هياكل البروتين النووي الريبي مع الحمض النووي الريبي ، بينما تلعب بروتينات الغشاء والغلاف أدوارا مركزية في تجميع الفيروس.
يستهدف الفحص الموصوف هنا ثلاثة حوامل مستقلة للوحدة الفرعية S1 المعبر عنها على سطح غلاف SARS-CoV-2. يتم استخدام التخفيفات التسلسلية لكل من طاف الخلايا المصابة بفيروس SARS-CoV-2 وغير المصابة. يتم التقاط الجسيمات الفيروسية عبر الكريات المجهرية المترافقة ACE2 التي تربط الوحدة الفرعية S1 على الفيروس. ثم يتم الكشف عن بروتين S للفيروس السطحي بالتوازي مع جزء متغير أحادي السلسلة من الغلوبولين المناعي الموسوم المتاح تجاريا (scFv) وجسم مضاد أحادي النسيلة بشري مضاد ل S1 (Hu-anti-S1) جنبا إلى جنب مع scFv الموسوم ب FLAG المطور داخليا. يتم الكشف عن Hu-anti-S1 بواسطة القناة الأولى (RP1) في نظام المراسل المزدوج مع الجسم المضاد الثانوي IgG-Fc المترافق R-phycoerythrin (PE) المترافق ، ويتم الكشف عن scFv بواسطة القناة الثانية (RP2) مع الجسم المضاد الثانوي المترافق Brilliant Violet 421 (BV421) المترافق ضد FLAG. يتم تمثيل مقايسة جسيمات الفيروس في الشكل 1.
Protocol
1. اقتران النيوترفيدين والأجسام المضادة للتحكم في الكريات المجهرية المغناطيسية
ملاحظة: تستخدم حبات مغناطيسية مصبوغة بالفلورسنت (كريات مجهرية من البوليسترين بقطر 6.5 ميكرومتر مع مغنتيت مدمج) مع ملصقات فلورية مختلفة ، مدرجة في جدول المواد لتوليد اتحادات الخرزة والضوابط التالية: (1) ACE2 البشري المؤتلف Biotinylated المرتبط بالخرز المقترن برابط نيوترافيدين ؛ (2) البيوتين مرتبط بالخرز المقترن برابط نيوترافيدين ؛ (3) الماعز IgG مقترنة مباشرة بالخرز. و (4) حبات غير مقترنة. يجب أن يكون البروتين المراد إقرانه بالخرز خاليا من أزيد الصوديوم أو ألبومين مصل الأبقار (BSA) أو الجلايسين أو تريس (هيدروكسي ميثيل) أمينوميثان (تريس) أو الجلسرين أو الإضافات المحتوية على أمين. المخزن المؤقت للتنشيط هو 0.1 M فوسفات الصوديوم أحادي القاعدية ، اللامائي (NaH2PO4) ، درجة الحموضة 6. 2-مورفولينوإيثان سلفونيك حمض (MES ؛ 50 mM) يستخدم المخزن المؤقت للأس الهيدروجيني 5 لتخفيف الاقترانات. المخزن المؤقت للغسيل هو PBS-T (1x PBS [محلول ملحي مخزن بالفوسفات] ، درجة الحموضة 7.4 + 0.05٪ (v / v) Tween-20). المخزن المؤقت للتخزين هو كاشف مانع 2.7 مجم / مل ل ELISA (BRE) + 0.1٪ مضادات حيوية (هنا ، ProClin 300).
- قم بإزالة مسحوق Sulfo- N-hydroxysulfosuccinimide (NHS) من الثلاجة ، و 65 مجم من 1-إيثيل -3- [3-ثنائي ميثيل أمينوبروبيل] كاربوديديميد هيدروكلوريد (EDC) من الفريزر واتركه يصل إلى درجة حرارة الغرفة (RT ؛ 18-22 درجة مئوية) لمدة 30 دقيقة. قم بتخزين كل من NHS و EDC في مظروف يحتوي على حبات السيليكا خلال هذه الخطوة لمنع التحلل المائي من الرطوبة الجوية.
- إعداد المجهرية للتنشيط والاقتران.
ملاحظة: الأصباغ الفلورية داخل الكريات المجهرية حساسة للضوء ، ويجب حفظ الخرز في الظلام وفي درجات حرارة الثلاجة (4-8 درجة مئوية) عندما لا تكون قيد الاستخدام النشط.- أعد تعليق 4 مخزون مختلف من الكرات المجهرية المشفرة بمعرف اللون (12.5 × 106 / مل) (جدول المواد) عن طريق الدوامة أو الصوتنة أو الدوران لفترة وجيزة (15 دقيقة عند 15-30 دورة في الدقيقة) ، وفقا لورقة معلومات المنتج.
- نقل 40 ميكرولتر من كل معلق حبة (5 × 105 كرات مجهرية) إلى الآبار المخصصة للوحة معايرة نصف بئر ، مسطحة القاع ، 96 بئرا (جدول المواد).
- اغسل الخرزات المغناطيسية.
ملاحظة: يمكن إجراء خطوات الغسيل إما يدويا أو باستخدام غسالة ألواح آلية.- أضف 80 ميكرولتر / بئر تنشيط المخزن المؤقت إلى الخرز وشل حركة الخرز على فاصل لوحة مغناطيسية لمدة 30 ثانية. قم بنضح المادة الطافية من الكرات المجهرية بينما يتم تثبيت الخرز على فاصل اللوحة المغناطيسية.
- قم بإزالة لوحة المعايرة الدقيقة من فاصل اللوحة المغناطيسية وأعد تعليق الخرز في 50 ميكرولتر من المخزن المؤقت للتنشيط.
- قم بتنشيط الخرز باستخدام Sulfo-NHS و EDC.
- تحضير محلول عمل Sulfo-NHS عند 50 مجم / مل في مخزن التنشيط في أنبوب ميكروفوج سعة 1.5 مل. أعد مسحوق NHS إلى الثلاجة (4-8 درجة مئوية) ، محميا من الرطوبة.
- تحضير محلول عمل EDC عند 50 مجم / مل في مخزن التنشيط في أنبوب الميكروفوج سعة 1.5 مل. قم بإذابة القسومات الجاهزة 65 مجم من مسحوق EDC في 1.3 مل من محلول التنشيط.
ملاحظة: يبدأ Sulfo-NHS و EDC في التحلل المائي وفقدان النشاط عند ذوبانه. تجنب مقاطعة إجراء الاقتران حتى تتم إضافة NHS و EDC إلى الخرزات. لا تحفظ محاليل NHS أو EDC المذابة لاستخدامها لاحقا. - قم بإعداد محلول التنشيط لتنشيط الخرزة عن طريق الجمع الحجمي بين محلول مخزون 20٪ Sulfo-NHS (50 مجم / مل) ، ومحلول مخزون EDC بنسبة 20٪ (50 مجم / مل) ، ومخزن مؤقت للتنشيط بنسبة 60٪. مطلوب محلول تنشيط 50 ميكرولتر لكل تفاعل تنشيط حبة (باستخدام 5 × 105 حبات / تفاعل) ، بالإضافة إلى حجم إضافي كاف لاستيعاب خسائر الماصة.
- أضف 50 ميكرولتر من محلول التنشيط الكامل لكل بئر يحتوي على خرز مغسول. مع حجم تعليق حبة 50 ميكرولتر الموجود مسبقا في مخزن التنشيط المؤقت ، لكل بئر ، سيكون التركيز النهائي ل Sulfo-NHS 5 مجم / مل ، وسيكون التركيز النهائي ل EDC أيضا 5 مجم / مل.
- أغلق لوحة تفاعل الكرة المجهرية بسدادة بلاستيكية لاصقة أو لوحة رقائق معدنية يمكن التخلص منها واحتضانها لمدة 20 دقيقة على شاكر مداري (650 دورة في الدقيقة) في درجة حرارة الغرفة (18-22 درجة مئوية) في الظلام.
- اغسل محلول التنشيط الزائد من الخرز.
- أجهزة الطرد المركزي لوحة microtiter في 233 × غرام لمدة 1 دقيقة.
- شل حركة الخرز المنشط على فاصل لوحة مغناطيسية لمدة 30 ثانية. قم بإزالة مانع تسرب اللوحة ونضح المادة الطافية من الخرز المثبت بالمغناطيس مع استمرار وضع لوحة المعايرة الدقيقة على الفاصل المغناطيسي.
- قم بإزالة لوحة المعايرة الدقيقة من الفاصل المغناطيسي وأضف 100 ميكرولتر من MES Buffer إلى كل بئر.
- كرر الخطوات 1.4.2-1.4.3 مرة إضافية واحدة ليصبح المجموع غسلتين.
- زوجان نيوترافيدين والماعز IgG (التحكم) لمجموعات حبة المناسبة. قم بإعداد حلول عمل كافية للنيوترافيدين والماعز IgG ، وتخطيط 100 ميكرولتر / تفاعل وإضافية كافية لاستيعاب خسائر السحب على النحو التالي:
ملاحظة: يتم إعادة تكوين مسحوق بروتين نيوترافيدين بماء عالي النقاء ثم يتم تخفيفه إلى محلول مخزون 1 مجم / مل مع برنامج تلفزيوني قبل الاقتباس للتخزين / الاستخدام (بروتين النيوترافيدين غير قابل للذوبان مباشرة في برنامج تلفزيوني ولكنه قابل للذوبان في الماء إلى ~ 10 مجم / مل).- تحضير محلول عمل النيوترافيدين بتركيز 125 ميكروغرام / مل في MES Buffer في أنبوب ميكروفوج منخفض الارتباط بالبروتين 1.5 مل.
- تحضير محلول عمل الأجسام المضادة للتحكم في IgG الماعز بتركيز 17.5 ميكروغرام / مل في MES Buffer.
- تحضير لوحة العيار الدقيق التي تحتوي على الخرز المنشط. شل حركة الخرز على فاصل لوحة مغناطيسية لمدة 30 ثانية. مع استمرار وضع لوحة المعايرة الدقيقة على الفاصل المغناطيسي ، قم بشفط المادة الطافية من الخرز المثبت بالمغناطيس.
- أضف 100 ميكرولتر من محلول عمل النيوترافيدين (125 ميكروغرام / مل) إلى الآبار المناسبة التي تحتوي على حبات (لاقتران نيوترافيدين-بيوتين ونيوترافيدين-ACE2).
- أضف 100 ميكرولتر من محلول عمل IgG للماعز (17.5 ميكروغرام / مل) إلى الخرزات المحتوية على البئر المخصصة كعناصر تحكم IgG للماعز فقط.
- أضف 100 ميكرولتر من MES Buffer إلى البئر المعين كخرز تحكم غير مقترن.
- أغلق لوحة المعايرة الدقيقة واحتضانها لمدة 2 ساعة على شاكر مداري (650 دورة في الدقيقة) عند RT (18-22 درجة مئوية) في الظلام. دوامة اللوحة لفترة وجيزة بعد 1 ساعة من الحضانة لضمان بقاء الخرز في التعليق.
- غسل الخرز مع PBS-T.
- جهاز طرد مركزي لوحة العيار الدقيق عند 233 × جم لمدة 1 دقيقة.
- شل حركة الخرز المقترن على فاصل لوحة مغناطيسية لمدة 30 ثانية. مع استمرار وضع لوحة المعايرة الدقيقة على الفاصل المغناطيسي ، قم بشفط المادة الطافية من الخرز المثبت بالمغناطيس.
- قم بإزالة لوحة المعايرة الدقيقة من الفاصل المغناطيسي.
- أضف 100 ميكرولتر من PBS-T إلى كل بئر يحتوي على خرز.
- كرر خطوات الغسيل 1.6.2-1.6.4 مرة واحدة لما مجموعه غسلتين باستخدام PBS-T.
- تحضير الخرز المترافق للتخزين.
- شل حركة الخرز المقترن على فاصل لوحة مغناطيسية لمدة 30 ثانية. مع استمرار وضع لوحة المعايرة الدقيقة على الفاصل المغناطيسي ، قم بشفط المادة الطافية من الخرز المثبت بالمغناطيس. قم بإزالة لوحة المعايرة الدقيقة من الفاصل المغناطيسي.
- أضف 50 ميكرولتر من المخزن المؤقت للتخزين إلى كل معرف كرة مجهرية لإخماد نشاط الخرزة المتبقي.
- احتضان لوحة المعايرة الدقيقة في درجات حرارة الثلاجة (4-8 درجة مئوية) في الظلام طوال الليل (16-22 ساعة).
- نقل معلقات الخرز غير المقترنة وخرز IgG المقترن بالماعز (50 ميكرولتر) إلى أنابيب الصمامات الدقيقة منخفضة الارتباط بالبروتين سعة 1.5 مل ، جنبا إلى جنب مع شطفين عازلة للتخزين سعة 100 ميكرولتر للآبار لضمان أقصى قدر من استرداد الخرز.
ملاحظة: سيبلغ عدد حبات IgG المقترنة غير المقترنة والماعز 5 × 105 في حجم نهائي يبلغ 250 ميكرولتر (أي 2 × 103 حبات / ميكرولتر). قم بتخزين أنابيب الميكروفوج في درجات حرارة الثلاجة (4-8 درجة مئوية) حتى الاستخدام.
- اربط البيوتينيل ACE2 والبيوتين بالخرز المقترن بالنيوترافيدين.
- تحضير محلول عمل ACE2 البشري المؤتلف عند 18 ميكروغرام / مل ACE2 في 10 مللي متر PBS. لكل تفاعل ، ستكون هناك حاجة إلى 100 ميكرولتر. تحضير محلول عمل البيوتين عند 2.4 مجم / مل من البيوتين في 10 مللي مول PBS. لكل تفاعل ، ستكون هناك حاجة إلى 100 ميكرولتر.
- تحضير لوحة العيار الدقيق التي تحتوي على كريات مجهرية مقترنة بالنيوترافيدين.
- شل حركة الكريات الدقيقة على فاصل لوحة مغناطيسية لمدة 30 ثانية. مع استمرار وضع لوحة المعايرة الدقيقة على الفاصل المغناطيسي ، قم بإزالة مانع تسرب اللوحة واستنشاق المادة الطافية من الكريات المجهرية المحركة بالمغناطيس.
- قم بإزالة لوحة المعايرة الدقيقة من الفاصل المغناطيسي وأضف 50 ميكرولتر من 10 مللي مول PBS / بئر.
- كرر الخطوات 1.8.2.1-1.8.2.2 مرة واحدة.
- أضف 100 ميكرولتر من محلول عمل Biotinylated-ACE2 إلى الآبار المناسبة التي تحتوي على كريات مجهرية مقترنة بالنيوترافيدين. أضف 100 ميكرولتر من محلول عمل البيوتين إلى الآبار المناسبة التي تحتوي على كريات مجهرية مقترنة بالنيوترافيدين.
- أغلق لوحة المعايرة الدقيقة واحتضانها لمدة 1 ساعة على شاكر مداري (650 دورة في الدقيقة) عند RT (18-22 درجة مئوية) في الظلام.
- اغسل الكريات المجهرية كما هو موضح في الخطوات 1.6.1-1.6.5.
- تحضير وتخزين الكرات المجهرية المقترنة بالإنزيم المحول للأنجيوتنسين والبيوتين كما هو موضح في الخطوات 1.7.1-1.7.4.
ملاحظة: سيبلغ عدد حبات الإنزيم المحول للأنجيوتنسين البيوتيني ACE2 والخرز المترافق بالبيوتين 5 × 105 في حجم نهائي يبلغ 250 ميكرولتر (أي 2 × 103 حبات / ميكرولتر).
2. اختبار الاقتران
- قم بإعداد خليط حبة من خلال الجمع بين جميع الأنواع الأربعة من الكرات المجهرية التي تم إنشاؤها في القسم 1 (على سبيل المثال ، البيوتينيل المقترن بالنيوترافيدين ACE2 ، والبيوتين المترافق بالنيوترافيدين ، والماعز IgG المترافق ، وغير المقترن).
ملاحظة: تم تخزين الكريات المجهرية للمخزون عند 2 × 103 حبات / ميكرولتر ودمجها بحيث يكون تركيز الخرزة النهائي في خليط الخرز العامل 40 حبة من كل مجموعة / ميكرولتر.- احسب حجم خليط حبة العمل اللازم للاختبار (5 ميكرولتر / تفاعل) ، مما يسمح للحجم الإضافي باستيعاب خسائر الماصة. قم بتدوير كل أنبوب لفترة وجيزة ودمج الأحجام المحسوبة المتساوية لكل معلق خرزة في أنبوب ميكروفوج جديد منخفض الارتباط بالبروتين. تركيز الخرزة الآن 400 حبة من كل مجموعة / ميكرولتر.
- قم بإنشاء خليط حبة العمل عن طريق تخفيف تعليق الخرزة المدمج بمقدار 10 أضعاف إضافية باستخدام مخزن التخزين المؤقت (40 من كل مجموعة / تركيز عمل ميكرولتر).
ملاحظة: اصنع كمية صغيرة من خليط الخرزة العامل أولا لتقدير عدد الكريات المجهرية / ميكرولتر لكل معرف.
- احتضان الكريات المجهرية بالأجسام المضادة للماعز المضادة ل ACE2.
- ماصة 5 ميكرولتر من خليط الخرز العامل في 3 آبار من صفيحة معايرة دقيقة مسطحة القاع ونصف بئر و 96 بئرا.
- أضف 50 ميكرولتر من الماعز المضاد للأنجيوتنسين 2 (0.4 ميكروغرام / مل مخفف في PBS-T ، جدول المواد) لكل منها إلى 3 آبار تحتوي على خرز في لوحة المعايرة الدقيقة. أغلق لوحة المعايرة الدقيقة ، الدوامة ، واحتضانها على شاكر مداري (650 دورة في الدقيقة) عند RT (18-22 درجة مئوية) لمدة 1 ساعة في الظلام.
- اخفق لوحة العيار الدقيق عند 233 × جم لمدة دقيقة واحدة واغسل الكريات المجهرية ثلاث مرات باستخدام PBS-T كما هو موضح في 1.6.2-1.6.4.
- احتضان المجهرية مع الأجسام المضادة الكشف.
- ماصة 5 ميكرولتر من خليط حبة العمل في 6 آبار جديدة من لوحة المعايرة الدقيقة.
- قم بإعداد 1 ميكروغرام / مل لكل من مخاليط الكشف العاملة: IgG PE المضاد للماعز ، و IgG PE المضاد للفأر ، و IgG PE المضاد للأرانب في 3 أنابيب منفصلة سعة 1.5 مل ، باستخدام PBS-T كمخفف.
- أضف 50 ميكرولتر من مخاليط الكشف إلى 3 آبار لكل منها ، ويضاف IgG المضاد للماعز إلى نفس الآبار مثل مضاد ACE2 من الخطوة 2.2.
- ختم ، دوامة ، واحتضان على شاكر مداري (650 دورة في الدقيقة) في RT (18-22 درجة مئوية) لمدة 30 دقيقة.
- اخفق الطبق عند 233 × جم لمدة دقيقة واحدة واغسل الكريات المجهرية ثلاث مرات باستخدام PBS-T كما هو موضح في 1.6.2-1.6.4.
- أضف 100 ميكرولتر من PBS-T وقم بتشغيله على أداة تحليل التدفق المزدوج مع الإعدادات التالية:
الوضع: مراسل مزدوج. المهلة: 45 ثانية ؛ DD-بوابة: 7500-17500 ؛ الحد الأدنى لعدد الكرات المجهرية: 100 كرة مجهرية / مجموعة (أدنى حد لمراقبة الجودة: 35 كرة مجهرية / مجموعة).
3. إنتاج طاف الخلايا المصابة بفيروس SARS-CoV-2
ينتشر فيروس SARS-CoV-2 في خلايا Vero E6 المضيفة (خط الخلايا الظهارية لكلية. أتك. جدول المواد). يتم استزراع خلايا Vero E6 في وسط النسور المعدلة (MEM) عند 37 درجة مئوية في جو 5٪ CO2 و 95٪ رطوبة نسبية. يتم استكمال كل لتر من MEM ب 10 مل من L-glutamine (200 mM) ، و 38 مل من NaHCO3 (7.5٪) ، و 5 مل من محلول البنسلين / الستربتومايسين ، و 50 مل من مصل الأبقار الجنينية (FCS) ؛ جدول المواد.
تنبيه: استخدم إجراءات ومعدات السلامة البيولوجية المناسبة عند التعامل مع SARS-CoV-2.
- تزرع خلايا Vero E6 لتلتقي في قارورتين لزراعة الأنسجة بطول 150 سم2 . أصاب قارورة واحدة بفيروس SARS-CoV-2 واستخدم الأخرى المصابة بالوهمية كعنصر تحكم.
- امزج ما يقرب من 100000 جسيم معدي من النوع البري (WT) SARS-CoV-2 مع 5 مل من وسط Eagles MEM.
- قم بشفط الوسائط من قارورة واحدة مقاس 150 سم2 وأضف 55 مل من MEM الكامل لتوليد طاف تحكم غير مصاب. نضح الوسائط من قارورة 150 سم2 الأخرى وأضف خليط الفيروس إلى الخلايا. احتضان الخلايا لمدة 1 ساعة عند 37 درجة مئوية. هز القارورة بشكل معتدل كل 15 دقيقة لتوزيع الفيروس.
- أضف 50 مل من وسط MEM الكامل إلى القارورة مع إضافة SARS-CoV-2 واحتضان الخلايا حتى يتم ملاحظة تأثيرات الاعتلال الخلوي ، وتقييم القوارير بصريا كل 24 ساعة.
ملاحظة: يجب أن يستغرق الأمر حوالي 3-4 أيام بعد الإصابة حتى يحدث الاعتلال الخلوي. يتم تقييم تأثيرات الاعتلال الخلوي على بنية الخلية أحادية الطبقة Vero E6 (على سبيل المثال ، تراجع الخلية ، والكرينة ، والتقريب ، وإزالة الالتصاق ، وفقدان التحبب داخل الهيولى ، والتحلل العلني) نوعيا من خلال مراقبة الخلايا باستخدام مجهر ضوئي مقلوب ، وفقا لإرشادات منظمة التقييس الدولية لاختبار السمية الخلوية في المختبر 16. - اجمع طاف الخلية من كل من القوارير وقم بتدويره لمدة 6 دقائق عند 253 × جم إلى حطام خلية الرواسب.
- فيروس SARS-CoV-2 المعطل للأشعة فوق البنفسجية في طافية الخلية
- ماصة 0.5 مل من المادة الطافية لكل بئر إلى 12 بئرا في صفيحة عيار 24 بئرا. قم بإشعاع لوحة المعايرة الدقيقة بالأشعة فوق البنفسجية ، بدون غطاء ، لمدة 30 ثانية تحت مصباح الأشعة فوق البنفسجية المناسب (جدول المواد).
ملاحظة: يجب التأكد من تعطيل الفيروس في طاف الخلية عن طريق محاولة انتشار الفيروس في مزارع خلايا Vero E6.
- ماصة 0.5 مل من المادة الطافية لكل بئر إلى 12 بئرا في صفيحة عيار 24 بئرا. قم بإشعاع لوحة المعايرة الدقيقة بالأشعة فوق البنفسجية ، بدون غطاء ، لمدة 30 ثانية تحت مصباح الأشعة فوق البنفسجية المناسب (جدول المواد).
- قسمة الخلية الطافية في أنابيب 1.5 مل وتخزينها في -20 درجة مئوية حتى الاستخدام مرة أخرى.
ملاحظة: يمكن تخزين طافية الخلية عند -80 درجة مئوية.
4. الفحص: الكشف عن الجسيمات الفيروسية SARS-CoV-2 في طافات الخلية
- قم بإعداد المخزن المؤقت للمقايسات عن طريق خلط 0.1٪ كازين ، 0.5٪ كحول بولي فينيل ، 0.8٪ بولي فينيل بيروليدون ، و 1٪ BSA (الكل وزن / حجم) (درجة الحموضة 7). قم بإعداد المخزن المؤقت لتخفيف العينة عن طريق تحضير 10٪ أرنب IgG في مخزن المقايسة.
- حساب وإعداد حجم خليط حبة العمل (الخطوة 2.1) اللازمة للاختبار (5 ميكرولتر / تفاعل) ، مما يسمح للحجم الزائد باستيعاب خسائر الماصة.
- تحضير سلسلة التخفيف طاف. احسب الأحجام الطافية اللازمة. فحص كل نقطة تخفيف في الآبار الثلاثية لكل من SCFs الخمسة ، مما ينتج عنه 15 بئرا لكل نقطة تخفيف ونوع العينة. استخدام 45 ميكرولتر من المواد الطافية المخففة في كل بئر ، ليصبح المجموع 675 ميكرولتر المطلوبة ؛ يكفي أنبوب واحد للصمامات الدقيقة سعة 1.5 مل لكل من SARS-CoV-2 ومواد التحكم الطافية.
- قم بإذابة طافات SARS-CoV-2 والتحكم في المواد الطافية عند 4 درجات مئوية لمدة 1 ساعة على الأقل. حافظ على برودة المواد الطافية وتخفيفاتها (2-8 درجة مئوية) حتى الاستخدام. قم بتسمية وترتيب ثمانية أنابيب ميكروفوج سعة 1.5 مل لكل منها ل SARS-CoV-2 والتحكم في المواد الطافية.
ملاحظة: سيكون أعلى تركيز تم فحصه هو تخفيف طاف 1: 1 (2 أضعاف) ، والذي سيتم من خلاله إجراء سلسلة من التخفيفات 1: 2 (3 أضعاف) باستخدام مخزن تخفيف العينة ، مع أعلى تخفيف هو تخفيف 1: 1458. تعمل الفراغات التي تحتوي على المخزن المؤقت لتخفيف العينة فقط كعناصر تحكم غير طافية. وبالتالي ، فإن التخفيفات المختبرة لكل نوع من أنواع المواد الطافية (SARS-CoV-2 أو السيطرة) ستكون 2 و 6 و 18 و 54 و 162 و 486 و 1458 ضعفا ، مع تحكم في المخزن المؤقت فقط. - أضف عينة مخففة عازلة إلى أنابيب microfuge الموسومة. تتطلب أنابيب التخفيف 1: 1 (2 أضعاف) 600 ميكرولتر من المخزن المؤقت ، وتتطلب الأنابيب المتبقية 800 ميكرولتر من المخزن المؤقت. قم بإنشاء أعلى تخفيف (1: 1 ؛ 2 أضعاف) لكل مادة طافية من خلال الجمع بين 600 ميكرولتر من المادة الطافية مع 600 ميكرولتر من محلول تخفيف العينة في أنابيب ذات علامات مناسبة ، متبوعة بدوامة الأنبوب لفترة وجيزة للخلط.
- استمر في السلسلة عن طريق نقل 400 ميكرولتر بالتتابع من المواد الطافية المخففة 1: 1 (2 أضعاف) إلى أنبوب التخفيف التالي (أي التخفيف 6 أضعاف) ، واستمر في التخفيفات 3 أضعاف حتى يتم إنشاء أقل تخفيف (1458 ضعفا). دوامة لفترة وجيزة كل طاف مخفف قبل الشروع في التخفيف التالي.
- قم بإذابة طافات SARS-CoV-2 والتحكم في المواد الطافية عند 4 درجات مئوية لمدة 1 ساعة على الأقل. حافظ على برودة المواد الطافية وتخفيفاتها (2-8 درجة مئوية) حتى الاستخدام. قم بتسمية وترتيب ثمانية أنابيب ميكروفوج سعة 1.5 مل لكل منها ل SARS-CoV-2 والتحكم في المواد الطافية.
- احتضان المجهرية مع طاف.
- دوامة خليط الخرزة العامل المعد مسبقا لمدة 30 ثانية لإعادة تعليق الكريات المجهرية وإضافة 5 ميكرولتر من خليط الخرزة إلى كل بئر مخصص للوحة عيار 384 بئر مسطحة القاع.
ملاحظة: يمكن أيضا استخدام لوحات 96 بئرا. - أضف 45 ميكرولتر من التخفيفات الطافية المحضرة إلى الآبار المخصصة التي تحتوي على كرات مجهرية في لوحة 384 بئرا. أغلق اللوحة واحتضانها طوال الليل (16-22 ساعة) على شاكر مداري (650 دورة في الدقيقة) عند RT (18-22 درجة مئوية) في الظلام.
- دوامة خليط الخرزة العامل المعد مسبقا لمدة 30 ثانية لإعادة تعليق الكريات المجهرية وإضافة 5 ميكرولتر من خليط الخرزة إلى كل بئر مخصص للوحة عيار 384 بئر مسطحة القاع.
- غسل طاف الزائدة من الخرز.
- قم بإزالة لوحة العيار الدقيق من شاكر المداري وقم بإزالة مانع تسرب اللوحة. أجهزة الطرد المركزي لوحة في 931 × ز لمدة 1 دقيقة.
- شل حركة الخرز عن طريق وضع لوحة المعايرة الدقيقة على فاصل لوحة مغناطيسية لمدة 30 ثانية. مع استمرار وضع لوحة المعايرة الدقيقة على الفاصل المغناطيسي ، قم بإزالة مانع تسرب اللوحة وشفط المادة الطافية من الخرز المثبت بالمغناطيس.
- قم بإزالة لوحة المعايرة الدقيقة من الفاصل المغناطيسي.
- أضف 60 ميكرولتر من PBS-T إلى كل خرز يحتوي على بئر.
- كرر خطوات الغسيل 4.5.2-4.5.4 مرتين ليصبح المجموع ثلاث غسلات PBS-T.
- قم بإعداد خلطات الكشف المختلفة في أنابيب منفصلة سعة 1.5 مل. يتكون كل مزيج كشف من جسم مضاد بشري أحادي النسيلة تجاري مضاد ل S1 (Hu-anti-S1) (1 ميكروغرام / مل) وواحد من خمسة SCFs مختلفة موسومة ب FLAG (1 ميكروغرام / مل) (الملف التكميلي 1 ، الجدول التكميلي 1 ، والجدول التكميلي 2) يستهدف بروتين سبايك على جسيم SARS-CoV-2 ، المخفف في Assay Buffer (الخطوة 4.1) ، مما ينتج عنه ما مجموعه خمسة خلطات كشف مختلفة.
- كرر الخطوات 4.5.2-4.5.3. أعد تعليق الكرات المجهرية المغسولة في 50 ميكرولتر / بئر من مزيج اكتشاف السنبلة المناسب الخاص ب scFv. أغلق لوحة المعايرة الدقيقة واحتضانها لمدة 1 ساعة على شاكر مداري (650 دورة في الدقيقة) عند RT (18-22 درجة مئوية) في الظلام.
- جهاز طرد مركزي لوحة العيار الدقيق عند 931 × جم لمدة 1 دقيقة. اغسل كاشف الكشف عن السنبلة الزائد من الخرز. قم بإجراء ثلاث خطوات غسيل باستخدام 60 ميكرولتر من PBS-T وفقا للخطوات 4.5.2-4.5.5.
- احتضان المجهرية مع خليط الأجسام المضادة للكشف عن الفلورسنت.
- قم بإعداد مزيج محلول فلوري يتكون من IgG المضاد للإنسان المترافق PE المتاح تجاريا مع الجسم المضاد المضاد ل FLAG المترافق BV421 المخفف في مخزن الفحص المؤقت ، بتركيزات عمل تبلغ 0.2 ميكروغرام / مل و 1 ميكروغرام / مل ، على التوالي. لكل تفاعل ، هناك حاجة إلى 50 ميكرولتر من كاشف الكشف عن الفلورسنت.
- كرر الخطوات 4.5.2-4.5.3. أعد تعليق الكريات المجهرية في 50 ميكرولتر / بئر من مزيج محلول الفلورسنت. أغلق لوحة المعايرة الدقيقة واحتضانها لمدة 30 دقيقة على شاكر مداري (650 دورة في الدقيقة) عند RT (18-22 درجة مئوية) في الظلام.
- قم بتدوير لوحة المعايرة الدقيقة عند 931 × جم لمدة 1 دقيقة. اغسل مزيج محلول الفلورسنت الزائد من الكريات المجهرية. قم بإجراء ثلاث خطوات غسيل باستخدام 60 ميكرولتر من PBS-T وفقا للخطوات 4.5.2-4.5.5.
- قم بتعليق الكريات المجهرية في 60 ميكرولتر من PBS-T من خطوة الغسيل الأخيرة. قم بتحليل اللوحة على نظام تحليل تدفق المراسل المزدوج بالإعدادات الموضحة في الخطوة 2.6.
النتائج
اختبار الاقتران
أظهر اختبار الاقتران أن ACE2 من الماعز IgG والنيوترافيدين والبيوتينيل قد تم اقترانهما بنجاح مع الكرات المجهرية. تم تأكيد خصوصية الكشف عن الفحص من خلال فحص الكرات المجهرية المترافقة ب ACE2 مع الأجسام المضادة الثانوية التي تحمل علامة PE والتي تم إنشاؤها في أنواع حيوانية مختلفة (الشكل 2). لم يلاحظ أي تفاعل متقاطع بين الأجسام المضادة المختلفة للكشف. عندما تم فحص مخاليط الخرز باستخدام الماعز المضاد للأنجيوتنسين 2 + IgG PE المضاد للماعز ، تم الكشف عن متوسط شدة مضان (MFI ؛ وحدات تعسفية) فوق الخلفية لكل من ACE2 و IgG المجهرية المترافقة للماعز ولكن ليس للكرة المجهرية غير المقترنة (عارية) أو للكرات المجهرية المغلفة بالبيوتين. تم استخدام IgG PE المضاد للفأر و IgG PE المضاد للأرانب كعناصر تحكم سلبية للتحقق من الإشارات الإيجابية الخاطئة. تم إنشاء إشارة مضان ضئيلة عند الحضانة مع المجهرية ، مما يشير إلى أن الإشارات الإيجابية ل ACE2 والماعز IgG كانت محددة.
إمكانية الكشف عن الجسيمات الفيروسية في طافات الخلايا
تم استخدام الخرزات المغناطيسية المقترنة ب ACE2 البشري المؤتلف لالتقاط الجسيمات الفيروسية SARS-CoV-2 من المنوية المصابة والسيطرة (بدون فيروس) على طاف زراعة خلايا VeroE6 ثم تم فحصها في وقت واحد بحثا عن منطقتين متميزتين من سبايك فيروسي باستخدام جسم مضاد وحيد النسيلة وواحد من خمسة SCFs متميزة. لوحظت إشارة تعتمد على التركيز في تخفيفات طافات الخلايا المصابة بفيروس SARS-Cov-2 في كلتا القناتين المراسلتين (RP1 و RP2) (الشكل 3) ، مما يشير إلى أن كلا من الجسم المضاد التجاري Hu-anti-S1 و scFvs المختلفة اكتشفوا الجسيم الفيروسي المرتبط بالغلاف المجهري المترافق ACE2. مع ثلاثة من أصل خمسة scFvs ، يمكن اكتشاف الفيروس في التخفيفات وصولا إلى 1:18 (scFv2 ، scFv3 ، scFv5) ؛ بالنسبة للاثنين المتبقيين من scFvs (scFv7 و scFv9) ، يمكن اكتشافه حتى 1: 6 تخفيفات. يمكن أن يعزى ذلك إلى تقارب مختلف للهدف. كما هو موضح في الشكل 3 والجدول 1 ، يوفر scFv3 أعلى كثافة MFI ، يليه scFv5 و scFv2 و scFv7 و scFv9 ، على التوالي.
على الصعيد العالمي ، يؤدي اكتشاف scFvs إلى انخفاض MFI مقارنة ب Hu-anti-S1. قد يشير هذا إلى انخفاض التقارب ، ولكن يمكن أن يكون أيضا قطعة أثرية بسبب وضع العلامات بأصباغ فلورية مختلفة (PE و BV421). هناك اتجاه آخر يمكن رؤيته ل scFv7 و scFv9 وهو أن قيم MFI أقل قليلا لقناة RP1 (المضادة للارتفاع) أيضا مقارنة بالتكوينات الثلاثة الأخرى. قد يشير هذا إلى أن scFvs إما تتفاعل أو تتداخل بطريقة أخرى مع تفاعل ACE2-Hu-anti-S1 ، مما قد يفسر أيضا الإشارة المنخفضة في قناة RP2. لم يتم الكشف عن أي جزيئات فيروسية في طاف خلايا Vero E6 غير المصابة في قناة RP1 أو RP2.
يتم استخدام المجهرية المترافقة بالنيوترافيدين والبيوتين ، والكرة المجهرية IgG الماعز ، والكرات المجهرية غير المقترنة كخرز تحكم سلبي. تم التقاط الجسيمات الفيروسية باستخدام كريات مجهرية مغناطيسية مقترنة ب ACE2 واختبارها باستخدام مضاد للارتفاع البشري التجاري في قناة مراسل RP1 ومع scFvs مختلفة في قناة مراسل RP2 (يشار إلى scFv في أعلى يسار كل لوحة). لم يتم الكشف عن أي جزيئات فيروس في أي من العينات المصابة وغير المصابة.
دقة الفحص والمتانة
لتقييم دقة الفحص ، تم تشغيل جميع الشروط في ثلاث نسخ. تم حساب معامل التباين (CV) للكرة المجهرية ACE2 لكل نقطة تخفيف. كانت جميع السير الذاتية المحسوبة للفحص أقل من 15٪ ، حيث كانت أعلى سيرة ذاتية مقاسة 13٪ ، وأدنى سيرة ذاتية 1٪ (الجدول 2). كما يتضح من مخطط الكثافة (الشكل 4) لقناة RP1 ، يظهر اكتشاف PE ل Hu-anti-S1 التجاري دقة أعلى ، يتركز بشكل أساسي حول السيرة الذاتية بنسبة 3٪. تعرض قناة RP2 ، اكتشاف BV ل scFVs ، سير ذاتية أعلى. ومع ذلك ، كما يتضح من الجدول 2 ، فإن النطاق الأعلى للسير الذاتية مدفوع بالعينات ذات التركيزات المنخفضة من الجسيمات الفيروسية ، مثل الفراغ. لاختبار متانة البروتوكول ، تم تكرار الفحص مرتين من قبل مشغلين مختلفين ، باستخدام مخاليط الخرز المتولدة في أيام مختلفة وحجم عينة أقل (أقل بنسبة 72٪). لوحظ ارتباط بيرسون جيد جدا ، يتراوح بين 0.98 و 1 ، لكل من قنوات RP1 و RP2 (القيمة p < 0.01) ، مما يؤكد متانة الفحص وإمكانية تطبيق الفحص عند توفر عينة أقل (الشكل 5). تتبع تقنية تحليل التدفق هذه "نظرية التحليل المحيط"17 ، مما يجعل الفحص حساسا للتركيز ولكن ليس الحجم.
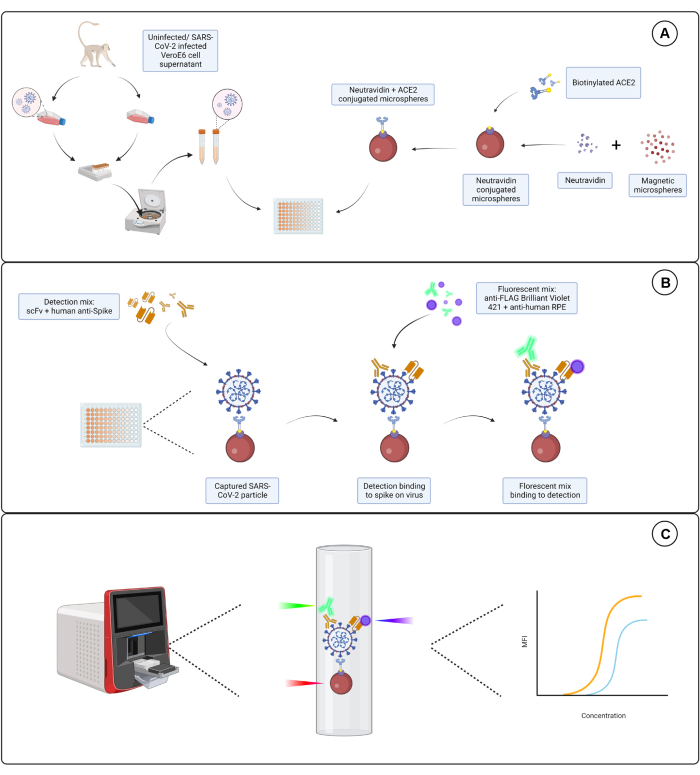
الشكل 1: مقايسة جسيمات الفيروس. (أ) تضاف الخلايا الطافية من كل من خلايا Vero E6 المصابة وغير المصابة في تخفيف تسلسلي إما إلى صفيحة 96 بئرا أو 384 بئرا ، جنبا إلى جنب مع الكريات المجهرية المغناطيسية المترافقة مع النيوترافيدين ، ثم تقترن إما ب ACE2 البشري البيوتينيل أو البيوتين. يتم استخدام الكرات المجهرية غير المقترنة إلى جانب الماعز IgG والكرات المجهرية العارية كضوابط سلبية جنبا إلى جنب مع المجهرية المترافقة بالنيوترافيدين والبيوتين. (ب) يتم الكشف عن مجمعات جسيمات الفيروسات المجهرية التي تشكلت باستخدام كوكتيل كشف يتكون من Hu-anti-S1 وأحد scFvs المختلفة مع علامة FLAG. ثم يتم إضافة مزيج من الفلورسنت مع IgG PE المضاد للإنسان الذي يستهدف Hu-anti-S1 و FLAG Brilliant Violet 421 الذي يستهدف scFvs. (ج) يصدر نظام الكشف المزدوج ثلاثي الليزر ليزرا أحمر وأخضر وبنفسجيا للكشف عن مركب الجسيمات الدقيقة. يكتشف الليزر الأحمر ملصق صبغة المجهرية ، بينما يكتشف الليزر الأخضر والبنفسجي مضاد S1 و scFvs، على التوالي. ثم يتم تحليل البيانات التي تم إنشاؤها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
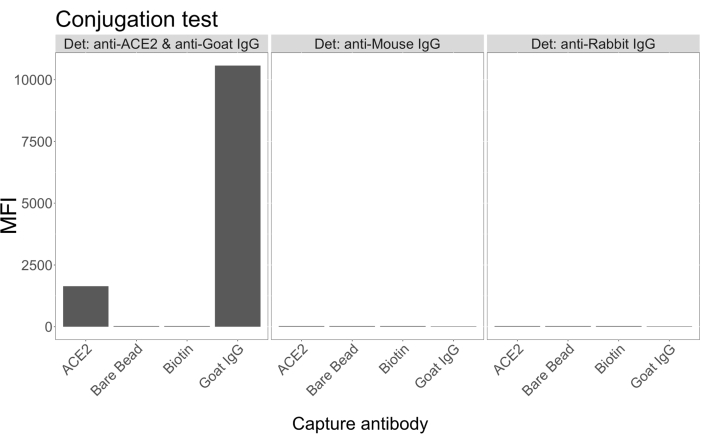
الشكل 2: مخطط تأكيد الاقتران. تتكون مخاليط الخرزات من أربعة معرفات مجهرية مختلفة ، كل منها مقترن ببروتين مختلف: نيوترافيدين-بيوتين-ACE2 (ACE2) ، وكرة مجهرية غير مقترنة (حبة عارية) ، نيوترافيدين-بيوتين (بيوتين) ، وماعز-IgG (Goat IgG). في اختبار الاقتران ، تم استخدام ثلاثة تكوينات مختلفة من فلوروفورات الكشف. وهي الماعز المضادة ل ACE2 + IgG PE المضادة للماعز ، و IgG PE المضادة للفأر ، و IgG PE المضادة للأرانب. يظهر المحور Y متوسط إشارة MFI المقاسة (متوسط شدة التألق ؛ الوحدات التعسفية) من كل كرة مجهرية مع الظروف الثلاثة المختلفة. يظهر المحور X الأجسام المضادة المختلفة المطبقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
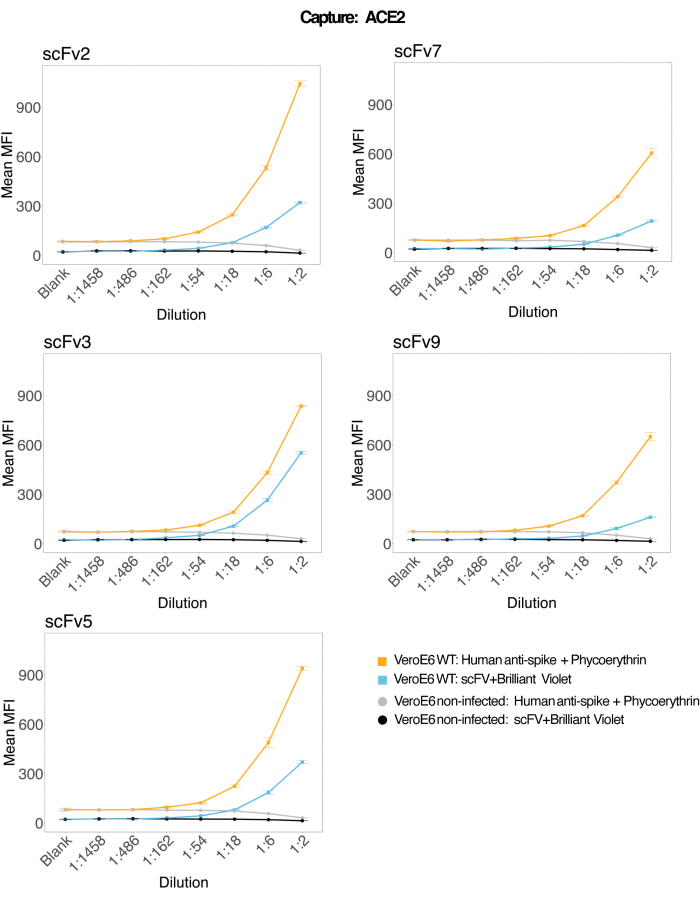
الشكل 3: الكشف المتعدد عن البروتينات السطحية. المحور Y: متوسط MFI (متوسط شدة التألق ؛ الوحدات التعسفية ± الانحراف المعياري) لكل عينة ، يتم تحليلها في آبار ثلاثية لكل حالة. المحور السيني: نقاط التخفيف التسلسلي لطافي الخلية. برتقالي: جزيئات الفيروس في طاف من Vero E6 المصابة بفيروس SARS-CoV-2 WT تم اكتشافها باستخدام مضاد للارتفاع البشري + PE المضاد للإنسان (phycoerythrin). الأزرق: طاف من Vero E6 مصاب ب SARS-CoV-2 WT تم اكتشافه باستخدام scFvs + Anti-FLAG Brilliant Violet 421 المختلف. الرمادي: تم اكتشاف طاف الخلايا غير المصاب بمضاد للسبايك البشري + PE المضاد للإنسان. أسود: تم اكتشاف طاف خلية غير مصاب باستخدام خمسة أنواع مختلفة من scFvs + Anti-FLAG Brilliant Violet 421. تم التقاط الجسيمات الفيروسية باستخدام كريات مجهرية مغناطيسية مقترنة ب ACE2 واختبارها باستخدام أجسام مضادة بشرية تجارية مضادة للارتفاع في قناة مراسل RP1 ومع scFvs مختلفة في قناة مراسل RP2 (يشار إلى scFv في أعلى يسار كل لوحة). لم يتم الكشف عن أي جزيئات الفيروس في أي من العينات غير المصابة. كان للخاتمة التي استهدفها scFv3 أعلى تقارب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
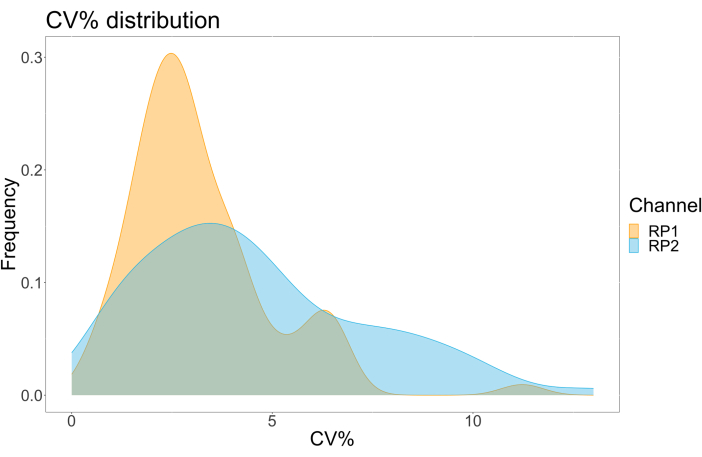
الشكل 4: مخطط تشتت التباين. المحور Y هو تكرار الأحداث ، ويظهر المحور X معامل التباين (CV) بالنسبة المئوية لكل نسخة مكررة من العينات المختلفة. RP1 و RP2 هما قناتا المراسل الأولى والثانية اللتان تكتشفان التألق المرتبط ب phycoerythrin و Brilliant Violet 421 ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
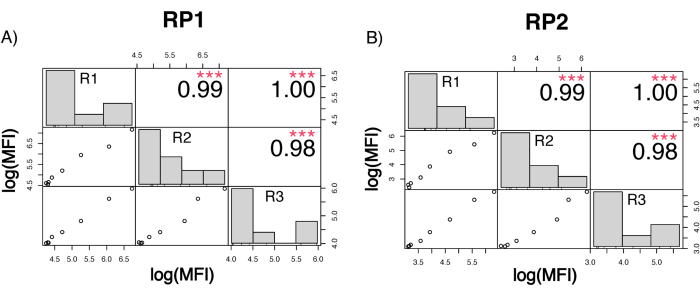
الشكل 5: تشغيل مصفوفة الارتباط. (أ ، ب) المحور ص: مصفوفة ارتباط بيرسون بمقياس log10 بين ثلاثة أشواط منفصلة ، يديرها ثلاثة مشغلين مختلفين وبمخاليط خرز مختلفة. تم تطبيق حجم عينة أقل في الجولة الثالثة. تظهر الرسوم البيانية توزيع مجموعات المتغيرات المختلفة بناء على MFI المقاس. (أ) ارتباط قناة مراسل RP1 بين الأشواط المختلفة. (ب) ارتباط قناة مراسل RP2 بين الأشواط المختلفة. MFI = متوسط شدة التألق في الوحدات التعسفية. ص < 0.001. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكشف | التفاعلية |
| scFv2 | ++ |
| scFv3 | +++ |
| scFv5 | ++ |
| scFv7 | + |
| scFv9 | + |
| الإنسان المضادة سبايك IgG | ++++ |
الجدول 1: ترتيب scFvs في الكشف بناء على كثافة MFI التي تم الحصول عليها في المنحنيات القياسية.
| RP1 (PE) | RP2 (BV421) | |
| تخفيف العينة | نطاق السيرة الذاتية [٪] | نطاق السيرة الذاتية [٪] |
| خلبي | 3–11 | 2–13 |
| 1:1458 | 1–7 | 2–7 |
| 1:456 | 4–6 | 3–8 |
| 1:162 | 3–6 | 3–7 |
| 1:54 | 2–4 | 2–4 |
| 1:18 | 2–4 | 1–4 |
| 1:6 | 2–6 | 1–6 |
| 1:2 | 1–5 | 1–3 |
الجدول 2: CV٪ (متوسط / انحراف معياري × 100) نطاق كل نقطة تخفيف للطاف المصاب بفيروس SARS-CoV-2 لكل من قنوات مراسل RP1 و RP2.
الملف التكميلي 1: توليد جزء متغير أحادي السلسلة من الغلوبولين المناعي (scFv). الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 1: فحص scFvs في أزواج مع Fabs مقابل التخفيف التسلسلي للسبايك المؤتلف (RBD). لتقييم أداء الببتيدات المختلفة للكشف ، تم استخدام 12 مجموعة من بروتين سبايك ، Fab ، كالتقاط في المخزن المؤقت مع RBD المؤتلف. تم تطبيق عشرة (10) scFvs تستهدف حوائط مختلفة من بروتين سبايك ككشف. اعتمادا على أداء زوج اكتشاف الالتقاط ، تم تمييزها إما على أنها فاشلة (-) أو ناجحة (+). الرجاء الضغط هنا لتنزيل هذا الملف.
الجدول التكميلي 2: فحص SCFVS في أزواج مع Fabs ضد التخفيف التسلسلي لطاف خلية Calu-3 المصاب بفيروس SARS-Cov-2. لتقييم أداء الببتيدات المختلفة للكشف ، تم استخدام 12 مجموعة من بروتين سبايك ، Fab ، كالتقاط في طاف خلية Calu-3 المصاب بفيروس SARS-Cov-2. تم تطبيق عشرة (10) scFvs تستهدف حوائط مختلفة من بروتين سبايك ككشف. اعتمادا على أداء زوج اكتشاف الالتقاط ، تم تمييزها إما على أنها فاشلة (-) أو ناجحة (+). الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
لقد ثبت أن تقنية تعدد الإرسال القائمة على الخرز هي منصة قيمة للكشف عن مسببات الأمراض عالية الإنتاجية في عدد من التطبيقات السريرية. تسمح المرونة العالية للمنصة ، بناء على مبادئ قياس التدفق الخلوي ، باستهداف الأجسام المضادة والبروتينات والأحماض النووية18،19،20،21،22 ، مما يؤدي إلى مضاعفة مئات التحليلات في وقت واحد. ومع ذلك ، على حد علمنا ، لم يتم تطبيق هذه التقنية من قبل للكشف عن الجسيمات الفيروسية السليمة. في هذا التقرير ، تم تطبيق التكنولوجيا للكشف عن الجسيمات الفيروسية السليمة من خلال استهداف ثلاثة حوائط سطحية مستقلة ل SARS-CoV-2.
تظهر فيروسات الحمض النووي الريبي المغلفة تشابها هيكليا عاليا مع الحويصلات خارج الخلية (EVs) ، والأغشية الفوسفوليبيد الصغيرة التي تحمل الحمض النووي الريبي الفيروسي والبروتينات جنبا إلى جنب مع البروتينات المضيفة23. تم تطبيق المقايسات المناعية للساندويتش سابقا للكشف عن المركبات الكهربائية ، باستخدام زوج من الأجسام المضادة يستهدف بروتينين سطحيين متميزين24,25. تتم إزالة الحد من مقايسات الساندويتش للكشف عن بروتينين فقط في وقت واحد من خلال طرق متعددة تسمح بالكشف المتزامن عن أكثر من بروتينين لكل تفاعل.
نظام الكشف عن المراسل المزدوج ثلاثي الليزر الموصوف هنا هو أداة تحليل التدفق القائمة على الخرزة الأكثر تقدما حتى الآن. فيما يتعلق بأنظمة قراءة المراسل الواحد ، يسمح المراسل المزدوج (قنوات RP1 و RP2) بالكشف عن ثلاثة بروتينات / حواتم سطحية بالتوازي. يوفر استهداف العديد من البروتينات السطحية الفيروسية والحواتم تمثيلا أكثر دقة لحمل البروتين الفيروسي ، والذي ، بالإضافة إلى تأكيد أن الفيروس سليم في الواقع ، يفتح أيضا الفرصة لمزيد من التحقيق في المستضدات السطحية الفيروسية وآليات تفاعلات البروتين الفيروسي والمضيف.
خلال جائحة COVID-19 ، كانت أهمية التعرف الفوري على الأفراد الذين يحملون جزيئات فيروسية نشطة مهمة في الجهود المبذولة لاحتواء انتشار الفيروس. يتم الكشف عن الحمض النووي الريبي الجينومي بواسطة RT-PCR الكمي بغض النظر عن أصله (جزيئات الفيروس سليمة أو مجانية). ومع ذلك ، فإن المغلف السليم الذي يحتوي على بروتين S الذي يمكن الوصول إليه هو الوحيد الذي يمكن أن يتوسط في دخول الخلية وتكرار الفيروس اللاحق. أظهرت الدراسات السابقة التي أجريت على رقائق الموائع الدقيقة في عينات المرضى كيف أن اكتشاف الجسيمات الفيروسية السليمة جنبا إلى جنب مع اختبار نقطة الرعاية سيمكن من إجراء اختبارات متكررة وتعزيز مراقبة انتشار المرض ، بما في ذلك اختيار أكثر استنارة للأفراد الذين سيتم عزلهم26. سيسمح تطبيق مقايسة متعددة الإرسال قائمة على المجهرية بتصميم مقايسات تهدف إلى فحص فيروسات متعددة ومتغيرات مستضداتها السطحية ، والحصول على صورة أكثر دقة لانتشار الفيروس بين السكان.
قياس التدفق الفيروسي هو تطور حديث لقياس التدفق الخلوي يهدف إلى تحليل الجسيمات الفيروسية. على الرغم من قدرتها على اكتشاف الجسيمات الفيروسية المنفصلة ، إلا أن تحليل الفيروسات الصغيرة يطرح مشكلة حالية لقياس تدفق الفيروسات27,28. على غرار الطريقة الموصوفة هنا ، يتضمن قياس التدفق التقاط الفيروسات السليمة بواسطة جسيمات الذهب النانوية المقترنة بالأجسام المضادة. تشمل القيود المفروضة على كلتا الطريقتين (i) الاعتماد على كواشف التقاط وكشف عالية التقارب للمستضد المعبر عنه سطحيا الذي تستهدفه الكريات المجهرية أو الجسيمات النانوية ، (ii) القدرة المحدودة على التمييز بين جزيئات الفيروس والحويصلات خارج الخلية ، و (iii) عدم وجود معايير للقياس الكمي المناسب للجسيمات.
تفرز الخلايا EVs في محيطها ، وعندما تصاب بفيروس ، قد تفرز أيضا فيروسات مماثلة لحجم EVs وقد تعبر في النهاية عن نفس المستضدات29. نظرا لأن المركبات الكهربائية سيكون لها تركيبات غشائية مماثلة للفيروس ، فقد يكون من الصعب تمييزها عن بعضها البعض باستخدام الطرق القائمة على التقارب فقط مثل نهج الليزر المزدوج أحادي المراسل. ومع ذلك ، فإن الاستراتيجيات الموصوفة هنا تتميز بقدرة مضاعفة أعلى ، مما يتيح إجراء تحقيق أوسع وأعمق في تكوين بروتين الجسيمات. تسمح الطرق القائمة على التدفق بتتبع الجسيمات المنفصلة ، مما يوفر فرصا للقياس الكمي الرقمي. تتمثل إحدى الاستراتيجيات لمعالجة مشكلة القياس الكمي في طريقتنا في استخدام حويصلات اصطناعية جيدة التوصيف تعبر عن المستضدات ذات الأهمية كجسيمات شبيهة بالفيروسات (VLPs) لإعداد منحنيات قياسية.
المسار المشترك لدخول وخروج SARS-CoV-2 من الخلايا المضيفة هو من خلال تفاعل الفيروس وغشاء الخلية المضيفة 2,15. في هذه العملية ، يكون احتمال دمج بروتينات الغشاء المضيف في سطح الفيروس مرتفعا. من خلال فحص البروتينات المضيفة المدمجة ، يمكن للمرء تتبع مسار العدوى والتنبؤ المحتمل بمسار المرض للمرضى المعرضين لمخاطر مختلفة ، مما يسمح باتخاذ قرارات العلاج المبكرة. كما يسمح بتوصيف الفيروسات عبر دفعات عينات مختلفة في مختبرات البحوث. يمكن استكشاف ذلك بشكل أكبر عن طريق اختبار ما إذا كانت الخصائص المختلفة مرتبطة بمستويات مختلفة من العدوى الفيروسية ولفحص الأجسام المضادة وجزيئات الأدوية التي تستهدف البروتينات السطحية الفيروسية.
أحد الجوانب المهمة المتعلقة بالطريقة الموصوفة هو أنها تعتمد على تقارب كواشف الالتقاط والكشف ضد البروتينات المستهدفة على الفيروس. وبالتالي ، فإن اختيار كواشف التقارب هو عامل حاسم في أداء الفحص. ربما ، يجب فحص كواشف التقارب المتعددة واختبارها لالتقاطها واكتشافها لاختيار تلك التي لديها أعلى تقارب. هنا ، تم تقييم أداء عشرة scFvs واثني عشر شظية Fab بشكل مبدئي باستخدام RBD المؤتلف وعلى الجسيمات الفيروسية من طاف الخلايا الظهارية الرئوية Calu-3 المصابة بفيروس SARS-Cov-2 (تم استخدام خلايا VeroE6 لثقافة / تقييم السمية الخلوية في جميع الدراسات اللاحقة). تم استخدام Anti-FLAG PE للكشف عن scFvs الموسوم ب FLAG (الجدول التكميلي 1 والجدول التكميلي 2). ثم تم اختيار أفضل خمسة SCFs أداء ليتم تطبيقها في اختبار المراسل المزدوج ، جنبا إلى جنب مع Hu-anti-S1 التجاري (الجدول 1) ، على المواد الطافية من الخلايا الظهارية لكلية الأخضر الأفريقي VeroE6.
عامل حاسم آخر لنجاح البروتوكول هو الإجراء المختار لاقتران الكرة المجهرية. يجب أن تكون طريقة الاقتران فعالة ، وفي الوقت نفسه ، تحافظ على الحواتم المطابقة أو بقايا الأحماض الأمينية المشاركة في ارتباط البروتين سليمة وغير معدلة. هنا ، تم تطبيق تفاعل EDC-NHS على زوج النيوترافيدين مباشرة إلى الكرات المجهرية ، وتكييف بروتوكول تم وصفه سابقا30 ونظام نيوترافيدين + بيوتين لربط ACE2 المؤتلف بالكريات المجهرية المقترنة. يمكن اختبار ومقارنة طرق الاقتران البديلة وكفاءتها. أخيرا ، لوحظ أن كواشف الكشف المختلفة ذات العلامات الفلورية (على سبيل المثال ، anti-FLAG PE (phycoerythrin) و anti-FLAG Brilliant Violet 421) قد تؤدي إلى مستويات مختلفة من MFI قد تؤثر على حساسية الفحص.
في الختام ، تسمح الطريقة الموصوفة باكتشاف الجزيئات الفيروسية السليمة في المحلول ، وتطبيق استراتيجية المراسل المزدوج. يوفر تحليل ثلاثة محددات سطحية بالتوازي أداة أكثر تحديدا لتوصيف الجسيمات الفيروسية وتمييزها في النهاية عن المركبات الكهربائية الأخرى (على سبيل المثال ، لا تحتوي على مستضدات فيروسية). هذه الاستراتيجية هي بديل لقياس التدفق الفيروسي. على الرغم من أن النهج الحالي لا يميز بين أحجام الجسيمات ، إلا أن استراتيجيات الخرزة المغناطيسية باستخدام الكريات المجهرية المرمزة بالألوان توفر قدرة أوسع في تنميط المستضد السطحي والتصميم التجريبي من خلال التحليل عالي الإرسال وعالي الإنتاجية. يظهر الفحص دقة ومتانة عالية ويمكن تمديده ليشمل تحليل أي نوع من الحويصلات خارج الخلية وأي نوع آخر من الجسيمات الحيوية التي تعرض المستضدات السطحية في سوائل الجسم أو المصفوفات السائلة الأخرى. كانت هذه دراسة إثبات المفهوم التي أظهرت فائدة استخدام scFvs ككاشف كشف واحد في تحليل متعدد الإرسال لحواجز بروتينية متعددة على الجسيمات الفيروسية. الدراسات المستقبلية ضرورية لتحديد الخصائص المحددة ل scFvs (على سبيل المثال ، الصلات الملزمة ، والتفاعل المتبادل مع الكواشف والأهداف الأخرى) إذا كان سيتم استخدامها لأغراض كمية أو سريرية.
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
نحن نعترف في SciLifeLab ، السويد ، بفريق وحدة Affinity Proteomics-Stockholm Scilifelab لتطوير وتطبيق الطريقة الموضحة هنا ، ووحدة علاجات الأجسام المضادة البشرية لتوفير كواشف scFvs و Fab ، و Jonas Klingström لخلايا VeroE6 المصابة بعزلات SARS-CoV-2 الناشئة عن العينات السريرية. يشكر المؤلفون شيري دنبار ، دكتوراه ، ماجستير في إدارة الأعمال من شركة Luminex Corporation (أوستن ، تكساس) ، لدعم البحث ، ومات سيلفرمان ماجستير ، دكتوراه في حلول النشر الطبي الحيوي (بنما سيتي ، فلوريدا ؛ mattsilver@yahoo.com) للمساعدة العلمية والكتابية. تم دعم هذا العمل بأموال من مؤسسة كنوت وأليس والنبرغ ومختبر العلوم من أجل الحياة (SciLifeLab) (VC2020-0015 إلى كلوديا فريدوليني وفرانشيسكا تشيودي و VC-2022-0028 إلى كلوديا فريدوليني).
Materials
| Name | Company | Catalog Number | Comments |
| ACE2-Biotin | Acro Biosystems (Newark, DE) | AC2-H82E6-25 ug | Conc: 340 µg/mL, LOT#BV35376-203HFI-2128 |
| Anti-Goat IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 705-116-147 | Host species: Donkey |
| Anti-Human IgG R-PE | Life Technologies/Thermo Fisher (Waltham, MA) | H10104 | Conc: 0.15 mg/mL, LOT#2079224, Host species: Goat |
| Anti-Mouse IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 115-116-146 | Host species: Goat |
| Anti-Rabbit IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 111-116-144 | Host species: Goat |
| Biotin | Thermo-Fisher Scientific (Waltham, MA) | 20RUO | 100 mM, pH 10 Conc. 1 mg/mL |
| Blocker Casein in PBS | Thermo-Fisher Scientific (Waltham, MA) | 37528 | LOT#VD301372 |
| Blocker reagent for ELISA (BRE) | Roche (Basel, Switzerland) | 11112589001 | |
| Brilliant Violet 421 anti-DYKDDDDK Tag Antibody (Anti-FLAG) 0.2 mg/ml, rat IgG2a, λ | BioLegend (Amsterdam, The Netherlands) | 637321 | |
| Bovine serum albumin (BSA) | Saveen & Werner (Limhamn, Sweden) | B2000-500 | LOT#04D5865 |
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Proteochem (Hurricane, UT) | C1100-custom (65 mg) | LOT# MK3857 |
| Fetal calf serum (FCS) | Gibco/Thermo Fisher (Waltham, MA) | 10270-106 | |
| Goat anti-ACE2 polyclonal antibody | R&D Systems/Bio-Techne (Minneapolis, MN) | AF933 | Host species: Goat |
| Goat IgG | Bethyl Labs (Montgomery, TX) | P50-200 | LOT#P50-200-6 |
| L-glutamine | Thermo-Fisher Scientific (Waltham, MA) | 25030024 | |
| Low-bind 1.5 mL microfuge tubes | VWR (Radnor, PA) | 525-0133 | |
| MagPlex-C Microspheres | Luminex Corporation (Austin, TX) | MC10XXX-01 | |
| MEM tissue cuture media | Gibco/Thermo Fisher (Waltham, MA) | 21430-020 | |
| Microplate, 96-Well, Polystyrene, Half-area, Clear | Greiner Bio-One (Kremsmünster, Austria) | 675101 | |
| NaHCO3 | Gibco/Thermo Fisher (Waltham, MA) | 25080-060 | |
| Neutravidin | Thermo-Fisher Scientific (Waltham, MA) | 31000 | LOT#UK292857 |
| PBS tablets | Medicago AB (Uppsala, Sweden) | 09-9400-100 | LOT#272320-01 |
| Penicillin/Streptomycin | Gibco/Thermo Fisher (Waltham, MA) | 15140122 | |
| Poly(vinyl alcohol) | Sigma-Aldrich (St. Louis, MO) | 360627 | |
| Polyvinylpyrrolidone | Sigma-Aldrich (St. Louis, MO) | 437190 | |
| ProClin 300 | Sigma-Aldrich (St. Louis, MO) | 48915-U | |
| Rabbit IgG | Bethyl Labs (Montgomery, TX) | P120-301 | LOT#12 |
| scFv-FAb1 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.12 mg/mL. | |
| scFv-FAb2 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc batch1: 0.38 mg/mL. Conc batch2: 0.45 mg/mL | |
| scFv-FAb3 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.34 mg/mL. | |
| scFv-FAb4 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 2.85 mg/mL. | |
| scFv-FAb5 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc:2.7mg/mL. | |
| SARS-CoV-2 infectious particles, Swedish isolate | In-house production | The Public Health Agency of Sweden | |
| SARS-CoV-2 Spike Antibody (Hu-anti-S1) | Novus Biologicals (Centennial, CO) | NBP2-90980 | Monoclonal antibody. Conc: 1 mg/mL. Host: Human. Clone: CR3022. Isotype: IgG1 Kappa. LOT#T201B06 |
| Sodium phosphate monobasic, anhydrous | Sigma-Aldrich (St. Louis, MO) | S3139 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo-Fisher Scientific (Waltham, MA) | 24510 | LOT# XH321563 |
| Tween | Thermo-Fisher Scientific (Waltham, MA) | BP337-50 | LOT#194435 |
| Ultraviolet lamp | Vilber Lourmat GmbH (Eberhardzell, Germany) | VL-215.G | Wavelength = 254 nm; 2 × 15-watt bulbs |
| Vero E6 cells | ATCC (Manassus, VA) | CRL-1586 | |
| xMAP INTELLIFLEX DR-SE (dual-reporter flow instrument) | Luminex Corporation (Austin, TX) | INTELLIFLEX-DRSE-RUO |
References
- Rey, F. A., Lok, S. M. Common features of enveloped viruses and implications for immunogen design for next-generation vaccines. Cell. 172 (6), 1319-1334 (2018).
- V'kovski, P., Kratzel, A., Steiner, S., Stalder, H., Thiel, V. Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology. 19 (3), 155-170 (2021).
- Burnie, J., et al. Flow virometry quantification of host proteins on the surface of HIV-1 pseudovirus particles. Viruses. 12 (11), 1296 (2020).
- Gentili, M., et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles. Science. 349 (6253), 1232-1236 (2015).
- Modrow, S., Falke, D., Truyen, U., Schätzl, H. . Viruses: Definition, Structure, Classification. In Molecular Virology. , 163-181 (2013).
- Trinh, K. T. L., Do, H. D. K., Lee, N. Y. Recent advances in molecular and immunological diagnostic platform for virus detection: A review. Biosensors. 13 (4), 490 (2023).
- Zamora, J. L. R., Aguilar, H. C. Flow virometry as a tool to study viruses. Methods. 134-135, 87-97 (2018).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Byström, S., et al. Affinity proteomic profiling of plasma for proteins associated to area-based mammographic breast density. Breast Cancer Research. 20 (1), 14 (2018).
- Rudberg, A. -. S., et al. SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden. Nature Communications. 11 (1), 5064 (2020).
- Liu, J., et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. Journal of Clinical Virology. 50 (4), 308-313 (2011).
- Gadsby, N. J., Hardie, A., Claas, E. C. J., Templeton, K. E. Comparison of the Luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. Journal of Clinical Microbiology. 48 (6), 2213-2216 (2010).
- Lorenzen, E., et al. Multiplexed analysis of the secretin-like GPCR-RAMP interactome. Science Advances. 5 (9), (2019).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments: JoVE. (170), e62487 (2021).
- Jackson, C. B., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews Molecular Cell Biology. 23 (1), 3-20 (2022).
- ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. International Standardization Organization Available from: https://nhiso.com/wp-content/uploads/2018/05/ISO-10993-5-2009.pdf (2009)
- Poetz, O., et al. Sequential multiplex analyte capturing for phosphoprotein profiling. Molecular & Cellular Proteomics. 9 (11), 2474-2481 (2010).
- Dunbar, S. A., Vander Zee, C. A., Oliver, K. G., Karem, K. L., Jacobson, J. W. Quantitative, multiplexed detection of bacterial pathogens: DNA and protein applications of the Luminex LabMAP system. Journal of Microbiological Methods. 53 (2), 245-252 (2003).
- Taniuchi, M., et al. Multiplex polymerase chain reaction method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples. Diagnostic Microbiology and Infectious Disease. 71 (4), 386-390 (2011).
- Wu, M., et al. High-throughput Luminex xMAP assay for simultaneous detection of antibodies against rabbit hemorrhagic disease virus, Sendai virus, and rabbit rotavirus. Archives of Virology. 164 (6), 1639-1646 (2019).
- Dias, D., et al. Optimization and validation of a multiplexed Luminex assay to quantify antibodies to neutralizing epitopes on human papillomaviruses 6, 11, 16, and 18. Clinical and Vaccine Immunology. 12 (8), 959-969 (2005).
- Opalka, D., et al. Simultaneous quantitation of antibodies to neutralizing epitopes on virus-like particles for human papillomavirus types 6, 11, 16, and 18 by a multiplexes lumina assay. Clinical and Diagnostic Laboratory Immunology. 10 (1), 108-115 (2003).
- Nolte-'T Hoen, E., Cremer, T., Gallo, R. C., Margolis, L. B. Extracellular vesicles and viruses: Are they close relatives. Proceedings of the National Academy of Sciences. 113 (33), 9155-9161 (2016).
- Ohmichi, T., et al. Quantification of brain-derived extracellular vesicles in plasma as a biomarker to diagnose Parkinson's and related diseases. Parkinsonism & Related Disorders. 61, 82-87 (2019).
- Ter-Ovanesyan, D., et al. Framework for rapid comparison of extracellular vesicle isolation methods. Elife. 10, e70725 (2021).
- Gamage, S. S. T., et al. Microfluidic affinity selection of active SARS-CoV-2 virus particles. Science Advances. 8 (39), (2022).
- Renner, T. M., Tang, V. A., Burger, D., Langlois, M. -. A. Intact viral particle counts measured by flow virometry provide insight into the infectivity and genome packaging efficiency of moloney murine leukemia virus. Journal of Virology. 94 (2), e01600-01619 (2020).
- Niraja, S., et al. A flow virometry process proposed for detection of SARS-CoV-2 and large-scale screening of COVID-19 cases. Future Virology. 15 (8), 525-532 (2020).
- Lippé, R. Flow virometry: A powerful tool to functionally characterize viruses. Journal of Virology. 92 (3), e01765 (2018).
- Drobin, K., Nilsson, P., Schwenk, J. M. Highly multiplexed antibody suspension bead arrays for plasma protein profiling. Methods in Molecular Biology. 1023, 137-145 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved