Method Article
יצירת פרופיל של אפיטופים של חלבון פני השטח על חלקיקים נגיפיים על ידי אסטרטגיית Multiplex Dual-Reporter
In This Article
Summary
כאן, אנו מתארים בדיקה חיסונית פלואורסצנטית מרובת מרבבים שפותחה לאחרונה המשתמשת במערכת ציטומטרית זרימה דו-מדווחת כדי לזהות בו זמנית שני אפיטופים ייחודיים של חלבון ספייק על חלקיקים נגיפיים שלמים של תסמונת נשימה חריפה חמורה קורונה 2 (SARS-CoV-2) שנלכדו על ידי מיקרוספרות מגנטיות מצומדות אנזים 2-2 הממירות אנגיוטנסין.
Abstract
חלבוני ממברנה על נגיפים עטופים ממלאים תפקיד חשוב בתפקודים ביולוגיים רבים הכוללים היצמדות של וירוסים לקולטני תאי מטרה, איחוי חלקיקים נגיפיים לתאים מארחים, אינטראקציות בין נגיף המאכסן ופתוגנזה של מחלות. יתר על כן, חלבוני קרום נגיפיים על חלקיקי נגיף ומוצגים על פני התא המארח הוכיחו את עצמם כמטרות מצוינות עבור אנטי-ויראלים וחיסונים. במאמר זה אנו מתארים פרוטוקול לחקירת חלבוני פני השטח על חלקיקים שלמים מסוג SARS-CoV-2 (SARS-CoV-2) באמצעות המערכת הציטומטרית של זרימה דו-מדווחת. הבדיקה מנצלת את טכנולוגיית המולטיפלקס כדי להשיג זיהוי משולש של חלקיקים נגיפיים על ידי שלוש תגובות זיקה בלתי תלויות. חרוזים מגנטיים מצומדים לאנזים אנושי רקומביננטי ממיר אנגיוטנסין-2 (ACE2) שימשו ללכידת חלקיקים נגיפיים מהסופרנאטנט של תאים נגועים ב- SARS-CoV-2. לאחר מכן, שני ריאגנטים לזיהוי המסומנים עם R-phycoerythrin (PE) או Brilliant Violet 421 (BV421) יושמו בו זמנית. כהוכחת היתכנות, נעשה שימוש במקטעי נוגדנים המכוונים לאפיטופים שונים של חלבון פני השטח SARS-CoV-2 Spike (S1). זיהוי חלקיקים נגיפיים על ידי שלוש תגובות זיקה עצמאיות מספק ספציפיות חזקה ומאשר את לכידתם של חלקיקי וירוס שלמים. עקומות תלות במינון של סופרנאטנט תאים נגועים ב- SARS-CoV-2 נוצרו עם שונות מקדם משוכפל (ממוצע / SD) ˂14%. ביצועי בדיקה טובים בשני הערוצים אישרו כי שני אפיטופים של חלבון מטרה על פני השטח של הנגיף ניתנים לזיהוי במקביל. הפרוטוקול המתואר כאן יכול להיות מיושם עבור (i) פרופיל מולטיפלקס גבוה, תפוקה גבוהה של חלבוני פני השטח המבוטאים על וירוסים עטופים; 2) זיהוי חלקיקים נגיפיים פעילים שלמים; ו-(iii) הערכה של ספציפיות וזיקה של נוגדנים ותרופות אנטי-ויראליות לאפיטופים של אנטיגנים נגיפיים. היישום יכול להיות מורחב פוטנציאלית לכל סוג של שלפוחיות וחלקיקים חוץ-תאיים, ולחשוף אנטיגנים פני השטח בנוזלי גוף או מטריצות נוזליות אחרות.
Introduction
הנגיפים הפתוגניים הנפוצים ביותר, כגון שפעת, HIV, ציטומגלווירוס אנושי וזני SARS-CoV, הם וירוסים עטופים. זיהום תאי על ידי וירוסים עטופים דורש איחוי של קרומי תאים נגיפיים ומארחים, וכתוצאה מכך שחרור הגנום הנגיפי לתוך הציטופלסמה. לאחר מכן RNA נגיפי ישתכפל לפני שהוא ארוז לתוך חלקיק נגיפיחדש 1,2. במהלך תהליכים אלה, לא רק חלבונים נגיפיים אלא גם חלבונים של הממברנה המארחת עשויים להשתלב במעטפת, ולהפוך לחלק בלתי נפרד מהחלקיק הנגיפי החדש. חלבוני קרום התא המארח המשולבים במעטפת הנגיף עשויים להקל על כניסת הנגיף לתא מארח חדש, תוך ניצול מנגנוני האינטראקציה בין התא, הביות ובריחת מערכת החיסון 3,4.
למרות החשיבות של חקירת חלבונים הקשורים לנגיף, רוב הטכניקות הזמינות כיום לניתוח וירוסים5 אינן תומכות באפיון תפוקה גבוהה ומולטיפלקס גבוה של אנטיגן פני השטח של הנגיף. הם גם אינם מסוגלים לזהות חלקיקים נגיפיים בודדים או להבחין בין חלקיקי וירוסים שלמים מדבקים, רנ"א לא זיהומי, חלבונים נגיפיים ותת-אוכלוסיות וירוסים המבטאות אנטיגנים שונים. לאחרונה, ציטומטריית זרימה שונתה והותאמה לשיטה חדשנית לניתוח חלקיקים נגיפיים, כלומר, וירומטריית זרימה. וירומטריית זרימה מאפשרת חקירה של חלקיקים נגיפיים בודדים והאנטיגנים שעל פני השטח שלהם. עם זאת, מגבלות הכוללות תפוקה נמוכה, יכולת מולטיפלקס נמוכה, מערך ניסוי מסובך וניתוח נתונים, ויכולת גילוי מוגבלת של חלקיקים נגיפיים בגודל קטן נותרו 6,7.
כימות מולטיפלקס מבוסס מיקרוספירה של חלבונים וחומצות גרעין הוא טכנולוגיה מבוססת היטב עם יישומים רבים החל מכימות חלבונים בנוזלי גוף, מחקרי אינטראקציה בין חלבון לחלבון ואבחון זיהומים ויראליים 8,9,10,11,12,13 . מכשיר ניתוח זרימה שהוצג לאחרונה כולל ערוץ דיווח כפול, המאפשר מדידה של שתי מולקולות כתב פלואורסצנטיות באותה באר תגובה. יכולת חדשה זו הוכחה כשימושית במיוחד עבור פרופיל מקביל של איזוטיפים שונים של אימונוגלובולינים14. כאן, מתואר כיצד ניתן להשתמש במערכת הדיווח הכפול כדי לזהות חלקיקים נגיפיים שלמים, המכוונים למספר אנטיגנים על פני השטח במקביל.
כהוכחת היתכנות, דו"ח זה מפרט את הפיתוח של מערכת זיהוי משולשת עבור חלקיקי נגיף SARS-CoV-2. SARS-CoV-2 מורכב מארבעה חלבונים עיקריים, אחד מהם הוא חלבון הספייק (S), המורכב משתי תת-יחידות. תת-היחידה הראשונה, S1, יוצרת את הקישור הראשוני ל-ACE2 המתבטא בקרומי תאים אנושיים. תת-היחידה השנייה, S2, מאפשרת כניסה לתא המטרה על ידי פפטיד היתוך, ויוצרת נקבובית בקרום תא המטרה שהוויריון יכול להיכנס אליה דרך15. שלוש אבני הבניין הנותרות של SARS-CoV-2 הן הנוקלאוקפסיד (N), חלבון הממברנה (M) וחלבון המעטפת (E). הנוקלאוקפסיד אחראי על אריזת הגנום הנגיפי על ידי יצירת מבנים ריבונוקלאו פרוטאינים עם RNA, בעוד חלבוני הממברנה והמעטפת ממלאים תפקידים מרכזיים בהרכבת הנגיף.
הבדיקה המתוארת כאן מכוונת לשלושה אפיטופים עצמאיים של תת-היחידה S1 המבוטאים על פני המעטפת של SARS-CoV-2. נעשה שימוש בדילולים סדרתיים של סופרנאטנטים של תאים נגועים ב- SARS-CoV-2 ושל תאים לא נגועים. חלקיקים נגיפיים נלכדים באמצעות מיקרוספרות מצומדות ACE2 הקושרות את תת-היחידה S1 על הנגיף. חלבון S של נגיף פני השטח מזוהה במקביל למקטע משתנה חד-שרשרת של אימונוגלובולין (scFv) המתויג מסחרית ונוגדן אנטי-S1 חד-שבטי אנושי (Hu-anti-S1) יחד עם scFv מתויג FLAG שפותח בתוך החברה. ה- Hu-anti-S1 מזוהה על ידי הערוץ הראשון (RP1) במערכת הדיווח הכפול עם נוגדן משני מסוג IgG-Fc אנטי-אנושי מצומד R-phycoerythrin (PE), וה- scFv מזוהה על ידי הערוץ השני (RP2) עם נוגדן אנטי-FLAG משני מצומד כחול Brilliant Violet 421 (BV421). בדיקת חלקיקי הנגיף מיוצגת באיור 1.
Protocol
1. הצמדה של נויטרווידין ונוגדנים בקרה למיקרוספרות מגנטיות
הערה: חרוזים מגנטיים צבועים פלואורסצנטית (מיקרוספרות פוליסטירן בקוטר 6.5 מיקרומטר עם מגנטיט משובץ) עם תוויות פלואורסצנטיות שונות, המפורטות בטבלת החומרים משמשים ליצירת מצומדות חרוזים ובקרות הבאות: (1) ACE2 אנושי רקומביננטי ביוטינילציה הקשור לחרוזים יחד עם מקשר נויטרווידין; (2) ביוטין קשור לחרוזים יחד עם מקשר נויטרווידין; (3) עיזים IgG המוצמדות ישירות לחרוזים; ו-(4) חרוזים לא מצומדים. החלבון שיש להצמיד לחרוזים צריך להיות ללא נתרן אזיד, אלבומין בסרום בקר (BSA), גליצין, תריס(הידרוקסי-מתיל)אמינומתאן (טריס), גליצרול או תוספים המכילים אמין. מאגר ההפעלה הוא 0.1 M נתרן פוספט monobasic, נטול מים (NaH2PO4), pH 6. 2-morpholinoethanesulfonic acid (MES; 50 mM) חיץ של pH 5 משמש לדילול מצומדים. Wash Buffer הוא PBS-T (1x PBS [מלוחים חוצצי פוספט], pH 7.4 + 0.05% (v/v) Tween-20). מאגר אחסון הוא מגיב חוסם 2.7 מ"ג / מ"ל עבור ELISA (BRE) + 0.1% אנטיביוטיקה (כאן, ProClin 300).
- הסר אבקת Sulfo- N-hydroxysulfosuccinimide (NHS) מהמקרר, ו 65 מ"ג מראש aliquotd 1-ethyl-3-[3-dimethylaminopropyl] carbodiimide hydrochloride (EDC) מהמקפיא ולאפשר להגיע לטמפרטורת החדר (RT; 18-22 ° C) במשך 30 דקות. אחסנו הן NHS והן EDC במעטפה המכילה חרוזי סיליקה במהלך שלב זה כדי למנוע הידרוליזה מלחות אטמוספרית.
- הכינו מיקרוספרות להפעלה וצימוד.
הערה: הצבעים הפלואורסצנטיים בתוך מיקרוספרות רגישים לאור, ויש לשמור חרוזים בחושך ובטמפרטורות מקרר (4-8 מעלות צלזיוס) כאשר אינם בשימוש פעיל.- השהה מחדש 4 מניות שונות של מיקרוספרות המקודדות בזיהוי צבע (12.5 x 106/mL) (טבלת חומרים) על ידי ערבול קצר, סוניקציה או סיבוב (15 דקות ב 15-30 סל"ד), על פי דף המידע של המוצר.
- העבר 40 μL של כל תרחיף חרוזים (5 x 105 מיקרוספרות) לבארות שהוקצו של צלחת מיקרוטיטר חצי באר, שטוחה, 96 בארות (טבלה של חומרים).
- לשטוף את החרוזים המגנטיים.
הערה: ניתן לבצע את שלבי השטיפה באופן ידני או באמצעות מכונת כביסה אוטומטית.- הוסף 80 μL/באר מאגר הפעלה לחרוזים והשתק את החרוזים על מפריד לוחות מגנטי למשך 30 שניות. שאפו את הסופרנאטנט מהמיקרוספרות בזמן שהחרוזים משותקים על מפריד הלוחות המגנטי.
- הסר את צלחת המיקרוטיטר ממפריד הלוחות המגנטי והשהה מחדש חרוזים ב- 50 μL של מאגר ההפעלה.
- הפעל את החרוזים עם Sulfo-NHS ו- EDC.
- הכן פתרון עבודה Sulfo-NHS ב 50 מ"ג / מ"ל במאגר הפעלה בצינור מיקרופוגה 1.5 מ"ל. להחזיר את אבקת NHS למקרר (4-8 מעלות צלזיוס), מוגנת מפני לחות.
- הכן את תמיסת העבודה של EDC במינון 50 מ"ג/מ"ל במאגר ההפעלה בצינור המיקרופוגה שלה בנפח 1.5 מ"ל. להמיס את aliquots מוכן מראש 65 מ"ג של אבקת EDC ב 1.3 מ"ל של מאגר ההפעלה.
הערה: Sulfo-NHS ו- EDC מתחילים הידרוליזה ומאבדים פעילות עם המסתם. הימנע מהפרעה להליך הצימוד עד ש- NHS ו- EDC נוספו לחרוזים. אל תשמור פתרונות NHS או EDC מומסים לשימוש מאוחר יותר. - הכן את פתרון ההפעלה להפעלת חרוזים על ידי שילוב נפחי של 20% תמיסת מלאי Sulfo-NHS (50 מ"ג/מ"ל), 20% תמיסת מלאי EDC (50 מ"ג/מ"ל) ומאגר הפעלה של 60%. תמיסת הפעלה של 50 μL נדרשת עבור כל תגובת הפעלת חרוזים (באמצעות 5 × 105 חרוזים/תגובה), בתוספת נפח נוסף מספיק כדי להכיל הפסדי צנרת.
- הוסף 50 μL של תמיסת הפעלה מלאה לכל באר המכילה חרוזים שטופים. עם נפח תרחיף החרוזים הקיים של 50 μL במאגר ההפעלה, לכל באר, הריכוז הסופי של Sulfo-NHS יהיה 5 מ"ג / מ"ל, והריכוז הסופי של EDC יהיה גם 5 מ"ג / מ"ל.
- אטמו את לוחית התגובה המיקרוספרית עם חותם חד פעמי מפלסטיק או נייר כסף ודגרו במשך 20 דקות על שייקר אורביטלי (650 סל"ד) בטמפרטורת החדר (18-22 מעלות צלזיוס) בחושך.
- שטפו את עודפי תמיסת ההפעלה מחרוזים.
- צנטריפוגה את צלחת microtiter ב 233 × גרם במשך 1 דקה.
- לשתק חרוזים מופעלים על מפריד לוח מגנטי במשך 30 שניות. הסר את אוטם הצלחת ושאפו את הסופרנאטנט מחרוזים משותקים מגנטיים כאשר צלחת המיקרוטיטר עדיין ממוקמת על המפריד המגנטי.
- הסר את צלחת המיקרוטיטר מהמפריד המגנטי והוסף 100 μL של מאגר MES לכל באר.
- חזור על שלבים 1.4.2-1.4.3 פעם אחת נוספת ובסך הכל שתי כביסות.
- זוג נויטרווידין ועז IgG (בקרה) לערכות חרוזים מתאימות. הכינו מספיק פתרונות עבודה מסוג Neutravidin ו-IgG של עיזים, תוך תכנון 100 μL/תגובה ומספיק תוספת כדי להכיל הפסדי צנרת באופן הבא:
הערה: אבקת חלבון Neutravidin מורכבת מחדש עם מים טהורים במיוחד ולאחר מכן מדולל לתמיסת מלאי 1 מ"ג / מ"ל עם PBS לפני aliquoting לאחסון/שימוש (חלבון neutravidin אינו מסיס ישירות PBS אבל הוא מסיס במים ~ 10 מ"ג / מ"ל).- הכן תמיסת עבודה של נויטרווידין בריכוז של 125 מיקרוגרם / מ"ל במאגר MES בצינור מיקרופוגה נמוך קושר חלבון של 1.5 מ"ל.
- הכינו תמיסת עבודה של נוגדנים לבקרת IgG בריכוז של 17.5 מיקרוגרם/מ"ל במאגר MES.
- הכינו את צלחת המיקרוטיטר המכילה חרוזים פעילים. לשתק חרוזים על מפריד צלחת מגנטית במשך 30 שניות. כאשר לוח המיקרוטיטר עדיין ממוקם על המפריד המגנטי, שאפו את הסופרנאטנט מחרוזים משותקים מגנטיים.
- הוסף 100 μL של תמיסת עבודה נויטרווידין (125 מיקרוגרם / מ"ל) לבארות המתאימות המכילות חרוזים (עבור צימוד נויטרווידין-ביוטין ונויטרווידין-ACE2).
- הוסף 100 μL של פתרון עבודה IgG עיזים (17.5 מיקרוגרם / מ"ל) לבאר המכילה חרוזים שהוקצו כפקדי IgG עיזים בלבד.
- הוסף 100 μL של מאגר MES לבאר שהוקצתה כפקד חרוזים לא מצומדים.
- אטמו את צלחת המיקרוטיטר ודגרו במשך שעתיים על שייקר אורביטלי (650 סל"ד) ב-RT (18-22°C) בחושך. סובבו את הצלחת לזמן קצר לאחר שעה של דגירה כדי להבטיח שהחרוזים יישארו בתרחיף.
- לשטוף חרוזים עם PBS-T.
- צנטריפוגה את צלחת microtiter ב 233 × גרם במשך 1 דקה.
- לשתק חרוזים מצומדים על מפריד לוח מגנטי במשך 30 שניות. כאשר לוח המיקרוטיטר עדיין ממוקם על המפריד המגנטי, שאפו את הסופרנאטנט מחרוזים משותקים מגנטיים.
- הסר את צלחת המיקרוטיטר מהמפריד המגנטי.
- הוסף 100 μL של PBS-T לכל באר המכילה חרוזים.
- חזור על שלבי הכביסה 1.6.2-1.6.4 פעם אחת ובסך הכל שתי שטיפות עם PBS-T.
- הכינו חרוזים מצומדים לאחסון.
- לשתק חרוזים מצומדים על מפריד לוח מגנטי במשך 30 שניות. כאשר לוח המיקרוטיטר עדיין ממוקם על המפריד המגנטי, שאפו את הסופרנאטנט מחרוזים משותקים מגנטיים. הסר את צלחת המיקרוטיטר מהמפריד המגנטי.
- הוסף 50 μL של מאגר אחסון לכל מזהה מיקרוספירה כדי להרוות את פעילות החרוזים הנותרת.
- דוגרים על צלחת המיקרוטיטר בטמפרטורות מקרר (4-8 מעלות צלזיוס) בחושך למשך הלילה (16-22 שעות).
- העבירו מתלי חרוזים מצומדים לא מצומדים ו-IgG עיזים (50 μL) לצינורות מיקרופוגה בעלי תווית מתאימה של 1.5 מ"ל עם קישור חלבון נמוך, בשילוב עם שתי שטיפות חיץ אחסון של 100 μL של הבארות כדי להבטיח התאוששות מקסימלית של החרוזים.
הערה: חרוזים לא מצומדים וחרוזי IgG מצומדים יעזים יספרו שניהם 5 × 105 בנפח סופי של 250 μL (כלומר, 2 × 103 חרוזים / μL). אחסנו את שפופרות המיקרופוגה בטמפרטורת מקרר (4-8°C) עד לשימוש.
- קשרו ACE2 ביוטיניל וביוטין לחרוזים מצומדים של נויטרווידין.
- הכן את תמיסת העבודה ACE2 האנושית הרקומביננטית ביוטינילציה ב-18 מיקרוגרם/מ"ל ACE2 ב-PBS של 10 מילימ"ר. לכל תגובה, 100 μL יהיה צורך. הכינו את תמיסת העבודה של הביוטין ב-2.4 מ"ג/מ"ל ביוטין ב-PBS של 10 מילימול. לכל תגובה, 100 μL יהיה צורך.
- הכינו את צלחת המיקרוטיטר המכילה מיקרוספרות מצומדות נויטרווידין.
- לשתק את המיקרוספרות על מפריד לוחות מגנטי במשך 30 שניות. כאשר לוחית המיקרוטיטר עדיין ממוקמת על המפריד המגנטי, הסירו את אוטם הצלחת ושאפו את הסופרנאטנט ממיקרוספרות משותקות מגנט.
- הסר את צלחת microtiter מן המפריד המגנטי ולהוסיף 50 μL של 10 mM PBS / באר.
- חזור על שלבים 1.8.2.1-1.8.2.2 פעם אחת.
- הוסף 100 μL של תמיסת העבודה biotinylated-ACE2 לבארות מתאימות המכילות מיקרוספרות מצומדות נויטרווידין. הוסף 100 μL של תמיסת העבודה ביוטין לבארות מתאימות המכילות מיקרוספרות מצומדות נויטרווידין.
- אטמו את צלחת המיקרוטיטר ודגרו במשך שעה אחת על שייקר אורביטלי (650 סל"ד) ב-RT (18-22 מעלות צלזיוס) בחושך.
- שטפו את המיקרוספרות כמתואר בשלבים 1.6.1-1.6.5.
- הכינו ואחסנו את המיקרוספרות המצומדות ACE2 וביוטין כמתואר בשלבים 1.7.1-1.7.4.
הערה: חרוזי ACE2 מצומדים לביוטין וביוטין יספרו שניהם 5 × 105 בנפח סופי של 250 μL (כלומר, 2 × 103 חרוזים/μL).
2. מבחן הצמידות
- הכינו תערובת חרוזים על ידי שילוב כל ארבעת סוגי המיקרוספרות שנוצרו בסעיף 1 (כלומר, ACE2 מצומד לביוטינילציה של נויטרווידין, ביוטין מצומד לנויטרווידין, IgG מצומד לעז ובלתי מצומד).
הערה: מיקרוספרות מלאי אוחסנו ב 2 × 103 חרוזים / μL ושולבו כך שריכוז החרוזים הסופי בתערובת החרוזים העובדת הוא 40 חרוזים מכל קבוצה / μL.- חשב את נפח תערובת החרוזים העובדת הדרושה לבדיקה (5 μL / תגובה), מה שמאפשר לנפח הנוסף להכיל הפסדי צנרת. מערבלים לזמן קצר כל צינור ומשלבים נפחים מחושבים שווים של כל תרחיף חרוזים בצינור מיקרופוגה חדש בעל קישור חלבון נמוך. ריכוז החרוזים הוא כעת 400 חרוזים מכל סט/μL.
- צור את תערובת חרוזי העבודה על ידי דילול מתלה החרוזים המשולב פי 10 נוסף עם מאגר אחסון (40 מכל סט / ריכוז עבודה μL).
הערה: הכינו תחילה כמות קטנה של תערובת חרוזים עובדת כדי להעריך את מספר המיקרוספרות/μL עבור כל מזהה.
- לדגור על המיקרוספרות עם נוגדן עז נגד ACE2.
- פיפטה 5 μL של תערובת חרוזים עובד לתוך 3 בארות של צלחת microtiter שטוח, חצי באר, 96 באר.
- הוסף 50 μL של עז anti-ACE2 (0.4 מיקרוגרם / מ"ל מדולל PBS-T, טבלה של חומרים) כל אחד ל 3 בארות המכילות חרוזים בלוח microtiter. אטמו את לוחית המיקרוטייטר, את המערבולת ודגרו על שייקר אורביטלי (650 סל"ד) ב-RT (18-22°C) למשך שעה אחת בחושך.
- דופקים את צלחת המיקרוטיטר במהירות של 233 × גרם למשך דקה אחת ושוטפים את המיקרוספרות שלוש פעמים עם PBS-T כמתואר ב-1.6.2-1.6.4.
- לדגור מיקרוספרות עם נוגדנים זיהוי.
- פיפטה 5 μL של תערובת חרוזים עובד לתוך 6 בארות חדשות של צלחת microtiter.
- הכינו 1 מיקרוגרם/מ"ל כל אחת מתערובות זיהוי העבודה: IgG PE נגד עיזים, IgG PE נגד עכברים ו-IgG PE נגד ארנבים ב-3 צינורות נפרדים של 1.5 מ"ל, תוך שימוש ב-PBS-T כמדלל.
- הוסף 50 μL של תערובות גילוי ל 3 בארות כל אחד, ואת IgG נגד עיזים מתווסף לאותן בארות כמו anti-ACE2 משלב 2.2.
- אוטמים, מערבלים ודגרים על שייקר מסלולי (650 סל"ד) ב-RT (18-22°C) למשך 30 דקות.
- יש לפעום את הצלחת בטמפרטורה של 233 × גרם למשך דקה אחת ולשטוף את המיקרוספרות שלוש פעמים עם PBS-T כמתואר ב-1.6.2-1.6.4.
- הוסף 100 μL של PBS-T והפעל במכשיר ניתוח זרימת הדיווח הכפול עם ההגדרות הבאות:
מצב: כתב כפול; פסק זמן: 45 שניות; DD-gating: 7500-17500; ספירת מיקרוספרות מינימלית: 100 מיקרוספרות / סט (חתך QC הנמוך ביותר: 35 מיקרוספרות / סט).
3. ייצור של סופרנאטנט תאים נגועים ב- SARS-CoV-2
נגיף SARS-CoV-2 מופץ בתאי Vero E6 מארחים (קו תאי אפיתל כליות של קופים; ATCC; טבלת חומרים). תאי Vero E6 מגודלים בתרבית בינונית של נשרים מהונדסים (MEM) בטמפרטורה של 37°C באטמוספירה של 5% CO2 ו-95% לחות יחסית. כל ליטר של MEM הוא בתוספת 10 מ"ל של L-גלוטמין (200 mM), 38 מ"ל של NaHCO3 (7.5%), 5 מ"ל של תמיסת פניצילין/סטרפטומיצין, ו 50 מ"ל של סרום בקר עוברי (FCS); טבלת חומרים.
זהירות: השתמש בנוהלי בטיחות ביולוגית ובציוד מתאימים בעת טיפול ב- SARS-CoV-2.
- תאי Vero E6 גדלים למפגש בשתי צלוחיות תרביתרקמה בגודל 150 ס"מ. הדביקו בקבוק אחד בנגיף SARS-CoV-2 והשתמשו בבקבוק השני הנגוע בדמה כבקרה.
- ערבבו כ-100,000 חלקיקים זיהומיים מסוג בר (WT) SARS-CoV-2 עם 5 מ"ל של מדיום MEM של נשרים.
- שאפו את המדיה מבקבוקאחד של 150 ס"מ 2 והוסיפו 55 מ"ל של MEM שלם כדי ליצור סופרנאטנטים של בקרה לא נגועים. שואפים את המדיה מהבקבוק השני בגודל 150 ס"מ2 ומוסיפים את תערובת הנגיף לתאים. לדגור את התאים במשך 1 שעה ב 37 ° C. נערו קלות את הבקבוק כל 15 דקות כדי להפיץ את הנגיף.
- הוסף 50 מ"ל של מדיום MEM מלא לבקבוק עם הוספת SARS-CoV-2 ודגור על התאים עד להשפעות ציטופתיות, הערכה חזותית של צלוחיות כל 24 שעות.
הערה: זה אמור לקחת בערך 3-4 ימים לאחר ההדבקה עבור ציטופתיה להתרחש. השפעות ציטופתיות על המבנה החד-שכבתי של תאי Vero E6 (למשל, נסיגת תאים, קריצה, עיגול, דה-הידבקות, אובדן גרעיניות תוך ציטופלזמית, ליזה גלויה) מוערכות איכותית על ידי התבוננות בתאים באמצעות מיקרוסקופ אור הפוך, בהתאם להנחיות ארגון התקינה הבינלאומי לבדיקת ציטוטוקסיות חוץ גופית 16. - אספו את הסופרנאטנט של התא משתי הצלוחיות וסובבו במשך 6 דקות במהירות של 253 × גרם למשקעים של פסולת התא.
- UV-להשבית את נגיף SARS-CoV-2 ב supernatant התא
- פיפטה 0.5 מ"ל של supernatant לכל באר ל 12 בארות בצלחת microtiter 24 באר. UV להקרין את צלחת microtiter, ללא מכסה, במשך 30 s תחת מנורה אולטרה סגול מתאים (טבלה של חומרים).
הערה: יש לוודא את השבתת הנגיפים בסופרנאטנט התא על ידי ניסיון התפשטות וירוסים בתרביות תאים מסוג Vero E6.
- פיפטה 0.5 מ"ל של supernatant לכל באר ל 12 בארות בצלחת microtiter 24 באר. UV להקרין את צלחת microtiter, ללא מכסה, במשך 30 s תחת מנורה אולטרה סגול מתאים (טבלה של חומרים).
- Aliquot התא supernatant לתוך צינורות 1.5 מ"ל ולאחסן ב -20 ° C עד לשימוש חדש.
הערה: ניתן לאחסן את הסופרנאטנט של התא בטמפרטורה של -80°C.
4. מבחן: זיהוי חלקיקים נגיפיים של SARS-CoV-2 בסופרנאטנט התא
- הכינו מאגר בדיקות על ידי ערבוב 0.1% קזאין, 0.5% אלכוהול פוליוויניל, 0.8% פוליוויניל פירולידון, ו 1% BSA (כל w / v) (pH 7). הכן את מאגר דילול הדגימה על ידי הכנת 10% ארנב IgG במאגר Assay.
- חשב והכן את נפח תערובת החרוזים העובדת (שלב 2.1) הדרוש לבדיקה (5 מיקרוליטר / תגובה), מה שמאפשר נפח עודף להכיל הפסדי צנרת.
- הכינו סדרת דילול סופרנטנטים. חשב את נפחי העל-נאטנט הדרושים. בדוק כל נקודת דילול בבארות משולשות עבור כל אחד מחמשת scFvs, וכתוצאה מכך 15 בארות לכל נקודת דילול וסוג מדגם. השתמש 45 μL של supernatants מדולל בכל באר, עבור סך של 675 μL נדרש; צינור מיקרופוגה יחיד של 1.5 מ"ל עבור כל אחד מ- SARS-CoV-2 וסופרנאטנטים בקרה מספיקים.
- הפשירו סופרנאטנטים של SARS-CoV-2 ובקרו סופרנאטנטים בטמפרטורה של 4°C למשך שעה אחת לפחות. שמרו על קור הסופרנאטנטים והדילולים שלהם (2-8°C) עד לשימוש. תייג וסדר שמונה צינורות מיקרופוגה של 1.5 מ"ל כל אחד עבור SARS-CoV-2 ובקר סופרנאטנטים.
הערה: הריכוז הגבוה ביותר שייבחן יהיה דילול סופרנאטנטי ביחס של 1:1 (פי 2), שממנו תתבצע סדרה של דילולים ביחס של 1:2 (פי 3) באמצעות מאגר דילול דגימה, כאשר הדילול הגבוה ביותר יהיה דילול בקנ"מ 1:1458. פריטים ריקים המכילים מאגר דילול לדוגמה משמשים רק כפקדים ללא סופרנטנטים. לפיכך, דילולים שנבדקו מכל סוג סופרנאטנט (SARS-CoV-2 או בקרה) יהיו פי 2, 6, 18, 54, 162, 486 ו-1458, עם בקרת חיץ בלבד. - הוסף מאגר דילול לדוגמה לצינורות המיקרופוגה המסומנים. צינורות הדילול 1:1 (פי 2) דורשים 600 μL של חיץ, והצינורות הנותרים דורשים 800 μL של חיץ. צור את הדילול הגבוה ביותר (1:1; פי 2) של כל סופרנאטנט על ידי שילוב של 600 μL של הסופרנאטנט עם 600 μL של מאגר דילול דגימה בצינורות המסומנים כראוי, ולאחר מכן מערבל לזמן קצר את הצינור כדי לערבב.
- המשיכו את הסדרה על ידי העברה רציפה של 400 μL של סופרנאטנטים מדוללים ביחס של 1:1 (פי 2) לצינור הדילול הבא (כלומר, דילול פי 6), והמשיכו בדילול פי 3 עד ליצירת הדילול הנמוך ביותר (פי 1458). מערבולות קצרות כל סופרנאטנט מדולל לפני שממשיכים עם הדילול הבא.
- הפשירו סופרנאטנטים של SARS-CoV-2 ובקרו סופרנאטנטים בטמפרטורה של 4°C למשך שעה אחת לפחות. שמרו על קור הסופרנאטנטים והדילולים שלהם (2-8°C) עד לשימוש. תייג וסדר שמונה צינורות מיקרופוגה של 1.5 מ"ל כל אחד עבור SARS-CoV-2 ובקר סופרנאטנטים.
- לדגור את המיקרוספרות עם supernatant.
- מערבול את תערובת החרוזים המוכנה מראש במשך 30 שניות כדי להשהות מחדש את המיקרוספרות ולהוסיף 5 μL של תערובת החרוזים לכל באר שהוקצתה של צלחת מיקרוטיטר בעלת תחתית שטוחה של 384 בארות.
הערה: ניתן להשתמש גם בצלחות 96 באר. - הוסף 45 μL של דילול supernatant מוכן לבארות שהוקצו המכילות microspheres בלוח 384 בארות. אטמו את הצלחת ודגרו למשך הלילה (16-22 שעות) על שייקר אורביטלי (650 סל"ד) ב-RT (18-22°C) בחושך.
- מערבול את תערובת החרוזים המוכנה מראש במשך 30 שניות כדי להשהות מחדש את המיקרוספרות ולהוסיף 5 μL של תערובת החרוזים לכל באר שהוקצתה של צלחת מיקרוטיטר בעלת תחתית שטוחה של 384 בארות.
- שוטפים עודפי סופרנאטנט מחרוזים.
- הסר את צלחת המיקרוטיטר משייקר המסלול והסר את אוטם הצלחת. צנטריפוגה את הצלחת ב 931 x גרם במשך 1 דקה.
- לשתק את החרוזים על ידי הנחת צלחת microtiter על מפריד צלחת מגנטית במשך 30 שניות. כאשר לוחית המיקרוטיטר עדיין ממוקמת על המפריד המגנטי, הסירו את חותם הצלחת ושאפו את הסופרנאטנט מחרוזים משותקים מגנטיים.
- הסר את צלחת המיקרוטיטר מהמפריד המגנטי.
- הוסף 60 μL של PBS-T לכל באר המכילה חרוזים.
- חזור על שלבי הכביסה 4.5.2-4.5.4 פעמיים ובסך הכל שלוש שטיפות PBS-T.
- הכינו את תערובות הזיהוי השונות בצינורות נפרדים של 1.5 מ"ל. כל תערובת זיהוי מורכבת מנוגדן מסחרי אנושי חד-שבטי נגד S1 (Hu-anti-S1) (1 מיקרוגרם/מ"ל) ואחד מחמישה scFvs שונים עם תיוג FLAG (1 מיקרוגרם/מ"ל) (קובץ משלים 1, טבלה משלימה 1 וטבלה משלימה 2) המכוונים לחלבון הספייק על חלקיק SARS-CoV-2, מדולל במאגר Assay (שלב 4.1), וכתוצאה מכך נוצרות בסך הכל חמש תערובות גילוי שונות.
- חזור על שלבים 4.5.2-4.5.3. השהה מחדש את המיקרוספרות שנשטפו ב- 50 μL / באר של תערובת זיהוי ספייק ספציפית ל- scFv המתאימה. אטמו את צלחת המיקרוטיטר ודגרו במשך שעה אחת על שייקר אורביטלי (650 סל"ד) ב-RT (18-22 מעלות צלזיוס) בחושך.
- צנטריפוגה את צלחת microtiter ב 931 × גרם במשך 1 דקה. שטפו מגיב זיהוי ספייק עודף מחרוזים. בצע שלושה שלבי כביסה עם 60 μL של PBS-T לפי שלבים 4.5.2-4.5.5.
- לדגור microspheres עם תערובת נוגדנים זיהוי פלואורסצנטי.
- הכינו תערובת תמיסה פלואורסצנטית המורכבת מ-IgG אנטי-אנושי מצומד PE הזמין מסחרית יחד עם נוגדן אנטי-FLAG מצומד BV421 המדולל במאגר Assay, עם ריכוזי עבודה של 0.2 מיקרוגרם/מ"ל ו-1 מיקרוגרם/מ"ל, בהתאמה. לכל תגובה, 50 μL של מגיב זיהוי פלואורסצנטי נדרש.
- חזור על שלבים 4.5.2-4.5.3. להשהות מחדש את המיקרוספרות ב 50 μL / באר של תערובת תמיסה פלואורסצנטית. אטמו את צלחת המיקרוטיטר ודגרו במשך 30 דקות על שייקר אורביטלי (650 סל"ד) ב-RT (18-22°C) בחושך.
- סובבו את צלחת המיקרוטיטר כלפי מטה ב-931 × גרם למשך דקה אחת. שטפו את תערובת התמיסה הפלואורסצנטית העודפת מהמיקרוספרות. בצע שלושה שלבי כביסה עם 60 μL של PBS-T לפי שלבים 4.5.2-4.5.5.
- להשעות את המיקרוספרות ב 60 μL של PBS-T משלב השטיפה האחרון. נתח את הלוח במערכת ניתוח זרימה בעלת דיווח כפול עם ההגדרות המתוארות בשלב 2.6.
תוצאות
מבחן הצמידות
בדיקת הצמידות הראתה כי ACE2 מסוג IgG ו-ACE2 מסוג נויטרווידין-ביוטינילציה צומדו בהצלחה למיקרוספרות. הספציפיות לזיהוי הבדיקה אושרה על-ידי בדיקת מיקרוספרות מצומדות ACE2 עם נוגדנים משניים המסומנים בתווית PE שנוצרו במינים שונים של בעלי חיים (איור 2). לא נצפתה תגובתיות צולבת בין נוגדני הזיהוי השונים. כאשר תערובות החרוזים נבדקו עם IgG PE נגד עיזים + אנטי-עזים, זוהה ערך עוצמת פלואורסצנטיות חציונית (MFI; יחידות שרירותיות) מעל הרקע הן עבור מיקרוספרות מצומדות מסוג ACE2 והן עבור מיקרוספרות מצומדות IgG של עיזים, אך לא עבור המיקרוספירה הבלתי מצומדת (חשופה) או עבור המיקרוספרות מצופות הביוטין. IgG PE נגד עכבר ונגד ארנב IgG PE שימשו כבקרות שליליות לבדיקת אותות חיוביים שגויים. אות פלואורסצנטי זניח נוצר עם הדגירה עם המיקרוספרות, מה שמצביע על כך שהאותות החיוביים עבור ACE2 והעז IgG היו ספציפיים.
יכולת זיהוי חלקיקים נגיפיים בסופרנאטנטים של תאים
חרוזים מגנטיים שהוצמדו ל-ACE2 אנושי רקומביננטי שימשו ללכידת חלקיקים נגיפיים של SARS-CoV-2 מסופרנאטנטים נגועים ונשלטים (ללא וירוס) של תרביות תאים VeroE6, ולאחר מכן נבדקו בו זמנית עבור שני אזורי ספייק נגיפיים נפרדים באמצעות נוגדן חד-שבטי ואחד מחמישה scFv שונים. אות תלוי ריכוז בדילולים של סופרנאטנטים של תאים נגועים ב-SARS-Cov-2 נצפה בשני ערוצי הכתבים (RP1 ו-RP2) (איור 3), מה שמצביע על כך שגם נוגדן Hu-anti-S1 המסחרי וגם scFvs השונים זיהו את החלקיק הנגיפי הקשור למיקרוספירה מצומדת ACE2. עם שלושה מתוך חמישה scFvs, הנגיף ניתן לזיהוי בדילול עד 1:18 (scFv2, scFv3, scFv5); עבור שני scFvs הנותרים (scFv7 ו- scFv9), ניתן לזהות אותו עד דילול של 1:6. ניתן לייחס זאת לזיקה שונה למטרה. כפי שניתן לראות באיור 3 ובטבלה 1, scFv3 מספק את עוצמת ה-MFI הגבוהה ביותר, ואחריו scFv5, scFv2, scFv7 ו-scFv9, בהתאמה.
ברחבי העולם, זיהוי scFvs מביא ל-MFI נמוך יותר בהשוואה ל-Hu-anti-S1. זה יכול להצביע על זיקה נמוכה יותר, אבל זה יכול להיות גם חפץ בגלל התיוג עם צבעים פלואורסצנטיים שונים (PE ו BV421). מגמה נוספת שניתן לראות עבור scFv7 ו- scFv9 היא שערכי MFI מעט נמוכים יותר עבור ערוץ RP1 (אנטי ספייק) כמו גם בהשוואה לשלוש התצורות האחרות. זה יכול להצביע על כך שה-scFvs מגיבים צולבים או מפריעים בדרך אחרת לאינטראקציה ACE2-Hu-anti-S1, מה שיכול להסביר גם את האות הנמוך יותר בערוץ RP2. לא זוהו חלקיקים נגיפיים בסופרנאטנט של תאי Vero E6 שאינם נגועים בערוץ RP1 או RP2.
המיקרוספירה המצומדת נויטרווידין-ביוטין, מיקרספירת העז-IgG והמיקרוספרות הבלתי מצומדות משמשות כחרוזי בקרה שליליים. החלקיקים הנגיפיים נלכדו באמצעות מיקרוספרות מגנטיות שהוצמדו ל-ACE2 ונבדקו עם אנטי-ספייק אנושי מסחרי בערוץ הכתבים RP1 ועם scFvs שונים בערוץ הכתב RP2 (scFv מצוין בפינה השמאלית העליונה של כל לוח). לא התגלו חלקיקי נגיף באף אחת מהדגימות הנגועות והלא נגועות.
דיוק ועמידות של Assay
כדי להעריך את דיוק הבדיקה, כל התנאים הופעלו בשלשה. מקדם שונות (CV) עבור מיקרספירת ACE2 חושב עבור כל נקודת דילול. כל קורות החיים המחושבים עבור הבדיקה היו מתחת ל-15%, כאשר קורות החיים הנמדדים הגבוהים ביותר היו 13%, וקורות החיים הנמוכים ביותר היו 1% (לוח 2). כפי שניתן לראות בתרשים הצפיפות (איור 4) של ערוץ RP1, זיהוי PE של Hu-anti-S1 המסחרי מראה דיוק גבוה יותר, בעיקר סביב קורות חיים של 3%. ערוץ RP2, זיהוי BV של scFVs, מציג קורות חיים גבוהים יותר. עם זאת, כפי שניתן לראות בטבלה 2, הטווח הגבוה יותר של קורות חיים מונע על ידי דגימות עם ריכוזים נמוכים של חלקיקים נגיפיים, כגון החסר. כדי לבדוק את איתנות הפרוטוקול, הבדיקה חזרה פעמיים על ידי מפעילים שונים, תוך שימוש בתערובות חרוזים שנוצרו בימים שונים ובנפח מדגם נמוך יותר (נמוך ב-72%). מתאם פירסון טוב מאוד, שנע בין 0.98 ל-1, נצפה הן עבור ערוצי RP1 והן עבור ערוץ RP2 (ערך p < 0.01), מה שמאשר את עמידות הבדיקה ואת האפשרות ליישם את הבדיקה כאשר פחות מדגם זמין (איור 5). טכנולוגיית ניתוח זרימה זו עוקבת אחר "תיאוריית ניתוח הסביבה"17, מה שהופך את הבדיקה לרגישה לריכוז אך לא לנפח.
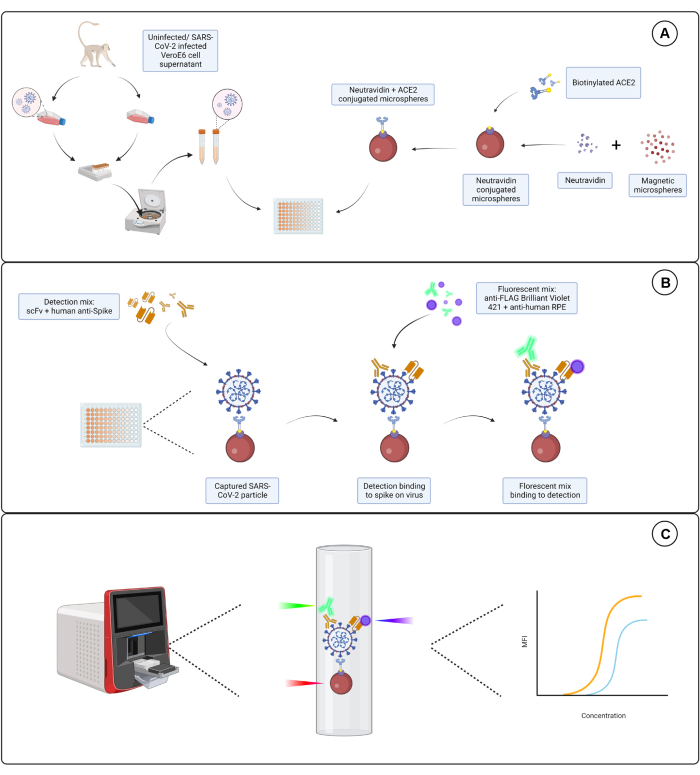
איור 1: בדיקת חלקיקי הנגיף. (A) סופרנאטנט תאים מתאי Vero E6 נגועים ולא נגועים מתווספים בדילול סדרתי ללוח של 96 בארות או 384 בארות, יחד עם מיקרוספרות מגנטיות מצומדות לנויטרווידין, ואז מצומדים ל-ACE2 אנושי שעבר ביוטינילציה או ביוטין. מיקרוספרות לא מצומדות יחד עם IgG עז ומיקרוספרות חשופות משמשות כבקרות שליליות יחד עם המיקרספירה המצומדת נויטרווידין-ביוטין. (B) קומפלקסים של חלקיקי וירוסים מיקרוספריים שנוצרו מזוהים באמצעות קוקטייל זיהוי המורכב מ-Hu-anti-S1 ואחד מה-scFvs השונים עם תג FLAG. לאחר מכן מתווספת תערובת פלואורסצנטית עם IgG PE אנטי-אנושי המכוונת ל-Hu-anti-S1 ול-anti-FLAG Brilliant Violet 421 המכוונת ל-scFvs. (C) מערכת הגילוי הכפול בעלת שלושת הלייזרים פולטת לייזר אדום, ירוק וסגול כדי לזהות את קומפלקס המיקרו-חלקיקים. הלייזר האדום מזהה את תווית הצבע המיקרספרית, בעוד שהלייזר הירוק והסגול מזהים את האנטי-S1 וה-scFvs, בהתאמה. הנתונים שנוצרו מנותחים לאחר מכן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
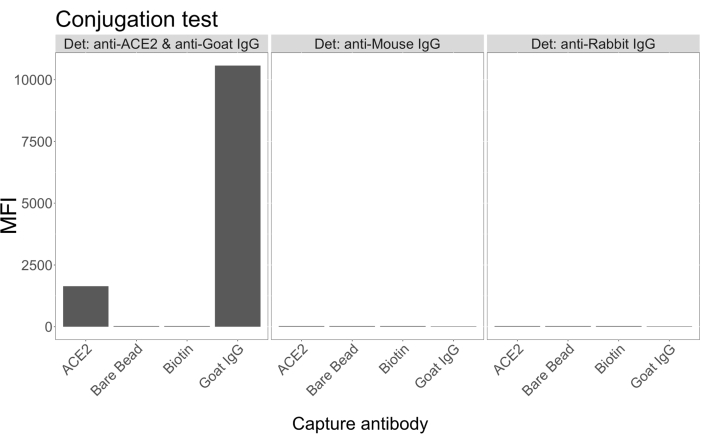
איור 2: תרשים אישור הצמדה. תערובות החרוזים הורכבו מארבעה מזהי מיקרוספירה שונים, שכל אחד מהם מצומד עם חלבון אחר: נויטרווידין-ביוטין-ACE2 (ACE2), מיקרוספירה לא מצומדת (חרוז חשוף), נויטרווידין-ביוטין (ביוטין) ו-IgG עיזים (IgG עיזים). במבחן הצמידות נעשה שימוש בשלוש תצורות שונות של פלואורופורים לגילוי. כלומר, עז נגד ACE2 + נגד עז IgG PE, נגד עכבר IgG PE, ונגד ארנב IgG PE. ציר Y מציג את האות הממוצע שנמדד MFI (עוצמת פלואורסצנטיות חציונית; יחידות שרירותיות) מכל מיקרוספירה עם שלושת התנאים השונים. ציר X מציג את נוגדני הלכידה השונים שהופעלו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
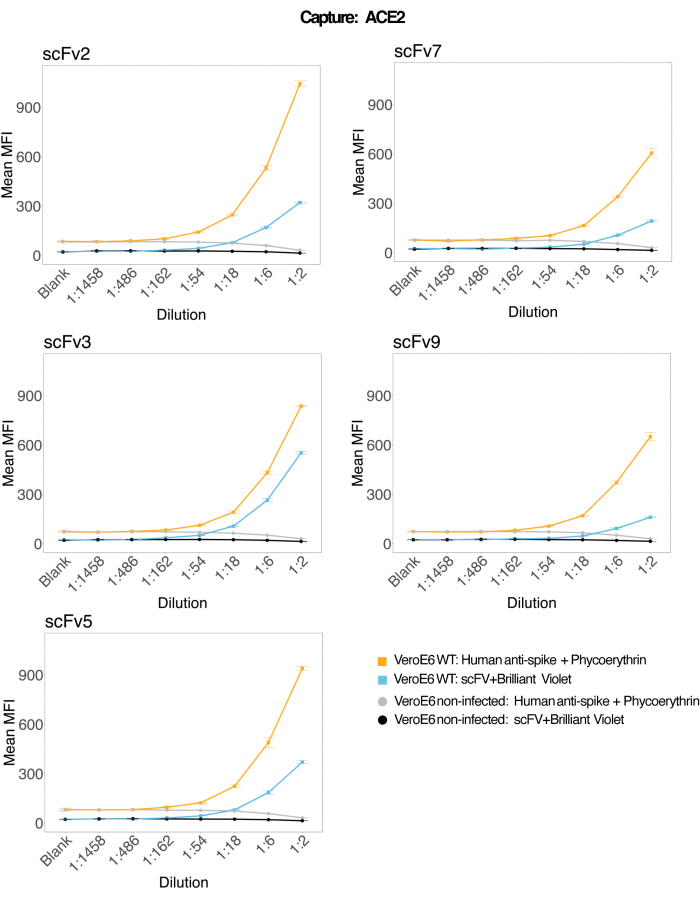
איור 3: זיהוי מרובב של חלבונים על פני השטח. ציר Y: ממוצע MFI (עוצמת פלואורסצנטיות חציונית; יחידות שרירותיות ± סטיית תקן) עבור כל דגימה, מנותח בבארות משולשות לכל מצב. ציר X: נקודות דילול סדרתי של סופרנטנט התא. כתום: חלקיקי וירוס בסופרנאטנט מ Vero E6 נגועים ב- SARS-CoV-2 WT שזוהו עם PE אנטי ספייק אנושי + PE אנטי אנושי (פיקואריתרין). כחול: Supernatant מ Vero E6 נגוע SARS-CoV-2 WT זוהה עם scFvs שונים + anti-FLAG מבריק סגול 421. אפור: סופרנאטנט תאים לא נגוע שזוהה עם PE אנטי-ספייק אנושי + אנטי-אנושי. שחור: סופרנאטנט תאים לא נגוע זוהה עם חמשת scFvs + anti-FLAG Brilliant Violet 421. החלקיקים הנגיפיים נלכדו באמצעות מיקרוספרות מגנטיות שהוצמדו ל-ACE2 ונבדקו עם נוגדנים מסחריים אנושיים נגד ספייק בערוץ הכתבים RP1 ועם scFvs שונים בערוץ הכתב RP2 (scFv מצוין בפינה השמאלית העליונה של כל פאנל). לא התגלו חלקיקי נגיף באף אחת מהדגימות הלא נגועות. האפיטופ שהותקף על ידי scFv3 היה בעל הזיקה הגבוהה ביותר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
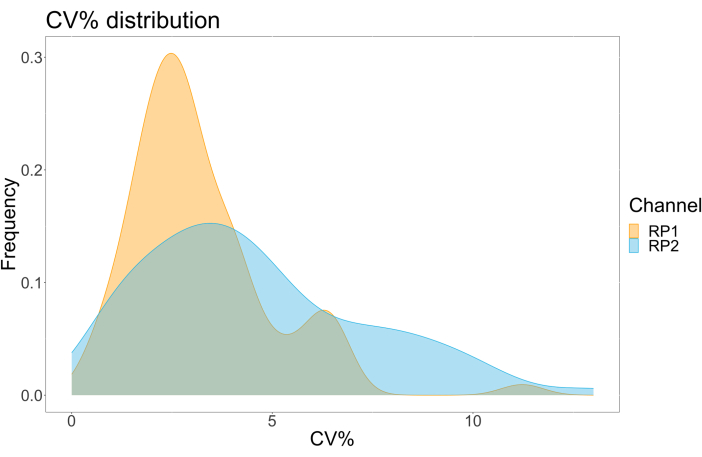
איור 4: תרשים פיזור וריאציות. ציר Y הוא תדירות האירועים, וציר X מציג את מקדם השונות (CV) באחוזים עבור כל העתק של הדגימות השונות. RP1 ו-RP2 הם ערוצי הכתב הראשון והשני המזהים פלואורסצנטיות הקשורה לפיקוריתרין ול-Brilliant Violet 421, בהתאמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
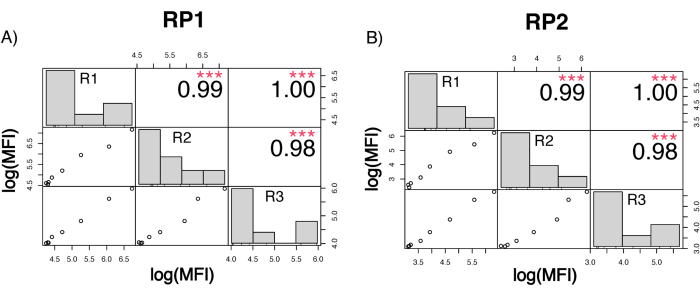
איור 5: מטריצת מתאם הפעלה. (A,B) ציר Y: מטריצת מתאם פירסון בסקאלת log10 בין שלוש ריצות נפרדות, המנוהלות על ידי שלושה אופרטורים שונים ועם תערובות חרוזים שונות. נפח מדגם נמוך יותר הוחל בסיבוב השלישי. ההיסטוגרמות מציגות את ההתפלגות של אשכולות המשתנים השונים בהתבסס על MFI שנמדד. (A) מתאם לערוץ כתב RP1 בין הריצות השונות. (ב) קורלציה לערוץ כתב RP2 בין הריצות השונות. MFI=עוצמת פלואורסצנטיות חציונית ביחידות שרירותיות. עמ' < 0.001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| זיהוי | תגובתיות |
| scFv2 | ++ |
| scFv3 | +++ |
| scFv5 | ++ |
| scFv7 | + |
| scFv9 | + |
| IgG אנטי-ספייק אנושי | ++++ |
טבלה 1: דירוג scFvs בזיהוי בהתבסס על עוצמת MFI המתקבלת בעקומות הסטנדרטיות.
| RP1 (PE) | RP2 (BV421) | |
| דילול לדוגמה | טווח קורות חיים [%] | טווח קורות חיים [%] |
| ריק | 3–11 | 2–13 |
| 1:1458 | 1–7 | 2–7 |
| 1:456 | 4–6 | 3–8 |
| 1:162 | 3–6 | 3–7 |
| 1:54 | 2–4 | 2–4 |
| 1:18 | 2–4 | 1–4 |
| 1:6 | 2–6 | 1–6 |
| 1:2 | 1–5 | 1–3 |
טבלה 2: טווח CV% (ממוצע/סטיית תקן × 100) של כל נקודת דילול של הסופרנאטנט הנגוע ב- SARS-CoV-2 הן עבור ערוצי RP1 והן עבור ערוצי הכתב RP2.
קובץ משלים 1: יצירת מקטע משתנה חד-שרשרת אימונוגלובולין (scFv). אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 1: סינון scFvs בזוגות עם Fabs כנגד דילול סדרתי של ספייק רקומביננטי (RBD). כדי להעריך את הביצועים של פפטידים שונים לזיהוי, 12 שילובים של חלבון ספייק, Fab, שימשו ללכידה במאגר עם RBD רקומביננטי. עשרה (10) scFvs המכוונים לאפיטופים שונים של חלבון הספייק יושמו כזיהוי. בהתאם לביצועים של זוג זיהוי הלכידה, הם סומנו כנכשלים (-) או כמוצלחים (+). אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 2: בדיקת scFvs בזוגות עם Fabs נגד דילול סדרתי של תא Calu-3 נגוע ב- SARS-Cov-2. לצורך הערכת ביצועי פפטידים שונים, 12 שילובים של חלבון ספייק, Fab, שימשו ללכידה בסופרנטנט תאי Calu-3 נגוע ב- SARS-Cov-2. עשרה (10) scFvs המכוונים לאפיטופים שונים של חלבון הספייק יושמו כזיהוי. בהתאם לביצועים של זוג זיהוי הלכידה, הם סומנו כנכשלים (-) או כמוצלחים (+). אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
טכנולוגיית מולטיפלקס מבוססת חרוזים הוכחה כפלטפורמה רבת ערך לזיהוי פתוגן בתפוקה גבוהה במספר יישומים קליניים. הגמישות הגבוהה של הפלטפורמה, המבוססת על עקרונות ציטומטריית זרימה, מאפשרת מיקוד נוגדנים, חלבונים וחומצות גרעין 18,19,20,21,22, תוך ריבוב מאות אנליטים בו זמנית. עם זאת, למיטב ידיעתנו, טכנולוגיה זו לא יושמה בעבר כדי לזהות חלקיקים נגיפיים שלמים. בדו"ח זה, הטכנולוגיה יושמה לזיהוי חלקיקים נגיפיים שלמים על ידי התמקדות בשלושה אפיטופים בלתי תלויים על פני השטח של SARS-CoV-2.
נגיפי RNA עטופים מראים דמיון מבני גבוה לשלפוחיות חוץ-תאיות (EVs), קרומי פוספוליפידים קטנים הנושאים RNA נגיפי וחלבונים יחד עם חלבונים מארחים23. בדיקות חיסוניות של סנדוויץ' יושמו בעבר לזיהוי כלי רכב חשמליים, באמצעות זוג נוגדנים המכוונים לשני חלבוני שטח נפרדים24,25. המגבלה של מבחני סנדוויץ' לזהות בו זמנית רק שני חלבונים מוסרת עם גישות מולטיפלקס המאפשרות זיהוי בו זמנית של יותר משני חלבונים לכל תגובה.
מערכת זיהוי שלושת הלייזרים בעלת הדיווח הכפול המתוארת כאן היא מכשיר ניתוח הזרימה מבוסס החרוזים המתקדם ביותר עד כה. בכל הנוגע למערכות קריאה של כתב יחיד, הדיווח הכפול (ערוצי RP1 ו-RP2) מאפשר גילוי של שלושה חלבונים/אפיטופים של פני השטח במקביל. התמקדות במספר חלבונים ואפיטופים של פני השטח הנגיפיים מספקת ייצוג מדויק יותר של עומס החלבונים הנגיפי, אשר מעבר לאישור כי הנגיף אכן שלם, פותח גם את ההזדמנות להמשיך לחקור אנטיגנים של פני השטח הנגיפיים ואת מנגנוני האינטראקציות בין חלבון נגיפי למארח.
במהלך מגיפת COVID-19, החשיבות של זיהוי מיידי של אנשים הנושאים חלקיקים נגיפיים פעילים הייתה חשובה במאמצים להכיל את התפשטות הנגיף. RNA גנומי מזוהה על ידי RT-PCR כמותי ללא קשר למקורו (חלקיקי וירוס שלמים או חופשיים). עם זאת, רק מעטפה שלמה עם חלבון S נגיש יכולה לתווך את כניסת התא ואת שכפול הנגיף לאחר מכן. מחקרים קודמים עם שבבים מיקרופלואידים בדגימות חולים הראו כיצד זיהוי חלקיקים נגיפיים שלמים בשילוב עם בדיקות נקודת טיפול יאפשר בדיקות תכופות ומעקב משופר אחר התפשטות המחלה, כולל בחירה מושכלת יותר של אנשים להיכנס לבידוד26. היישום של בדיקה מבוססת מיקרוספירה מרובת משתתפים יאפשר תכנון של בדיקות שמטרתן סינון של וירוסים מרובים וגרסאות האנטיגן שלהם על פני השטח, קבלת תמונה מדויקת יותר של התפשטות הנגיף באוכלוסייה.
וירומאטריית זרימה היא פיתוח עדכני של ציטומטריית זרימה שמטרתו ניתוח של חלקיקים נגיפיים. למרות היכולת לזהות חלקיקים נגיפיים בדידים, ניתוח של וירוסים קטנים מהווה בעיה נוכחית עבור וירומטריית זרימה27,28. בדומה לשיטה המתוארת כאן, וירומטריית זרימה כוללת לכידת נגיפים שלמים על ידי ננו-חלקיקי זהב המצומדים לנוגדנים. המגבלות עבור שתי השיטות כוללות (i) את התלות בריאגנטים בעלי זיקה גבוהה ללכידה וגילוי עבור אנטיגן המתבטא בפני השטח הממוקד על ידי המיקרוספרות או הננו-חלקיקים, (ii) יכולת מוגבלת להבחין בין חלקיקי וירוסים לבין בועיות חוץ-תאיות, ו-(iii) היעדר סטנדרטים לכימות חלקיקים נאות.
תאים מפרישים כלי רכב חשמליים לסביבתם, וכאשר הם נדבקים בנגיף, הם עשויים גם להפריש נגיפים בגודל דומה לזה של כלי הרכב החשמליים ועשויים בסופו של דבר לבטא את אותם אנטיגנים29. מכיוון שלרכבים החשמליים יהיו הרכבי קרום דומים לנגיף, יהיה קשה להבדיל ביניהם באמצעות שיטות מבוססות זיקה בלבד, כגון גישת הלייזר הכפול לכתב יחיד. עם זאת, האסטרטגיות המתוארות כאן כוללות קיבולת מולטיפלקס גבוהה יותר, המאפשרת חקירה רחבה ועמוקה יותר של הרכב החלבונים של חלקיקים. שיטות מבוססות זרימה מאפשרות מעקב אחר חלקיקים בדידים, ומספקות הזדמנויות לכימות דיגיטלי. אסטרטגיה אחת לטיפול בבעיית הכימות בשיטה שלנו תהיה להשתמש בשלפוחיות סינתטיות מאופיינות היטב המבטאות אנטיגנים בעלי עניין כחלקיקים דמויי וירוס (VLPs) להכנת עקומות סטנדרטיות.
נתיב נפוץ של כניסה ויציאה של SARS-CoV-2 מהתאים המארחים הוא באמצעות האינטראקציה של הנגיף וקרום התא המארח 2,15. בתהליך זה, ההסתברות לשילוב חלבוני קרום המאכסן במשטח הנגיף גבוהה. על ידי סינון חלבונים מארחים משולבים, ניתן לעקוב אחר מסלול הזיהום ולחזות את מהלך המחלה עבור חולים בסיכון שונה, מה שמאפשר החלטות טיפול מוקדמות יותר. זה גם מאפשר אפיון של הנגיפים על פני אצוות דגימה שונות במעבדות מחקר. ניתן לחקור זאת עוד יותר על ידי בדיקה אם מאפיינים שונים קשורים לרמות שונות של הדבקה נגיפית ולסינון של נוגדנים ומולקולות תרופה המכוונות לחלבוני פני השטח של הנגיף.
היבט חשוב הנוגע לשיטה המתוארת הוא שהיא מסתמכת על הזיקה של ריאגנטים ללכידה וגילוי כנגד חלבוני המטרה שלהם על הנגיף. הבחירה בריאגנטים של זיקה היא, אם כן, גורם מכריע בביצועי המבחן. ייתכן, ריאגנטים של אהדה מרובה צריכים להיבדק ולהיבדק ללכידה וזיהוי כדי לבחור את אלה עם האהדה הגבוהה ביותר. כאן, הביצועים של עשרה scFvs ושנים עשר מקטעי Fab הוערכו באופן ראשוני באמצעות RBD רקומביננטי ועל חלקיקים נגיפיים מהסופרנאטנט של תאי אפיתל ריאה Calu-3 נגועים ב- SARS-Cov-2 (תאי VeroE6 שימשו לתרבית / הערכת ציטוטוקסיות בכל המחקרים הבאים). Anti-FLAG PE שימש לזיהוי scFvs עם תיוג FLAG (טבלה משלימה 1 וטבלה משלימה 2). לאחר מכן נבחרו חמשת ה-scFvs בעלי הביצועים הטובים ביותר ליישום במבחן הדיווח הכפול, יחד עם Hu-anti-S1 מסחרי (טבלה 1), על סופרנאטנטים מתאי אפיתל נגועים של כליות הקוף הירוק האפריקני VeroE6.
גורם קריטי נוסף להצלחת הפרוטוקול הוא ההליך שנבחר לצימוד מיקרוספירה. שיטת הצימוד צריכה להיות יעילה, ובו זמנית, לשמור על אפיטופים קונפורמטיביים או שאריות חומצות אמינו המעורבים בקשירת החלבון שלמים וללא שינוי. כאן, תגובת EDC-NHS יושמה על זוג נויטרווידין ישירות למיקרוספרות, תוך התאמת פרוטוקול שתואר קודם לכן30 ומערכת נויטרווידין + ביוטין כדי לקשור ACE2 רקומביננטי למיקרוספרות המצומדות. ניתן לבדוק ולהשוות שיטות צימוד חלופיות ויעילותן. לבסוף, נצפה כי ריאגנטים שונים המסומנים באופן פלואורסצנטי (למשל, Anti-FLAG PE (phycoerythrin) ו- anti-FLAG Brilliant Violet 421) עשויים לגרום לרמות MFI שונות שעשויות להשפיע על רגישות הבדיקה.
לסיכום, השיטה המתוארת מאפשרת זיהוי חלקיקים נגיפיים שלמים בתמיסה, תוך יישום אסטרטגיית דיווח כפול. ניתוח של שלושה דטרמיננטים על פני השטח במקביל מספק כלי ספציפי יותר לאפיון חלקיקים נגיפיים ובסופו של דבר להבדיל אותם מכלי רכב חשמליים אחרים (למשל, שאינם מכילים אנטיגנים נגיפיים). אסטרטגיה זו היא חלופה לווירומטריית זרימה. למרות שהגישה הנוכחית אינה מפלה את גודל החלקיקים, אסטרטגיות חרוזים מגנטיים המשתמשות במיקרוספרות מקודדות בצבע מציעות יכולת רחבה יותר בפרופיל אנטיגן פני השטח ובתכנון ניסיוני על ידי ניתוח מולטיפלקס גבוה ותפוקה גבוהה. הבדיקה מראה דיוק וחוסן גבוהים וניתן להרחיב אותה לניתוח של כל סוג של שלפוחית חוץ-תאית וכל סוג אחר של חלקיק ביולוגי החושף אנטיגנים על פני השטח בנוזלי גוף או מטריצות נוזליות אחרות. זה היה מחקר הוכחת היתכנות שהדגים את התועלת של שימוש ב- scFvs כמגיב זיהוי אחד בניתוח מולטיפלקס של אפיטופים חלבוניים מרובים על חלקיקים נגיפיים. מחקרים עתידיים נחוצים כדי לקבוע את המאפיינים הספציפיים של scFvs (למשל, זיקות קשירה, תגובתיות צולבת עם ריאגנטים ומטרות אחרות) אם הם ישמשו למטרות כמותיות או קליניות.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
אנו מודים ב-SciLifeLab, שוודיה, לצוות יחידת Scilifelab של Affinity Proteomics-Stockholm על פיתוח ויישום השיטה המתוארת כאן, ליחידה לטיפול בנוגדנים אנושיים על אספקת scFvs וריאגנטים Fab, ולג'ונאס קלינגסטרום על תאי VeroE6 הנגועים במבודדי SARS-CoV-2 הנובעים מדגימות קליניות. המחברים מודים לשרי דנבר, PhD, MBA של Luminex Corporation (אוסטין, טקסס), על התמיכה במחקר, ומאט סילברמן MSci, PhD של פתרונות הוצאה לאור ביו-רפואיים (פנמה סיטי, פלורידה; mattsilver@yahoo.com) על סיוע מדעי וכתיבה. עבודה זו נתמכה על ידי קרנות מקרן קנוט ואליס ולנברג וממעבדת המדע לחיים (SciLifeLab) (VC2020-0015 לקלאודיה פרדוליני ופרנצ'סקה צ'יודי ו-VC-2022-0028 לקלאודיה פרדוליני).
Materials
| Name | Company | Catalog Number | Comments |
| ACE2-Biotin | Acro Biosystems (Newark, DE) | AC2-H82E6-25 ug | Conc: 340 µg/mL, LOT#BV35376-203HFI-2128 |
| Anti-Goat IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 705-116-147 | Host species: Donkey |
| Anti-Human IgG R-PE | Life Technologies/Thermo Fisher (Waltham, MA) | H10104 | Conc: 0.15 mg/mL, LOT#2079224, Host species: Goat |
| Anti-Mouse IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 115-116-146 | Host species: Goat |
| Anti-Rabbit IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 111-116-144 | Host species: Goat |
| Biotin | Thermo-Fisher Scientific (Waltham, MA) | 20RUO | 100 mM, pH 10 Conc. 1 mg/mL |
| Blocker Casein in PBS | Thermo-Fisher Scientific (Waltham, MA) | 37528 | LOT#VD301372 |
| Blocker reagent for ELISA (BRE) | Roche (Basel, Switzerland) | 11112589001 | |
| Brilliant Violet 421 anti-DYKDDDDK Tag Antibody (Anti-FLAG) 0.2 mg/ml, rat IgG2a, λ | BioLegend (Amsterdam, The Netherlands) | 637321 | |
| Bovine serum albumin (BSA) | Saveen & Werner (Limhamn, Sweden) | B2000-500 | LOT#04D5865 |
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Proteochem (Hurricane, UT) | C1100-custom (65 mg) | LOT# MK3857 |
| Fetal calf serum (FCS) | Gibco/Thermo Fisher (Waltham, MA) | 10270-106 | |
| Goat anti-ACE2 polyclonal antibody | R&D Systems/Bio-Techne (Minneapolis, MN) | AF933 | Host species: Goat |
| Goat IgG | Bethyl Labs (Montgomery, TX) | P50-200 | LOT#P50-200-6 |
| L-glutamine | Thermo-Fisher Scientific (Waltham, MA) | 25030024 | |
| Low-bind 1.5 mL microfuge tubes | VWR (Radnor, PA) | 525-0133 | |
| MagPlex-C Microspheres | Luminex Corporation (Austin, TX) | MC10XXX-01 | |
| MEM tissue cuture media | Gibco/Thermo Fisher (Waltham, MA) | 21430-020 | |
| Microplate, 96-Well, Polystyrene, Half-area, Clear | Greiner Bio-One (Kremsmünster, Austria) | 675101 | |
| NaHCO3 | Gibco/Thermo Fisher (Waltham, MA) | 25080-060 | |
| Neutravidin | Thermo-Fisher Scientific (Waltham, MA) | 31000 | LOT#UK292857 |
| PBS tablets | Medicago AB (Uppsala, Sweden) | 09-9400-100 | LOT#272320-01 |
| Penicillin/Streptomycin | Gibco/Thermo Fisher (Waltham, MA) | 15140122 | |
| Poly(vinyl alcohol) | Sigma-Aldrich (St. Louis, MO) | 360627 | |
| Polyvinylpyrrolidone | Sigma-Aldrich (St. Louis, MO) | 437190 | |
| ProClin 300 | Sigma-Aldrich (St. Louis, MO) | 48915-U | |
| Rabbit IgG | Bethyl Labs (Montgomery, TX) | P120-301 | LOT#12 |
| scFv-FAb1 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.12 mg/mL. | |
| scFv-FAb2 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc batch1: 0.38 mg/mL. Conc batch2: 0.45 mg/mL | |
| scFv-FAb3 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.34 mg/mL. | |
| scFv-FAb4 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 2.85 mg/mL. | |
| scFv-FAb5 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc:2.7mg/mL. | |
| SARS-CoV-2 infectious particles, Swedish isolate | In-house production | The Public Health Agency of Sweden | |
| SARS-CoV-2 Spike Antibody (Hu-anti-S1) | Novus Biologicals (Centennial, CO) | NBP2-90980 | Monoclonal antibody. Conc: 1 mg/mL. Host: Human. Clone: CR3022. Isotype: IgG1 Kappa. LOT#T201B06 |
| Sodium phosphate monobasic, anhydrous | Sigma-Aldrich (St. Louis, MO) | S3139 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo-Fisher Scientific (Waltham, MA) | 24510 | LOT# XH321563 |
| Tween | Thermo-Fisher Scientific (Waltham, MA) | BP337-50 | LOT#194435 |
| Ultraviolet lamp | Vilber Lourmat GmbH (Eberhardzell, Germany) | VL-215.G | Wavelength = 254 nm; 2 × 15-watt bulbs |
| Vero E6 cells | ATCC (Manassus, VA) | CRL-1586 | |
| xMAP INTELLIFLEX DR-SE (dual-reporter flow instrument) | Luminex Corporation (Austin, TX) | INTELLIFLEX-DRSE-RUO |
References
- Rey, F. A., Lok, S. M. Common features of enveloped viruses and implications for immunogen design for next-generation vaccines. Cell. 172 (6), 1319-1334 (2018).
- V'kovski, P., Kratzel, A., Steiner, S., Stalder, H., Thiel, V. Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology. 19 (3), 155-170 (2021).
- Burnie, J., et al. Flow virometry quantification of host proteins on the surface of HIV-1 pseudovirus particles. Viruses. 12 (11), 1296 (2020).
- Gentili, M., et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles. Science. 349 (6253), 1232-1236 (2015).
- Modrow, S., Falke, D., Truyen, U., Schätzl, H. . Viruses: Definition, Structure, Classification. In Molecular Virology. , 163-181 (2013).
- Trinh, K. T. L., Do, H. D. K., Lee, N. Y. Recent advances in molecular and immunological diagnostic platform for virus detection: A review. Biosensors. 13 (4), 490 (2023).
- Zamora, J. L. R., Aguilar, H. C. Flow virometry as a tool to study viruses. Methods. 134-135, 87-97 (2018).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Byström, S., et al. Affinity proteomic profiling of plasma for proteins associated to area-based mammographic breast density. Breast Cancer Research. 20 (1), 14 (2018).
- Rudberg, A. -. S., et al. SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden. Nature Communications. 11 (1), 5064 (2020).
- Liu, J., et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. Journal of Clinical Virology. 50 (4), 308-313 (2011).
- Gadsby, N. J., Hardie, A., Claas, E. C. J., Templeton, K. E. Comparison of the Luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. Journal of Clinical Microbiology. 48 (6), 2213-2216 (2010).
- Lorenzen, E., et al. Multiplexed analysis of the secretin-like GPCR-RAMP interactome. Science Advances. 5 (9), (2019).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments: JoVE. (170), e62487 (2021).
- Jackson, C. B., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews Molecular Cell Biology. 23 (1), 3-20 (2022).
- ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. International Standardization Organization Available from: https://nhiso.com/wp-content/uploads/2018/05/ISO-10993-5-2009.pdf (2009)
- Poetz, O., et al. Sequential multiplex analyte capturing for phosphoprotein profiling. Molecular & Cellular Proteomics. 9 (11), 2474-2481 (2010).
- Dunbar, S. A., Vander Zee, C. A., Oliver, K. G., Karem, K. L., Jacobson, J. W. Quantitative, multiplexed detection of bacterial pathogens: DNA and protein applications of the Luminex LabMAP system. Journal of Microbiological Methods. 53 (2), 245-252 (2003).
- Taniuchi, M., et al. Multiplex polymerase chain reaction method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples. Diagnostic Microbiology and Infectious Disease. 71 (4), 386-390 (2011).
- Wu, M., et al. High-throughput Luminex xMAP assay for simultaneous detection of antibodies against rabbit hemorrhagic disease virus, Sendai virus, and rabbit rotavirus. Archives of Virology. 164 (6), 1639-1646 (2019).
- Dias, D., et al. Optimization and validation of a multiplexed Luminex assay to quantify antibodies to neutralizing epitopes on human papillomaviruses 6, 11, 16, and 18. Clinical and Vaccine Immunology. 12 (8), 959-969 (2005).
- Opalka, D., et al. Simultaneous quantitation of antibodies to neutralizing epitopes on virus-like particles for human papillomavirus types 6, 11, 16, and 18 by a multiplexes lumina assay. Clinical and Diagnostic Laboratory Immunology. 10 (1), 108-115 (2003).
- Nolte-'T Hoen, E., Cremer, T., Gallo, R. C., Margolis, L. B. Extracellular vesicles and viruses: Are they close relatives. Proceedings of the National Academy of Sciences. 113 (33), 9155-9161 (2016).
- Ohmichi, T., et al. Quantification of brain-derived extracellular vesicles in plasma as a biomarker to diagnose Parkinson's and related diseases. Parkinsonism & Related Disorders. 61, 82-87 (2019).
- Ter-Ovanesyan, D., et al. Framework for rapid comparison of extracellular vesicle isolation methods. Elife. 10, e70725 (2021).
- Gamage, S. S. T., et al. Microfluidic affinity selection of active SARS-CoV-2 virus particles. Science Advances. 8 (39), (2022).
- Renner, T. M., Tang, V. A., Burger, D., Langlois, M. -. A. Intact viral particle counts measured by flow virometry provide insight into the infectivity and genome packaging efficiency of moloney murine leukemia virus. Journal of Virology. 94 (2), e01600-01619 (2020).
- Niraja, S., et al. A flow virometry process proposed for detection of SARS-CoV-2 and large-scale screening of COVID-19 cases. Future Virology. 15 (8), 525-532 (2020).
- Lippé, R. Flow virometry: A powerful tool to functionally characterize viruses. Journal of Virology. 92 (3), e01765 (2018).
- Drobin, K., Nilsson, P., Schwenk, J. M. Highly multiplexed antibody suspension bead arrays for plasma protein profiling. Methods in Molecular Biology. 1023, 137-145 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved