Method Article
Viral Partiküller Üzerindeki Yüzey Protein Epitoplarının Multipleks Çift Raportör Stratejisi ile Profillenmesi
Bu Makalede
Özet
Burada, anjiyotensin dönüştürücü enzim-2'ye bağlı manyetik mikroküreler tarafından yakalanan sağlam şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2) viral partikülleri üzerinde iki benzersiz spike protein epitopunu aynı anda tespit etmek için çift raportörlü bir akış sitometrik sistemi kullanan yeni geliştirilmiş bir multipleks floresan immünolojik testi açıklıyoruz.
Özet
Zarflı virüsler üzerindeki membran proteinleri, virüsün hedef hücre reseptörlerine bağlanması, viral partiküllerin konak hücrelere füzyonu, konak-virüs etkileşimleri ve hastalık patogenezini içeren birçok biyolojik fonksiyonda önemli bir rol oynamaktadır. Ayrıca, virüs partikülleri üzerindeki ve konak hücre yüzeylerinde sunulan viral zar proteinlerinin antiviraller ve aşılar için mükemmel hedefler olduğu kanıtlanmıştır. Burada, çift raportörlü akış sitometrik sistemini kullanarak sağlam şiddetli akut solunum sendromu koronavirüs 2 (SARS-CoV-2) partikülleri üzerindeki yüzey proteinlerini araştırmak için bir protokol açıklıyoruz. Tahlil, üç bağımsız afinite reaksiyonu ile viral partiküllerin üçlü tespitini elde etmek için multipleks teknolojisinden yararlanır. SARS-CoV-2 ile enfekte olmuş hücrelerin süpernatantından viral partikülleri yakalamak için rekombinant insan anjiyotensin dönüştürücü enzim-2'ye (ACE2) konjuge manyetik boncuklar kullanıldı. Daha sonra, R-fikoeritrin (PE) veya Brilliant Violet 421 (BV421) ile etiketlenmiş iki tespit reaktifi aynı anda uygulandı. Kavram kanıtı olarak, SARS-CoV-2 yüzey proteini Spike'ın (S1) farklı epitoplarını hedefleyen antikor fragmanları kullanıldı. Viral partiküllerin üç bağımsız afinite reaksiyonu ile tespiti, güçlü bir özgüllük sağlar ve bozulmamış virüs partiküllerinin yakalandığını doğrular. SARS-CoV-2 ile enfekte hücre süpernatantının doz bağımlılık eğrileri, tekrarlanan katsayı varyansları (ortalama / SD) ˂4% ile üretildi. Her iki kanalda da iyi test performansı, iki virüs yüzeyi hedef protein epitopunun paralel olarak tespit edilebildiğini doğruladı. Burada açıklanan protokol, (i) zarflı virüsler üzerinde eksprese edilen yüzey proteinlerinin yüksek multipleks, yüksek verimli profillemesi; ii) aktif bozulmamış viral partiküllerin tespiti; ve (iii) viral antijenlerin yüzey epitopları için antikorların ve antiviral ilaçların özgüllüğünün ve afinitesinin değerlendirilmesi. Uygulama, vücut sıvılarında veya diğer sıvı matrislerde yüzey antijenlerini açığa çıkaran her türlü hücre dışı vezikül ve biyopartiküllere potansiyel olarak genişletilebilir.
Giriş
Grip, HIV, insan sitomegalovirüsü ve SARS-CoV suşları gibi en yaygın patojenik virüsler zarflı virüslerdir. Zarflı virüslerin neden olduğu hücre enfeksiyonu, viral ve konak hücre zarlarının füzyonunu gerektirir, bu da viral genomun sitoplazmaya salınmasına neden olur. Viral RNA daha sonra yeni bir viral parçacık 1,2'ye paketlenmeden önce çoğalacaktır. Bu işlemler sırasında, sadece viral proteinler değil, aynı zamanda konak zarı proteinleri de zarfa dahil edilebilir ve yeni viral partikülün ayrılmaz bir parçası haline gelebilir. Virüs zarfına dahil edilen konak hücre zarı proteinleri, hücre-hücre etkileşimleri, hedef arama ve bağışıklık sisteminden kaçış mekanizmalarından yararlanarak virüsün yeni bir konak hücreye girişini kolaylaştırabilir 3,4.
Virüsle ilişkili proteinlerin araştırılmasının önemine rağmen, virüs analizi için şu anda mevcut olan tekniklerinçoğu 5 virüs yüzey antijeninin yüksek verimli ve yüksek multipleks karakterizasyonunu desteklememektedir. Tek tek viral partikülleri tespit etme veya enfeksiyöz bozulmamış virüs partikülleri, enfeksiyöz olmayan RNA, viral proteinler ve farklı antijenleri ifade eden virüs alt popülasyonları arasında ayrım yapma yeteneğine de sahip değildirler. Son zamanlarda, akış sitometrisi modifiye edilmiş ve viral partiküllerin analizi için yeni bir yönteme, yani akış virometrisine uyarlanmıştır. Akış virometrisi, tek viral partiküllerin ve bunların yüzey antijenlerinin araştırılmasına izin verir. Bununla birlikte, düşük verim, düşük multipleks yeteneği, karmaşık deney kurulumu ve veri analizi ve küçük boyutlu viral parçacıkların sınırlı tespit edilebilirliği gibi sınırlamalar devam etmektedir 6,7.
Proteinlerin ve nükleik asidin mikroküre tabanlı çoğullanmış miktar tayini, vücut sıvılarında protein miktar tayini, protein-protein etkileşim çalışmaları ve viral enfeksiyonların teşhisine kadar çok sayıda uygulamaya sahip köklü bir teknolojidir 8,9,10,11,12,13 . Yakın zamanda piyasaya sürülen bir akış analiz cihazı, aynı reaksiyon kuyusunda iki floresan raportör molekülünün ölçülmesine izin veren çift raportör bir kanala sahiptir. Bu yeni yeteneğin, farklı immünoglobulin izotiplerinin14 paralel profillemesi için özellikle yararlı olduğu gösterilmiştir. Burada, ikili raportör sisteminin, paralel olarak birden fazla yüzey antijenini hedef alan bozulmamış viral partikülleri tespit etmek için nasıl kullanılabileceği açıklanmaktadır.
Kavramın bir kanıtı olarak bu rapor, SARS-CoV-2 virüs parçacıkları için üçlü bir tespit sisteminin geliştirilmesini detaylandırıyor. SARS-CoV-2 dört ana proteinden oluşur, biri iki alt birimden oluşan spike proteinidir (S). İlk alt birim olan S1, insan hücre zarlarında eksprese edilen ACE2'ye birincil bağlanmayı yapar. İkinci alt birim olan S2, bir füzyon peptidi ile hedef hücreye girişi kolaylaştırır ve hedef hücre zarında virion'un15'ten girebileceği bir gözenek oluşturur. SARS-CoV-2'nin kalan üç yapı taşı nükleokapsid (N), zar proteini (M) ve zarf proteinidir (E). Nükleokapsid, RNA ile ribonükleoprotein yapıları oluşturarak viral genomun paketlenmesinden sorumludur, zar ve zarf proteinleri ise virüs montajında merkezi rol oynar.
Burada açıklanan tahlil, SARS-CoV-2'nin zarf yüzeyinde ifade edilen S1 alt biriminin üç bağımsız epitopunu hedefler. Hem SARS-CoV-2 ile enfekte olmuş hem de enfekte olmamış hücre süpernatantlarının seri seyreltmeleri kullanılır. Viral partiküller, S1 alt birimini virüse bağlayan ACE2 ile konjuge mikroküreler yoluyla yakalanır. Yüzey virüsü S proteini daha sonra ticari olarak temin edilebilen etiketli bir immünoglobulin tek zincirli değişken fragman (scFv) ve bir insan monoklonal anti-S1 antikoru (Hu-anti-S1) ile birlikte kurum içinde geliştirilen FLAG etiketli bir scFv ile paralel olarak tespit edilir. Hu-anti-S1, turuncu R-fikoeritrin (PE) konjuge anti-insan IgG-Fc ikincil antikoru ile çift raportör sistemdeki birinci kanal (RP1) tarafından tespit edilir ve scFv, mavi Brilliant Violet 421 (BV421) konjuge ikincil anti-FLAG antikoru ile ikinci kanal (RP2) tarafından tespit edilir. Virüs partikül tahlili Şekil 1'de temsil edilmektedir.
Protokol
1. Nötravidin ve kontrol antikorlarının manyetik mikrokürelere konjugasyonu
NOT: Malzeme Tablosunda listelenen farklı floresan etiketlere sahip floresanla boyanmış manyetik boncuklar (gömülü manyetitli 6,5 μm çapında polistiren mikro küreler), aşağıdaki boncuk konjugatlarını ve kontrollerini oluşturmak için kullanılır: (1) Bir nötravidin bağlayıcı ile birleştirilmiş boncuklara bağlı biyotinile rekombinant insan ACE2; (2) Bir nötravidin bağlayıcı ile birleştirilmiş boncuklara bağlı biyotin; (3) Keçi IgG doğrudan boncuklara bağlanmış; ve (4) Eşlenik olmayan boncuklar. Boncuklara bağlanacak protein, sodyum azid, sığır serum albümini (BSA), glisin, tris (hidroksi-metil) aminometan (Tris), gliserol veya amin içeren katkı maddeleri içermemelidir. Aktivasyon Tamponu 0.1 M Sodyum fosfat monobazik, susuz (NaH2PO4), pH 6'dır. 2-morfolinoetansülfonik asit (MES; 50 mM) Konjugatları seyreltmek için pH 5 tamponu kullanılır. Yıkama Tamponu PBS-T'dir (1x PBS [fosfat tamponlu salin], pH 7.4 +% 0.05 (h/h) Tween-20). Depolama Tamponu, ELISA (BRE) için 2.7 mg / mL Bloke Edici Reaktif +% 0.1 antibiyotiktir (burada, ProClin 300).
- Sülfo-N-hidroksisülfosüksinimid (NHS) tozunu buzdolabından ve 65 mg önceden alıntılanmış 1-etil-3- [3-dimetilaminopropil] karbodiimid hidroklorürü (EDC) dondurucudan çıkarın ve oda sıcaklığına (RT; 18-22 °C) 30 dakika bekleyin. Atmosferik nemden hidrolizi önlemek için bu adım sırasında hem NHS'yi hem de EDC'yi silika boncuklar içeren bir zarfta saklayın.
- Aktivasyon ve birleştirme için mikro küreler hazırlayın.
NOT: Mikro kürecikler içindeki floresan boyalar ışığa duyarlıdır ve boncuklar aktif kullanılmadığında karanlıkta ve buzdolabı sıcaklıklarında (4-8 °C) tutulmalıdır.- Ürün bilgi sayfasına göre, renk kimliği kodlu mikro kürelerin (12,5 x 106 / mL) (Malzeme Tablosu) 4 farklı stokunu kısaca girdaplama, sonikasyon veya döndürme (15-30 rpm'de 15 dakika) ile yeniden askıya alın.
- Her bir boncuk süspansiyonunun (5 x 105 mikroküre) 40 μL'sini yarı kuyulu, düz tabanlı, 96 oyuklu bir mikrotitre plakasının (Malzeme Tablosu) atanmış kuyularına aktarın.
- Manyetik boncukları yıkayın.
NOT: Yıkama adımları manuel olarak veya otomatik bir plaka yıkayıcı kullanılarak gerçekleştirilebilir.- Boncuklara 80 μL/kuyu Aktivasyon Tamponu ekleyin ve boncukları 30 saniye boyunca manyetik plaka ayırıcı üzerinde hareketsiz hale getirin. Boncuklar manyetik plaka ayırıcı üzerinde hareketsiz hale getirilirken süpernatanı mikro küreciklerden aspire edin.
- Mikrotitre plakasını manyetik plaka ayırıcıdan çıkarın ve boncukları 50 μL Aktivasyon tamponunda yeniden süspanse edin.
- Boncukları Sulfo-NHS ve EDC ile aktive edin.
- 1.5 mL'lik bir mikrofüj tüpünde Aktivasyon Tamponunda 50 mg / mL'de Sulfo-NHS çalışma solüsyonu hazırlayın. Stok NHS tozunu nemden koruyarak buzdolabına (4-8 °C) geri koyun.
- 1.5 mL mikrofüj tüpünde Aktivasyon Tamponunda 50 mg / mL'de EDC çalışma solüsyonu hazırlayın. Önceden hazırlanmış 65 mg EDC tozu alikotlarını 1.3 mL Aktivasyon Tamponu içinde çözün.
NOT: Sulfo-NHS ve EDC, çözündükten sonra hidrolize olmaya ve aktivitesini kaybetmeye başlar. Boncuklara NHS ve EDC eklenene kadar birleştirme prosedürünü kesintiye uğratmaktan kaçının. Çözünmüş NHS veya EDC çözeltilerini daha sonra kullanmak üzere saklamayın. - %20 Sulfo-NHS stok solüsyonu (50 mg/mL), %20 EDC stok solüsyonu (50 mg/mL) ve %60 Aktivasyon Tamponunu hacimsel olarak birleştirerek boncuk aktivasyonu için Aktivasyon Solüsyonu hazırlayın. Her boncuk aktivasyon reaksiyonu için 50 μL'lik Aktivasyon Çözeltisi (5 × 105 boncuk/reaksiyon kullanılarak) ve ayrıca pipetleme kayıplarını karşılamak için yeterli ekstra hacim gereklidir.
- Yıkanmış boncuklar içeren her bir kuyucuğa 50 μL tam Aktivasyon Çözeltisi ekleyin. Aktivasyon Tamponunda önceden var olan 50 μL boncuk süspansiyon hacmi ile, oyuk başına, Sulfo-NHS'nin nihai konsantrasyonu 5 mg / mL olacak ve nihai EDC konsantrasyonu da 5 mg / mL olacaktır.
- Mikroküre reaksiyon plakasını tek kullanımlık bir yapışkan plastik veya folyo plaka kapatıcı ile kapatın ve karanlıkta oda sıcaklığında (18-22 °C) bir orbital çalkalayıcı (650 rpm) üzerinde 20 dakika inkübe edin.
- Fazla Aktivasyon Solüsyonunu boncuklardan yıkayın.
- Mikrotitre plakasını 233 × g'da 1 dakika santrifüjleyin.
- Aktif boncukları manyetik plaka ayırıcı üzerinde 30 saniye boyunca hareketsiz hale getirin. Plaka kapatıcıyı çıkarın ve mikrotitre plakası hala manyetik ayırıcı üzerinde konumundayken süpernatanı mıknatısla hareketsiz hale getirilmiş boncuklardan aspire edin.
- Mikrotitre plakasını manyetik ayırıcıdan çıkarın ve her oyuğa 100 μL MES Tamponu ekleyin.
- Toplam iki yıkama için 1.4.2-1.4.3 adımlarını bir kez daha tekrarlayın.
- Nötravidin ve keçi IgG'yi (kontrol) uygun boncuk setlerine birleştirin. Pipetleme kayıplarını karşılamak için 100 μL/reaksiyon ve yeterli ekstra planlayarak yeterli nötravidin ve keçi IgG çalışma solüsyonlarını aşağıdaki gibi hazırlayın:
NOT: Nötravidin protein tozu, ultra saf su ile sulandırılır ve daha sonra depolama / kullanım için ayrılmadan önce PBS ile 1 mg / mL'lik bir stok çözeltisine seyreltilir (nötravidin proteini PBS'de doğrudan çözünür değildir, ancak suda ~ 10 mg / mL'ye kadar çözünür).- 1.5 mL düşük protein bağlayıcı mikrofüj tüpünde MES Tamponunda 125 μg / mL konsantrasyonda nötravidin çalışma solüsyonu hazırlayın.
- MES Tamponunda 17.5 μg / mL konsantrasyonda keçi IgG kontrol antikoru çalışma solüsyonu hazırlayın.
- Aktif boncuklar içeren mikrotitre plakasını hazırlayın. Boncukları manyetik plaka ayırıcı üzerinde 30 saniye boyunca hareketsiz hale getirin. Mikrotitre plakası hala manyetik ayırıcı üzerinde konumdayken, süpernatanı mıknatısla hareketsiz hale getirilmiş boncuklardan aspire edin.
- 100 μL nötravidin çalışma solüsyonu (125 μg/mL) içeren boncuklar içeren uygun kuyucuklara ekleyin (nötravidin-biotin ve nötravidin-ACE2 eşleşmesi için).
- 100 μL keçi IgG çalışma çözeltisi (17.5 μg / mL), yalnızca keçi IgG kontrolleri olarak atanan boncukları içeren kuyuya ekleyin.
- Kontrol olarak atanan kuyuya 100 μL MES Tamponu ekleyin Konjuge Olmayan Boncuklar.
- Mikrotitre plakasını kapatın ve karanlıkta RT'de (18-22 °C) bir orbital çalkalayıcı (650 rpm) üzerinde 2 saat inkübe edin. Boncukların süspansiyonda kalmasını sağlamak için 1 saatlik inkübasyondan sonra plakayı kısa bir süre vorteksleyin.
- Boncukları PBS-T ile yıkayın.
- Mikrotitre plakasını 233 × g'da 1 dakika santrifüjleyin.
- Birleştirilmiş boncukları 30 saniye boyunca manyetik plaka ayırıcı üzerinde hareketsiz hale getirin. Mikrotitre plakası hala manyetik ayırıcı üzerinde konumdayken, süpernatanı mıknatısla hareketsiz hale getirilmiş boncuklardan aspire edin.
- Mikrotitre plakasını manyetik ayırıcıdan çıkarın.
- Boncuk içeren her oyuğa 100 μL PBS-T ekleyin.
- PBS-T ile toplam iki yıkama için 1.6.2-1.6.4 yıkama adımlarını bir kez tekrarlayın.
- Depolama için konjuge boncuklar hazırlayın.
- Birleştirilmiş boncukları 30 saniye boyunca manyetik plaka ayırıcı üzerinde hareketsiz hale getirin. Mikrotitre plakası hala manyetik ayırıcı üzerinde konumdayken, süpernatanı mıknatısla hareketsiz hale getirilmiş boncuklardan aspire edin. Mikrotitre plakasını manyetik ayırıcıdan çıkarın.
- Kalan boncuk aktivitesini söndürmek için her bir mikroküre kimliğine 50 μL Depolama Tamponu ekleyin.
- Mikrotitre plakasını buzdolabı sıcaklıklarında (4-8 °C) gece boyunca karanlıkta (16-22 saat) inkübe edin.
- Konjuge olmayan ve keçi-IgG konjuge boncuk süspansiyonlarını (50 μL), maksimum boncuk geri kazanımını sağlamak için kuyucukların iki adet 100 μL'lik Depolama Tamponu duruması ile birlikte uygun şekilde etiketlenmiş 1,5 mL düşük protein bağlayıcı mikrofüj tüplerine aktarın.
NOT: Konjuge olmayan ve keçi IgG konjuge boncukların her ikisi de 250 μL'lik bir son hacimde 5 × 105 olarak numaralandırılacaktır (yani, 2 × 103 boncuk / μL). Mikrofuj tüplerini kullanana kadar buzdolabı sıcaklıklarında (4-8 °C) saklayın.
- Biyotinile ACE2 ve biyotini nötravidin konjuge boncuklara bağlayın.
- 10 mM PBS'de 18 μg / mL ACE2'de rekombinant insan biyotinile ACE2 çalışma çözeltisini hazırlayın. Reaksiyon başına 100 μL'ye ihtiyaç duyulacaktır. Biyotin çalışma çözeltisini 10 mM PBS'de 2.4 mg / mL biyotinde hazırlayın. Reaksiyon başına 100 μL'ye ihtiyaç duyulacaktır.
- Nötravidin konjuge mikroküreler içeren mikrotitre plakasını hazırlayın.
- Mikro küreleri 30 saniye boyunca manyetik plaka ayırıcı üzerinde hareketsiz hale getirin. Mikrotitre plakası hala manyetik ayırıcı üzerinde konumdayken, plaka kapatıcıyı çıkarın ve süpernatanı mıknatısla hareketsiz hale getirilmiş mikro küreciklerden aspire edin.
- Mikrotitre plakasını manyetik ayırıcıdan çıkarın ve 50 μL 10 mM PBS/kuyu ekleyin.
- 1.8.2.1-1.8.2.2 adımlarını bir kez tekrarlayın.
- Nötravidin konjuge mikroküreler içeren uygun kuyucuklara 100 μL biyotinile ACE2 çalışma solüsyonu ekleyin. Nötravidin konjuge mikroküreler içeren uygun kuyucuklara 100 μL biyotin çalışma çözeltisi ekleyin.
- Mikrotitre plakasını kapatın ve karanlıkta RT'de (18-22 °C) bir orbital çalkalayıcı (650 rpm) üzerinde 1 saat inkübe edin.
- Mikro kürecikleri 1.6.1-1.6.5 adımlarında açıklandığı gibi yıkayın.
- ACE2 ve biyotin ile konjuge mikro küreleri adım 1.7.1-1.7.4'te açıklandığı gibi hazırlayın ve saklayın.
NOT: Biyotinile ACE2- ve biyotin konjuge boncukların her ikisi de 250 μL'lik bir nihai hacimde 5 × 105 olarak numaralandırılacaktır (yani, 2 × 103 boncuk / μL).
2. Konjugasyon testi
- Bölüm 1'de oluşturulan dört tür mikrokürenin tümünü birleştirerek bir Boncuk Karışımı hazırlayın (yani, nötravidin ile konjuge biyotinillenmiş ACE2, nötravidin ile konjuge biotin, keçi IgG konjuge ve Konjuge Olmayan).
NOT: Stok mikrokürecikler 2 × 103 boncuk/μL'de depolandı ve çalışma Boncuk Karışımındaki nihai boncuk konsantrasyonu her set/μL'den 40 boncuk olacak şekilde birleştirildi.- Test için gerekli olan çalışan Boncuk Karışımının hacmini (5 μL/reaksiyon) hesaplayarak ekstra hacmin pipetleme kayıplarını karşılamasına izin verin. Her bir tüpü kısaca vorteksleyin ve her bir boncuk süspansiyonunun eşit hesaplanan hacimlerini yeni bir düşük protein bağlayıcı mikrofüj tüpünde birleştirin. Boncuk konsantrasyonu şimdi her set / μL'den 400 boncuktur.
- Kombine boncuk süspansiyonunu Depolama Tamponu (her set/μL çalışma konsantrasyonundan 40 adet) ile 10 kat daha seyrelterek çalışan Boncuk Karışımını oluşturun.
NOT: Her bir ID için mikro küre/μL sayısını tahmin etmek için önce az miktarda çalışan Boncuk Karışımı yapın.
- Mikroküreleri keçi anti-ACE2 antikoru ile inkübe edin.
- 5 μL çalışma boncuk karışımını düz tabanlı, yarı kuyulu, 96 oyuklu mikrotitre plakanın 3 kuyusuna pipetleyin.
- Mikrotitre plakasındaki boncukları içeren 3 oyuğun her birine 50 μL keçi anti-ACE2 (PBS-T, Malzeme Tablosunda seyreltilmiş 0.4 μg / mL) ekleyin. Mikrotitre plakasını kapatın, girdap yapın ve karanlıkta 650 saat boyunca RT'de (18-22 ° C) bir orbital çalkalayıcı (1 rpm) üzerinde inkübe edin.
- Mikrotitre plakasını 1 dakika boyunca 233 × g'da aşağı çekin ve mikroküreleri 1.6.2-1.6.4'te tarif edildiği gibi PBS-T ile üç kez yıkayın.
- Mikroküreleri tespit antikorları ile inkübe edin.
- 5 μL çalışma boncuk karışımını mikrotitre plakasının 6 yeni kuyusuna pipetleyin.
- Çalışma algılama karışımlarının her biri için 1 μg/mL hazırlayın: seyreltici olarak PBS-T kullanarak 3 ayrı 1,5 mL tüpte keçi önleyici IgG PE, fare önleyici IgG PE ve tavşan önleyici IgG PE.
- Her biri 3 oyuğa 50 μL tespit karışımı ekleyin ve keçi önleyici IgG, adım 2.2'deki anti-ACE2 ile aynı kuyucuklara eklenir.
- RT'de (650-18 ° C) bir orbital çalkalayıcı (22 rpm) üzerinde 30 dakika boyunca kapatın, girdaplayın ve inkübe edin.
- Plakayı 1 dakika boyunca 233 × g'da aşağı çekin ve mikroküreleri 1.6.2-1.6.4'te açıklandığı gibi PBS-T ile üç kez yıkayın.
- 100 μL PBS-T ekleyin ve aşağıdaki ayarlarla çift raporlayıcılı akış analizi cihazında çalıştırın:
Mod: Çift muhabir; Zaman aşımı: 45 sn; DD-geçit: 7500-17500; Minimum mikroküre sayısı: 100 mikroküre/set (en düşük QC kesmesi: 35 mikroküre/set).
3. SARS-CoV-2 ile enfekte hücre süpernatantının üretimi
SARS-CoV-2 virüsü, konakçı Vero E6 hücrelerinde (maymun böbrek epitel hücre hattı; ATCC; Malzeme Tablosu). Vero E6 hücreleri, %5 CO2 ve% 95 bağıl nem atmosferinde 37 ° C'de Modifiye Kartallar ortamında (MEM) kültürlenir. Her litre MEM, 10 mL L-glutamin (200 mM), 38 mLNaHCO3 (% 7.5), 5 mL penisilin / streptomisin çözeltisi ve 50 mL fetal sığır serumu (FCS) ile desteklenir; Malzeme Tablosu.
DİKKAT: SARS-CoV-2'yi kullanırken uygun biyogüvenlik prosedürlerini ve ekipmanlarını kullanın.
- Vero E6 hücreleri, iki adet 150cm2'lik doku kültürü şişesinde birleşecek şekilde büyütülür. Bir şişeyi SARS-CoV-2 virüsü ile enfekte edin ve sahte enfekte olmuş diğerini kontrol olarak kullanın.
- Yaklaşık 100.000 vahşi tip (WT) SARS-CoV-2 bulaşıcı partikülünü 5 mL Eagles MEM ortamı ile karıştırın.
- Ortamı 150cm'lik 2'lik bir şişeden aspire edin ve enfekte olmamış kontrol süpernatanları oluşturmak için 55 mL tam MEM ekleyin. Diğer 150cm'lik 2 şişeden ortamı aspire edin ve virüs karışımını hücrelere ekleyin. Hücreleri 37 ° C'de 1 saat inkübe edin. Virüsü dağıtmak için şişeyi her 15 dakikada bir hafifçe sallayın.
- SARS-CoV-2 eklenmiş şişeye 50 mL tam MEM ortamı ekleyin ve hücreleri sitopatik etkiler gözlenene kadar inkübe edin, şişeler her 24 saatte bir görsel olarak değerlendirilir.
NOT: Sitopatinin ortaya çıkması enfeksiyondan yaklaşık 3-4 gün sonra sürmelidir. Vero E6 hücre tek tabaka yapısı üzerindeki sitopatik etkiler (ör., hücre geri çekilmesi, krenation, yuvarlama, yapışma kaybı, intrasitoplazmik granülerlik kaybı, açık lizis), in vitro sitotoksisite testi için Uluslararası Standardizasyon Örgütü yönergelerine göre, ters çevrilmiş bir ışık mikroskobu kullanılarak hücrelerin gözlemlenmesiyle kalitatif olarak değerlendirilir16. - Hücre süpernatantını her iki şişeden toplayın ve hücre kalıntılarını çökeltmek için 253 × g'da 6 dakika döndürün.
- Hücre süpernatanında SARS-CoV-2 virüsünü UV ile inaktive eder
- 24 oyuklu bir mikrotitre plakasında 12 oyuğa oyuk başına 0,5 mL süpernatan pipetleyin. Mikrotitre plakasını kapaksız olarak uygun bir ultraviyole lamba altında 30 saniye boyunca UV ışınlayın (Malzeme Tablosu).
NOT: Hücre süpernatanında viral inaktivasyon, Vero E6 hücre kültürlerinde virüs yayılımı denenerek tespit edilmelidir.
- 24 oyuklu bir mikrotitre plakasında 12 oyuğa oyuk başına 0,5 mL süpernatan pipetleyin. Mikrotitre plakasını kapaksız olarak uygun bir ultraviyole lamba altında 30 saniye boyunca UV ışınlayın (Malzeme Tablosu).
- Hücre süpernatanını 1.5 mL'lik tüplere alın ve daha fazla kullanılana kadar -20 ° C'de saklayın.
NOT: Hücre süpernatanı -80 °C'de saklanabilir.
4. Tahlil: Hücre süpernatanında SARS-CoV-2 viral partiküllerinin tespiti
- % 0.1 kazein,% 0.5 polivinil alkol,% 0.8 polivinilpirolidon ve% 1 BSA'yı (tümü w / v) (pH 7) karıştırarak Tahlil Tamponu hazırlayın. Tahlil Tamponunda %10 tavşan IgG hazırlayarak Numune Seyreltme Tamponunu hazırlayın.
- Test için gerekli olan çalışma Boncuk Karışımının hacmini (adım 2.1) hesaplayın ve hazırlayın (5 μL/reaksiyon), böylece fazla hacmin pipetleme kayıplarını karşılamasına izin verin.
- Süpernatan seyreltme serisini hazırlayın. Gerekli süpernatan hacimlerini hesaplayın. Beş scFv'nin her biri için üçlü kuyucuklarda her bir seyreltme noktasını test edin, bu da seyreltme noktası ve numune tipi başına 15 kuyucuk ile sonuçlanır. Her oyukta toplam 675 μL için 45 μL seyreltilmiş süpernatan kullanın; SARS-CoV-2 ve kontrol süpernatantlarının her biri için tek bir 1,5 mL mikrofüj tüpü yeterlidir.
- SARS-CoV-2 süpernatantlarını çözün ve süpernatanları 4 °C'de en az 1 saat kontrol edin. Süpernatanları ve seyreltmelerini kullanana kadar soğuk (2-8 °C) tutun. SARS-CoV-2 ve kontrol süpernatanları için her biri sekiz adet 1,5 mL'lik mikrofüj tüpünü etiketleyin ve düzenleyin.
NOT: Test edilen en yüksek konsantrasyon, 1:1 (2 kat) süpernatan seyreltme olacaktır, bundan Numune Seyreltme Tamponu kullanılarak bir dizi 1:2 (3 kat) seyreltme yapılacaktır ve en yüksek seyreltme 1:1458 seyreltme olacaktır. Numune Seyreltme Tamponu içeren boşluklar yalnızca süpernatan içermeyen kontroller olarak işlev görür. Bu nedenle, her bir süpernatan tipinin (SARS-CoV-2 veya kontrol) test edilen seyreltmeleri, yalnızca tampon kontrolü ile 2, 6, 18, 54, 162, 486 ve 1458 kat olacaktır. - Etiketli mikrofüj tüplerine Numune Seyreltme Tamponu ekleyin. 1:1 (2 katlı) seyreltme tüpleri 600 μL tampon gerektirir ve kalan tüpler 800 μL tampon gerektirir. 600 μL süpernatanı 600 μL Numune Seyreltme Tamponu ile uygun şekilde etiketlenmiş tüplerde birleştirerek ve ardından tüpü karıştırmak için kısaca girdaplayarak her süpernatantın en yüksek seyreltmesini (1:1; 2 kat) oluşturun.
- 1: 1 (2 kat) seyreltilmiş süpernatanların 400 μL'sini bir sonraki seyreltme tüpüne (yani 6 kat seyreltme) sırayla aktararak seriye devam edin ve en düşük seyreltme (1458 kat) oluşturulana kadar 3 kat seyreltmeye devam edin. Bir sonraki seyreltmeye devam etmeden önce her seyreltilmiş süpernatanı kısaca girdaplayın.
- SARS-CoV-2 süpernatantlarını çözün ve süpernatanları 4 °C'de en az 1 saat kontrol edin. Süpernatanları ve seyreltmelerini kullanana kadar soğuk (2-8 °C) tutun. SARS-CoV-2 ve kontrol süpernatanları için her biri sekiz adet 1,5 mL'lik mikrofüj tüpünü etiketleyin ve düzenleyin.
- Mikroküreleri süpernatan ile inkübe edin.
- Mikroküreleri yeniden süspanse etmek için önceden hazırlanmış çalışma Boncuk Karışımını 30 saniye boyunca vorteksleyin ve düz tabanlı 384 oyuklu bir mikrotitre plakasının atanmış her bir kuyucuğuna 5 μL Boncuk Karışımı ekleyin.
NOT: 96 oyuklu plakalar da kullanılabilir. - Hazırlanan süpernatan seyreltmelerden 45 μL'yi, 384 oyuklu plakada mikroküreler içeren atanmış oyuklara ekleyin. Plakayı kapatın ve karanlıkta RT'de (16-22 ° C) bir orbital çalkalayıcıda (650 rpm) gece boyunca (18-22 saat) inkübe edin.
- Mikroküreleri yeniden süspanse etmek için önceden hazırlanmış çalışma Boncuk Karışımını 30 saniye boyunca vorteksleyin ve düz tabanlı 384 oyuklu bir mikrotitre plakasının atanmış her bir kuyucuğuna 5 μL Boncuk Karışımı ekleyin.
- Boncuklardan fazla süpernatanı yıkayın.
- Mikrotitre plakasını orbital çalkalayıcıdan çıkarın ve plaka kapatıcıyı çıkarın. Plakayı 1 dakika boyunca 931 x g'da santrifüjleyin.
- Mikrotitre plakasını 30 saniye boyunca manyetik bir plaka ayırıcı üzerine yerleştirerek boncukları hareketsiz hale getirin. Mikrotitre plakası hala manyetik ayırıcı üzerinde konumdayken, plaka kapatıcıyı çıkarın ve süpernatanı mıknatısla hareketsiz hale getirilmiş boncuklardan aspire edin.
- Mikrotitre plakasını manyetik ayırıcıdan çıkarın.
- Boncuk içeren her oyuğa 60 μL PBS-T ekleyin.
- Toplam üç PBS-T yıkaması için 4.5.2-4.5.4 yıkama adımlarını iki kez tekrarlayın.
- Farklı Algılama Karışımlarını ayrı 1.5 mL tüplerde hazırlayın. Her tespit karışımı, ticari bir insan monoklonal anti-S1 (Hu-anti-S1) antikorundan (1 μg/mL) ve beş farklı FLAG etiketli scFv'den (1 μg/mL) birinden oluşur (Ek Dosya 1, Ek Tablo 1 ve Ek Tablo 2), SARS-CoV-2 partikülü üzerindeki spike proteinini hedefleyen, Test Tamponunda seyreltilmiş (adım 4.1), toplam beş farklı tespit karışımı ile sonuçlanır.
- 4.5.2-4.5.3 adımlarını tekrarlayın. Yıkanmış mikroküreleri uygun scFv'ye özgü Spike Detection Mix'in 50 μL/oyuğunda yeniden süspanse edin. Mikrotitre plakasını kapatın ve karanlıkta RT'de (18-22 °C) bir orbital çalkalayıcı (650 rpm) üzerinde 1 saat inkübe edin.
- Mikrotitre plakasını 931 × g'da 1 dakika santrifüjleyin. Boncuklardaki fazla Spike Detection Reaktifini yıkayın. Adım 4.5.2-4.5.5.5'e göre 60 μL PBS-T ile üç yıkama adımı gerçekleştirin.
- Mikroküreleri floresan algılama antikoru karışımı ile inkübe edin.
- Sırasıyla 0.2 μg/mL ve 1 μg/mL çalışma konsantrasyonları ile Test Tamponunda seyreltilmiş BV421 konjuge anti-FLAG antikoru ile birlikte ticari olarak temin edilebilen PE konjuge anti-insan IgG'den oluşan bir Floresan Çözelti Karışımı hazırlayın. Reaksiyon başına 50 μL Floresan Algılama Reaktifi gereklidir.
- 4.5.2-4.5.3 adımlarını tekrarlayın. Mikroküreleri 50 μL / kuyu Floresan Çözelti Karışımı içinde yeniden süspanse edin. Mikrotitre plakasını kapatın ve karanlıkta RT'de (18-22 °C) bir orbital çalkalayıcı (650 rpm) üzerinde 30 dakika inkübe edin.
- Mikrotitre plakasını 931 × g'da 1 dakika aşağı döndürün. Fazla Floresan Solüsyon Karışımını mikro küreciklerden yıkayın. Adım 4.5.2-4.5.5.5'e göre 60 μL PBS-T ile üç yıkama adımı gerçekleştirin.
- Mikroküreleri son yıkama adımından itibaren 60 μL PBS-T'de askıya alın. Plakayı, adım 2.6'da açıklanan ayarlarla çift raporlayıcılı bir akış analiz sisteminde analiz edin.
Sonuçlar
Konjugasyon testi
Konjugasyon testi, keçi-IgG ve nötravidin-biyotinillenmiş ACE2'nin mikrokürelere başarılı bir şekilde konjuge edildiğini gösterdi. Test saptama özgüllüğü, ACE2 ile konjuge mikrokürelerin farklı hayvan türlerinde üretilen PE etiketli ikincil antikorlarla araştırılmasıyla doğrulandı (Şekil 2). Farklı tespit antikorları arasında çapraz reaktivite gözlenmedi. Boncuk karışımları keçi anti-ACE2 + anti-keçi IgG PE ile incelendiğinde, hem ACE2 hem de keçi IgG konjuge mikroküreler için arka planın üzerinde bir medyan floresan yoğunluğu (MFI; keyfi birimler) değeri tespit edildi, ancak konjuge olmayan mikroküre (çıplak) veya biyotin kaplı mikroküreler için değil. Yanlış pozitif sinyalleri kontrol etmek için negatif kontroller olarak anti-fare IgG PE ve anti-tavşan IgG PE kullanıldı. Mikrokürelerle inkübasyon sırasında ihmal edilebilir bir floresan sinyali üretildi, bu da ACE2 ve keçi IgG için pozitif sinyallerin spesifik olduğunu gösterdi.
Hücre süpernatantlarında viral partikül tespit edilebilirliği
Rekombinant insan ACE2'ye bağlı manyetik boncuklar, enfekte olmuş ve kontrol (virüssüz) VeroE6 hücre kültürü süpernatantlarından SARS-CoV-2 viral partiküllerini yakalamak için kullanıldı ve daha sonra bir monoklonal antikor ve beş farklı scFv'den biri kullanılarak iki farklı viral spike bölgesi için aynı anda araştırıldı. SARS-Cov-2 ile enfekte hücre süpernatantlarının seyreltmelerinde her iki raportör kanalda (RP1 ve RP2) konsantrasyona bağlı bir sinyal gözlendi (Şekil 3), bu hem ticari Hu-anti-S1 antikorunun hem de farklı scFv'lerin ACE2 konjuge mikroküreye bağlı viral partikülü tespit ettiğini gösterir. Beş scFv'den üçü ile virüs, 1:18'e (scFv2, scFv3, scFv5) kadar olan seyreltmelerde tespit edilebilir; kalan iki scFv (scFv7 ve scFv9) için 1:6 dilüsyona kadar tespit edilebilir. Bu, hedef için farklı bir yakınlığa atfedilebilir. Şekil 3 ve Tablo 1'de gösterildiği gibi, scFv3 en yüksek MFI yoğunluğunu sağlar, bunu sırasıyla scFv5, scFv2, scFv7 ve scFv9 izler.
Küresel olarak, scFvs algılama, Hu-anti-S1'e kıyasla daha düşük MFI ile sonuçlanır. Bu, daha düşük afiniteye işaret edebilir, ancak farklı floresan boyalarla (PE ve BV421) etiketleme nedeniyle bir artefakt da olabilir. scFv7 ve scFv9 için görülebilecek bir başka eğilim, MFI değerlerinin RP1 kanalı (anti-spike) için de diğer üç konfigürasyona kıyasla biraz daha düşük olmasıdır. Bu, scFv'lerin ACE2-Hu-anti-S1 etkileşimi ile çapraz reaksiyona girdiğini veya başka bir şekilde müdahale ettiğini gösterebilir, bu da RP2 kanalındaki daha düşük sinyali açıklayabilir. RP1 veya RP2 kanalındaki enfekte olmayan Vero E6 hücrelerinin süpernatanında hiçbir viral partikül tespit edilmedi.
Nötravidin-biyotin konjuge mikroküre, keçi-IgG mikroküre ve konjuge olmayan mikroküreler negatif kontrol boncukları olarak kullanılır. Viral parçacıklar, ACE2'ye bağlı manyetik mikroküreler ile yakalandı ve RP1 raportör kanalında ticari insan anti-spike ile ve RP2 raportör kanalında farklı scFv'lerle test edildi (scFv, her panelin sol üst köşesinde belirtilmiştir). Enfekte ve enfekte olmayan örneklerin hiçbirinde virüs partikülü tespit edilmedi.
Tahlil hassasiyeti ve sağlamlığı
Tahlil hassasiyetini değerlendirmek için, tüm koşullar üç nüsha halinde çalıştırıldı. Her seyreltme noktası için ACE2 mikroküre için bir varyans katsayısı (CV) hesaplandı. Tahlil için hesaplanan CV'lerin tamamı %15'in altında, en yüksek ölçülen CV %13 ve en düşük CV %1 idi (Tablo 2). RP1 kanalının yoğunluk grafiğinde (Şekil 4) görülebileceği gibi, ticari Hu-anti-S1'in PE tespiti, esas olarak %3'lük bir CV etrafında yoğunlaşan daha yüksek hassasiyet gösterir. RP2 kanalı, scFV'lerin BV tespiti, daha yüksek CV'leri gösterir. Bununla birlikte, Tablo 2'de görülebileceği gibi, daha yüksek CV aralığı, boşluk gibi düşük konsantrasyonlarda viral partikül içeren numuneler tarafından yönlendirilir. Protokolün sağlamlığını test etmek için tahlil, farklı günlerde üretilen boncuk karışımları ve daha düşük bir numune hacmi (%72 daha düşük) kullanılarak farklı operatörler tarafından iki kez tekrarlandı. Hem RP1 hem de RP2 kanalları için 0.98 ile 1 arasında değişen çok iyi bir Pearson korelasyonu gözlendi (p değeri < 0.01), bu da testin sağlamlığını ve daha az numune mevcut olduğunda testin uygulanma olasılığını doğruladı (Şekil 5). Bu akış analizi teknolojisi, "ortam analit teorisini"17 takip eder ve tahlili konsantrasyona duyarlı hale getirir ancak hacme duyarlı hale getirmez.
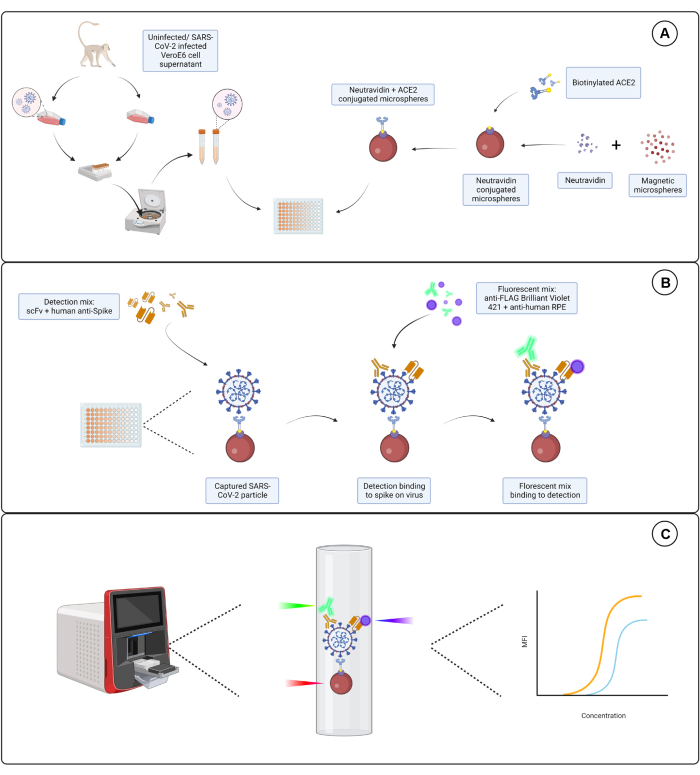
Şekil 1: Virüs partikül tayini. (A) Hem enfekte olmuş hem de enfekte olmamış Vero E6 hücrelerinden elde edilen hücre süpernatanı, nötravidin ile konjuge edilmiş manyetik mikroküreler ile birlikte 96 oyuklu veya 384 oyuklu bir plakaya seri bir seyreltme ile eklenir ve daha sonra biyotinile edilmiş insan ACE2 veya Biotin'e bağlanır. Keçi-IgG ve çıplak mikroküreler ile birleştirilmiş konjuge olmayan mikroküreler, nötravidin-biyotin konjuge mikroküre ile birlikte negatif kontroller olarak kullanılır. (B) Oluşmuş olan mikroküre-virüs parçacık kompleksleri, Hu-anti-S1 ve FLAG etiketli farklı scFv'lerden birinden oluşan bir tespit kokteyli ile tespit edilir. Daha sonra Hu-anti-S1'i hedefleyen anti-insan IgG PE ve scFv'leri hedefleyen anti-FLAG Brilliant Violet 421 ile bir floresan karışımı eklenir. (C) Üç lazerli, çift algılama sistemi, mikropartikül kompleksini tespit etmek için kırmızı, yeşil ve mor bir lazer yayar. Kırmızı lazer, mikroküre boya etiketini algılarken, yeşil ve mor lazerler sırasıyla anti-S1 ve scFv'leri algılar. Oluşturulan veriler daha sonra analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
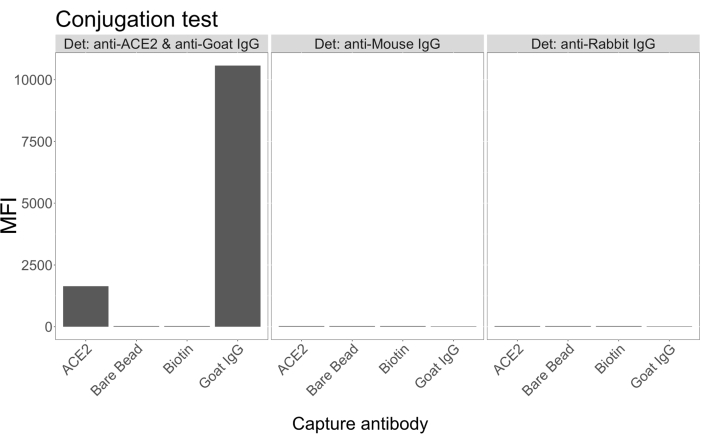
Şekil 2: Konjugasyon doğrulama grafiği. Boncuk karışımları, her biri farklı bir proteinle konjuge edilmiş dört farklı mikroküre kimliğinden oluşuyordu: nötravidin-biotin-ACE2 (ACE2), konjuge olmayan mikroküre (Çıplak Boncuk), nötravidin-biyotin (Biotin) ve keçi-IgG (Keçi IgG). Konjugasyon testinde üç farklı tespit florofor konfigürasyonu kullanılmıştır. Yani, keçi anti-ACE2 + anti-keçi IgG PE, anti-fare IgG PE ve anti-tavşan IgG PE. Y ekseni, üç farklı koşulla her bir mikroküreden ölçülen ortalama MFI (medyan floresan yoğunluğu; keyfi birimler) sinyalini gösterir. X ekseni, uygulanan farklı yakalama antikorlarını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
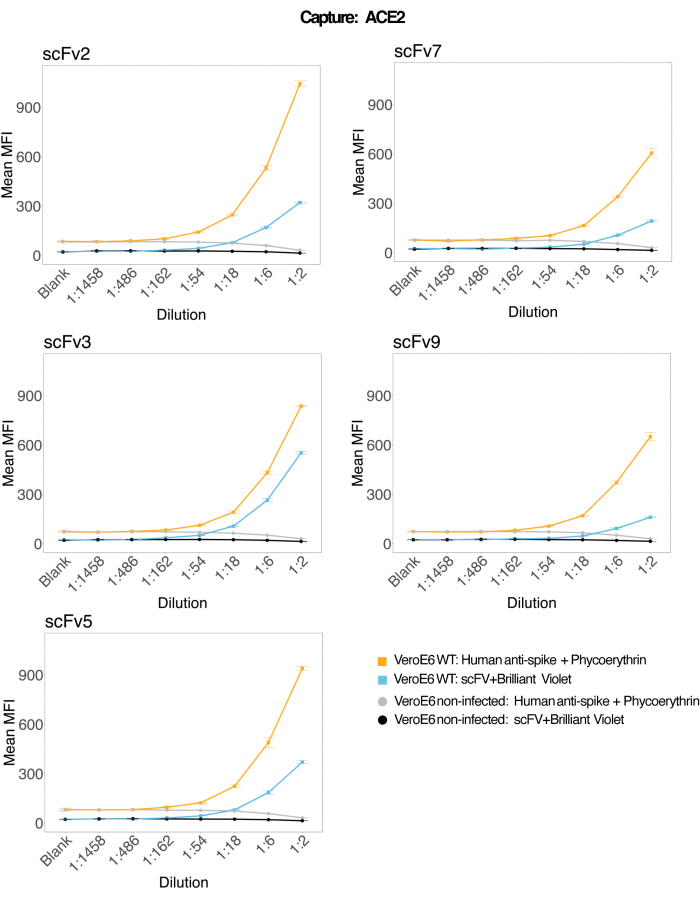
Şekil 3: Yüzey proteinlerinin çoğullanmış tespiti. Y ekseni: Her numune için ortalama MFI (medyan floresan yoğunluğu; keyfi birimler ± standart sapma), koşul başına üç kopya kuyucuklarda analiz edilir. X ekseni: Hücre süpernatantının seri seyreltme noktaları. Turuncu: SARS-CoV-2 WT ile enfekte olmuş Vero E6'dan süpernatanttaki virüs parçacıkları, insan anti-spike + anti-insan PE (fikoeritrin) ile tespit edildi. Mavi: SARS-CoV-2 WT ile enfekte olmuş Vero E6'dan süpernatant, farklı scFvs + anti-FLAG Brilliant Violet 421 ile tespit edildi. Gri: İnsan anti-spike + anti-insan PE ile tespit edilen enfekte olmayan hücre süpernatanı. Siyah: Enfekte olmayan hücre süpernatanı, beş farklı scFv + anti-FLAG Brilliant Violet 421 ile tespit edildi. Viral parçacıklar, ACE2'ye bağlı manyetik mikroküreler ile yakalandı ve RP1 raportör kanalında ticari insan anti-spike antikorları ile ve RP2 raportör kanalında farklı scFv'lerle test edildi (scFv, her panelin sol üst köşesinde belirtilmiştir). Enfekte olmayan örneklerin hiçbirinde virüs partikülü tespit edilmedi. ScFv3 tarafından hedeflenen epitop en yüksek afiniteye sahipti. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
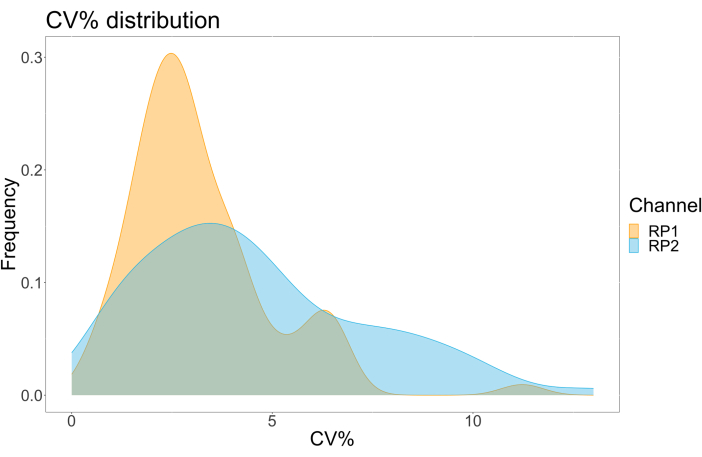
Şekil 4: Varyasyon dağılım grafiği. Y ekseni, olayların sıklığıdır ve X ekseni, farklı örneklerin her bir kopyası için yüzde olarak varyans katsayısını (CV) gösterir. RP1 ve RP2, sırasıyla fikoeritrin ve Brilliant Violet 421 ile ilişkili floresanı tespit eden birinci ve ikinci raportör kanallardır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Korelasyon matrisini çalıştırın. (A,B) Y ekseni: log10'daki Pearson korelasyon matrisi, üç farklı operatör tarafından ve farklı boncuk karışımları ile çalıştırılan üç ayrı çalışma arasında ölçeklenir. Üçüncü çalışmada daha düşük bir numune hacmi uygulandı. Histogramlar, ölçülen MFI'ye dayalı olarak farklı değişken kümelerin dağılımını gösterir. (A) RP1 raportör kanalı için farklı çalıştırmalar arasındaki korelasyon. (B) RP2 raportör kanalı için farklı çalıştırmalar arasındaki korelasyon. MFI = keyfi birimlerde medyan floresan yoğunluğu. p < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Algılama | Reaktivite |
| scFv2 | ++ |
| scFv3 | +++ |
| scFv5 | ++ |
| scFv7 | + |
| scFv9 | + |
| İnsan anti-Spike IgG | ++++ |
Tablo 1: Standart eğrilerde elde edilen MFI yoğunluğuna dayalı olarak algılamada scFv'lerin sıralaması.
| RP1 (PE) | RP2 (BV421) Serisi | |
| Numune Seyreltme | CV aralığı [%] | CV aralığı [%] |
| Boş | 3–11 | 2–13 |
| 1:1458 | 1–7 | 2–7 |
| 1:456 | 4–6 | 3–8 |
| 1:162 | 3–6 | 3–7 |
| 1:54 | 2–4 | 2–4 |
| 1:18 | 2–4 | 1–4 |
| 1:6 | 2–6 | 1–6 |
| 1:2 | 1–5 | 1–3 |
Tablo 2: Hem RP1 hem de RP2 raportör kanalları için SARS-CoV-2 ile enfekte süpernatantın her bir seyreltme noktasının %1 (ortalama/standart sapma × 1) aralığı.
Ek Dosya 1: İmmünoglobulin tek zincirli değişken fragman (scFv) üretimi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 1: Rekombinant Spike'ın (RBD) seri seyreltilmesine karşı scFv'lerin Fab'larla çiftler halinde taranması. Farklı tespit peptitlerinin performansını değerlendirmek için, 12 spike protein kombinasyonu, Fab, rekombinant RBD ile çivilenmiş tamponda yakalama olarak kullanıldı. Spike proteininin farklı epitoplarını hedefleyen on (10) scFv tespit olarak uygulandı. Yakalama-algılama çiftinin performansına bağlı olarak, bunlar başarısız (-) veya başarılı (+) olarak işaretlendi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo 2: SARS-Cov-2 ile enfekte Calu-3 hücre süpernatantının seri seyreltilmesine karşı scFv'lerin Fabs ile çiftler halinde taranması. Farklı tespit peptitlerinin performansının değerlendirilmesi için, SARS-Cov-2 ile enfekte Calu-3 hücre süpernatanında yakalama olarak 12 spike proteini kombinasyonu, Fab kullanıldı. Spike proteininin farklı epitoplarını hedefleyen on (10) scFv tespit olarak uygulandı. Yakalama-algılama çiftinin performansına bağlı olarak, bunlar başarısız (-) veya başarılı (+) olarak işaretlendi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Boncuk tabanlı multipleks teknolojisinin, bir dizi klinik uygulamada yüksek verimli patojen tespiti için değerli bir platform olduğu gösterilmiştir. Akış sitometrisi prensiplerine dayanan platformun yüksek esnekliği, antikorların, proteinlerin ve nükleik asitlerin18,19,20,21,22 hedeflenmesine ve aynı anda yüzlerce analitin çoğullanmasına izin verir. Bununla birlikte, bildiğimiz kadarıyla, bu teknoloji daha önce bozulmamış viral partikülleri tespit etmek için uygulanmamıştır. Bu raporda teknoloji, SARS-CoV-2'nin üç bağımsız yüzey epitopunu hedefleyerek bozulmamış viral partiküllerin tespiti için uygulandı.
Zarflı RNA virüsleri, konak proteinlerle birlikte viral RNA ve proteinleri taşıyan küçük fosfolipid membranlar olan hücre dışı veziküllere (EV'ler) yüksek yapısal benzerlik gösterir23. Sandviç immünolojik testler daha önce EV'lerin saptanması için iki farklı yüzey proteinini hedefleyen bir antikor çifti kullanılarak uygulanmıştır24,25. Sandviç tahlillerinin aynı anda sadece iki proteini tespit etme sınırlaması, reaksiyon başına ikiden fazla proteinin aynı anda saptanmasına izin veren multipleks yaklaşımlarla ortadan kaldırılır.
Burada açıklanan üç lazerli çift raportör algılama sistemi, bugüne kadarki en gelişmiş boncuk tabanlı akış analizi cihazıdır. Tek raporlu okuma sistemleri ile ilgili olarak, çift raporlayıcı (RP1 ve RP2 kanalları) paralel olarak üç yüzey proteininin/epitopunun saptanmasına izin verir. Birden fazla viral yüzey proteinini ve epitopunu hedeflemek, viral protein yükünün daha doğru bir temsilini sağlar, bu da virüsün aslında sağlam olduğunu doğrulamanın ötesinde, viral yüzey antijenlerini ve viral ve konakçı protein etkileşimlerinin mekanizmalarını daha fazla araştırma fırsatı sunar.
COVID-19 salgını sırasında, virüsün yayılmasını kontrol altına alma çabalarında aktif viral partiküller taşıyan bireylerin derhal tanımlanmasının önemi önemliydi. Genomik RNA, kökenine bakılmaksızın (bozulmamış virüs parçacıkları veya serbest) kantitatif RT-PCR ile tespit edilir. Bununla birlikte, yalnızca erişilebilir S proteinine sahip sağlam bir zarf, hücre girişine ve ardından virüs replikasyonuna aracılık edebilir. Hasta örneklerinde mikroakışkan çiplerle yapılan önceki çalışmalar, bakım noktası testleriyle birlikte bozulmamış viral partiküllerin tespit edilmesinin, karantinaya alınacak bireylerin daha bilinçli bir şekilde seçilmesi de dahil olmak üzere, sık sık test yapılmasını ve hastalık yayılmasının gelişmiş gözetimini nasıl sağlayacağını göstermiştir26. Çoğullanmış mikroküre bazlı bir tahlilin uygulanması, çoklu virüslerin ve bunların yüzey antijen varyantlarının taranmasını amaçlayan tahlillerin tasarımına izin verecek ve popülasyondaki virüs yayılımının daha doğru bir resmini elde edecektir.
Flow virometri, viral partiküllerin analizini amaçlayan yeni bir akım sitometrisi gelişmesidir. Ayrık viral partikülleri tespit edebilmesine rağmen, küçük virüslerin analizi akış virometresi27,28 için güncel bir sorun teşkil etmektedir. Burada açıklanan yönteme benzer şekilde, akış virometrisi, antikorlara bağlı altın nanopartiküller tarafından bozulmamış virionların yakalanmasını içerir. Her iki yöntem için de sınırlamalar şunları içerir: (i) mikroküreler veya nanopartiküller tarafından hedeflenen yüzey eksprese edilen antijen için yüksek afiniteli yakalama ve tespit reaktiflerine bağımlılık, (ii) virüs partikülleri ve hücre dışı veziküller arasında ayrım yapma yeteneğinin sınırlı olması ve (iii) uygun partikül miktarı için standartların eksikliği.
Hücreler EV'leri çevrelerine salgılarlar ve bir virüs tarafından enfekte olduklarında, EV'lerle benzer büyüklükte viryonlar salgılayabilirler ve sonunda aynı antijenleri eksprese edebilirler29. EV'ler virüsle benzer zar bileşimlerine sahip olacağından, çift lazerli tek raporlayıcı yaklaşımı gibi yalnızca afinite tabanlı yöntemler kullanarak bunları birbirinden ayırt etmek zor olabilir. Bununla birlikte, burada açıklanan stratejiler, parçacıkların protein bileşiminin daha geniş ve daha derin bir şekilde araştırılmasını sağlayan daha yüksek bir multipleks kapasiteye sahiptir. Akış tabanlı yöntemler, ayrık parçacıkların izlenmesine izin vererek dijital niceleme için fırsatlar sağlar. Yöntemimizdeki nicelik belirleme sorununu ele almak için bir strateji, standart eğrileri hazırlamak için virüs benzeri parçacıklar (VLP'ler) olarak ilgilenilen antijenleri ifade eden iyi karakterize edilmiş sentetik veziküller kullanmak olacaktır.
SARS-CoV-2'nin konakçı hücrelerden yaygın bir giriş ve çıkış yolu, virüs ve konak hücre zarınınetkileşimidir 2,15. Bu süreçte, konak zarı proteinlerinin virüs yüzeyine dahil olma olasılığı yüksektir. Dahil edilmiş konakçı proteinleri tarayarak, enfeksiyonun yolunu izleyebilir ve farklı riskli hastalar için potansiyel olarak hastalık seyrini tahmin ederek daha erken tedavi kararlarına izin verebilir. Ayrıca, araştırma laboratuvarlarında farklı numune gruplarında virüslerin karakterizasyonuna da izin verir. Bu, farklı özelliklerin farklı viral enfektivite seviyeleri ile ilişkili olup olmadığını test ederek ve viral yüzey proteinlerini hedef alan antikorların ve ilaç moleküllerinin taranması yoluyla daha fazla araştırılabilir.
Açıklanan yöntemle ilgili önemli bir husus, yakalama ve tespit reaktiflerinin virüs üzerindeki hedef proteinlerine karşı afinitesine dayanmasıdır. Bu nedenle, afinite reaktiflerinin seçimi, tahlil performansında belirleyici bir faktördür. Muhtemelen, en yüksek afiniteye sahip olanları seçmek için çoklu afinite reaktifleri taranmalı ve yakalama ve tespit için test edilmelidir. Burada, on scFv ve on iki Fab fragmanının performansı, rekombinant RBD kullanılarak ve SARS-Cov-2 ile enfekte Calu-3 akciğer epitel hücrelerinin süpernatantından elde edilen viral partiküller üzerinde ön olarak değerlendirildi (VeroE6 hücreleri, sonraki tüm çalışmalarda sitotoksisiteyi kültürlemek/değerlendirmek için kullanıldı). FLAG etiketli scFv'leri tespit etmek için Anti-FLAG PE kullanıldı (Ek Tablo 1 ve Ek Tablo 2). En iyi performans gösteren beş scFv daha sonra, enfekte VeroE6 Afrika yeşil maymun böbrek epitel hücrelerinden elde edilen süpernatanlar üzerinde ticari Hu-anti-S1 (Tablo 1) ile birlikte çift raportör testinde uygulanmak üzere seçildi.
Protokolün başarısı için bir diğer kritik faktör, mikroküre birleştirme için seçilen prosedürdür. Birleştirme yöntemi verimli olmalı ve aynı zamanda protein bağlanmasında yer alan konformasyonel epitopları veya amino asit kalıntılarını sağlam ve modifiye edilmemiş tutmalıdır. Burada, EDC-NHS reaksiyonu, nötravidi doğrudan mikrokürelere bağlamak için uygulandı, daha önce30 tarif edilen bir protokolü ve rekombinant ACE2'yi birleştirilmiş mikrokürelere bağlamak için bir nötravidin + biyotin sistemini uyarladı. Alternatif birleştirme yöntemleri ve verimlilikleri test edilebilir ve karşılaştırılabilir. Son olarak, floresan etiketli farklı tespit reaktiflerinin (örneğin, anti-FLAG PE (fikoeritrin) ve anti-FLAG Brilliant Violet 421) tahlil duyarlılığını etkileyebilecek farklı MFI seviyelerine neden olabileceği gözlenmiştir.
Sonuç olarak, açıklanan yöntem, çift raportör stratejisi uygulayarak çözelti içindeki bozulmamış viral partiküllerin tespit edilmesine izin verir. Üç yüzey belirleyicisinin paralel olarak analizi, viral partikülleri karakterize etmek ve nihayetinde onları diğer EV'lerden ayırt etmek için daha spesifik bir araç sağlar (örneğin, viral antijenler içermeyen). Bu strateji akım virometrisine bir alternatiftir. Mevcut yaklaşım parçacık boyutlarını ayırt etmese de, renk kodlu mikro küreler kullanan manyetik boncuk stratejileri, yüksek multipleks ve yüksek verimli analiz ile yüzey antijen profili oluşturma ve deneysel tasarımda daha geniş bir yetenek sunmaktadır. Tahlil, yüksek hassasiyet ve sağlamlık gösterir ve vücut sıvılarında veya diğer sıvı matrislerde yüzey antijenlerini açığa çıkaran her türlü hücre dışı vezikül ve diğer herhangi bir biyopartikül türünün analizine genişletilebilir. Bu, viral partiküller üzerindeki çoklu protein epitoplarının multipleks analizinde scFvs'nin tek bir tespit reaktifi olarak kullanılmasının faydasını gösteren bir kavram kanıtı çalışmasıydı. Kantitatif veya klinik amaçlar için kullanılacaklarsa, scFv'lerin spesifik özelliklerini (örneğin, bağlanma afiniteleri, diğer reaktifler ve hedeflerle çapraz reaktivite) belirlemek için gelecekteki çalışmalar gereklidir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
İsveç'teki SciLifeLab'da, burada açıklanan yöntemi geliştirmek ve uygulamak için Affinity Proteomics-Stockholm Scilifelab Birimi ekibine, scFvs ve Fab reaktifleri sağlamak için İnsan Antikor Terapötik Birimi'ne ve klinik örneklerden kaynaklanan SARS-CoV-2 izolatları ile enfekte olmuş VeroE6 hücreleri için Jonas Klingström'e teşekkür ederiz. Yazarlar, araştırma desteği için Luminex Corporation'dan (Austin, TX) MBA yapan Sherry Dunbar'a ve bilimsel ve yazma yardımı için Biyomedikal Yayıncılık Çözümleri Doktoru Matt Silverman MSci'ye (Panama City, FL; mattsilver@yahoo.com) teşekkür eder. Bu çalışma, Knut ve Alice Wallenberg Vakfı ve Yaşam için Bilim Laboratuvarı'ndan (SciLifeLab) sağlanan fonlarla desteklenmiştir (VC2020-0015 Claudia Fredolini ve Francesca Chiodi'ye ve VC-2022-0028 Claudia Fredolini'ye).
Malzemeler
| Name | Company | Catalog Number | Comments |
| ACE2-Biotin | Acro Biosystems (Newark, DE) | AC2-H82E6-25 ug | Conc: 340 µg/mL, LOT#BV35376-203HFI-2128 |
| Anti-Goat IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 705-116-147 | Host species: Donkey |
| Anti-Human IgG R-PE | Life Technologies/Thermo Fisher (Waltham, MA) | H10104 | Conc: 0.15 mg/mL, LOT#2079224, Host species: Goat |
| Anti-Mouse IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 115-116-146 | Host species: Goat |
| Anti-Rabbit IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 111-116-144 | Host species: Goat |
| Biotin | Thermo-Fisher Scientific (Waltham, MA) | 20RUO | 100 mM, pH 10 Conc. 1 mg/mL |
| Blocker Casein in PBS | Thermo-Fisher Scientific (Waltham, MA) | 37528 | LOT#VD301372 |
| Blocker reagent for ELISA (BRE) | Roche (Basel, Switzerland) | 11112589001 | |
| Brilliant Violet 421 anti-DYKDDDDK Tag Antibody (Anti-FLAG) 0.2 mg/ml, rat IgG2a, λ | BioLegend (Amsterdam, The Netherlands) | 637321 | |
| Bovine serum albumin (BSA) | Saveen & Werner (Limhamn, Sweden) | B2000-500 | LOT#04D5865 |
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Proteochem (Hurricane, UT) | C1100-custom (65 mg) | LOT# MK3857 |
| Fetal calf serum (FCS) | Gibco/Thermo Fisher (Waltham, MA) | 10270-106 | |
| Goat anti-ACE2 polyclonal antibody | R&D Systems/Bio-Techne (Minneapolis, MN) | AF933 | Host species: Goat |
| Goat IgG | Bethyl Labs (Montgomery, TX) | P50-200 | LOT#P50-200-6 |
| L-glutamine | Thermo-Fisher Scientific (Waltham, MA) | 25030024 | |
| Low-bind 1.5 mL microfuge tubes | VWR (Radnor, PA) | 525-0133 | |
| MagPlex-C Microspheres | Luminex Corporation (Austin, TX) | MC10XXX-01 | |
| MEM tissue cuture media | Gibco/Thermo Fisher (Waltham, MA) | 21430-020 | |
| Microplate, 96-Well, Polystyrene, Half-area, Clear | Greiner Bio-One (Kremsmünster, Austria) | 675101 | |
| NaHCO3 | Gibco/Thermo Fisher (Waltham, MA) | 25080-060 | |
| Neutravidin | Thermo-Fisher Scientific (Waltham, MA) | 31000 | LOT#UK292857 |
| PBS tablets | Medicago AB (Uppsala, Sweden) | 09-9400-100 | LOT#272320-01 |
| Penicillin/Streptomycin | Gibco/Thermo Fisher (Waltham, MA) | 15140122 | |
| Poly(vinyl alcohol) | Sigma-Aldrich (St. Louis, MO) | 360627 | |
| Polyvinylpyrrolidone | Sigma-Aldrich (St. Louis, MO) | 437190 | |
| ProClin 300 | Sigma-Aldrich (St. Louis, MO) | 48915-U | |
| Rabbit IgG | Bethyl Labs (Montgomery, TX) | P120-301 | LOT#12 |
| scFv-FAb1 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.12 mg/mL. | |
| scFv-FAb2 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc batch1: 0.38 mg/mL. Conc batch2: 0.45 mg/mL | |
| scFv-FAb3 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.34 mg/mL. | |
| scFv-FAb4 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 2.85 mg/mL. | |
| scFv-FAb5 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc:2.7mg/mL. | |
| SARS-CoV-2 infectious particles, Swedish isolate | In-house production | The Public Health Agency of Sweden | |
| SARS-CoV-2 Spike Antibody (Hu-anti-S1) | Novus Biologicals (Centennial, CO) | NBP2-90980 | Monoclonal antibody. Conc: 1 mg/mL. Host: Human. Clone: CR3022. Isotype: IgG1 Kappa. LOT#T201B06 |
| Sodium phosphate monobasic, anhydrous | Sigma-Aldrich (St. Louis, MO) | S3139 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo-Fisher Scientific (Waltham, MA) | 24510 | LOT# XH321563 |
| Tween | Thermo-Fisher Scientific (Waltham, MA) | BP337-50 | LOT#194435 |
| Ultraviolet lamp | Vilber Lourmat GmbH (Eberhardzell, Germany) | VL-215.G | Wavelength = 254 nm; 2 × 15-watt bulbs |
| Vero E6 cells | ATCC (Manassus, VA) | CRL-1586 | |
| xMAP INTELLIFLEX DR-SE (dual-reporter flow instrument) | Luminex Corporation (Austin, TX) | INTELLIFLEX-DRSE-RUO |
Referanslar
- Rey, F. A., Lok, S. M. Common features of enveloped viruses and implications for immunogen design for next-generation vaccines. Cell. 172 (6), 1319-1334 (2018).
- V'kovski, P., Kratzel, A., Steiner, S., Stalder, H., Thiel, V. Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology. 19 (3), 155-170 (2021).
- Burnie, J., et al. Flow virometry quantification of host proteins on the surface of HIV-1 pseudovirus particles. Viruses. 12 (11), 1296 (2020).
- Gentili, M., et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles. Science. 349 (6253), 1232-1236 (2015).
- Modrow, S., Falke, D., Truyen, U., Schätzl, H. . Viruses: Definition, Structure, Classification. In Molecular Virology. , 163-181 (2013).
- Trinh, K. T. L., Do, H. D. K., Lee, N. Y. Recent advances in molecular and immunological diagnostic platform for virus detection: A review. Biosensors. 13 (4), 490 (2023).
- Zamora, J. L. R., Aguilar, H. C. Flow virometry as a tool to study viruses. Methods. 134-135, 87-97 (2018).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Byström, S., et al. Affinity proteomic profiling of plasma for proteins associated to area-based mammographic breast density. Breast Cancer Research. 20 (1), 14 (2018).
- Rudberg, A. -. S., et al. SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden. Nature Communications. 11 (1), 5064 (2020).
- Liu, J., et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. Journal of Clinical Virology. 50 (4), 308-313 (2011).
- Gadsby, N. J., Hardie, A., Claas, E. C. J., Templeton, K. E. Comparison of the Luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. Journal of Clinical Microbiology. 48 (6), 2213-2216 (2010).
- Lorenzen, E., et al. Multiplexed analysis of the secretin-like GPCR-RAMP interactome. Science Advances. 5 (9), (2019).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments: JoVE. (170), e62487 (2021).
- Jackson, C. B., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews Molecular Cell Biology. 23 (1), 3-20 (2022).
- ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. International Standardization Organization Available from: https://nhiso.com/wp-content/uploads/2018/05/ISO-10993-5-2009.pdf (2009)
- Poetz, O., et al. Sequential multiplex analyte capturing for phosphoprotein profiling. Molecular & Cellular Proteomics. 9 (11), 2474-2481 (2010).
- Dunbar, S. A., Vander Zee, C. A., Oliver, K. G., Karem, K. L., Jacobson, J. W. Quantitative, multiplexed detection of bacterial pathogens: DNA and protein applications of the Luminex LabMAP system. Journal of Microbiological Methods. 53 (2), 245-252 (2003).
- Taniuchi, M., et al. Multiplex polymerase chain reaction method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples. Diagnostic Microbiology and Infectious Disease. 71 (4), 386-390 (2011).
- Wu, M., et al. High-throughput Luminex xMAP assay for simultaneous detection of antibodies against rabbit hemorrhagic disease virus, Sendai virus, and rabbit rotavirus. Archives of Virology. 164 (6), 1639-1646 (2019).
- Dias, D., et al. Optimization and validation of a multiplexed Luminex assay to quantify antibodies to neutralizing epitopes on human papillomaviruses 6, 11, 16, and 18. Clinical and Vaccine Immunology. 12 (8), 959-969 (2005).
- Opalka, D., et al. Simultaneous quantitation of antibodies to neutralizing epitopes on virus-like particles for human papillomavirus types 6, 11, 16, and 18 by a multiplexes lumina assay. Clinical and Diagnostic Laboratory Immunology. 10 (1), 108-115 (2003).
- Nolte-'T Hoen, E., Cremer, T., Gallo, R. C., Margolis, L. B. Extracellular vesicles and viruses: Are they close relatives. Proceedings of the National Academy of Sciences. 113 (33), 9155-9161 (2016).
- Ohmichi, T., et al. Quantification of brain-derived extracellular vesicles in plasma as a biomarker to diagnose Parkinson's and related diseases. Parkinsonism & Related Disorders. 61, 82-87 (2019).
- Ter-Ovanesyan, D., et al. Framework for rapid comparison of extracellular vesicle isolation methods. Elife. 10, e70725 (2021).
- Gamage, S. S. T., et al. Microfluidic affinity selection of active SARS-CoV-2 virus particles. Science Advances. 8 (39), (2022).
- Renner, T. M., Tang, V. A., Burger, D., Langlois, M. -. A. Intact viral particle counts measured by flow virometry provide insight into the infectivity and genome packaging efficiency of moloney murine leukemia virus. Journal of Virology. 94 (2), e01600-01619 (2020).
- Niraja, S., et al. A flow virometry process proposed for detection of SARS-CoV-2 and large-scale screening of COVID-19 cases. Future Virology. 15 (8), 525-532 (2020).
- Lippé, R. Flow virometry: A powerful tool to functionally characterize viruses. Journal of Virology. 92 (3), e01765 (2018).
- Drobin, K., Nilsson, P., Schwenk, J. M. Highly multiplexed antibody suspension bead arrays for plasma protein profiling. Methods in Molecular Biology. 1023, 137-145 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır