Method Article
Multiplex Dual-Reporter Strategy를 통한 바이러스 입자의 표면 단백질 에피토프 프로파일링
요약
여기에서는 이중 리포터 유세포 분석 시스템을 사용하여 안지오텐신 변환 효소-2 결합 자기 마이크로스피어에 의해 포착된 온전한 중증 급성 호흡기 증후군 코로나바이러스 2(SARS-CoV-2) 바이러스 입자에서 두 개의 고유한 스파이크 단백질 에피토프를 동시에 검출하는 새로 개발된 다중 형광 면역분석법에 대해 설명합니다.
초록
외피 바이러스의 막 단백질은 표적 세포 수용체에 대한 바이러스 부착, 숙주 세포에 대한 바이러스 입자의 융합, 숙주 바이러스 상호 작용 및 질병 발병과 관련된 많은 생물학적 기능에서 중요한 역할을 합니다. 또한, 바이러스 입자에 있는 바이러스 막 단백질과 숙주 세포 표면에 존재하는 바이러스막 단백질은 항바이러스제 및 백신의 우수한 표적이 되는 것으로 입증되었습니다. 여기에서는 이중 리포터 유세포 분석 시스템을 사용하여 온전한 중증 급성 호흡기 증후군 코로나바이러스 2(SARS-CoV-2) 입자의 표면 단백질을 조사하는 프로토콜에 대해 설명합니다. 이 분석은 멀티플렉스 기술을 활용하여 3개의 독립적인 친화성 반응을 통해 바이러스 입자를 3중 검출합니다. 재조합 인간 안지오텐신 전환 효소-2(ACE2)에 접합된 마그네틱 비드를 사용하여 SARS-CoV-2에 감염된 세포의 상층액에서 바이러스 입자를 포획했습니다. 그런 다음 R-phycoerythrin(PE) 또는 Brilliant Violet 421(BV421)로 표지된 두 개의 검출 시약을 동시에 적용했습니다. 개념 증명으로 SARS-CoV-2 표면 단백질 스파이크(S1)의 다양한 에피토프를 표적으로 하는 항체 단편이 사용되었습니다. 3개의 독립적인 친화성 반응에 의한 바이러스 입자 검출은 강력한 특이성을 제공하고 온전한 바이러스 입자의 포획을 확인합니다. SARS-CoV-2 감염 세포 상층액의 용량 의존성 곡선은 복제 계수 분산(평균/SD) ˂14%로 생성되었습니다. 두 채널 모두에서 우수한 분석 성능을 통해 두 개의 바이러스 표면 표적 단백질 에피토프를 동시에 검출할 수 있음을 확인했습니다. 여기에 설명된 프로토콜은 (i) 외피 바이러스에 발현된 표면 단백질의 고-다중, 고-처리량 프로파일링; ii) 활성 온전한 바이러스 입자의 검출; (iii) 바이러스 항원의 표면 에피토프에 대한 항체 및 항바이러스 약물의 특이성 및 친화도 평가. 이 응용 분야는 잠재적으로 모든 유형의 세포외 소포체 및 생체 입자로 확장될 수 있으며, 체액 또는 기타 액체 매트릭스에서 표면 항원을 노출시킬 수 있습니다.
서문
인플루엔자, HIV, 인간 거대세포바이러스 및 SARS-CoV 균주와 같은 가장 흔한 병원성 바이러스는 외피 바이러스입니다. 외피 바이러스에 의한 세포 감염은 바이러스 세포막과 숙주 세포막의 융합을 필요로 하며, 그 결과 바이러스 게놈이 세포질로 방출됩니다. 그런 다음 바이러스 RNA는 새로운 바이러스 입자 1,2에 포장되기 전에 복제됩니다. 이러한 과정에서 바이러스 단백질뿐만 아니라 숙주 막 단백질도 외피에 통합되어 새로운 바이러스 입자의 필수적인 부분이 될 수 있습니다. 바이러스 외피에 통합된 숙주 세포막 단백질은 바이러스가 새로운 숙주 세포로 진입하는 것을 촉진하여 세포간 상호 작용, 귀환 및 면역 체계 탈출 메커니즘을 이용할 수 있습니다 3,4.
바이러스 관련 단백질 조사의 중요성에도 불구하고, 현재바이러스 분석5에 사용할 수 있는 대부분의 기법은 바이러스 표면 항원의 고처리량 및 고다중 특성 분석을 지원하지 않습니다. 또한 개별 바이러스 입자를 검출하거나 감염성이 없는 온전한 바이러스 입자, 비감염성 RNA, 바이러스 단백질 및 다른 항원을 발현하는 바이러스 하위 집단을 구별할 수 없습니다. 최근에는 유세포 분석법이 수정되어 바이러스 입자 분석을 위한 새로운 방법, 즉 유동 바이러스 측정법으로 채택되었습니다. Flow virometry를 사용하면 단일 바이러스 입자와 그 표면 항원을 조사할 수 있습니다. 그러나 낮은 처리량, 낮은 멀티플렉스 기능, 복잡한 실험 설정 및 데이터 분석, 소형 바이러스 입자의 제한된 검출 가능성 등의 한계는 여전히남아 있습니다 6,7.
단백질 및 핵산의 마이크로스피어 기반 다중 정량화는 체액 내 단백질 정량화, 단백질-단백질 상호 작용 연구 및 바이러스 감염 진단에 이르기까지 다양한 응용 분야에서 잘 알려진 기술입니다 8,9,10,11,12,13 . 최근에 도입된 유동 분석 기기는 이중 리포터 채널을 특징으로 하여 동일한 반응 웰에서 두 개의 형광 리포터 분자를 측정할 수 있습니다. 이 새로운 기능은 다양한 면역글로불린 동형(14)의 병렬 프로파일링에 특히 유용한 것으로 나타났습니다. 여기에서는 이중 리포터 시스템을 사용하여 여러 표면 항원을 병렬로 표적화하여 손상되지 않은 바이러스 입자를 검출하는 방법을 설명합니다.
개념 증명으로 이 보고서는 SARS-CoV-2 바이러스 입자에 대한 삼중 검출 시스템 개발에 대해 자세히 설명합니다. SARS-CoV-2는 4개의 주요 단백질로 구성되며, 그 중 하나는 2개의 소단위로 구성된 스파이크 단백질(S)입니다. 첫 번째 소단위체인 S1은 인간 세포막에서 발현되는 ACE2에 대한 1차 결합을 만듭니다. 두 번째 소단위체인 S2는 융합 펩타이드에 의한 표적 세포로의 진입을 용이하게 하여 비리온이15를 통해 들어갈 수 있는 표적 세포막에 기공을 생성합니다. SARS-CoV-2의 나머지 세 가지 구성 요소는 뉴클레오캡시드(N), 막 단백질(M) 및 외피 단백질(E)입니다. 뉴클레오캡시드는 RNA와 함께 리보핵단백질 구조를 형성하여 바이러스 게놈의 패키징을 담당하며, 막과 외피 단백질은 바이러스 조립에서 중심적인 역할을 합니다.
여기에 설명된 분석은 SARS-CoV-2의 외피 표면에 발현된 S1 소단위체의 3개의 독립적인 에피토프를 표적으로 합니다. SARS-CoV-2에 감염된 세포 상층액과 감염되지 않은 세포 상층액 모두의 연속 희석액이 사용됩니다. 바이러스 입자는 바이러스의 S1 소단위체에 결합하는 ACE2 복합 미세구를 통해 포획됩니다. 그런 다음 표면 바이러스 S 단백질은 자체 개발한 FLAG 태그 scFv와 함께 상업적으로 이용 가능한 태그가 지정된 면역글로불린 단일 사슬 변수 단편(scFv) 및 인간 단클론 항-S1 항체(Hu-anti-S1)와 병렬로 검출됩니다. Hu-anti-S1은 주황색 R-phycoerythrin(PE) 접합 항인간 IgG-Fc 2차 항체가 있는 이중 리포터 시스템의 첫 번째 채널(RP1)에 의해 검출되고, scFv는 파란색 Brilliant Violet 421(BV421) 접합 2차 항-FLAG 항체가 있는 두 번째 채널(RP2)에 의해 검출됩니다. 바이러스 입자 분석은 그림 1에 나와 있습니다.
프로토콜
1. neutravidin과 control antibody의 자기 미세구에 대한 접합
참고: 재료 표 에 나열된 다양한 형광 라벨이 있는 형광 염색 마그네틱 비드(마그네타이트가 내장된 6.5μm 직경의 폴리스티렌 마이크로스피어)는 다음과 같은 비드 접합체 및 대조군을 생성하는 데 사용됩니다: (1) 뉴트라비딘 링커와 결합된 비드에 결합된 비오틴화 재조합 인간 ACE2; (2) 뉴트라비딘 링커(neutravidin linker)와 결합된 비드(bead)에 결합된 비오틴; (3) 비드에 직접 결합 된 염소 IgG; (4) 공액되지 않은 비드. 비드에 결합할 단백질에는 아지드화나트륨, 소 혈청 알부민(BSA), 글리신, 트리스(하이드록시메틸)아미노메탄(트리스), 글리세롤 또는 아민 함유 첨가제가 없어야 합니다. 활성화 완충액은 0.1M 인산나트륨 일염기성, 무수(NaH2PO4), pH 6입니다. pH 5의 2-모르폴리노에탄술폰산(MES; 50mM) 완충액은 접합체 희석에 사용됩니다. 세척 버퍼는 PBS-T(1x PBS[인산염 완충 식염수], pH 7.4 + 0.05%(v/v) Tween-20)입니다. 저장 버퍼는 ELISA용 차단 시약 2.7mg/mL(BRE) + 0.1% 항생제(여기서는 ProClin 300)입니다.
- 냉장고에서 Sulfo-N-hydroxysulfosuccinimide(NHS) 분말을 제거하고 냉동실에서 65mg의 사전 분취된 1-에틸-3-[3-디메틸아미노프로필]카르보디이미드 염산염(EDC)을 제거하고 30분 동안 실온(RT, 18-22°C)에 둡니다. 이 단계에서 NHS와 EDC를 모두 실리카 비드가 들어 있는 봉투에 넣어 대기 수분으로 인한 가수분해를 방지합니다.
- 활성화 및 결합을 위해 마이크로스피어를 준비합니다.
알림: 마이크로스피어 내의 형광 염료는 빛에 민감하며 비드는 사용하지 않을 때 어두운 곳과 냉장고 온도(4-8°C)에서 보관해야 합니다.- 제품 정보 시트에 따라 4개의 다른 색상 ID 코딩 마이크로스피어(12.5 x 106/mL)(재료 표)를 짧게 소용돌이, 초음파 처리 또는 회전(15-30rpm에서 15분)하여 재현탁합니다.
- 각 비드 현탁액 40μL(5 x 105 마이크로스피어)를 half-well, flat-bottom, 96-well microtiter plate(재료 표)의 할당된 웰로 옮깁니다.
- 마그네틱 비즈를 씻으십시오.
알림: 세척 단계는 수동으로 또는 자동 플레이트 세척기를 사용하여 수행할 수 있습니다.- 비드에 80 μL/well Activation Buffer를 추가하고 비드를 마그네틱 플레이트 분리기에 30초 동안 고정시킵니다. 비드가 자기 플레이트 분리기에 고정되어 있는 동안 마이크로스피어에서 상층액을 흡입합니다.
- 마그네틱 플레이트 분리기에서 마이크로타이터 플레이트를 제거하고 50μL의 활성화 버퍼에 비드를 재현탁합니다.
- Sulfo-NHS 및 EDC로 비드를 활성화합니다.
- 1.5mL 미세분리 튜브의 활성화 완충액에서 50mg/mL의 Sulfo-NHS 작업 용액을 준비합니다. 재고 NHS 분말을 습기로부터 보호하여 냉장고(4-8 °C)에 다시 넣습니다.
- 1.5mL 미세분리 튜브의 활성화 완충액에서 50mg/mL의 EDC 작업 용액을 준비합니다. 미리 만들어진 EDC 분말 65mg 분취액을 활성화 완충액 1.3mL에 녹입니다.
알림: Sulfo-NHS 및 EDC는 용해되면 가수분해를 시작하고 활성을 잃습니다. NHS 및 EDC가 비드에 추가될 때까지 커플링 절차를 중단하지 마십시오. 나중에 사용하기 위해 용해된 NHS 또는 EDC 솔루션을 저장하지 마십시오. - 20% Sulfo-NHS 스톡 용액(50mg/mL), 20% EDC 스톡 용액(50mg/mL) 및 60% 활성화 완충액을 부피 측정적으로 결합하여 비드 활성화를 위한 활성화 용액을 준비합니다. 각 비드 활성화 반응(5 × 105 비드/반응 사용)에 대해 50 μL의 활성화 용액이 필요하며, 피펫팅 손실을 수용할 수 있는 충분한 추가 부피가 필요합니다.
- 세척된 비드가 들어 있는 각 웰에 50 μL의 완전한 활성화 용액을 추가합니다. 활성화 완충액에 이미 존재하는 50μL 비드 현탁액 부피를 사용하면 웰당 Sulfo-NHS의 최종 농도는 5mg/mL이고 EDC의 최종 농도도 5mg/mL입니다.
- 일회용 접착 플라스틱 또는 호일 플레이트 씰러로 마이크로스피어 반응 플레이트를 밀봉하고 어두운 곳에서 실온(18-22°C)에서 궤도 셰이커(650rpm)에서 20분 동안 배양합니다.
- 비드에서 여분의 활성화 용액을 씻어냅니다.
- 마이크로타이터 플레이트를 233× g 에서 1분 동안 원심분리합니다.
- 활성화된 비드를 마그네틱 플레이트 분리기에 30초 동안 고정시킵니다. 플레이트 실러를 제거하고 마이크로타이터 플레이트가 자기 분리기에 여전히 위치하도록 하여 자석에 고정된 비드에서 상층액을 흡입합니다.
- 자기 분리기에서 마이크로타이터 플레이트를 제거하고 각 웰에 100μL의 MES 버퍼를 추가합니다.
- 1.4.2-1.4.3 단계를 한 번 더 반복하여 총 두 번 세탁합니다.
- 뉴트라비딘과 염소 IgG(대조군)를 적절한 비드 세트에 결합합니다. 다음과 같이 100 μL/반응 및 피펫팅 손실을 수용할 수 있는 충분한 추가 계획을 통해 충분한 중성전환 및 염소 IgG 작업 용액을 준비합니다.
참고: 뉴트라비딘 단백질 분말은 초순수로 재구성한 다음 보관/사용을 위해 분취하기 전에 PBS가 있는 1mg/mL 원액으로 희석합니다(뉴트라비딘 단백질은 PBS에 직접 용해되지 않지만 ~10mg/mL까지 물에 용해됨).- 1.5mL 저단백질 결합 미세분리 튜브의 MES 버퍼에서 125μg/mL 농도의 뉴트라비딘 작업 용액을 준비합니다.
- MES 완충액에서 17.5μg/mL 농도의 염소 IgG 대조 항체 작업 용액을 준비합니다.
- 활성 비드가 들어 있는 마이크로타이터 플레이트를 준비합니다. 마그네틱 플레이트 분리기에 비드를 30초 동안 고정합니다. 마이크로타이터 플레이트를 자기 분리기에 계속 배치한 상태에서 자석이 고정된 비드에서 상층액을 흡입합니다.
- 100μL의 뉴트라비딘 작업 용액(125μg/mL)을 비드가 포함된 적절한 웰(뉴트라비딘-비오틴 및 뉴트라비딘-ACE2 커플링용)에 추가합니다.
- 100μL의 염소 IgG 작업 용액(17.5μg/mL)을 염소 IgG 전용 대조군으로 할당된 비드가 포함된 웰에 추가합니다.
- 100 μL의 MES Buffer를 control Unconjugated Beads로 할당된 웰에 추가합니다.
- 마이크로타이터 플레이트를 밀봉하고 어두운 곳에서 RT(18-22°C)의 궤도 셰이커(650rpm)에서 2시간 동안 배양합니다. 비드가 현탁액에 남아 있는지 확인하기 위해 배양 1시간 후에 플레이트를 잠시 소용돌이칩니다.
- PBS-T로 비즈를 세척하십시오.
- 마이크로타이터 플레이트를 233× g 에서 1분 동안 원심분리합니다.
- 결합된 비드를 마그네틱 플레이트 분리기에 30초 동안 고정합니다. 마이크로타이터 플레이트를 자기 분리기에 계속 배치한 상태에서 자석이 고정된 비드에서 상층액을 흡입합니다.
- 자기 분리기에서 마이크로타이터 플레이트를 제거합니다.
- 비드가 포함된 각 웰에 100μL의 PBS-T를 추가합니다.
- 세탁 단계 1.6.2-1.6.4를 한 번 반복하여 PBS-T로 총 두 번 세탁합니다.
- 보관을 위해 복합 비드를 준비합니다.
- 결합된 비드를 마그네틱 플레이트 분리기에 30초 동안 고정합니다. 마이크로타이터 플레이트를 자기 분리기에 계속 배치한 상태에서 자석이 고정된 비드에서 상층액을 흡입합니다. 자기 분리기에서 마이크로타이터 플레이트를 제거합니다.
- 각 마이크로스피어 ID에 50μL의 저장 버퍼를 추가하여 남아 있는 비드 활성을 억제합니다.
- 마이크로타이터 플레이트를 냉장고 온도(4-8°C)에서 어두운 밤(16-22시간)에 배양합니다.
- 비접합 및 goat-IgG 접합 비드 현탁액(50 μL)을 적절하게 라벨링된 1.5 mL 저단백질 결합 마이크로퓨지 튜브로 옮기고 웰의 100-μL 저장 버퍼 헹굼 2회를 결합하여 비드 회수율을 극대화합니다.
참고: 비공액 및 염소 IgG 복합 비드는 모두 250 μL(즉, 2 × 103 beads/μL)의 최종 부피에서 5 × 105 번호가 매겨집니다. 사용할 때까지 마이크로분리 튜브를 냉장고 온도(4-8 °C)에 보관하십시오.
- 비오틴화된 ACE2와 비오틴을 뉴트라비딘 접합 비드에 결합합니다.
- 10mM PBS의 18μg/mL ACE2에서 재조합 인간 비오틴화 ACE2 작업 용액을 준비합니다. 반응당 100μL가 필요합니다. 10mM PBS에서 2.4mg/mL 비오틴으로 비오틴 작업 용액을 준비합니다. 반응당 100μL가 필요합니다.
- 뉴트라비딘 복합 마이크로스피어를 포함하는 마이크로타이터 플레이트를 준비합니다.
- 마그네틱 플레이트 분리기에 마이크로스피어를 30초 동안 고정시킵니다. 마이크로타이터 플레이트를 자기 분리기에 계속 배치한 상태에서 플레이트 실러를 제거하고 자석으로 고정된 마이크로스피어에서 상층액을 흡입합니다.
- 자기 분리기에서 마이크로타이터 플레이트를 제거하고 50μL의 10mM PBS/웰을 추가합니다.
- 1.8.2.1-1.8.2.2단계를 한 번 반복합니다.
- 100μL의 비오틴화-ACE2 작업 용액을 뉴트라비딘 복합 마이크로스피어가 포함된 적절한 웰에 추가합니다. 100μL의 비오틴 작업 용액을 뉴트라비딘 복합 마이크로스피어가 포함된 적절한 웰에 추가합니다.
- 마이크로타이터 플레이트를 밀봉하고 어두운 곳에서 RT(18-22°C)의 궤도 셰이커(650rpm)에서 1시간 동안 배양합니다.
- 1.6.1-1.6.5 단계에 설명된 대로 마이크로스피어를 세척합니다.
- 1.7.1-1.7.4단계에서 설명한 대로 ACE2 및 비오틴 복합 마이크로스피어를 준비하고 저장합니다.
참고: 비오틴화 ACE2 및 비오틴 복합 비드는 모두 250 μL(즉, 2 × 103 비드/μL)의 최종 부피에서 5 × 105로 번호가 매겨집니다.
2. 활용 시험
- 섹션 1에서 생성된 4가지 유형의 마이크로스피어(즉, 뉴트라비딘 복합 비오틴화 ACE2, 뉴트라비딘 접합 비오틴, 염소 IgG 접합 및 비접합)를 모두 결합하여 비드 혼합물을 준비합니다.
참고: 스톡 마이크로스피어는 2 × 103 beads/μL에서 저장되었으며 작업 비드 혼합물의 최종 비드 농도가 각 set/μL의 40 beads가 되도록 결합되었습니다.- 테스트에 필요한 작업 비드 혼합물의 부피(5 μL/reaction)를 계산하여 추가 부피가 피펫팅 손실을 수용할 수 있도록 합니다. 각 튜브를 간략하게 소용돌이치고 각 비드 현탁액의 동일한 계산된 부피를 새로운 저단백질 결합 미세분리 튜브에 결합합니다. 비드 농도는 이제 각 세트/μL당 400개의 비드입니다.
- 결합된 비드 현탁액을 Storage Buffer(각 세트/μL 작업 농도 40)로 추가로 10배 희석하여 작업 비드 혼합물을 생성합니다.
참고: 먼저 소량의 작업 비드 혼합물을 만들어 각 ID에 대한 마이크로스피어/μL의 수를 추정합니다.
- 염소 anti-ACE2 항체로 미세구를 배양합니다.
- 5 μL의 작업 비드 혼합물을 평평한 바닥, 절반 웰, 96웰 마이크로타이터 플레이트의 3웰에 피펫팅합니다.
- 50μL의 염소 anti-ACE2(PBS-T, Table of Materials에 희석된 0.4μg/mL)를 마이크로타이터 플레이트의 비드가 포함된 3개의 웰에 각각 추가합니다. 마이크로타이터 플레이트, 와류를 밀봉하고 RT(18-22°C)에서 오비탈 셰이커(650rpm)에서 어둠 속에서 1시간 동안 배양합니다.
- 233 × g 에서 1분 동안 마이크로타이터 플레이트를 펄스하고 1.6.2-1.6.4에 설명된 대로 PBS-T로 마이크로스피어를 세 번 세척합니다.
- 검출 항체가 있는 마이크로스피어를 배양합니다.
- 5 μL의 작업 비드 혼합물을 마이크로타이터 플레이트의 6개의 새 웰에 피펫팅합니다.
- PBS-T를 희석제로 사용하여 항염소 IgG PE, 항 마우스 IgG PE 및 항 토끼 IgG PE와 같은 항 염소 IgG PE를 각각 1μg/mL의 1.5mL 튜브에 준비합니다.
- 검출 혼합물 50μL를 각각 3개의 웰에 첨가하고 항염소 IgG를 2.2단계의 항-ACE2와 동일한 웰에 첨가합니다.
- RT(650-18°C)에서 궤도 셰이커(18-22rpm)에서 30분 동안 밀봉, 소용돌이 및 배양합니다.
- 233× g 에서 1분 동안 플레이트를 펄스하고 1.6.2-1.6.4에 설명된 대로 PBS-T로 마이크로스피어를 세 번 세척합니다.
- 100 μL의 PBS-T를 추가하고 다음 설정으로 듀얼 리포터 유량 분석 기기에서 실행합니다.
모드 : 듀얼 리포터; 시간 제한: 45초; DD-게이팅: 7500-17500; 최소 마이크로스피어 수: 100 마이크로스피어/세트(최저 QC 컷오프: 35 마이크로스피어/세트).
3. SARS-CoV-2 감염 세포 상층액의 생산
SARS-CoV-2 바이러스는 숙주 Vero E6 세포(원숭이 신장 상피 세포주; ATCC; 재료 목차). Vero E6 세포는 5% CO2 및 95% 상대 습도 분위기에서 37°C의 MEM(Modified Eagles Medium)에서 배양됩니다. MEM의 각 리터에는 L-글루타민(200mM) 10mL, NaHCO3 38mL(7.5%), 페니실린/스트렙토마이신 용액 5mL, 소 태아 혈청(FCS) 50mL가 보충됩니다. 재료 표.
주의: SARS-CoV-2를 취급할 때는 적절한 생물안전 절차와 장비를 사용하십시오.
- Vero E6 세포는 두 개의 150cm2 조직 배양 플라스크에서 합류하도록 성장합니다. 한 플라스크를 SARS-CoV-2 바이러스에 감염시키고 다른 가짜 감염을 대조군으로 사용합니다.
- 약 100,000개의 야생형(WT) SARS-CoV-2 감염 입자를 5mL의 Eagles MEM 배지와 혼합합니다.
- 150cm2 플라스크 1개에서 배지를 흡입하고 55mL의 완전한 MEM을 추가하여 감염되지 않은 대조군 상층액을 생성합니다. 다른 150cm2 플라스크에서 배지를 흡입하고 바이러스 혼합물을 세포에 추가합니다. 37°C에서 1시간 동안 세포를 배양합니다. 15분마다 플라스크를 가볍게 흔들어 바이러스를 퍼뜨립니다.
- SARS-CoV-2가 첨가된 플라스크에 50mL의 완전한 MEM 배지를 추가하고 세포병증 효과가 관찰될 때까지 세포를 배양하여 24시간마다 플라스크를 육안으로 평가합니다.
참고: 감염 후 세포병증이 발생하려면 약 3-4일이 소요됩니다. Vero E6 세포 단층 구조에 대한 세포병증 효과(예: 세포 수축, 생성, 라운딩, 탈접착, 세포질 내 입도의 손실, 명백한 용해)는 시험관 내 세포독성 검사에 대한 국제 표준화 기구 지침16에 따라 도립광 현미경을 사용하여 세포를 관찰하여 정성적으로 평가됩니다. - 두 플라스크에서 세포 상층액을 수집하고 253× g 에서 6분 동안 회전시켜 세포 파편을 침전시킵니다.
- 세포 상층액의 UV 비활성화 SARS-CoV-2 바이러스
- 웰당 0.5mL의 상층액을 24웰 마이크로타이터 플레이트에서 12웰까지 피펫팅합니다. 뚜껑 없이 마이크로타이터 플레이트를 적절한 자외선 램프 아래에서 30초 동안 UV로 조사합니다(재료표).
참고: 세포 상층액의 바이러스 불활성화는 Vero E6 세포 배양에서 바이러스 증식을 시도하여 확인해야 합니다.
- 웰당 0.5mL의 상층액을 24웰 마이크로타이터 플레이트에서 12웰까지 피펫팅합니다. 뚜껑 없이 마이크로타이터 플레이트를 적절한 자외선 램프 아래에서 30초 동안 UV로 조사합니다(재료표).
- 세포 상층액을 1.5mL 튜브에 분취하고 나중에 사용할 때까지 -20°C에서 보관합니다.
알림: 셀 상층액은 -80 °C에서 보관할 수 있습니다.
4. 분석: 세포 상층액에서 SARS-CoV-2 바이러스 입자 검출
- 0.1% 카제인, 0.5% 폴리비닐 알코올, 0.8% 폴리비닐피롤리돈 및 1% BSA(모두 w/v)(pH 7)를 혼합하여 분석 완충액을 준비합니다. 분석 완충액에 10% 토끼 IgG를 준비하여 시료 희석 완충액을 준비합니다.
- 테스트에 필요한 작업 비드 혼합물(단계 2.1)의 부피(5μL/반응)를 계산하고 준비하여 피펫팅 손실을 수용할 수 있는 초과 부피를 허용합니다.
- 상층액 희석 시리즈를 준비합니다. 필요한 상층액 부피를 계산합니다. 5개의 scFv 각각에 대해 3개의 웰에서 각 희석점을 분석하여 희석점 및 시료 유형당 15개의 웰을 생성합니다. 각 웰에 45μL의 희석된 상층액을 사용하여 총 675μL가 필요합니다. SARS-CoV-2 및 대조군 상층액 각각에 대해 단일 1.5mL 미세분리 튜브로 충분합니다.
- SARS-CoV-2 상층액을 해동하고 대조군 상층액을 4°C에서 최소 1시간 동안 해동합니다. 상층액과 희석액을 사용할 때까지 차갑게(2-8°C) 보관하십시오. SARS-CoV-2 및 대조군 상층액에 대해 각각 8개의 1.5mL 미세분리 튜브를 라벨링하고 배열합니다.
참고: 가장 높은 농도의 분석은 1:1(2배) 상층액 희석이며, 이로부터 Sample Dilution Buffer를 사용하여 일련의 1:2(3배) 희석을 수행하며 가장 높은 희석은 1:1458 희석입니다. Sample Dilution Buffer가 포함된 블랭크는 상층액이 없는 대조군으로만 사용됩니다. 따라서 각 상층액 유형(SARS-CoV-2 또는 대조군)의 테스트된 희석액은 완충액 전용 대조군으로 2, 6, 18, 54, 162, 486 및 1458배가 됩니다. - Sample Dilution Buffer를 라벨링된 microfuge 튜브에 추가합니다. 1:1(2겹) 희석 튜브에는 600μL의 완충액이 필요하고 나머지 튜브에는 800μL의 완충액이 필요합니다. 적절하게 라벨링된 튜브에서 상층액 600μL와 Sample Dilution Buffer 600μL를 결합하여 각 상층액의 가장 높은 희석액(1:1, 2배)을 생성한 다음 튜브를 잠시 소용돌이쳐 혼합합니다.
- 400μL의 1:1(2배) 희석된 상층액을 다음 희석 튜브(즉, 6배 희석)로 순차적으로 옮기고, 가장 낮은 희석액(1458배)이 생성될 때까지 3배 희석을 계속합니다. 다음 희석을 진행하기 전에 희석된 각 상층액을 간략하게 소용돌이칩니다.
- SARS-CoV-2 상층액을 해동하고 대조군 상층액을 4°C에서 최소 1시간 동안 해동합니다. 상층액과 희석액을 사용할 때까지 차갑게(2-8°C) 보관하십시오. SARS-CoV-2 및 대조군 상층액에 대해 각각 8개의 1.5mL 미세분리 튜브를 라벨링하고 배열합니다.
- 상층액으로 미세구를 배양합니다.
- 사전 준비된 작업 비드 혼합물을 30초 동안 소용돌이치게 하여 미세구를 현탁시키고 바닥이 평평한 384웰 마이크로타이터 플레이트의 할당된 각 웰에 5μL의 비드 혼합물을 추가합니다.
참고: 96웰 플레이트도 사용할 수 있습니다. - 준비된 상층액 희석액 45μL를 384웰 플레이트에 마이크로스피어가 포함된 할당된 웰에 추가합니다. 플레이트를 밀봉하고 어두운 곳에서 RT(18-22°C)에서 오비탈 셰이커(650rpm)에서 밤(16-22시간) 배양합니다.
- 사전 준비된 작업 비드 혼합물을 30초 동안 소용돌이치게 하여 미세구를 현탁시키고 바닥이 평평한 384웰 마이크로타이터 플레이트의 할당된 각 웰에 5μL의 비드 혼합물을 추가합니다.
- 구슬에서 과도한 상청액을 씻어냅니다.
- 오비탈 셰이커에서 마이크로타이터 플레이트를 제거하고 플레이트 실러를 제거합니다. 플레이트를 931 x g 에서 1분 동안 원심분리합니다.
- microtiter 플레이트를 자기 플레이트 분리기에 30초 동안 놓아 비드를 고정합니다. 마이크로타이터 플레이트를 자기 분리기에 계속 배치한 상태에서 플레이트 밀봉기를 제거하고 자석으로 고정된 비드에서 상층액을 흡입합니다.
- 자기 분리기에서 마이크로타이터 플레이트를 제거합니다.
- 비드가 포함된 각 웰에 60μL의 PBS-T를 추가합니다.
- 세탁 단계 4.5.2-4.5.4를 두 번 반복하여 총 3번의 PBS-T 세탁을 합니다.
- 다양한 검출 혼합물을 별도의 1.5mL 튜브에 준비합니다. 각 검출 혼합물은 SARS-CoV-2 입자의 스파이크 단백질을 표적으로 하는 상용 인간 단클론 항-S1(Hu-anti-S1) 항체(1μg/mL)와 SARS-CoV-2 입자의 스파이크 단백질을 표적으로 하는 5개의 서로 다른 FLAG 태그 scFv(1μg/mL) 중 하나(보충 파일 1, 보충 표 1 및 보충 표 2) 중 하나로 구성되며, 이는 분석 완충액(단계 4.1)에 희석되어 총 5개의 서로 다른 검출 혼합물을 생성합니다.
- 4.5.2-4.5.3단계를 반복합니다. 세척된 마이크로스피어를 적절한 scFv 특이적 Spike Detection Mix의 50μL/웰에 재현탁시킵니다. 마이크로타이터 플레이트를 밀봉하고 어두운 곳에서 RT(18-22°C)의 궤도 셰이커(650rpm)에서 1시간 동안 배양합니다.
- 마이크로타이터 플레이트를 931× g 에서 1분 동안 원심분리합니다. 비드에서 과도한 Spike Detection Reagent를 세척하십시오. 4.5.2-4.5.5단계에 따라 60μL의 PBS-T로 3단계 세척을 수행합니다.
- 형광 검출 항체 혼합물로 마이크로스피어를 배양합니다.
- 분석 완충액에 희석한 BV421 복합 항-FLAG 항체와 함께 상업적으로 이용 가능한 PE 접합 항인간 IgG로 구성된 형광 용액 혼합물을 각각 0.2μg/mL 및 1μg/mL의 작동 농도로 준비합니다. 반응당 50μL의 형광 검출 시약이 필요합니다.
- 4.5.2-4.5.3단계를 반복합니다. 형광 용액 혼합물의 50 μL/웰에 마이크로스피어를 재현탁시킵니다. 마이크로타이터 플레이트를 밀봉하고 어두운 곳에서 RT(18-22 °C)의 궤도 셰이커(650 rpm)에서 30분 동안 배양합니다.
- 931 × g 에서 1분 동안 마이크로타이터 플레이트를 스핀다운합니다. 마이크로스피어에서 과도한 Fluorescent Solution Mix를 세척합니다. 4.5.2-4.5.5단계에 따라 60μL의 PBS-T로 3단계 세척을 수행합니다.
- 마지막 세척 단계에서 60μL의 PBS-T에 마이크로스피어를 현탁합니다. 2.6단계에서 설명한 설정으로 이중 리포터 흐름 분석 시스템에서 플레이트를 분석합니다.
결과
활용 테스트
접합 테스트는 goat-IgG와 neutravidin-biotinylated ACE2가 미세구에 성공적으로 접합되었음을 보여주었습니다. 분석 검출 특이성은 다양한 동물 종에서 생성된 PE 표지 2차 항체가 있는 ACE2 복합 마이크로구를 조사하여 확인되었습니다(그림 2). 서로 다른 검출 항체 간의 교차 반응은 관찰되지 않았습니다. 염소 항-ACE2 + 항-염소 IgG PE로 비드 혼합물을 조사했을 때, ACE2 및 염소 IgG 접합 마이크로스피어 모두에 대해 배경 위의 중간 형광 강도(MFI, 임의 단위) 값이 검출되었지만, 비접합 마이크로스피어(베어) 또는 비오틴 코팅 마이크로스피어에 대해서는 검출되지 않았습니다. 항-마우스 IgG PE 및 항-토끼 IgG PE를 위양성 신호를 확인하기 위한 음성 대조군으로 사용하였다. 마이크로스피어로 배양할 때 무시할 수 있는 형광 신호가 생성되었으며, 이는 ACE2 및 염소 IgG에 대한 양성 신호가 특이적임을 나타냅니다.
세포 상층액에서 바이러스 입자 검출 가능성
재조합 인간 ACE2에 결합된 마그네틱 비드를 사용하여 감염 및 대조(바이러스 없음) VeroE6 세포 배양 상층액에서 SARS-CoV-2 바이러스 입자를 포획한 다음 단클론 항체와 5개의 별개의 scFv 중 하나를 사용하여 2개의 별개의 바이러스 스파이크 영역을 동시에 조사했습니다. SARS-Cov-2 감염 세포 상층액의 희석액에서 농도 의존적 신호가 두 리포터 채널(RP1 및 RP2)에서 관찰되었으며(그림 3), 이는 상용 Hu-anti-S1 항체와 다른 scFv 모두 ACE2 접합 미세구에 결합된 바이러스 입자를 검출했음을 나타냅니다. 5개의 scFv 중 3개의 바이러스는 1:18(scFv2, scFv3, scFv5)까지 희석하여 검출할 수 있습니다. 나머지 2개의 scFv(scFv7 및 scFv9)의 경우 1:6 희석까지 검출할 수 있습니다. 이는 대상에 대한 다른 친화력에 기인할 수 있습니다. 그림 3 과 표 1에서 볼 수 있듯이 scFv3는 가장 높은 MFI 강도를 제공하고 각각 scFv5, scFv2, scFv7 및 scFv9가 그 뒤를 잇습니다.
전 세계적으로 scFvs 감지는 Hu-anti-S1에 비해 MFI가 낮습니다. 이는 친화도가 낮다는 것을 나타낼 수 있지만 다른 형광 염료(PE 및 BV421)로 라벨링하기 때문에 인공물일 수도 있습니다. scFv7 및 scFv9에서 볼 수 있는 또 다른 추세는 다른 세 가지 컨피그레이션에 비해 RP1 채널(안티스파이크)에 대한 MFI 값이 약간 낮다는 것입니다. 이는 scFv가 ACE2-Hu-anti-S1 상호 작용과 교차 반응하거나 다른 방식으로 간섭하고 있음을 나타낼 수 있으며, 이는 RP2 채널의 더 낮은 신호를 설명할 수도 있습니다. RP1 또는 RP2 채널에서 감염되지 않은 Vero E6 세포의 상층액에서 바이러스 입자가 검출되지 않았습니다.
뉴트라비딘-비오틴 복합 미세구, 염소-IgG 미세구 및 비접합 미세구는 음성 대조군 비드로 사용됩니다. 바이러스 입자는 ACE2에 결합된 자기 미세구로 포획하고 RP1 리포터 채널에서 상용 인간 안티 스파이크로 테스트하고 RP2 리포터 채널에서 다른 scFv로 테스트했습니다(scFv는 각 패널의 왼쪽 상단에 표시됨). 감염된 샘플과 감염되지 않은 샘플에서 바이러스 입자가 검출되지 않았습니다.
분석 정밀도 및 견고성
분석 정밀도를 평가하기 위해 모든 조건을 삼중으로 실행했습니다. ACE2 마이크로스피어에 대한 분산 계수(CV)는 각 희석 지점에 대해 계산되었습니다. 분석을 위해 계산된 모든 CV는 15% 미만이었으며, 여기서 가장 높게 측정된 CV는 13%였고 가장 낮은 CV는 1%였습니다(표 2). RP1 채널의 밀도 플롯(그림 4)에서 볼 수 있듯이 상용 Hu-anti-S1의 PE 검출은 주로 3%의 CV에 집중되어 더 높은 정밀도를 보여줍니다. RP2 채널, scFV의 BV 감지는 더 높은 CV를 보여줍니다. 그러나 표 2 에서 볼 수 있듯이 CV의 더 높은 범위는 블랭크와 같은 바이러스 입자의 농도가 낮은 샘플에 의해 주도됩니다. 프로토콜의 견고성을 테스트하기 위해 서로 다른 작업자가 서로 다른 날짜에 생성된 비드 혼합물과 더 적은 샘플 부피(72% 더 낮음)를 사용하여 분석을 두 번 반복했습니다. RP1 및 RP2 채널 모두에서 0.98과 1 사이의 매우 우수한 Pearson 상관 관계가 관찰되었으며(p-값 < 0.01), 이는 분석 견고성과 사용 가능한 샘플이 적을 때 분석을 적용할 가능성을 확인했습니다(그림 5). 이 유동 분석 기술은 "주변 분석물 이론"17을 따르므로 분석은 농도에 민감하지만 부피에는 민감하지 않습니다.
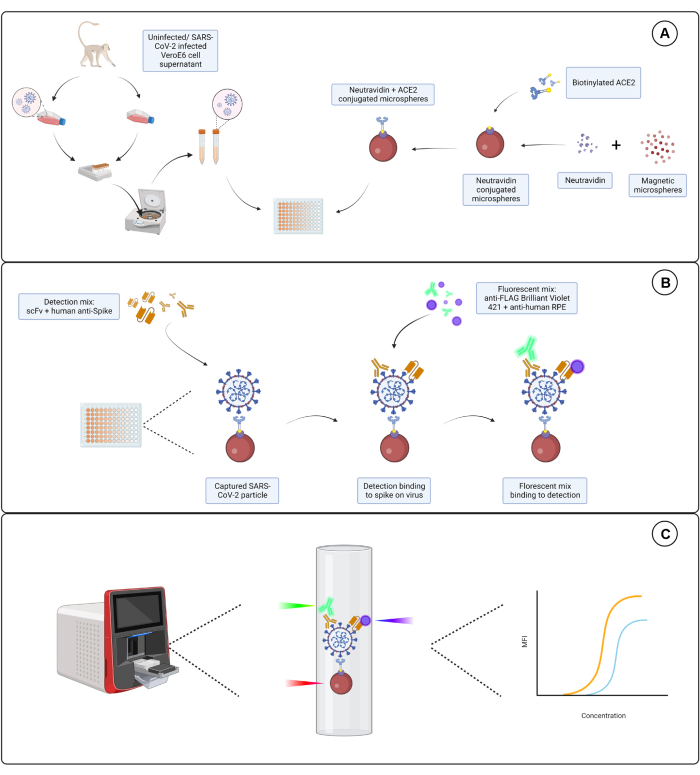
그림 1: 바이러스 입자 분석. (A) 감염된 세포와 감염되지 않은 Vero E6 세포 모두의 세포 상층액을 96웰 또는 384웰 플레이트에 연속 희석하여 뉴트라비딘과 접합된 자기 마이크로스피어와 함께 첨가한 다음 비오틴화된 인간 ACE2 또는 비오틴에 결합합니다. 염소-IgG 및 베어 마이크로스피어와 결합된 비접합 마이크로스피어는 뉴트라비딘-비오틴 복합 마이크로스피어와 함께 음성 대조군으로 사용됩니다. (B) 형성된 마이크로스피어-바이러스 입자 복합체는 Hu-anti-S1과 FLAG-tag가 있는 다양한 scFv 중 하나로 구성된 검출 칵테일로 검출됩니다. 그런 다음 scFv를 표적으로 하는 Hu-anti-S1 및 anti-FLAG Brilliant Violet 421을 표적으로 하는 항인간 IgG PE와 형광 혼합물을 첨가합니다. (C) 3개의 레이저, 이중 검출 시스템은 적색, 녹색 및 보라색 레이저를 방출하여 미립자 복합체를 검출합니다. 적색 레이저는 마이크로스피어 염료 라벨을 감지하는 반면, 녹색 및 보라색 레이저는 각각 anti-S1 및 scFv를 감지합니다. 그런 다음 생성된 데이터를 분석합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
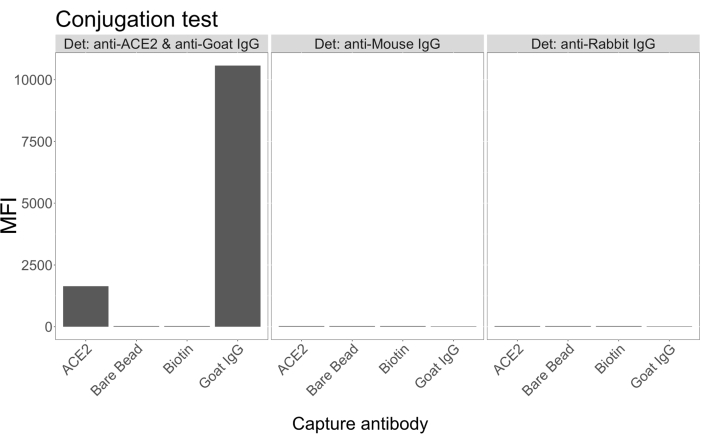
그림 2: 접합 확인 플롯. 비드 혼합물은 각각 다른 단백질, 즉 뉴트라비딘-비오틴-ACE2(ACE2), 비결합 미세구(베어 비드), 뉴트라비딘-비오틴(비오틴) 및 염소-IgG(염소 IgG)와 접합된 4개의 서로 다른 마이크로스피어 ID로 구성되었습니다. 접합 테스트에서는 세 가지 다른 구성의 검출 형광단이 사용되었습니다. 즉, 염소 항 ACE2 + 항 염소 IgG PE, 항 마우스 IgG PE 및 항 토끼 IgG PE. Y축은 세 가지 다른 조건을 가진 각 마이크로스피어에서 측정된 평균 MFI(median fluorescence intensity; 임의 단위) 신호를 보여줍니다. X축은 적용된 다양한 포획 항체를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
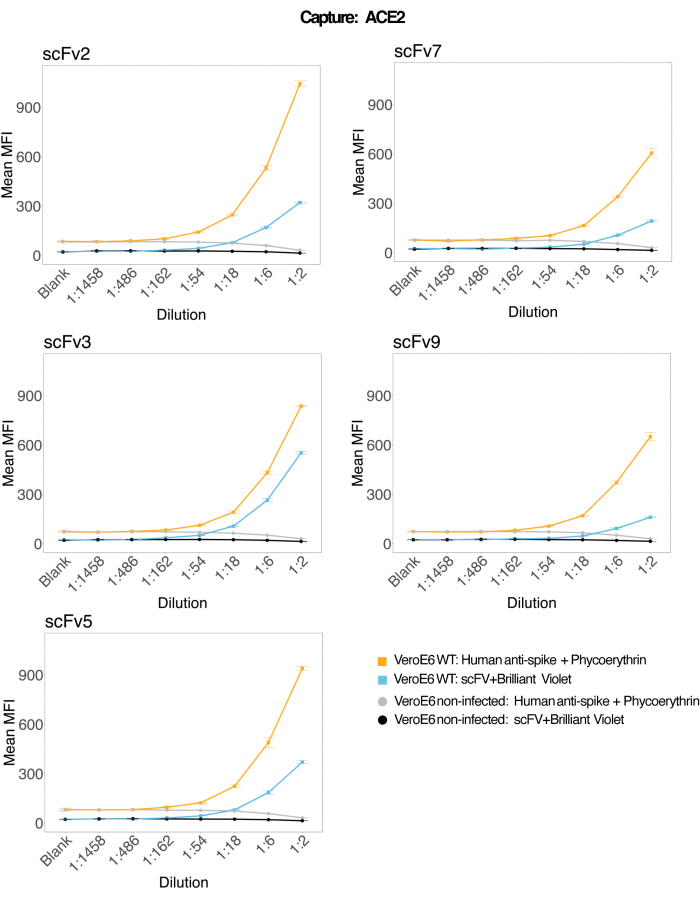
그림 3: 표면 단백질의 다중 검출. Y축: 조건당 3중 웰에서 분석된 각 샘플에 대한 평균 MFI(median fluorescence intensity, 임의 단위 ± 표준 편차)입니다. X축: 세포 상층액의 연속 희석점. 주황색: SARS-CoV-2 WT에 감염된 Vero E6의 상층액에 있는 바이러스 입자가 인간 항 스파이크 + 항인간 PE(피코에리트린)로 감지되었습니다. 파란색: SARS-CoV-2 WT에 감염된 Vero E6의 상층액이 다른 scFvs + anti-FLAG Brilliant Violet 421로 감지되었습니다. 회색: 인간 안티 스파이크 + 안티 인간 PE로 검출된 비감염 세포 상층액. 검정색: 5가지 scFvs + anti-FLAG Brilliant Violet 421로 검출된 비감염 세포 상층액. 바이러스 입자는 ACE2에 결합된 자기 마이크로스피어로 포획하고 RP1 리포터 채널에서 상용 인간 안티 스파이크 항체로 테스트하고 RP2 리포터 채널에서 다른 scFv로 테스트했습니다(scFv는 각 패널의 왼쪽 상단에 표시됨). 감염되지 않은 샘플에서 바이러스 입자가 검출되지 않았습니다. scFv3에 의해 표적이 된 에피토프(epitope)는 친화도가 가장 높았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
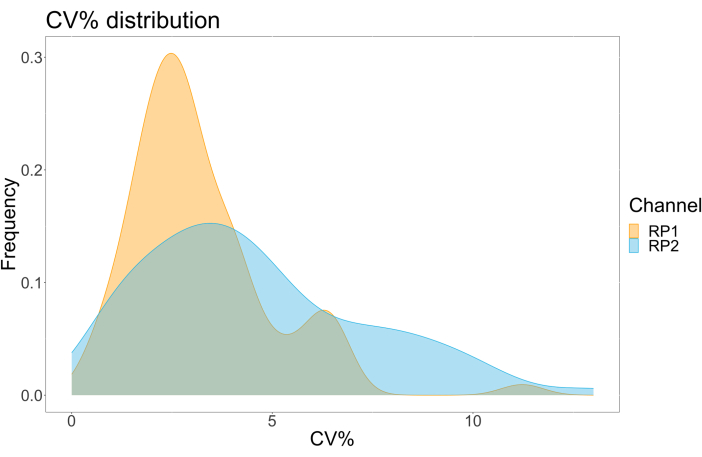
그림 4: 변동 분산 플롯. Y축은 사건의 빈도이고, X축은 서로 다른 표본의 각 반복실험에 대한 분산 계수(CV)를 백분율로 표시합니다. RP1 및 RP2는 각각 phycoerythrin 및 Brilliant Violet 421과 관련된 형광을 감지하는 첫 번째 및 두 번째 리포터 채널입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 5: 상관 행렬 실행. (A,B) Y축: 세 개의 다른 작업자와 다른 비드 혼합물로 실행되는 세 개의 개별 런 사이의 log10-scale의 Pearson 상관 행렬. 세 번째 실행에서 더 낮은 샘플 부피가 적용되었습니다. 히스토그램은 측정된 MFI를 기반으로 여러 변수 군집의 분포를 보여줍니다. (A) 서로 다른 실행 간의 RP1 리포터 채널에 대한 상관 관계. (B) 서로 다른 실행 간의 RP2 리포터 채널에 대한 상관 관계. MFI=임의의 단위의 평균 형광 강도. P < 0.001입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 탐지 | 반응성 |
| scFv2 | ++ |
| scFv3 | +++ |
| scFv5 | ++ |
| scFv7 | + |
| scFv9 | + |
| 인간 안티 스파이크 IgG | ++++ |
표 1: 표준 곡선에서 얻은 MFI 강도를 기반으로 한 검출에서 scFv의 순위.
| RP1 (PE) | RP2 (BV421) | |
| 시료 희석 | CV 범위 [%] | CV 범위 [%] |
| 빈 | 3–11 | 2–13 |
| 1:1458 | 1–7 | 2–7 |
| 1:456 | 4–6 | 3–8 |
| 1:162 | 3–6 | 3–7 |
| 1:54 | 2–4 | 2–4 |
| 1:18 | 2–4 | 1–4 |
| 1:6 | 2–6 | 1–6 |
| 1:2 | 1–5 | 1–3 |
표 2: RP1 및 RP2 리포터 채널 모두에 대한 SARS-CoV-2 감염 상층액의 각 희석 지점의 CV%(평균/표준 편차 × 100) 범위.
보충 파일 1: 면역글로불린 단쇄 가변 단편(scFv) 생성. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 재조합 스파이크(RBD)의 직렬 희석에 대해 Fab와 쌍으로 scFv를 스크리닝합니다. 다양한 검출 펩타이드의 성능을 평가하기 위해 스파이크 단백질인 Fab의 12가지 조합을 재조합 RBD로 스파이크된 완충액에서 포획으로 사용했습니다. 스파이크 단백질의 상이한 항원결정기를 표적으로 하는 10개의 scFv를 검출로 적용하였다. 캡처-탐지 쌍의 성능에 따라 실패(-) 또는 성공(+)으로 표시되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: SARS-Cov-2에 감염된 Calu-3 세포 상층액의 연속 희석에 대해 Fabs와 쌍을 이루는 scFv 스크리닝. 다양한 검출 펩타이드 성능을 평가하기 위해 SARS-Cov-2에 감염된 Calu-3 세포 상층액에서 스파이크 단백질인 Fab의 12가지 조합을 포획으로 사용했습니다. 스파이크 단백질의 상이한 항원결정기를 표적으로 하는 10개의 scFv를 검출로 적용하였다. 캡처-탐지 쌍의 성능에 따라 실패(-) 또는 성공(+)으로 표시되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
비드 기반 멀티플렉스 기술은 여러 임상 응용 분야에서 고처리량 병원체 검출을 위한 유용한 플랫폼으로 입증되었습니다. 유세포 분석 원리를 기반으로 하는 플랫폼의 높은 유연성으로 항체, 단백질 및 핵산 18,19,20,21,22를 표적화하여 수백 개의 분석물을 동시에 다중화할 수 있습니다. 그러나 우리가 아는 한, 이 기술은 이전에 손상되지 않은 바이러스 입자를 검출하는 데 적용된 적이 없습니다. 이 보고서에서 이 기술은 SARS-CoV-2의 3개의 독립적인 표면 에피토프를 표적으로 하여 온전한 바이러스 입자를 검출하는 데 적용되었습니다.
외피 RNA 바이러스는 숙주 단백질과 함께 바이러스 RNA 및 단백질을 운반하는 작은 인지질막인 세포외 소포체(EV)와 높은 구조적 유사성을 보여줍니다23. 샌드위치 면역분석은 이전에 두 개의 별개의 표면 단백질을 표적으로 하는 항체 쌍을 사용하여 EV 검출에 적용되었습니다24,25. 두 개의 단백질만 동시에 검출하는 샌드위치 분석의 한계는 반응당 두 개 이상의 단백질을 동시에 검출할 수 있는 다중 접근 방식을 통해 제거됩니다.
여기에 설명된 3개의 레이저 이중 리포터 감지 시스템은 현재까지 가장 진보된 비드 기반 흐름 분석 기기입니다. 단일 리포터 판독 시스템과 관련하여 이중 리포터(RP1 및 RP2 채널)를 사용하면 3개의 표면 단백질/에피토프를 병렬로 검출할 수 있습니다. 여러 바이러스 표면 단백질 및 항원결정기를 표적화하면 바이러스 단백질 부하를 보다 정확하게 표현할 수 있으며, 이는 바이러스가 실제로 손상되지 않았음을 확인하는 것을 넘어 바이러스 표면 항원과 바이러스 및 숙주 단백질 상호 작용의 메커니즘을 추가로 조사할 수 있는 기회를 제공합니다.
COVID-19 팬데믹 기간 동안 바이러스 확산을 억제하기 위한 노력에서 활성 바이러스 입자를 보유한 개인을 신속하게 식별하는 것이 중요했습니다. 게놈 RNA는 출처(원형, 바이러스 입자 또는 유리)에 관계없이 정량적 RT-PCR로 검출됩니다. 그러나 접근 가능한 S 단백질이 있는 온전한 외피만이 세포 진입과 후속 바이러스 복제를 중재할 수 있습니다. 환자 샘플에서 미세유체 칩을 사용한 이전 연구에서는 현장 검사와 결합된 온전한 바이러스 입자의 검출이 어떻게 빈번한 검사와 질병 확산에 대한 강화된 감시를 가능하게 하는지 보여주었으며, 여기에는 더 많은 정보에 입각한 격리 대상자 선택이 포함된다26. 다중 마이크로스피어 기반 분석을 적용하면 여러 바이러스 및 표면 항원 변이체의 스크리닝을 목표로 하는 분석을 설계할 수 있어 집단 내 바이러스 확산에 대한 보다 정확한 그림을 얻을 수 있습니다.
유동 바이러스 측정법은 바이러스 입자 분석을 목표로 하는 유세포 분석법의 최근 개발입니다. 개별 바이러스 입자를 검출할 수 있음에도 불구하고 작은 바이러스의 분석은 유동 바이러스 측정법27,28에 현재 문제를 제기합니다. 여기에 설명된 방법과 유사하게, 유동 바이러스 측정은 항체에 결합된 금 나노 입자에 의해 온전한 바이러스를 포획하는 것을 포함합니다. 두 방법 모두의 한계점에는 (i) 마이크로스피어 또는 나노입자에 의해 표적화된 표면 발현 항원에 대한 고친화성 캡처 및 검출 시약에 대한 의존성, (ii) 바이러스 입자와 세포외 소포체를 구별할 수 있는 제한된 능력, (iii) 적절한 입자 정량화를 위한 표준물질 부족 등이 포함됩니다.
세포는 EV를 주변으로 분비하며, 바이러스에 감염되면 EV와 비슷한 크기의 바이러스를 분비할 수 있으며 결국 동일한 항원을 발현할 수 있습니다29. EV는 바이러스와 유사한 막 조성을 갖기 때문에 이중 레이저 단일 리포터 접근 방식과 같은 친화성 기반 방법만으로는 서로 구별하기 어려울 수 있습니다. 그러나 여기에 설명된 전략은 더 높은 멀티플렉스 용량을 특징으로 하여 입자의 단백질 조성에 대한 더 광범위하고 심층적인 조사를 가능하게 합니다. 흐름 기반 분석법을 사용하면 개별 입자를 추적할 수 있어 디지털 정량화의 기회를 얻을 수 있습니다. 당사 분석법에서 정량화 문제를 해결하기 위한 한 가지 전략은 표준 곡선을 준비하기 위해 관심 항원을 바이러스 유사 입자(VLP)로 발현하는 잘 특성화된 합성 소포를 사용하는 것입니다.
숙주 세포에서 SARS-CoV-2가 진입하고 나가는 일반적인 경로는 바이러스와 숙주 세포막 2,15의 상호 작용을 통해서입니다. 이 과정에서 숙주막 단백질이 바이러스 표면에 통합될 확률이 높습니다. 통합된 숙주 단백질을 스크리닝함으로써 감염 경로를 추적하고 잠재적으로 다양한 위험 환자에 대한 질병 경과를 예측할 수 있으므로 조기 치료 결정을 내릴 수 있습니다. 또한 연구 실험실의 다양한 샘플 배치에서 바이러스의 특성을 분석할 수 있습니다. 이는 서로 다른 특성이 서로 다른 수준의 바이러스 감염성과 관련이 있는지 테스트하고 바이러스 표면 단백질을 표적으로 하는 항체 및 약물 분자를 스크리닝하여 더 자세히 조사할 수 있습니다.
설명된 방법과 관련된 중요한 측면은 바이러스에 대한 표적 단백질에 대한 포획 및 검출 시약의 친화력에 의존한다는 것입니다. 따라서 친화성 시약의 선택은 분석 성능을 결정하는 요소입니다. 아마도 여러 친화성 시약을 스크리닝하고 캡처 및 검출을 테스트하여 친화성이 가장 높은 시약을 선택해야 할 것입니다. 여기에서 재조합 RBD를 사용하여 SARS-Cov-2에 감염된 Calu-3 폐 상피 세포의 상층액에서 바이러스 입자에 대한 10개의 scFv 및 12개의 Fab 단편의 성능을 예비 평가했습니다(VeroE6 세포는 모든 후속 연구에서 세포 독성을 배양/평가하는 데 사용됨). Anti-FLAG PE를 사용하여 FLAG 태그가 지정된 scFv를 탐지했습니다(보충 표 1 및 보충 표 2). 그런 다음 감염된 VeroE6 아프리카 녹색 원숭이 신장 상피 세포의 상층액에 대해 상용 Hu-anti-S1(표 1)과 함께 이중 리포터 분석에 적용하기 위해 5개의 최고 성능 scFv를 선택했습니다.
프로토콜의 성공을 위한 또 다른 중요한 요소는 마이크로스피어 커플링을 위해 선택된 절차입니다. 커플링 방법은 효율적이어야 하며, 동시에 단백질 결합에 관여하는 구조적 에피토프 또는 아미노산 잔기를 변형되지 않은 상태로 유지해야 합니다. 여기서, EDC-NHS 반응은 이전에 설명한프로토콜 30 과 뉴트라비딘 + 비오틴 시스템을 적용하여 재조합 ACE2를 결합된 미세구에 결합시키기 위해 뉴트라비딘을 직접 미세구에 결합하는 데 적용되었습니다. 대체 커플링 방법과 그 효율성을 테스트하고 비교할 수 있습니다. 마지막으로, 서로 다른 형광 표지 검출 시약(예: anti-FLAG PE(phycoerythrin) 및 anti-FLAG Brilliant Violet 421)로 인해 분석 민감도에 영향을 줄 수 있는 다양한 MFI 수준이 발생할 수 있음을 관찰했습니다.
결론적으로, 설명된 방법을 사용하면 용액에서 손상되지 않은 바이러스 입자를 검출할 수 있으며 이중 리포터 전략을 적용할 수 있습니다. 세 가지 표면 결정 요인을 병렬로 분석하면 바이러스 입자를 특성화하고 궁극적으로 다른 EV(예: 바이러스 항원을 포함하지 않음)와 구별할 수 있는 보다 구체적인 도구를 제공합니다. 이 전략은 유동 바이러스 측정의 대안입니다. 현재 접근 방식은 입자 크기를 구별하지 않지만, 색상으로 구분된 마이크로스피어를 사용하는 마그네틱 비드 전략은 고다중화 및 고처리량 분석을 통한 표면 항원 프로파일링 및 실험 설계에서 더 광범위한 기능을 제공합니다. 이 분석은 높은 정밀도와 견고성을 보여주며 모든 유형의 세포외 소포체 및 체액 또는 기타 액체 매트릭스에서 표면 항원을 노출시키는 기타 유형의 생체 입자 분석으로 확장될 수 있습니다. 이것은 바이러스 입자에 대한 여러 단백질 에피토프의 다중 분석에서 scFvs를 하나의 검출 시약으로 사용하는 유용성을 입증한 개념 증명 연구였습니다. 정량적 또는 임상적 목적으로 사용될 경우 scFv의 특정 특성(예: 결합 친화도, 다른 시약 및 표적과의 교차 반응)을 결정하기 위해 향후 연구가 필요합니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
스웨덴 SciLifeLab에서는 여기에 설명된 방법을 개발 및 적용한 Affinity Proteomics-Stockholm Scilifelab Unit 팀, scFvs 및 Fab 시약을 제공한 Human Antibody Therapeutics Unit, 임상 샘플에서 유래한 SARS-CoV-2 분리체에 감염된 VeroE6 세포를 위한 Jonas Klingström을 인정합니다. 저자들은 연구 지원을 해준 Luminex Corporation(텍사스 주 오스틴)의 Sherry Dunbar 박사와 과학 및 집필 지원을 제공한 Matt Silverman MSci, Biomedical Publishing Solutions 박사(플로리다주 파나마 시티, mattsilver@yahoo.com)에게 감사를 표합니다. 이 연구는 Knut and Alice Wallenberg Foundation 및 Science for Life Laboratory(SciLifeLab)의 기금으로 지원되었습니다(VC2020-0015는 Claudia Fredolini와 Francesca Chiodi, VC-2022-0028은 Claudia Fredolini).
자료
| Name | Company | Catalog Number | Comments |
| ACE2-Biotin | Acro Biosystems (Newark, DE) | AC2-H82E6-25 ug | Conc: 340 µg/mL, LOT#BV35376-203HFI-2128 |
| Anti-Goat IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 705-116-147 | Host species: Donkey |
| Anti-Human IgG R-PE | Life Technologies/Thermo Fisher (Waltham, MA) | H10104 | Conc: 0.15 mg/mL, LOT#2079224, Host species: Goat |
| Anti-Mouse IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 115-116-146 | Host species: Goat |
| Anti-Rabbit IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 111-116-144 | Host species: Goat |
| Biotin | Thermo-Fisher Scientific (Waltham, MA) | 20RUO | 100 mM, pH 10 Conc. 1 mg/mL |
| Blocker Casein in PBS | Thermo-Fisher Scientific (Waltham, MA) | 37528 | LOT#VD301372 |
| Blocker reagent for ELISA (BRE) | Roche (Basel, Switzerland) | 11112589001 | |
| Brilliant Violet 421 anti-DYKDDDDK Tag Antibody (Anti-FLAG) 0.2 mg/ml, rat IgG2a, λ | BioLegend (Amsterdam, The Netherlands) | 637321 | |
| Bovine serum albumin (BSA) | Saveen & Werner (Limhamn, Sweden) | B2000-500 | LOT#04D5865 |
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Proteochem (Hurricane, UT) | C1100-custom (65 mg) | LOT# MK3857 |
| Fetal calf serum (FCS) | Gibco/Thermo Fisher (Waltham, MA) | 10270-106 | |
| Goat anti-ACE2 polyclonal antibody | R&D Systems/Bio-Techne (Minneapolis, MN) | AF933 | Host species: Goat |
| Goat IgG | Bethyl Labs (Montgomery, TX) | P50-200 | LOT#P50-200-6 |
| L-glutamine | Thermo-Fisher Scientific (Waltham, MA) | 25030024 | |
| Low-bind 1.5 mL microfuge tubes | VWR (Radnor, PA) | 525-0133 | |
| MagPlex-C Microspheres | Luminex Corporation (Austin, TX) | MC10XXX-01 | |
| MEM tissue cuture media | Gibco/Thermo Fisher (Waltham, MA) | 21430-020 | |
| Microplate, 96-Well, Polystyrene, Half-area, Clear | Greiner Bio-One (Kremsmünster, Austria) | 675101 | |
| NaHCO3 | Gibco/Thermo Fisher (Waltham, MA) | 25080-060 | |
| Neutravidin | Thermo-Fisher Scientific (Waltham, MA) | 31000 | LOT#UK292857 |
| PBS tablets | Medicago AB (Uppsala, Sweden) | 09-9400-100 | LOT#272320-01 |
| Penicillin/Streptomycin | Gibco/Thermo Fisher (Waltham, MA) | 15140122 | |
| Poly(vinyl alcohol) | Sigma-Aldrich (St. Louis, MO) | 360627 | |
| Polyvinylpyrrolidone | Sigma-Aldrich (St. Louis, MO) | 437190 | |
| ProClin 300 | Sigma-Aldrich (St. Louis, MO) | 48915-U | |
| Rabbit IgG | Bethyl Labs (Montgomery, TX) | P120-301 | LOT#12 |
| scFv-FAb1 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.12 mg/mL. | |
| scFv-FAb2 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc batch1: 0.38 mg/mL. Conc batch2: 0.45 mg/mL | |
| scFv-FAb3 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.34 mg/mL. | |
| scFv-FAb4 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 2.85 mg/mL. | |
| scFv-FAb5 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc:2.7mg/mL. | |
| SARS-CoV-2 infectious particles, Swedish isolate | In-house production | The Public Health Agency of Sweden | |
| SARS-CoV-2 Spike Antibody (Hu-anti-S1) | Novus Biologicals (Centennial, CO) | NBP2-90980 | Monoclonal antibody. Conc: 1 mg/mL. Host: Human. Clone: CR3022. Isotype: IgG1 Kappa. LOT#T201B06 |
| Sodium phosphate monobasic, anhydrous | Sigma-Aldrich (St. Louis, MO) | S3139 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo-Fisher Scientific (Waltham, MA) | 24510 | LOT# XH321563 |
| Tween | Thermo-Fisher Scientific (Waltham, MA) | BP337-50 | LOT#194435 |
| Ultraviolet lamp | Vilber Lourmat GmbH (Eberhardzell, Germany) | VL-215.G | Wavelength = 254 nm; 2 × 15-watt bulbs |
| Vero E6 cells | ATCC (Manassus, VA) | CRL-1586 | |
| xMAP INTELLIFLEX DR-SE (dual-reporter flow instrument) | Luminex Corporation (Austin, TX) | INTELLIFLEX-DRSE-RUO |
참고문헌
- Rey, F. A., Lok, S. M. Common features of enveloped viruses and implications for immunogen design for next-generation vaccines. Cell. 172 (6), 1319-1334 (2018).
- V'kovski, P., Kratzel, A., Steiner, S., Stalder, H., Thiel, V. Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology. 19 (3), 155-170 (2021).
- Burnie, J., et al. Flow virometry quantification of host proteins on the surface of HIV-1 pseudovirus particles. Viruses. 12 (11), 1296 (2020).
- Gentili, M., et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles. Science. 349 (6253), 1232-1236 (2015).
- Modrow, S., Falke, D., Truyen, U., Schätzl, H. . Viruses: Definition, Structure, Classification. In Molecular Virology. , 163-181 (2013).
- Trinh, K. T. L., Do, H. D. K., Lee, N. Y. Recent advances in molecular and immunological diagnostic platform for virus detection: A review. Biosensors. 13 (4), 490 (2023).
- Zamora, J. L. R., Aguilar, H. C. Flow virometry as a tool to study viruses. Methods. 134-135, 87-97 (2018).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Byström, S., et al. Affinity proteomic profiling of plasma for proteins associated to area-based mammographic breast density. Breast Cancer Research. 20 (1), 14 (2018).
- Rudberg, A. -. S., et al. SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden. Nature Communications. 11 (1), 5064 (2020).
- Liu, J., et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. Journal of Clinical Virology. 50 (4), 308-313 (2011).
- Gadsby, N. J., Hardie, A., Claas, E. C. J., Templeton, K. E. Comparison of the Luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. Journal of Clinical Microbiology. 48 (6), 2213-2216 (2010).
- Lorenzen, E., et al. Multiplexed analysis of the secretin-like GPCR-RAMP interactome. Science Advances. 5 (9), (2019).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments: JoVE. (170), e62487 (2021).
- Jackson, C. B., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews Molecular Cell Biology. 23 (1), 3-20 (2022).
- ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. International Standardization Organization Available from: https://nhiso.com/wp-content/uploads/2018/05/ISO-10993-5-2009.pdf (2009)
- Poetz, O., et al. Sequential multiplex analyte capturing for phosphoprotein profiling. Molecular & Cellular Proteomics. 9 (11), 2474-2481 (2010).
- Dunbar, S. A., Vander Zee, C. A., Oliver, K. G., Karem, K. L., Jacobson, J. W. Quantitative, multiplexed detection of bacterial pathogens: DNA and protein applications of the Luminex LabMAP system. Journal of Microbiological Methods. 53 (2), 245-252 (2003).
- Taniuchi, M., et al. Multiplex polymerase chain reaction method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples. Diagnostic Microbiology and Infectious Disease. 71 (4), 386-390 (2011).
- Wu, M., et al. High-throughput Luminex xMAP assay for simultaneous detection of antibodies against rabbit hemorrhagic disease virus, Sendai virus, and rabbit rotavirus. Archives of Virology. 164 (6), 1639-1646 (2019).
- Dias, D., et al. Optimization and validation of a multiplexed Luminex assay to quantify antibodies to neutralizing epitopes on human papillomaviruses 6, 11, 16, and 18. Clinical and Vaccine Immunology. 12 (8), 959-969 (2005).
- Opalka, D., et al. Simultaneous quantitation of antibodies to neutralizing epitopes on virus-like particles for human papillomavirus types 6, 11, 16, and 18 by a multiplexes lumina assay. Clinical and Diagnostic Laboratory Immunology. 10 (1), 108-115 (2003).
- Nolte-'T Hoen, E., Cremer, T., Gallo, R. C., Margolis, L. B. Extracellular vesicles and viruses: Are they close relatives. Proceedings of the National Academy of Sciences. 113 (33), 9155-9161 (2016).
- Ohmichi, T., et al. Quantification of brain-derived extracellular vesicles in plasma as a biomarker to diagnose Parkinson's and related diseases. Parkinsonism & Related Disorders. 61, 82-87 (2019).
- Ter-Ovanesyan, D., et al. Framework for rapid comparison of extracellular vesicle isolation methods. Elife. 10, e70725 (2021).
- Gamage, S. S. T., et al. Microfluidic affinity selection of active SARS-CoV-2 virus particles. Science Advances. 8 (39), (2022).
- Renner, T. M., Tang, V. A., Burger, D., Langlois, M. -. A. Intact viral particle counts measured by flow virometry provide insight into the infectivity and genome packaging efficiency of moloney murine leukemia virus. Journal of Virology. 94 (2), e01600-01619 (2020).
- Niraja, S., et al. A flow virometry process proposed for detection of SARS-CoV-2 and large-scale screening of COVID-19 cases. Future Virology. 15 (8), 525-532 (2020).
- Lippé, R. Flow virometry: A powerful tool to functionally characterize viruses. Journal of Virology. 92 (3), e01765 (2018).
- Drobin, K., Nilsson, P., Schwenk, J. M. Highly multiplexed antibody suspension bead arrays for plasma protein profiling. Methods in Molecular Biology. 1023, 137-145 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유