A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة شفط ميكروماصة مضان للتحقيق في ميكانوسن خلايا الدم الحمراء
In This Article
Summary
يعد استكشاف السلوك الخلوي تحت الضغط الميكانيكي أمرا محوريا للتقدم في الميكانيكا الخلوية وعلم الأحياء الميكانيكي. نقدم تقنية شفط الماصة الدقيقة الفلورية (fMPA) ، وهي طريقة جديدة تجمع بين التحفيز الميكانيكي المتحكم فيه والتحليل الشامل للإشارات داخل الخلايا في الخلايا المفردة. تبحث هذه التقنية في دراسات متعمقة جديدة لعلم الأحياء الميكانيكية للخلايا الحية.
Abstract
لطالما كانت فحوصات شفط الماصة الدقيقة حجر الزاوية في التحقيق في ميكانيكا الخلايا الحية ، حيث تقدم رؤى حول الاستجابات الخلوية للإجهاد الميكانيكي. توضح هذه الورقة بالتفصيل تكيفا مبتكرا لمقايسة شفط الماصة الدقيقة المقترنة بالفلورة (fMPA). يقدم اختبار fMPA القدرة على إدارة قوى ميكانيكية دقيقة مع مراقبة عمليات النقل الميكانيكي للخلايا الحية بوساطة القنوات الأيونية في نفس الوقت. يشتمل الإعداد المتطور على ماصة دقيقة من زجاج البورسليكات المصمم بدقة ومتصلة بخزان مياه منظم بدقة ونظام شفط هوائي ، مما يسهل تطبيق الضغط المتحكم فيه بزيادات تصل إلى ± 1 مم زئبق. ومن التحسينات المهمة دمج التصوير الفلوري الوهمي ، مما يسمح بالمراقبة المتزامنة والقياس الكمي للتغيرات المورفولوجية للخلايا وتدفقات الكالسيوم داخل الخلايا أثناء الشفط. يضع اختبار fMPA ، من خلال مزيجه التآزري من التصوير الفلوري epi-fluorescence مع شفط الماصة الدقيقة ، معيارا جديدا لدراسة الاستشعار الميكانيكي للخلايا في البيئات الصعبة ميكانيكيا. هذا النهج متعدد الأوجه قابل للتكيف مع الإعدادات التجريبية المختلفة ، مما يوفر رؤى نقدية حول آليات الاستشعار الميكانيكي أحادية الخلية.
Introduction
أبرزت الاكتشافات التي تتكشف في عالم السلوكيات الخلوية دور المحفزات الميكانيكية ، مثل التوتر ، وإجهاد قص السوائل ، والضغط ، وصلابة الركيزة ، في إملاء الأنشطة الخلوية الديناميكية مثل الالتصاق والهجرة والتمايز. هذه الجوانب الميكانيكية البيولوجية لها أهمية قصوى في توضيح كيفية تفاعل الخلايا مع بيئاتها الفسيولوجية والاستجابة لها ، مما يؤثر على العمليات البيولوجية المختلفة 1,2.
على مدى العقد الماضي ، برزت مقايسات الشفط القائمة على الماصة الدقيقة كأداة متعددة الاستخدامات في دراسة الاستجابات الخلوية المتنوعة للمنبهات الميكانيكية. تقدم هذه التقنية رؤى قيمة حول الخصائص الميكانيكية الجوهرية للخلايا الحية على مستوى الخلية الواحدة ، بما في ذلك معامل المرونة الخلوية ، والتصلب ، والتوتر القشري. تمكن هذه المقايسات من قياس المعلمات الميكانيكية المختلفة ، مثل توتر غشاء الخلية ، والضغط الذي يمارس على غشاء الخلية ، والتوتر القشري (الملخص في الجدول 1). لقد أثرت دراسة القوى الطموحة فهمنا لكيفية تأثيرها على الوظائف والعمليات الخلوية ، لا سيما في مجال ديناميكيات الغشاء ، بما في ذلك التجزئة والاستطالة والتبرعم 3,4.
| المعلمة الميكانيكية | وصف | النهج المنوية |
| تصلب الخلايا | قياس الصلابة الميكانيكية للخلية ومرونتها. | طموح غشاء الخلية وتحليل استجابة التشوه للضغط السلبي20,21. |
| قوة التصاق | تقييم مدى قوة التصاق الخلايا بالأسطح. | تطبيق الشفط المتحكم فيه لفصل الخلايا الملتصقة من الركيزة2,22. |
| توتر الغشاء | تقييم التوتر أو الإجهاد داخل أغشية الخلايا. | قياس تشوه الغشاء استجابة للضغط المطبق23,24. |
| خصائص لزجة مرنة | توصيف السلوك اللزج والمرن للخلية. | تحليل استجابة التشوه المعتمدة على الوقت للطموح23,25. |
| التشوه | تحديد مدى سهولة تغيير شكل الخلية. | تقييم مدى التشوه تحت الشفط الخاضع للرقابة20,24. |
| توتر سطحي | قياس التوتر على سطح الخلية. | تقييم الضغط المطلوب لتشكيل نتوء غشاء ماصةدقيقة 26. |
| التفاعل بين الخلية والمواد | دراسة التفاعلات بين الخلايا والمواد أو الركائز. | طموح الخلايا الملامسة للمواد المختلفة ومراقبة التفاعلات2,24. |
| التفاعل بين الخلايا والخلايا | فحص التفاعلات بين الخلايا المجاورة. | طموح مجموعة من الخلايا وتحليل قواها بين الخلايا27. |
الجدول 1: المعلمات الميكانيكية التي تتميز بمقايسة شفط الماصة الدقيقة.
تم استخدام تقنية الشفط القائمة على الماصة الدقيقة على نطاق واسع لدراسة خلايا الدم الحمراء (RBCs) ، وتقييم التشوه والخصائص الميكانيكية المختلفة لكرات الدم الحمراء ، وهو أمر ضروري لفهم وظيفتها في الدورة الدموية. تظهر كرات الدم الحمراء قدرة رائعة على التكيف ، حيث تحافظ على تنوعها الميكانيكي ضد التشوه عند التنقل عبر الشبكة الشعرية المعقدة والشقوق بين البطانيات 5,6. خلال هذه الرحلة ، يجب أن تجتاز كرات الدم الحمراء ممرات ضيقة مثل 0.5-1.0 ميكرومتر ، معرضة نفسها للعديد من القوى الميكانيكية ، بما في ذلك التوتر والضغط7،8،9. لديهم أيضا حساسية عالية لإجهاد القص الناتج عن تدفق الدم أثناء الدورة الدموية10. تعزز هذه العمليات تنشيط الآليات التنظيمية التي تنطوي على تدفق الكالسيوم ، وهو حدث إشارات حاسم له أدوار راسخة في الاستجابات الخلوية للمنبهات الميكانيكية11,12. لا تزال الآليات المعقدة التي تحكم الاستشعار الميكانيكي بوساطة الكالسيوم مواضيع مقنعة للتحقيق المستمر.
في هذا السياق ، يقف fMPA كنهج فعال للكشف عن مدى تعبئة الكالسيوم تحت قوى ميكانيكية يتم التحكم فيها بدقة ، مما يسمح بالتطبيق المتزامن للتعديل الميكانيكي (باستخدام نظام شفط الماصة الدقيقة) وتصور كثافة الكالسيوم (باستخدام مؤشرات الفلورسنت). إنه يحاكي بشكل خاص السيناريو الفسيولوجي عندما ينتقل كرات الدم الحمراء عبر تضييق الأوعية الدموية. تجدر الإشارة إلى أن نظام fMPA الذي طورناه يمكن أن يولد ضغطا بدقة 1 مم زئبق. يمكن للكاميرا عالية السرعة المطبقة تحقيق دقة زمنية تبلغ 100 مللي ثانية ودقة مكانية على مستوى المتر دون الميكرون. تضمن هذه التكوينات التطبيق الدقيق للقوى الميكانيكية على الخلايا الحية والتقاط الإشارات الخلوية الناتجة في نفس الوقت. علاوة على ذلك ، نظرا للطبيعة الهندسية التكاملية لهذا الإعداد ، يمكن تكييف مقايسة شفط الماصة الدقيقة بسهولة لاستكمال المعدات أو التقنيات الأخرى ، مما يتيح مزيدا من الاستكشاف لتعقيدات ميكانيكا الخلية. هذا التنوع يقف كميزة إضافية لهذا النهج.
Protocol
يتبع هذا البروتوكول المبادئ التوجيهية للجنة أخلاقيات البحوث البشرية بجامعة سيدني وقد تمت الموافقة عليها. تم الحصول على موافقة مستنيرة من الجهات المانحة لهذه الدراسة.
1. عزل كرات الدم الحمراء البشرية
ملاحظة: يجب تنفيذ الخطوة 1.1 من قبل أخصائي فصد مدرب باستخدام بروتوكول تمت الموافقة عليه من قبل مجلس المراجعة المؤسسية.
- اسحب 5 مل من الدم من الوريد المرفقي المتوسط باستخدام إبرة فراشة 19 جرام.
- نقل الدم الذي تم جمعه إلى أنبوب سعة 15 مل يحتوي على 1: 200 إينوكسابارين لمنع التخثر.
- تمييع 5 ميكرولتر من الدم المضاد للتخثر enoxaparin في 1 مل من المخزن المؤقت للكربونات / البيكربونات (C-buffer ، الرقم الهيدروجيني = 8.5-9 ؛ جدول المواد).
- أجهزة الطرد المركزي عينة الدم المخففة في 900 × غرام لمدة 1 دقيقة لترسب كرات الدم الحمراء. صب بعناية طاف دون إزعاج بيليه.
- قم بإجراء غسلتين من حبيبات كرات الدم الحمراء مع 1 مل من C-buffer (جدول المواد) ، والطرد المركزي في كل مرة عند 900 × جم لمدة دقيقة واحدة.
- بعد ذلك ، اغسل حبيبات RBC 2x ب 1 مل من المخزن المؤقت ل Tyrode باستخدام نفس ظروف الطرد المركزي ثم أعد تعليق الحبيبات النهائية في 1 مل من المخزن المؤقت ل Tyrode للحصول على تعليق RBC للمخزون المغسول.
2. تحميل مؤشر الكالسيوم
- اضبط تركيز محلول كرات الدم الحمراء للمخزون المغسول إلى 10 × 106 خلايا / مل في المخزن المؤقت ل Tyrode ، بناء على عدد الخلايا الذي تم الحصول عليه باستخدام عداد الخلايا التلقائي (جدول المواد).
- قم بتسمية الكالسيوم داخل كرات الدم الحمراء عن طريق الحضانة باستخدام 16.67 ميكرومتر Cal-520 AM ، وهي صبغة حساسة للكالسيوم ، أثناء التقليب على خلاط أنبوب دوار لمدة 1 ساعة.
- تمييع كرات الدم الحمراء في المخزن المؤقت لتيرود الذي يحتوي على 0.5٪ من ألبومين مصل الأبقار (BSA) بنسبة 1:50. الخلايا جاهزة الآن للاستخدام التجريبي.
3. تصنيع الماصة الدقيقة
- قم بتركيب الأنبوب الشعري الزجاجي البورسليكات (القطر الخارجي 1 مم × القطر الداخلي 0.6 مم) على مجتذب P-1000 micropipette لإنتاج ماصة دقيقة مقابلة مع أطراف مغلقة في موقع السحب باستخدام برنامج السحب المحدد مسبقا. لهذا الإعداد ، استخدم قيم برنامج السحب التالية: الحرارة 516 ، السحب 150 ، السرعة 75 ، الوقت 250 ، والضغط 500.
ملاحظة: يمكن تخصيص معلمات التسخين والسحب المحددة في برنامج السحب وتعتمد على الإعدادات المطلوبة للتصميم التجريبي12. نقطة تفتيش (انظر الجدول التكميلي S1). - افتح الطرف المغلق عن طريق تركيب أحد الماصات الدقيقة المغلقة التي تم شراؤها بعد سحبها على قاطع الماصة الدقيقة. اضبط درجة حرارة التسخين على حوالي 50-60 درجة مئوية.
- حدد موقع الماصة الدقيقة باستخدام عدسة 10x. حرك الماصة الدقيقة بالقرب من حبة زجاج البورسليكات باستخدام المقابض للضبط.
- قم بتغيير العدسة إلى 30x قبل وضع الماصة الدقيقة بالقرب من حبة زجاج البورسليكات قدر الإمكان دون ثني طرف الماصة.
- قم بتليين حبة زجاج البورسليكات باستخدام الحرارة عن طريق الضغط على دواسة التسخين. أدخل طرف الماصة المغلقة الخام برفق في الخرزة اللينة حتى يتم الوصول إلى نقطة النهاية المطلوبة ، قطر الفتحة.
- حرر دواسة القدم واترك حبة الزجاج تبرد. تأكد من بقاء طرف الماصة الدقيقة دائما داخل الخرزة.
ملاحظة: يؤدي إدخال الطرف إلى زيادة أقطار الفتح. - استخرج الماصة الدقيقة برفق ، مما يؤدي إلى قطع مستقيم واضح على الماصة الدقيقة المغلقة. تأكد من أن القطر النهائي للشعيرات الدموية هو 1 ميكرومتر.
ملاحظة: نقطة تفتيش (انظر الجدول التكميلي S1)
4. إعداد غرفة الخلية
- استخدم قلم رصاص ماسي لتقسيم غطاء زجاجي قياسي مقاس 40 مم × 22 مم × 0.17 مم إلى ثلاثة شرائح متساوية.
- التمسك قطعة واحدة من الغطاء الزجاجي المقطوع إلى أسفل حامل غرفة محلية الصنع مع الشحوم فراغ.
ملاحظة: يتكون حامل الحجرة من مربعين معدنيين (نحاس/ألومنيوم) متصلين بمقبض منحني. يجب أن تمتد المسافة بين الكتل المعدنية أقل من 40 مم حتى يلتصق غطاء الغطاء المقطوع بالحامل لتشكيل غرفة متوازية. - التمسك القطعة الثانية من الغطاء الزجاجي المقطوع بالجزء العلوي من حامل الغرفة محلي الصنع مع شحم فراغ .
ملاحظة: نقطة تفتيش (انظر الجدول التكميلي S1) - قم بحقن 200 ميكرولتر من تعليق RBC المسمى بين منزلقين للغطاء باستخدام مسدس ماصة سعة 200 ميكرولتر (الشكل 1).
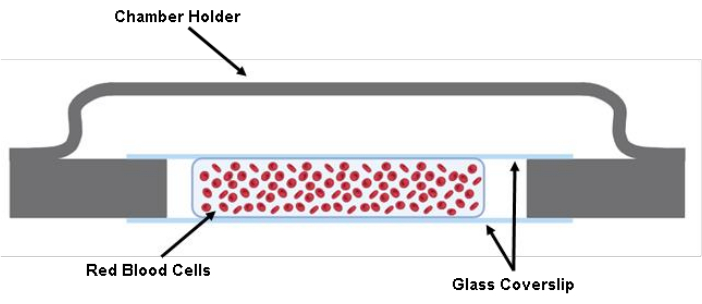
الشكل 1: رسم توضيحي لحجرة الخلية. يتم لصق قطعتين مقطوعتين من انزلاق الغطاء الزجاجي 40 مم × 22 مم × 0.17 مم بحامل الحجرة باستخدام الشحوم. بين الغطاءين الزجاجيين المقطوعين ، يتم زرع ما يقرب من 200 ميكرولتر من محلول الخلية في Tyrode's Buffer. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. تجميع شفط الماصة الدقيقة
- قم بتركيب حجرة الخلية على مرحلة الحامل الموجودة على منصة المجهر. اضبط الموضع بحيث تكون غرفة الخلية أعلى الهدف مباشرة (الشكل 2 ب).
- اخفض حامل الماصة الدقيقة إلى ما دون مستوى السائل لخزان المياه المتصل.
- قم بحقن الماء منزوع المعادن أو مخزن Tyrode المؤقت في الماصة الدقيقة المصنعة وقم بإزالة جميع فقاعات الهواء بعناية باستخدام حقنة مقترنة بإبرة 34 جم (انظر جدول المواد).
- قم بفك طرف حامل الماصة الدقيقة في منتصف الطريق واترك الماء يقطر من حامل الماصة الدقيقة لبضع ثوان.
ملاحظة: نقطة تفتيش (انظر الجدول التكميلي S1) - أدخل الماصة الدقيقة في طرف الحامل. اربط برغي الحامل للتأكد من تثبيت الماصة الدقيقة.
- أدخل الماصة الدقيقة في حجرة الخلية وحدد موقع الماصة الدقيقة وكرات الدم الحمراء تحت المجهر. استخدم المناور الدقيق لضبط الموضع.
- اخفض طرف الماصة الدقيقة بشكل أكبر لضمان تسوية الطرف مع كرات الدم الحمراء الموجودة.
ملاحظة: نقطة تفتيش (انظر الجدول التكميلي S1) - قم بتصفير الضغط الهيدروليكي عند طرف الماصة الدقيقة عن طريق ضبط ارتفاع خزان المياه. ثم ارفع خزان المياه قليلا لتوليد ضغط إيجابي دقيق عند الحافة.
6. إجراء مقايسة شفط الماصة الدقيقة المقترنة بالفلورة
- قم بتشغيل مصدر ضوء الإثارة الفلورسنت 488 نانومتر. لا تقم بتشغيل الغالق الفلوري في هذه المرحلة لتجنب التبييض الضوئي (الشكل 2C). قم بتشغيل الكاميرا الفلورية والكاميرا المرسلة.
ملاحظة: يتم تشغيل كلتا الكاميرتين باستخدام البرنامج المناسب (انظر جدول المواد). - قم بإعداد وقت التعرض المطلوب (100 مللي ثانية لكلتا الكاميرتين في هذه الدراسة) ، ومنطقة الاهتمام (ROI) ، وحجم binning (لا شيء لهذه الدراسة) لكلتا الكاميرتين في البرنامج. افتح لوحة الاستحواذ متعددة الأبعاد لإعداد رقم إطار الاستحواذ ، 2000 لهذه الدراسة ، ودليل الحفظ.
ملاحظة: يعتمد رقم إطار الاستحواذ على العدد المطلوب من أحداث الطموح التي سيتم تسجيلها. بالنسبة لحدث الطموح الأول ، يجب تعيين نطاق رقم الاستحواذ في حدود 100-500 ، أي ما يقرب من 10-50 ثانية. - ابحث عن الماصة الدقيقة تحت مجال الرؤية باستخدام المعالج الدقيق.
- قم بتشغيل مشبك الضغط الهوائي ، بما في ذلك صندوق التحكم ونظام المشبك (الشكل 2 أ). تأكد من أن صندوق التحكم في وضع EXTRNL. قم بتعويض أي ضغط إزاحة داخل النظام عن طريق تدوير المقبض ببطء.
- قم بتشغيل البرنامج المنفصل الذي يتحكم في المشبك الهوائي. يحتوي البرنامج على لوحة تحكم كهربائية للتحكم في الإدخال التناظري المنفصل لنظام المشبك. يتم التحكم في الضغط بعامل تحويل 20 مللي فولت / مم زئبق.
- صفر الضغط داخل النظام. انقل الماصة الدقيقة بعناية بالقرب من كرات الدم الحمراء. اضبط موضع خزان المياه حتى يلاحظ ضغط إيجابي دقيق عند طرف الماصة الدقيقة.
- ابدأ عملية الاستحواذ في برنامج تشغيل الكاميرا. قم بتشغيل الغالق الفلوري.
- نضح كرات الدم الحمراء عن طريق كتابة حجم الجهد المحسوب في لوحة التحكم للوصول إلى الضغط المطلوب.
ملاحظة: عادة ما يكون ضغط استنشاق كرات الدم الحمراء في نطاق Δp = -5 إلى -40 مم زئبق. يجب أن يكون هناك استطالة لسان ملحوظة داخل طرف الماصة الدقيقة (الشكل 2 د). - استمر في الضغط لفترة محددة مسبقا ؛ ثم حرر الضغط.
- حرك الماصة الدقيقة لالتقاط الخلية التالية وكرر التجربة.
7. تحليل شدة التألق
- قم بتحميل الصور الفلورية المحفوظة في برنامج التحليل.
- اضبط حد الكثافة باستخدام علامة تبويب ضبط العرض . قم بذلك إما عن طريق إدخال القيم يدويا أو استخدام شريط التمرير للتأكد من أن الصور الفلورية تظهر تباينا واضحا للخلية في برنامج التحليل (انظر الملف التكميلي 1-الشكل التكميلي S1).
- قم بالتمرير إلى المخطط الزمني في الجزء السفلي من البرنامج. حدد موقع حدث الطموح المعين.
- انقر على إضافة مساحات جديدة. حدد عائد الاستثمار للتحليل.
ملاحظة: يوفر البرنامج عملية موجهة من خمس خطوات لضبط وإكمال التجزئة (انظر الملف التكميلي 1-الشكل التكميلي S2 والشكل التكميلي S3).
ملاحظة: حافظ على عائد الاستثمار صغيرا قدر الإمكان لتوفير الموارد الحسابية. - استخدم منزلق الطرح في الخلفية واضبط حد التجزئة باستخدام شريط التمرير للحصول على أفضل نتيجة تجزئة.
ملاحظة: هذا يعني أنه بصرف النظر عن حدث الطموح ، يجب تقسيم الخلفية بأكبر قدر ممكن من الدقة (انظر الملف التكميلي 1-الشكل التكميلي S4 والشكل التكميلي S5). - أضف مرشح منطقة لاستبعاد ضوضاء الخلفية (انظر الملف التكميلي 1-الشكل التكميلي S6).
ملاحظة: يتم الانتهاء من ذلك في مرحلة ما بعد العملية. - حدد علامة التبويب الإحصائيات | علامة التبويب التفصيلية | علامة التبويب "متوسط القيم ". قم بالتمرير للعثور على متوسط الكثافة وتحديده (انظر الملف التكميلي 1-الشكل التكميلي S7).
- تصدير تتبع إشارة التألق بمرور الوقت إلى ملف .csv.
- افتح ملف csv الذي تم تصديره. اطرح إشارات الخلفية ، Fb ، من جميع القياسات.
- احسب التغير في شدة الكالسيوم ، ΔFmax ، باستخدام المعادلة (1):
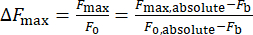 (1)
(1)
حيث ΔFmax هو الحد الأقصى لتغير شدة الكالسيوم ، Fb ، هي شدة الخلفية ، و F0 هي شدة الراحة.
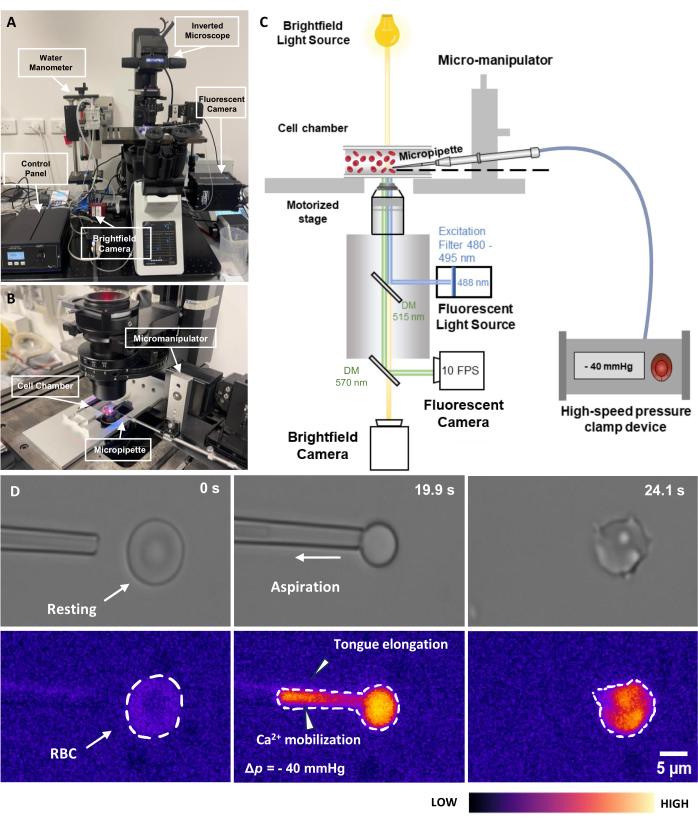
الشكل 2: مجموعة شفط الماصة الدقيقة المقترنة بالتألق. (أ) نظرة عامة على نظام أجهزة fMPA الذي يشتمل على المجهر المقلوب جنبا إلى جنب مع كاميرات برايت فيلد وفلورنس. يصور الجانب الأيسر من الصورة مقياس ضغط المياه محلي الصنع وصندوق التحكم الذي يسمح بضبط ضغط مضخة الضغط الهوائية بدقة. (ب) مرحلة المجهر التي تصور غرفة خلية التجربة ونظام المناور الدقيق بماصة مجهرية واحدة. (ج) رسم تخطيطي لإعداد نظام fMPA. التصوير المتزامن لإشارات برايت فيلد (الأصفر) والتألق (الانبعاث الأزرق ، الإثارة الخضراء) باستخدام مرآتين مزدوجتي اللون لتوجيه مسارات الضوء من مصدر الضوء الفلوري (الأزرق) إلى الهدف ، ثم إلى الكاميرات للتصوير (الأخضر). (د) يصور الصف العلوي صور الحقل الساطع بينما يوضح الصف السفلي صور التألق. يمثل اليسار موضع الماصة الدقيقة قبل الشفط عندما يكون كرات الدم الحمراء في حالة سكون. يلتقط العمود الأوسط عملية الشفط حيث تتعرض كرات الدم الحمراء لضغط سلبي يبلغ -40 مم زئبق. يصور اليمين مورفولوجيا الخلية بعد التعرض لضغط الشفط السلبي. شريط المقياس = 5 ميكرومتر. الاختصارات: fMPA = شفط الماصة الدقيقة المقترنة بالتألق ؛ DM = مرآة ثنائية اللون ؛ كرات الدم الحمراء = خلايا الدم الحمراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لإنشاء مقايسات شفط الماصة الدقيقة ، قمنا أولا ببناء غرفة خلية مخصصة تتكون من مربعين معدنيين (نحاس / ألومنيوم) متصلين بمقبض. تم لصق غطاءين زجاجيين من القطع الثالث (40 مم × 7 مم × 0.17 مم) لإنشاء غرفة مليئة ب 200 ميكرولتر من كرات الدم الحمراء المعلقة في Tyrode's Buffer. بعد إدخال كرات الدم الحمراء في الغرفة ...
Discussion
تجسد فحوصات شفط الماصة الدقيقة منهجية محسنة ، حيث تنشر تعديلا كبيرا للضغط ، وتنسيقا مكانيا دقيقا ، وتمييزا زمنيا موثوقا به لاستكشاف التعقيدات العميقة للميكانيكا الحيوية الخلوية. تركز هذه الدراسة بشكل خاص على تطبيق fMPA كأداة حاسمة للكشف عن الاستجابات الدقيقة الحساسة للميكانيكا التي أظهرت...
Disclosures
ويعلن المؤلفون أنه ليس لديهم مصالح متنافسة للإبلاغ عنها فيما يتعلق بهذه الدراسة.
Acknowledgements
نشكر نور عائشة زين العابدين ولورا مولدوفان على تجنيد متبرعين إضافيين وجمع الدم ودعم الفصد. نشكر توماس أندرسون وأريان ناصر على تنظيم المعدات والكواشف. تم تمويل هذا البحث من قبل مشروع اكتشاف مجلس البحوث الأسترالي (ARC) (DP200101970-L. أ. ج.) ؛ المجلس الوطني للصحة والبحوث الطبية (NHMRC) في أستراليا منحة الأفكار (APP2003904-L. أ. ج.) ؛ منحة معدات NHMRC - L.A.J. ؛ برنامج بناء قدرات القلب والأوعية الدموية في نيو ساوث ويلز (منحة الباحث في وقت مبكر من منتصف الحياة المهنية) ؛ منحة الابتكار البحثي NSW CVRN-VCCRI ؛ مكتب المشاركة العالمية والبحثية (جائزة التعاون في شراكة سيدني - غلاسكو - L.A.J.) ؛ LAJ هو زميل قائد المستقبل لمؤسسة القلب الوطنية المستوى 2 (105863) ، وزميل مؤسسة أبحاث الثلج الطبية (2022SF176).
Materials
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
References
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved