Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Аспирационный анализ флуоресцентной микропипетки для исследования механочувствия эритроцитов
В этой статье
Резюме
Изучение поведения клеток при механическом напряжении имеет решающее значение для достижений в клеточной механике и механобиологии. Мы представляем метод флуоресцентной микропипеточной аспирации (fMPA), новый метод, сочетающий контролируемую механическую стимуляцию с комплексным анализом внутриклеточной сигнализации в отдельных клетках. Этот метод исследует новые углубленные исследования механобиологии живых клеток.
Аннотация
Аспирационные анализы с помощью микропипеток уже давно являются краеугольным камнем для исследования механики живых клеток, давая представление о клеточных реакциях на механический стресс. В данной статье подробно описывается инновационная адаптация метода аспирации микропипеток с флуоресцентной связью (fMPA). Анализ fMPA дает возможность управлять точными механическими силами при одновременном мониторинге процессов механотрансдукции живых клеток, опосредованных ионными каналами. Сложная установка включает в себя прецизионную микропипетку из боросиликатного стекла, подключенную к точно регулируемому резервуару для воды и пневматической системе аспирации, что облегчает применение контролируемого давления с шагом ± 1 мм рт. ст. Существенным усовершенствованием является интеграция эпифлуоресцентной визуализации, позволяющая одновременно наблюдать и количественно оценивать морфологические изменения клеток и внутриклеточные потоки кальция во время аспирации. Анализ fMPA, благодаря синергетическому сочетанию эпифлуоресцентной визуализации с аспирацией микропипеток, устанавливает новый стандарт для изучения клеточного механочувствия в механически сложных средах. Этот многогранный подход может быть адаптирован к различным экспериментальным установкам, обеспечивая критически важное представление о механизмах механочувствительности отдельных клеток.
Введение
Открытия в мире клеточного поведения подчеркнули роль механических стимулов, таких как растяжение, напряжение сдвига жидкости, сжатие и жесткость субстрата, в определении динамических клеточных активностей, таких как адгезия, миграция и дифференциация. Эти механобиологические аспекты имеют первостепенное значение для выяснения того, как клетки взаимодействуют с физиологической средой и реагируют на нее, влияя на различные биологические процессы 1,2.
За последнее десятилетие аспирационные анализы на основе микропипеток стали универсальным инструментом в изучении различных клеточных реакций на механические раздражители. Этот метод дает ценную информацию о внутренних механических свойствах живых клеток на уровне одной клетки, включая модуль упругости клеток, жесткость и напряжение коры головного мозга. Эти анализы позволяют измерять различные механические параметры, такие как натяжение клеточной мембраны, давление, оказываемое на клеточную мембрану, и кортикальное напряжение (обобщенное в таблице 1). Изучение аспиративных сил обогатило наше понимание того, как они влияют на клеточные функции и процессы, особенно в области мембранной динамики, включая фрагментацию, удлинение и почкование 3,4.
| Механический параметр | Описание | Основополагающие подходы |
| Жесткость ячеек | Измерение механической жесткости и эластичности ячейки. | Аспирация клеточной мембраны и анализ деформационной реакции на отрицательное давление20,21. |
| Адгезионная прочность | Оценка того, насколько сильно клетки прилипают к поверхностям. | Применение контролируемого отсоса для отделения прилипших клеток от субстрата2,22. |
| Натяжение мембраны | Оценка напряжения или стресса в клеточных мембранах. | Измерение деформации мембраны в ответ на приложенное давление23,24. |
| Вязкоупругие свойства | Характеристика комбинированного вязкого и упругого поведения клетки. | Анализ нестационарной деформационной реакции на аспирацию23,25. |
| Деформативность | Определение того, насколько легко клетка может менять форму. | Оценка степени деформации при контролируемом всасывании20,24. |
| Поверхностное натяжение | Измерение натяжения на поверхности ячейки. | Оценка давления, необходимого для формирования выпячивания мембраны микропипетки26. |
| Взаимодействие клетки с материалом | Изучение взаимодействий между клетками и материалами или субстратами. | Аспирация клеток, контактирующих с различными материалами, и наблюдение за взаимодействиями2,24. |
| Межклеточное взаимодействие | Изучение взаимодействий между соседними клетками. | Аспирация группы клеток и анализ их межклеточных сил27. |
Таблица 1: Механические параметры, характеризуемые микропипеточным аспирационным анализом.
Метод аспирации на основе микропипеток широко используется для изучения эритроцитов (эритроцитов), оценки деформируемости и различных механических характеристик эритроцитов, что имеет важное значение для понимания их функции в системе кровообращения. Эритроциты демонстрируют замечательную приспособляемость, сохраняя свою механическую универсальность против деформации при навигации через сложную капиллярную сеть и межэндотелиальные щели 5,6. Во время этого путешествия эритроциты должны проходить через проходы шириной 0,5-1,0 мкм, подвергаясь воздействию множества механических сил, включая растяжение и сжатие 7,8,9. Они также обладают высокой чувствительностью к напряжению сдвига, создаваемому кровотоком во времяциркуляции 10. Эти процессы способствуют активации регуляторных механизмов, включающих приток кальция, важнейшее сигнальное событие, играющее хорошо известную роль в клеточных реакциях на механические раздражители11,12. Сложные механизмы, управляющие кальций-опосредованным механозондированием, остаются неотразимыми предметами продолжающихся исследований.
В этом контексте фМПА является эффективным подходом к выявлению степени мобилизации кальция при точно контролируемых механических силах, позволяющим одновременно применять механическую модуляцию (с помощью системы аспирации микропипеток) и визуализацию интенсивности кальция (с помощью флуоресцентных индикаторов). В частности, он имитирует физиологический сценарий, когда эритроциты проходят через сужающиеся кровеносные сосуды. Стоит отметить, что разработанная нами система fMPA может генерировать давление с разрешением 1 мм рт. Реализованная высокоскоростная камера позволяет достигать временного разрешения 100 мс и пространственного разрешения на уровне субмикронного метра. Эти конфигурации обеспечивают точное приложение механических сил к живым клеткам и одновременно улавливают результирующую клеточную сигнализацию. Кроме того, благодаря интегративному инженерному характеру этой установки, аспирационный анализ с помощью микропипеток может быть легко адаптирован к другому оборудованию или методам, что позволяет глубже исследовать тонкости клеточной механики. Эта универсальность является дополнительным преимуществом такого подхода.
протокол
Этот протокол соответствует руководящим принципам и был одобрен Комитетом по этике исследований на людях Сиднейского университета. Для проведения данного исследования было получено информированное согласие доноров.
1. Изоляция эритроцитов человека
ПРИМЕЧАНИЕ: Шаг 1.1 должен выполняться квалифицированным флеботомистом с использованием протокола, одобренного Институциональным наблюдательным советом.
- Возьмите 5 мл крови из срединной кубитальной вены с помощью иглы-бабочки 19 G.
- Переложите собранную кровь в пробирку объемом 15 мл, содержащую эноксапарин в соотношении 1:200 для предотвращения свертывания крови.
- Развести 5 мкл эноксапарин-антикоагулянтной крови в 1 мл карбонатного/бикарбонатного буфера (С-буфер, рН = 8,5-9; Оглавление материалов).
- Центрифугируют разбавленный образец крови при 900 × г в течение 1 мин для осаждения эритроцитов. Осторожно сцедите надосадочную жидкость, не повредив гранулу.
- Проводят две промывки гранул эритроцитов 1 мл С-буфера (таблица материалов), каждый раз центрифугируя при 900 × г в течение 1 мин.
- Затем промывают гранулу эритроцитов 2 раза 1 мл буфера Tyrode, используя те же условия центрифугирования, а затем повторно суспендируют конечную гранулу в 1 мл буфера Tyrode для получения суспензии промытых эритроцитов.
2. Нагрузка кальциевым индикатором
- Отрегулируйте концентрацию промытого исходного раствора эритроцитов до 10 × 106 клеток/мл в буфере Tyrode на основе количества клеток, полученного с помощью автоматического счетчика клеток (таблица материалов).
- Маркировку кальция внутри эритроцитов путем инкубации с кальций-чувствительным красителем Cal-520 AM 16,67 мкМ при перемешивании на ротационном трубчатом смесителе в течение 1 ч.
- Разбавьте эритроциты в буфере Tyrode, содержащем 0,5% бычьего сывороточного альбумина (БСА) в соотношении 1:50. Теперь клетки готовы к экспериментальному использованию.
3. Изготовление микропипеток
- Установите капиллярную трубку из боросиликатного стекла (наружный диаметр 1 мм x внутренний диаметр 0,6 мм) на съемник микропипеток P-1000 для получения двух соответствующих микропипеток с закрытыми наконечниками в месте вытягивания с помощью предварительно заданной программы вытягивания. Для этой настройки используйте следующие значения программы вытягивания: нагрев 516, тяга 150, скорость 75, время 250 и давление 500.
ПРИМЕЧАНИЕ: Параметры нагрева и вытягивания, заданные в программе вытягивания, могут быть настроены и зависят от желаемых настроек экспериментальной конструкции12. КОНТРОЛЬНАЯ ТОЧКА (см. Дополнительную таблицу S1). - Откройте закрытый наконечник, установив одну из микропипеток с закрытым концом, приобретенных после натягивания на резак для микропипеток. Отрегулируйте температуру нагрева примерно до 50-60 °C.
- Найдите микропипетку с помощью окуляра с 10-кратным увеличением. Переместите микропипетку ближе к шарику из боросиликатного стекла, используя ручки для регулировки.
- Установите окуляр на 30x, прежде чем расположить микропипетку как можно ближе к шарику боросиликатного стекла, не сгибая наконечник пипетки.
- Размягчите шарик боросиликатного стекла с помощью тепла, наступив на педаль нагрева. Осторожно вставьте необработанный закрытый наконечник микропипетки в размягченный шарик до тех пор, пока не будет достигнута желаемая конечная точка, диаметр отверстия.
- Отпустите педаль и дайте стеклянной бусине остыть. Следите за тем, чтобы кончик микропипетки всегда оставался внутри шарика.
ПРИМЕЧАНИЕ: Дальнейшая установка наконечника приводит к увеличению диаметра отверстия. - Осторожно извлеките микропипетку, чтобы получить четкий прямой срез на закрытой микропипетке. Убедитесь, что конечный диаметр капилляра составляет 1 мкм.
ПРИМЕЧАНИЕ: КОНТРОЛЬНАЯ ТОЧКА (см. Дополнительную таблицу S1)
4. Подготовка камеры ячейки
- С помощью алмазного карандаша разделите стандартный стеклянный листок размером 40 мм x 22 мм x 0,17 мм на три равные полосы.
- Приклейте один кусок вырезанного стеклянного защитного стекла к нижней части самодельного держателя камеры с помощью вакуумной смазки.
ПРИМЕЧАНИЕ: Держатель патронника состоит из двух металлических (медных/алюминиевых) квадратов, соединенных изогнутой ручкой. Расстояние между металлическими блоками должно быть менее 40 мм, чтобы разрезанный покровный щиток прилегал к держателю и образовывал параллельную камеру. - Приклейте второй кусок вырезанного стеклянного покровного стекла к верхней части самодельного держателя камеры с помощью вакуумной смазки.
ПРИМЕЧАНИЕ: КОНТРОЛЬНАЯ ТОЧКА (см. Дополнительную таблицу S1) - Введите 200 мкл меченой суспензии эритроцитов между двумя покровными стеклами с помощью пистолета-пипетки на 200 мкл (рис. 1).
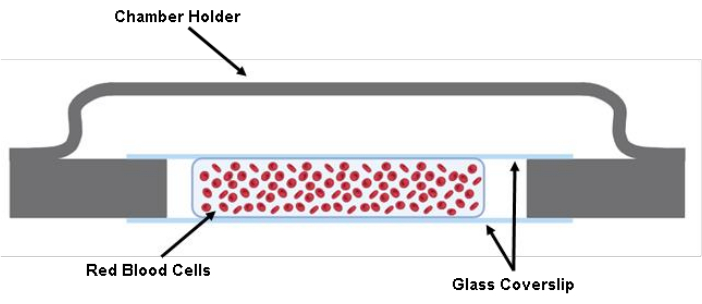
Рисунок 1: Иллюстрация камеры ячейки. Два вырезанных куска стеклянной крышки размером 40 мм x 22 мм x 0,17 мм приклеиваются к держателю камеры с помощью смазки. Между двумя вырезанными стеклянными покровными стеклами помещается примерно 200 мкл клеточного раствора в буфере Tyrode. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
5. Узел аспирации микропипетки
- Установите камеру ячейки на столик-держатель, установленный на платформе микроскопа. Отрегулируйте положение так, чтобы камера ячейки находилась прямо над объективом (Рисунок 2B).
- Опустите держатель микропипетки ниже уровня жидкости в подключенном резервуаре для воды.
- Введите деминерализованную воду или буфер Tyrode в изготовленную микропипетку и осторожно удалите все пузырьки воздуха с помощью шприца в сочетании с иглой 34 G (см. Таблицу материалов).
- Отвинтите конец держателя микропипетки наполовину и дайте воде стечь из держателя микропипетки в течение нескольких секунд.
ПРИМЕЧАНИЕ: КОНТРОЛЬНАЯ ТОЧКА (см. Дополнительную таблицу S1) - Вставьте микропипетку в наконечник держателя. Затяните винт держателя, чтобы убедиться, что микропипетка зафиксирована.
- Вставьте микропипетку в камеру клетки и найдите микропипетку и эритроциты под микроскопом. Используйте микроманипулятор для регулировки положения.
- Опустите наконечник микропипетки еще ниже, чтобы убедиться, что наконечник находится на одном уровне с расположенными эритроцитами.
ПРИМЕЧАНИЕ: КОНТРОЛЬНАЯ ТОЧКА (см. Дополнительную таблицу S1) - Обнулите гидравлическое давление на наконечнике микропипетки, отрегулировав высоту резервуара для воды. Затем слегка приподнимите резервуар для воды, чтобы создать легкое положительное давление на кончике.
6. Выполните аспирационный анализ микропипеток с флуоресцентной связью
- Включите источник флуоресцентного возбуждающего света с длиной волны 488 нм. Не включайте флуоресцентный затвор на этом этапе, чтобы избежать фотообесцвечивания (Рисунок 2C). Включите флуоресцентную камеру и передающую камеру.
ПРИМЕЧАНИЕ: Обе камеры управляются с помощью соответствующего программного обеспечения (см. Таблицу материалов). - Установите желаемое время экспозиции (100 мс для обеих камер в этом исследовании), область интереса (ROI), размер биннинга (нет для этого исследования) для обеих камер в программном обеспечении. Откройте панель многомерного сбора , чтобы установить номер кадра съемки, 2 000 для этого исследования и каталог сохранения.
ПРИМЕЧАНИЕ: Номер кадра регистрации зависит от желаемого количества событий аспирации, которые должны быть записаны. Для 1 события аспирации диапазон числа захвата должен быть установлен в пределах 100-500, что составляет примерно 10-50 с. - Найдите микропипетку под полем зрения с помощью микроманипулятора.
- Включите пневматический зажим давления, включая блок управления и систему зажимов (Рисунок 2A). Убедитесь, что блок управления находится в режиме EXTRNL. Компенсируйте любое смещение давления внутри системы, медленно вращая ручку.
- Включите отдельное программное обеспечение, которое управляет пневматическим зажимом. Программное обеспечение имеет электрическую панель управления для управления дискретным аналоговым входом в систему зажимов. Давление регулируется с помощью коэффициента пересчета 20 мВ/мм рт.ст.
- Обнулите давление внутри системы. Осторожно расположите микропипетку близко к эритроцитам. Отрегулируйте положение резервуара для воды до тех пор, пока на кончике микропипетки не появится легкое положительное давление.
- Запустите съемку в программном обеспечении, управляющем камерой. Включите люминесцентный затвор.
- Аспирируйте эритроциты, введя рассчитанную величину напряжения в панель управления, чтобы достичь желаемого давления.
ПРИМЕЧАНИЕ: Давление для аспирации эритроцитов обычно находится в диапазоне Δp = от -5 до -40 мм рт.ст. В пределах кончика микропипетки должно быть заметное удлинение языка (рис. 2D). - Удерживайте давление в течение заданного периода времени; Затем ослабьте давление.
- Переместите микропипетку, чтобы взять следующую клетку, и повторите эксперимент.
7. Анализ интенсивности флуоресценции
- Загрузите сохраненные флуоресцентные изображения в аналитическое программное обеспечение.
- Отрегулируйте порог интенсивности с помощью вкладки настройки дисплея . Это можно сделать, либо вручную введя значения, либо используя ползунок, чтобы убедиться, что флуоресцентные изображения показывают четкий контраст клетки в аналитическом программном обеспечении (см. Дополнительный файл 1 - Дополнительный рисунок S1).
- Прокрутите страницу до временной шкалы в нижней части программного обеспечения. Найдите обозначенное событие аспирации.
- Нажмите кнопку Добавить новые поверхности. Определите рентабельность инвестиций в анализ.
ПРИМЕЧАНИЕ: Программное обеспечение предоставляет управляемый пятиступенчатый процесс для настройки и завершения сегментации (см. Дополнительный файл 1 - Дополнительный рисунок S2 и Дополнительный рисунок S3).
ПРИМЕЧАНИЕ: Держите окупаемость инвестиций как можно меньше, чтобы сэкономить вычислительные ресурсы. - Используйте ползунок «Вычитание фона» и отрегулируйте порог сегментации с помощью ползунка, чтобы получить наилучший результат сегментации.
ПРИМЕЧАНИЕ: Это означает, что, за исключением события аспирации, фон должен быть сегментирован как можно точнее (см. Дополнительный файл 1 - Дополнительный рисунок S4 и Дополнительный рисунок S5). - Добавьте фильтр по площади для исключения фоновых шумов (см. Дополнительный файл 1-Дополнительный рисунок S6).
ПРИМЕЧАНИЕ: Это выполняется на этапе постобработки. - Выберите вкладку статистики | Подробная вкладка | вкладка «Средние значения ». Прокрутите, чтобы найти и выбрать среднее значение интенсивности (см. Дополнительный файл 1 - Дополнительный рисунок S7).
- Экспортируйте трассировку сигнала флуоресценции с течением времени в файл .csv.
- Откройте экспортированный CSV-файл. Вычтите фоновые сигналы, Fb, из всех измерений.
- Рассчитайте изменение интенсивности кальция, ΔFmax, используя уравнение (1):
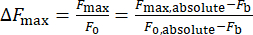 (1)
(1)
Где ΔFmax — максимальное изменение интенсивности кальция, Fb — интенсивность фона, а F0 — интенсивность покоя.
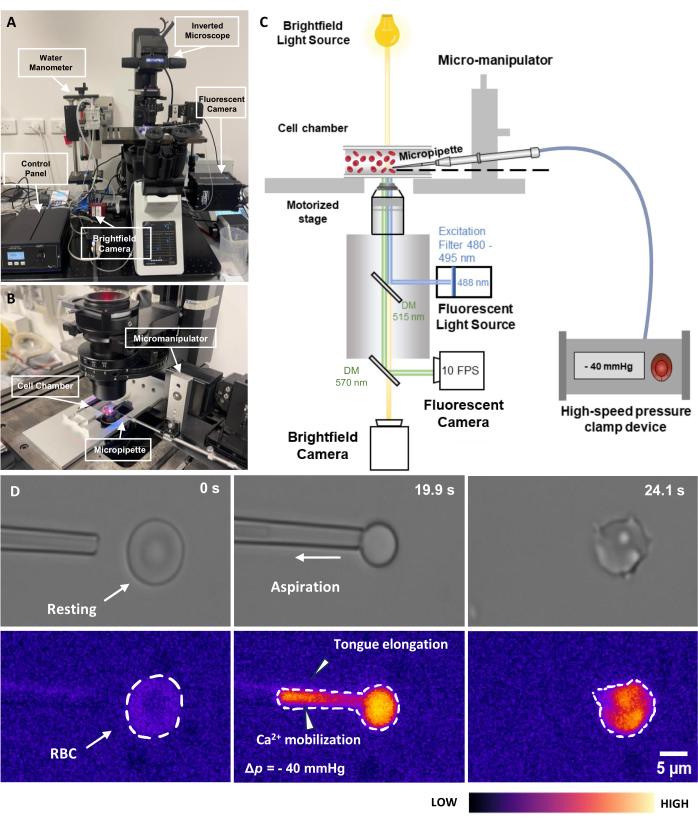
Иллюстрация 2: Узел аспирации микропипеток с флуоресцентной связью. (A) Обзор аппаратной системы fMPA, включающей инвертированный микроскоп в сочетании со светлопольной и флуоресцентной камерами. В левой части изображения изображен самодельный водяной манометр и блок управления, позволяющий точно настроить давление пневматического нагнетательного насоса. (B) Столик микроскопа, изображающий камеру экспериментальной ячейки и систему микроманипулятора с одной микропипеткой. (C) Схема настройки системы fMPA. Одновременная визуализация светлопольных (желтый) и флуоресцентных (синее излучение, зеленое возбуждение) сигналов с использованием двух дихроичных зеркал для направления световых путей от источника флуоресцентного света (синий) к мишени, а затем к камерам для получения изображения (зеленый). (D) В верхнем ряду показаны изображения светлого поля, а в нижнем — флуоресцентные изображения. Слева показано положение микропипетки перед аспирацией, когда эритроциты находятся в состоянии покоя. В средней колонке показан процесс аспирации, в котором эритроциты испытывают отрицательное давление -40 мм рт. Справа показана морфология клеток после отрицательного аспирационного давления. Масштабная линейка = 5 мкм. Сокращения: fMPA = Аспирация микропипеток с флуоресцентной связью; DM = дихроичное зеркало; эритроциты = эритроциты. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Для проведения аспирационных анализов с помощью микропипеток мы сначала построили специальную камеру, состоящую из двух металлических квадратов (медь/алюминий), соединенных ручкой. Два стеклянных покровных стекла (40 мм × 7 мм × 0,17 мм) были прикреплены для создания камеры, заполненной 200 ...
Обсуждение
Аспирационные анализы с помощью микропипеток воплощают в себе усовершенствованную методологию, использующую существенную модуляцию давления, точную пространственную оркестровку и надежное временное различение для исследования глубоких тонкостей клеточной биомеханики. В этом иссл...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов, которые они могли бы сообщить в отношении настоящего исследования.
Благодарности
Мы благодарим Нурул Айшу Зайнал Абидин и Лауру Молдован за дополнительный набор доноров, сбор крови и поддержку флеботомии. Мы благодарим Томаса Андерсона и Ариана Насера за организацию оборудования и реагентов. Это исследование финансировалось Австралийским исследовательским советом (ARC) Discovery Project (DP200101970-L. А.Дж.); Грант Национального совета по здравоохранению и медицинским исследованиям (NHMRC) Австралии (APP2003904-L. А.Дж.); NHMRC Equipment Grant-L.A.J.; Программа наращивания потенциала в области сердечно-сосудистых заболеваний штата Новый Южный Уэльс (Грант для исследователей в начале и середине карьеры, Лос-Анджелес); Грант на исследовательские инновации NSW CVRN-VCCRI; Управление по глобальному и научно-исследовательскому взаимодействию (Премия за сотрудничество в партнерстве между Сиднеем и Глазго, Лос-Анджелес); L.A.J. является стипендиатом Национального фонда сердца 2-го уровня (105863) и стипендиатом Фонда медицинских исследований снега (2022SF176).
Материалы
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
Ссылки
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены