Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Test d’aspiration par micropipette à fluorescence pour étudier la mécanodétection des globules rouges
Dans cet article
Résumé
L’exploration du comportement cellulaire sous stress mécanique est essentielle pour les progrès de la mécanique cellulaire et de la mécanobiologie. Nous introduisons la technique d’aspiration par micropipette de fluorescence (fMPA), une nouvelle méthode combinant une stimulation mécanique contrôlée avec une analyse complète de la signalisation intracellulaire dans des cellules individuelles. Cette technique étudie de nouvelles études approfondies de la mécanobiologie des cellules vivantes.
Résumé
Les tests d’aspiration par micropipette ont longtemps été la pierre angulaire de l’étude de la mécanique des cellules vivantes, offrant des informations sur les réponses cellulaires au stress mécanique. Cet article détaille une adaptation innovante du test d’aspiration par micropipette couplée à la fluorescence (fMPA). Le test fMPA introduit la capacité d’administrer des forces mécaniques précises tout en surveillant simultanément les processus de mécanotransduction des cellules vivantes médiés par les canaux ioniques. L’installation sophistiquée intègre une micropipette en verre borosilicaté de précision connectée à un réservoir d’eau finement régulé et à un système d’aspiration pneumatique, facilitant l’application d’une pression contrôlée avec des incréments allant jusqu'± 1 mmHg. Une amélioration significative est l’intégration de l’imagerie par épifluorescence, permettant l’observation et la quantification simultanées des changements morphologiques cellulaires et des flux de calcium intracellulaires pendant l’aspiration. Le test fMPA, grâce à sa combinaison synergique d’imagerie par épifluorescence et d’aspiration par micropipette, établit une nouvelle norme pour l’étude de la mécanodétection cellulaire dans des environnements mécaniquement difficiles. Cette approche multidimensionnelle est adaptable à diverses configurations expérimentales, fournissant des informations essentielles sur les mécanismes de mécanodétection unicellulaires.
Introduction
Les découvertes en cours dans le monde des comportements cellulaires ont accentué le rôle des stimuli mécaniques, tels que la tension, la contrainte de cisaillement des fluides, la compression et la rigidité du substrat, dans la dictature des activités cellulaires dynamiques telles que l’adhésion, la migration et la différenciation. Ces aspects mécanobiologiques sont d’une importance capitale pour élucider comment les cellules interagissent avec leur environnement physiologique et y répondent, ce qui a un impact sur divers processus biologiques 1,2.
Au cours de la dernière décennie, les tests d’aspiration à base de micropipettes se sont imposés comme un outil polyvalent dans l’étude de diverses réponses cellulaires aux stimuli mécaniques. Cette technique offre des informations précieuses sur les propriétés mécaniques intrinsèques des cellules vivantes au niveau de la cellule unique, y compris le module d’élasticité cellulaire, la rigidité et la tension corticale. Ces tests permettent de mesurer divers paramètres mécaniques, tels que la tension de la membrane cellulaire, la pression exercée sur la membrane cellulaire et la tension corticale (résumée dans le tableau 1). L’étude des forces aspirationnelles a enrichi notre compréhension de la façon dont elles influencent les fonctions et les processus cellulaires, en particulier dans le domaine de la dynamique membranaire, y compris la fragmentation, l’élongation et le bourgeonnement 3,4.
| Paramètre mécanique | Description | Approches fondamentales |
| Rigidité cellulaire | Mesure de la rigidité mécanique et de l’élasticité d’une cellule. | Aspiration de la membrane cellulaire et analyse de la réponse de déformation à la pression négative20,21. |
| Force d’adhérence | Évaluation de la force d’adhérence des cellules aux surfaces. | Application d’une aspiration contrôlée pour détacher les cellules collées d’un substrat2,22. |
| Membrane Tension | Évaluation de la tension ou du stress au sein des membranes cellulaires. | Mesure de la déformation de la membrane en réponse à la pression appliquée23,24. |
| Propriétés viscoélastiques | Caractérisation du comportement visqueux et élastique combiné d’une cellule. | Analyse de la réponse de déformation à l’aspiration en fonction du temps23,25. |
| Déformabilité | Détermination de la facilité avec laquelle une cellule peut changer de forme. | Évaluation de l’étendue de la déformation sous aspiration contrôlée20,24. |
| Tension superficielle | Mesure de la tension à la surface de la cellule. | Évaluation de la pression nécessaire pour former une saillie de la membrane de la micropipette26. |
| Interaction cellule-matériau | Etude des interactions entre les cellules et les matériaux ou substrats. | Aspiration de cellules en contact avec différents matériaux et observation des interactions2,24. |
| Interaction cellule-cellule | Examen des interactions entre cellules voisines. | Aspiration d’un groupe de cellules et analyse de leurs forces intercellulaires27. |
Tableau 1 : Paramètres mécaniques caractérisés par le test d’aspiration par micropipette.
La technique d’aspiration à base de micropipettes a été largement utilisée pour étudier les globules rouges (GR), en évaluant la déformabilité et diverses caractéristiques mécaniques des globules rouges, ce qui est essentiel pour comprendre leur fonction dans le système circulatoire. Les globules rouges présentent une adaptabilité remarquable, préservant leur polyvalence mécanique contre la déformation lors de la navigation dans le réseau capillaire complexe et les fentes inter-endothéliales 5,6. Au cours de ce voyage, les globules rouges doivent traverser des passages aussi étroits que 0,5 à 1,0 μm, se soumettant à une multitude de forces mécaniques, y compris la tension et la compression 7,8,9. Ils ont également une grande sensibilité à la contrainte de cisaillement générée par le flux sanguin pendant la circulation10. Ces processus favorisent l’activation de mécanismes de régulation impliquant l’afflux de calcium, un événement de signalisation crucial dont le rôle est bien établi dans les réponses cellulaires aux stimuli mécaniques11,12. Les mécanismes complexes régissant la mécanodétection médiée par le calcium restent des sujets de recherche convaincants.
Dans ce contexte, le fMPA est une approche efficace pour révéler l’étendue de la mobilisation du calcium sous des forces mécaniques contrôlées avec précision, permettant l’application simultanée de la modulation mécanique (à l’aide du système d’aspiration par micropipette) et de la visualisation de l’intensité du calcium (à l’aide d’indicateurs fluorescents). Il imite particulièrement le scénario physiologique lorsque le GR se déplace à travers des vaisseaux sanguins rétrécis. Il convient de noter que le système d’AMPf que nous avons développé peut générer de la pression avec une résolution de 1 mmHg. La caméra haute vitesse mise en œuvre peut atteindre une résolution temporelle de 100 ms et une résolution spatiale au niveau du mètre submicronique. Ces configurations assurent l’application précise des forces mécaniques aux cellules vivantes et capturent simultanément la signalisation cellulaire résultante. De plus, en raison de la nature technique intégrative de cette configuration, le test d’aspiration par micropipette peut être facilement adapté pour compléter d’autres équipements ou techniques, permettant une exploration plus approfondie des subtilités de la mécanique cellulaire. Cette polyvalence constitue un avantage supplémentaire de cette approche.
Protocole
Ce protocole suit les directives du Comité d’éthique de la recherche sur l’être humain de l’Université de Sydney et a été approuvé par celui-ci. Le consentement éclairé des donateurs a été obtenu pour cette étude.
1. Isolement des globules rouges humains
REMARQUE : L’étape 1.1 doit être effectuée par un phlébotomiste formé selon un protocole approuvé par le comité d’examen institutionnel.
- Prélevez 5 ml de sang de la veine cubitale médiane à l’aide d’une aiguille papillon de 19 G.
- Transférez le sang prélevé dans un tube de 15 mL contenant de l’énoxaparine 1:200 pour empêcher la coagulation.
- Diluer 5 μL de sang anticoagulé à l’énoxaparine dans 1 mL de tampon carbonate/bicarbonate (tampon C, pH = 8,5-9 ; Table des matériaux).
- Centrifuger l’échantillon de sang dilué à 900 × g pendant 1 min pour sédimenter les globules rouges.
- Effectuer deux lavages de la pastille de globules rouges avec 1 mL de tampon C (table des matériaux), en centrifugeant à chaque fois à 900 × g pendant 1 min.
- Par la suite, laver la pastille de globules rouges 2x avec 1 mL de tampon de Tyrode en utilisant les mêmes conditions de centrifugation, puis remettre en suspension la pastille finale dans 1 mL de tampon de Tyrode pour obtenir la suspension de globules rouges lavée.
2. Charge de l’indicateur de calcium
- Ajuster la concentration de la solution de globules rouges lavés à 10 × 106 cellules/mL dans le tampon de Tyrode, en fonction du nombre de cellules obtenu à l’aide d’un compteur automatique de cellules (tableau des matériaux).
- Étiqueter le calcium à l’intérieur des globules rouges en l’incubant avec 16,67 μM Cal-520 AM, un colorant sensible au calcium, tout en agitant sur un mélangeur à tube rotatif pendant 1 h.
- Diluer les globules rouges dans le tampon de Tyrode contenant 0,5 % d’albumine sérique bovine (BSA) dans un rapport de 1:50. Les cellules sont maintenant prêtes pour une utilisation expérimentale.
3. Fabrication de micropipettes
- Montez le tube capillaire en verre borosilicaté (diamètre extérieur de 1 mm x diamètre intérieur de 0,6 mm) sur l’extracteur de micropipettes P-1000 pour produire deux micropipettes correspondantes avec des pointes fermées sur le site de tirage à l’aide du programme de tirage prédéfini. Pour cette configuration, utilisez les valeurs de programme de tirage suivantes : heat 516, pull 150, velocity 75, time 250 et pressure 500.
REMARQUE : Les paramètres de chauffage et de traction définis dans le programme de traction peuvent être personnalisés et dépendent des paramètres souhaités de la conception expérimentale12. CHECKPOINT (voir tableau supplémentaire S1). - Ouvrez la pointe fermée en montant l’une des micropipettes à extrémité fermée obtenues après avoir tiré sur le coupe-micropipette. Réglez la température de chauffage à environ 50-60 °C.
- Localisez la micropipette à l’aide d’un oculaire 10x. Déplacez la micropipette près de la perle de verre borosilicate en utilisant les boutons pour le réglage.
- Réglez l’oculaire à 30x avant de positionner la micropipette aussi près que possible de la perle de verre borosilicate sans plier la pointe de la pipette.
- Ramollissez la perle de verre borosilicate à l’aide de la chaleur en appuyant sur la pédale de chauffage. Insérez délicatement la pointe de micropipette fermée brute dans la perle ramollie jusqu’à ce que le point final souhaité, le diamètre d’ouverture, soit atteint.
- Relâchez la pédale et laissez refroidir la perle de verre. Assurez-vous que la pointe de la micropipette reste toujours à l’intérieur de la perle.
REMARQUE : L’insertion de l’embout conduit à des diamètres d’ouverture plus importants. - Extraire délicatement la micropipette, ce qui permet d’obtenir une coupe nette et droite sur la micropipette fermée. Confirmez que le diamètre final du capillaire est de 1 μm.
NOTE : POINT DE CONTRÔLE (voir le tableau supplémentaire S1)
4. Préparation de la chambre cellulaire
- Utilisez un crayon diamant pour diviser une lamelle en verre standard de 40 mm x 22 mm x 0,17 mm en trois bandes égales.
- Collez un morceau de lamelle en verre taillé au fond d’un support de chambre fait maison avec de la graisse sous vide.
REMARQUE : Le support de chambre se compose de deux carrés métalliques (cuivre/aluminium) reliés par une poignée incurvée. La distance entre les blocs métalliques doit s’étendre sur moins de 40 mm pour que la lamelle coupée adhère au support pour former une chambre parallèle. - Collez le deuxième morceau de lamelle en verre taillé sur le dessus du support de chambre fait maison avec de la graisse sous vide.
NOTE : POINT DE CONTRÔLE (voir le tableau supplémentaire S1) - Injecter 200 μL de la suspension de globules rouges marqués entre deux lamelles à l’aide d’un pistolet pipette de 200 μL (figure 1).
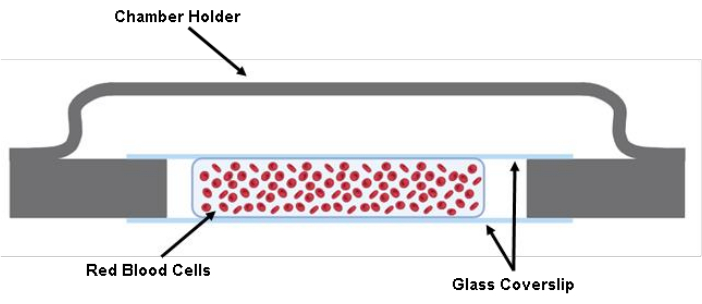
Figure 1 : Illustration de la chambre cellulaire. Deux morceaux coupés d’une lamelle de verre de 40 mm x 22 mm x 0,17 mm sont collés sur le support de chambre à l’aide de graisse. Entre les deux lamelles de verre taillé, environ 200 μL de la solution cellulaire dans le tampon de Tyrode sont ensemencés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Assemblage d’aspiration par micropipette
- Montez la chambre cellulaire sur la platine de support présente sur la plate-forme du microscope. Ajustez la position de manière à ce que la chambre de la cellule soit directement au-dessus de l’objectif (Figure 2B).
- Abaissez le porte-micropipette en dessous du niveau de liquide du réservoir d’eau connecté.
- Injectez de l’eau déminéralisée ou du tampon Tyrode dans la micropipette fabriquée et éliminez soigneusement toutes les bulles d’air à l’aide d’une seringue couplée à une aiguille de 34 G (voir le tableau des matériaux).
- Dévissez l’extrémité du porte-micropipette à mi-course et laissez l’eau s’égoutter du porte-micropipette pendant quelques secondes.
NOTE : POINT DE CONTRÔLE (voir le tableau supplémentaire S1) - Insérez la micropipette dans l’embout du support. Serrez la vis du support pour vous assurer que la micropipette est fixée.
- Insérez la micropipette dans la chambre cellulaire et localisez la micropipette et les globules rouges sous le microscope. Utilisez le micromanipulateur pour régler la position.
- Abaissez davantage la pointe de la micropipette pour vous assurer que la pointe est au même niveau que le globule rouge localisé.
NOTE : POINT DE CONTRÔLE (voir le tableau supplémentaire S1) - Zéro pression hydraulique à l’extrémité de la micropipette en ajustant la hauteur du réservoir d’eau. Ensuite, soulevez légèrement le réservoir d’eau pour générer une pression positive subtile à l’extrémité.
6. Effectuer le test d’aspiration par micropipette couplée à la fluorescence
- Allumez la source lumineuse d’excitation fluorescente de 488 nm. N’activez pas l’obturateur de fluorescence à ce stade pour éviter le photoblanchiment (Figure 2C). Allumez la caméra de fluorescence et la caméra transmise.
REMARQUE : Les deux caméras fonctionnent à l’aide du logiciel approprié (voir Tableau des matériaux). - Configurez le temps d’exposition souhaité (100 ms pour les deux caméras de cette étude), la région d’intérêt (ROI), la taille de binning (aucune pour cette étude) pour les deux caméras dans le logiciel. Ouvrez le panneau d’acquisition multidimensionnel pour configurer le numéro de trame d’acquisition, 2 000 pour cette étude, et le répertoire de sauvegarde.
REMARQUE : Le numéro de trame d’acquisition dépend du nombre souhaité d’événements d’aspiration à enregistrer. Pour 1 événement d’aspiration, la plage du nombre d’acquisition doit être définie entre 100 et 500, soit environ 10 à 50 s. - Trouvez la micropipette sous le champ de vision à l’aide du micromanipulateur.
- Activez la pince de pression pneumatique, y compris le boîtier de commande et le système de serrage (Figure 2A). Assurez-vous que le boîtier de commande est en mode EXTRNL. Compensez toute pression décalée à l’intérieur du système en tournant lentement le bouton.
- Activez le logiciel séparé qui contrôle la pince pneumatique. Le logiciel dispose d’un panneau de commande électrique pour contrôler l’entrée analogique discrète du système de serrage. La pression est contrôlée par un facteur de conversion de 20 mV/mmHg.
- Zéro pression à l’intérieur du système. Ajustez la position du réservoir d’eau jusqu’à ce qu’une pression positive subtile soit remarquée à l’extrémité de la micropipette.
- Démarrez l’acquisition dans le logiciel d’exploitation de l’appareil photo. Activez l’obturateur de fluorescence.
- Aspirez un RBC en tapant l’amplitude de tension calculée dans le panneau de commande pour atteindre la pression souhaitée.
REMARQUE : La pression d’aspiration d’un GR est généralement de l’ordre de Δp = -5 à -40 mmHg. Il doit y avoir un allongement notable de la langue dans la pointe de la micropipette (Figure 2D). - Maintenez la pression pendant une période prédéfinie ; Ensuite, relâchez la pression.
- Déplacez la micropipette pour prendre la cellule suivante et répétez l’expérience.
7. Analyse de l’intensité de fluorescence
- Chargez les images de fluorescence enregistrées dans le logiciel d’analyse.
- Ajustez le seuil d’intensité à l’aide de l’onglet de réglage de l’affichage . Pour ce faire, saisissez manuellement les valeurs ou utilisez le curseur pour vous assurer que les images de fluorescence montrent un contraste clair de la cellule dans le logiciel d’analyse (voir Fichier supplémentaire 1-Figure supplémentaire S1).
- Faites défiler jusqu’à la chronologie en bas du logiciel. Localisez l’événement d’aspiration désigné.
- Cliquez sur Ajouter de nouvelles surfaces. Définissez le ROI de l’analyse.
REMARQUE : Le logiciel fournit un processus guidé en cinq étapes pour ajuster et compléter la segmentation (voir Fichier supplémentaire 1 - Figure supplémentaire S2 et Figure supplémentaire S3).
REMARQUE : Gardez le retour sur investissement aussi faible que possible pour économiser les ressources de calcul. - Utilisez le curseur de soustraction d’arrière-plan et ajustez le seuil de segmentation à l’aide du curseur pour obtenir le meilleur résultat de segmentation.
REMARQUE : Cela signifie qu’en dehors de l’événement d’aspiration, le bruit de fond doit être segmenté aussi précisément que possible (voir Fichier supplémentaire 1 - Figure supplémentaire S4 et Figure supplémentaire S5). - Ajoutez un filtre de zone pour exclure les bruits de fond (voir Fichier supplémentaire 1-Figure supplémentaire S6).
REMARQUE : Ceci est terminé à l’étape du post-traitement. - Sélectionnez l’onglet Statistiques | Onglet détaillé | Onglet Valeurs moyennes . Faites défiler pour trouver et sélectionner la moyenne d’intensité (voir le fichier supplémentaire 1 - Figure supplémentaire S7).
- Exportez la trace du signal de fluorescence au fil du temps dans un fichier .csv.
- Ouvrez le fichier csv exporté. Soustrayez les signaux de fond, Fb, de toutes les mesures.
- Calculer la variation de l’intensité calcique, ΔFmax, à l’aide de l’équation (1) :
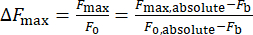 (1)
(1)
Où ΔFmax est la variation maximale de l’intensité calcique, Fb est l’intensité de fond et F0 est l’intensité au repos.
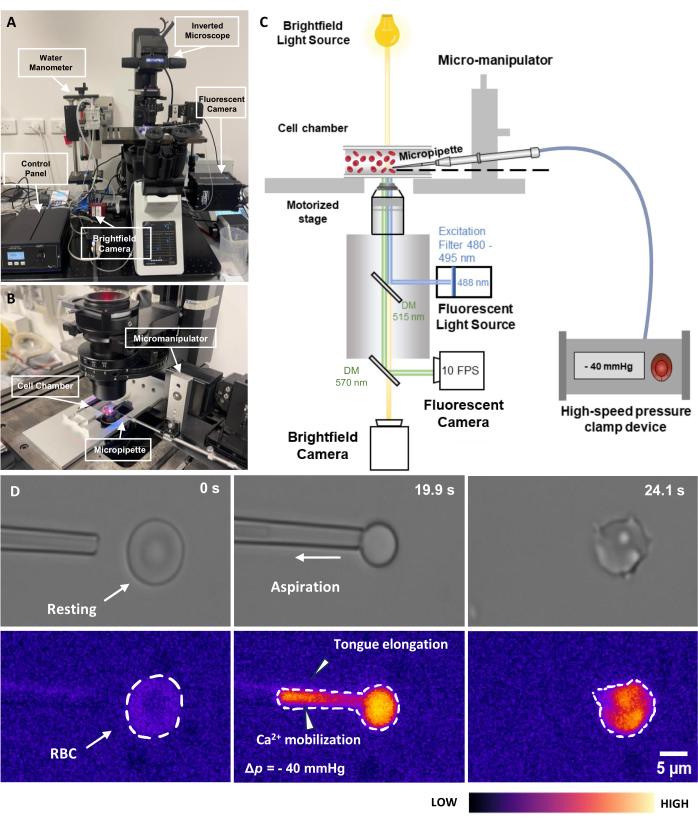
Figure 2 : Ensemble d’aspiration de micropipettes couplées à la fluorescence. (A) Présentation du système matériel fMPA incorporant le microscope inversé combiné aux caméras à fond clair et à fluorescence. Le côté gauche de l’image représente le manomètre à eau fait maison et le boîtier de commande qui permet de régler avec précision la pression de la pompe à pression pneumatique. (B) La platine du microscope représentant la chambre de la cellule d’expérimentation et le système de micromanipulateur avec une seule micropipette. (C) Schéma de la configuration du système fMPA. Imagerie simultanée des signaux en fond clair (jaune) et de fluorescence (émission bleue, excitation verte) utilisant deux miroirs dichroïques pour diriger les trajets lumineux de la source lumineuse de fluorescence (bleu) vers la cible, puis vers les caméras pour l’imagerie (vert). (D) La rangée supérieure représente les images en fond clair tandis que la rangée inférieure montre les images de fluorescence. La gauche représente la position de la micropipette avant l’aspiration lorsque le globule rouge est au repos. La colonne du milieu illustre le processus d’aspiration où le GR subit une pression négative de -40 mmHg. La droite représente la morphologie cellulaire après avoir subi la pression d’aspiration négative. Barre d’échelle = 5 μm. Abréviations : fMPA = Fluorescence-coupled Micropipette Aspiration ; DM = miroir dichroïque ; GR = globule rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Pour établir des tests d’aspiration par micropipette, nous avons d’abord construit une chambre cellulaire sur mesure comprenant deux carrés métalliques (cuivre/aluminium) reliés par une poignée. Deux lamelles de verre de troisième taille (40 mm × 7 mm × 0,17 mm) ont été apposées pour créer une chambre remplie de 200 μL de globules rouges en suspension dans le tampon de Tyrode. Après avoir introduit des globules rouges dans la chambre, une micropipette en borosilicate sur mesure a été fixée sur un sup...
Discussion
Les tests d’aspiration par micropipette incarnent une méthodologie raffinée, déployant une modulation de pression substantielle, une orchestration spatiale exacte et un discernement temporel fiable pour sonder les subtilités profondes de la biomécanique cellulaire. Cette étude met particulièrement l’accent sur l’application de la MPMf en tant qu’outil crucial pour dévoiler les réponses mécanosensibles nuancées mises en évidence par les globules rouges sous divers stimuli. L’utilisation simultanée d...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents à signaler concernant la présente étude.
Remerciements
Nous remercions Nurul Aisha Zainal Abidin et Laura Moldovan pour le recrutement de donneurs, la collecte de sang et le soutien en matière de phlébotomie. Nous remercions Tomas Anderson et Arian Nasser pour l’organisation de l’équipement et des réactifs. Cette recherche a été financée par le projet de découverte du Conseil australien de la recherche (ARC) (DP200101970-L. A.J.) ; la subvention Ideas du National Health and Medical Research Council (NHMRC) d’Australie (APP2003904-L. A.J.) ; Subvention d’équipement du NHMRC-L.A.J. ; Programme de renforcement des capacités cardiovasculaires de la Nouvelle-Galles du Sud (subvention de chercheur en début et milieu de carrière) ; Subvention d’innovation en recherche CVRN-VCCRI de la Nouvelle-Galles du Sud ; Bureau de l’engagement mondial et de la recherche (Sydney-Glasgow Partnership Collaboration Award-L.A.J.) ; L.A.J. est membre de la National Heart Foundation Future Leader Fellow de niveau 2 (105863) et de la Snow Medical Research Foundation (2022SF176).
matériels
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
Références
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon