Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kırmızı Kan Hücresi Mekanosalgılamasını Araştırmak için Floresan Mikropipet Aspirasyon Testi
Bu Makalede
Özet
Mekanik stres altında hücresel davranışın araştırılması, hücresel mekanik ve mekanobiyolojideki ilerlemeler için çok önemlidir. Kontrollü mekanik stimülasyonu tek hücrelerde hücre içi sinyallemenin kapsamlı analizi ile birleştiren yeni bir yöntem olan Floresan Mikropipet Aspirasyonu (fMPA) tekniğini sunuyoruz. Bu teknik, canlı hücre mekanobiyolojisinin yeni derinlemesine çalışmalarını araştırır.
Özet
Mikropipet aspirasyon testleri, canlı hücre mekaniğinin araştırılması için uzun süredir bir mihenk taşı olmuştur ve mekanik strese hücresel tepkiler hakkında içgörüler sunmaktadır. Bu makale, floresan bağlantılı mikropipet aspirasyonu (fMPA) testinin yenilikçi bir uyarlamasını detaylandırmaktadır. fMPA testi, iyon kanallarının aracılık ettiği canlı hücre mekanotransdüksiyon süreçlerini eşzamanlı olarak izlerken hassas mekanik kuvvetleri yönetme yeteneğini sunar. Gelişmiş kurulum, hassas bir şekilde düzenlenmiş bir su haznesine ve pnömatik aspirasyon sistemine bağlı, hassas bir şekilde tasarlanmış bir borosilikat cam mikropipet içerir ve 1 mmHg'± kadar rafine artışlarla kontrollü basınç uygulamasını kolaylaştırır. Önemli bir gelişme, aspirasyon sırasında hücre morfolojik değişikliklerinin ve hücre içi kalsiyum akışlarının eşzamanlı olarak gözlemlenmesine ve ölçülmesine izin veren epi-floresan görüntülemenin entegrasyonudur. fMPA testi, epi-floresan görüntülemenin mikropipet aspirasyonu ile sinerjik kombinasyonu sayesinde, mekanik olarak zorlu ortamlarda hücre mekanizasyonu çalışması için yeni bir standart belirliyor. Bu çok yönlü yaklaşım, çeşitli deney düzeneklerine uyarlanabilir ve tek hücreli mekanoalgılama mekanizmalarına ilişkin kritik bilgiler sağlar.
Giriş
Hücresel davranışlar dünyasında ortaya çıkan keşifler, yapışma, göç ve farklılaşma gibi dinamik hücresel aktiviteleri dikte etmede gerilim, sıvı kesme gerilimi, sıkıştırma ve substrat sertliği gibi mekanik uyaranların rolünü vurgulamıştır. Bu mekanobiyolojik yönler, hücrelerin fizyolojik çevreleriyle nasıl etkileşime girdiğini ve bunlara nasıl tepki verdiğini aydınlatmada büyük önem taşır ve çeşitli biyolojik süreçleri etkiler 1,2.
Son on yılda, mikropipet bazlı aspirasyon testleri, mekanik uyaranlara verilen çeşitli hücresel tepkilerin incelenmesinde çok yönlü bir araç olarak öne çıkmıştır. Bu teknik, hücresel elastik modül, sertlik ve kortikal gerginlik dahil olmak üzere tek hücre düzeyinde canlı hücrelerin içsel mekanik özellikleri hakkında değerli bilgiler sunar. Bu tahliller, hücre zarı gerginliği, hücre zarına uygulanan basınç ve kortikal gerginlik gibi çeşitli mekanik parametrelerin ölçülmesini sağlar (Tablo 1'de özetlenmiştir). İlham verici kuvvetleri incelemek, özellikle parçalanma, uzama ve tomurcuklanmadahil olmak üzere zar dinamiği alanında, hücresel işlevleri ve süreçleri nasıl etkilediklerine dair anlayışımızı zenginleştirmiştir 3,4.
| Mekanik Parametre | Tarif | Ufuk açıcı yaklaşımlar |
| Hücre Sertliği | Bir hücrenin mekanik sertliğinin ve elastikiyetinin ölçülmesi. | Hücre zarının aspirasyonu ve negatif basınca deformasyon tepkisinin analizi20,21. |
| Yapışma Dayanımı | Hücrelerin yüzeylere ne kadar güçlü yapıştığının değerlendirilmesi. | Yapışan hücreleri bir substrattan ayırmak için kontrollü emme uygulaması2,22. |
| Membran Gerginliği | Hücre zarlarındaki gerginlik veya stresin değerlendirilmesi. | Uygulanan basınca tepki olarak membran deformasyonunun ölçülmesi23,24. |
| Viskoelastik Özellikler | Bir hücrenin birleşik viskoz ve elastik davranışının karakterizasyonu. | Aspirasyona zamana bağlı deformasyon yanıtının analizi23,25. |
| Deforme olabilirlik | Bir hücrenin şeklini ne kadar kolay değiştirebileceğinin belirlenmesi. | Kontrollü emiş altında deformasyon derecesinin değerlendirilmesi20,24. |
| Yüzey gerilimi | Hücre yüzeyindeki gerilimin ölçülmesi. | Mikropipet membran çıkıntısı oluşturmak için gereken basıncın değerlendirilmesi26. |
| Hücre-Malzeme Etkileşimi | Hücreler ve malzemeler veya substratlar arasındaki etkileşimlerin incelenmesi. | Farklı maddelerle temas eden hücrelerin aspirasyonu ve etkileşimlerinin gözlenmesi2,24. |
| Hücre-Hücre Etkileşimi | Komşu hücreler arasındaki etkileşimlerin incelenmesi. | Bir grup hücrenin aspirasyonu ve hücreler arası kuvvetlerinin analizi27. |
Tablo 1: Mikropipet aspirasyon testi ile karakterize edilen mekanik parametreler.
Mikropipet bazlı aspirasyon tekniği, dolaşım sistemindeki işlevlerini anlamak için gerekli olan eritrositlerin deforme olabilirliğini ve çeşitli mekanik özelliklerini değerlendiren kırmızı kan hücrelerini (RBC'ler) incelemek için yaygın olarak kullanılmaktadır. RBC'ler, karmaşık kılcal ağ ve endotelyal yarıklararasında gezinirken deformasyona karşı mekanik çok yönlülüklerini koruyarak dikkate değer bir uyarlanabilirlik sergilerler 5,6. Bu yolculuk sırasında, RBC'ler 0.5-1.0 μm kadar dar geçitlerden geçmeli ve kendilerini gerilim ve sıkıştırma 7,8,9 dahil olmak üzere çok sayıda mekanik kuvvete maruz bırakmalıdır. Ayrıca dolaşım sırasında kan akışının oluşturduğu kayma gerilimine karşı yüksek hassasiyete sahiptirler10. Bu süreçler, mekanik uyaranlara hücresel tepkilerde köklü rolleri olan çok önemli bir sinyal olayı olan kalsiyum akışını içeren düzenleyici mekanizmaların aktivasyonunu teşvik eder 11,12. Kalsiyum aracılı mekanosalgılamayı yöneten karmaşık mekanizmalar, devam eden araştırmaların zorlayıcı konuları olmaya devam etmektedir.
Bu bağlamda, fMPA, mekanik modülasyonun (mikropipet aspirasyon sistemi kullanılarak) eşzamanlı olarak uygulanmasına ve kalsiyum yoğunluğunun görselleştirilmesine (floresan göstergeler kullanılarak) izin vererek, hassas bir şekilde kontrol edilen mekanik kuvvetler altında kalsiyum mobilizasyonunun kapsamını ortaya çıkarmak için etkili bir yaklaşım olarak durmaktadır. Özellikle RBC daralan kan damarlarından geçerken fizyolojik senaryoyu taklit eder. Geliştirdiğimiz fMPA sisteminin 1 mmHg çözünürlükte basınç üretebildiğini belirtmekte fayda var. Uygulanan yüksek hızlı kamera, 100 ms'lik bir zamansal çözünürlüğe ve mikron altı düzeyde uzamsal bir çözünürlüğe ulaşabilir. Bu konfigürasyonlar, mekanik kuvvetlerin canlı hücrelere hassas bir şekilde uygulanmasını sağlar ve aynı anda ortaya çıkan hücresel sinyali yakalar. Ayrıca, bu kurulumun bütünleştirici mühendislik doğası nedeniyle, mikropipet aspirasyon testi, diğer ekipman veya teknikleri tamamlayacak şekilde kolayca uyarlanabilir ve hücre mekaniğinin karmaşıklıklarının daha fazla araştırılmasını sağlar. Bu çok yönlülük, bu yaklaşımın ek bir avantajı olarak durmaktadır.
Protokol
Bu protokol, Sidney Üniversitesi İnsan Araştırmaları Etik Komitesi'nin yönergelerini takip eder ve bu komite tarafından onaylanmıştır. Bu çalışma için donörlerden bilgilendirilmiş onam alındı.
1. İnsan RBC izolasyonu
NOT: Adım 1.1, Kurumsal İnceleme Kurulu tarafından onaylanmış bir protokol kullanılarak eğitimli bir flebotomist tarafından gerçekleştirilmelidir.
- 19 G kelebek iğnesi kullanarak medyan kübital damardan 5 mL kan çekin.
- Pıhtılaşmayı önlemek için toplanan kanı 1:200 enoksaparin içeren 15 mL'lik bir tüpe aktarın.
- 5 μL enoksaparin-antikoagüle kanı 1 mL karbonat/bikarbonat tamponunda seyreltin (C-tamponu, pH = 8.5-9; Malzeme Tablosu).
- Seyreltilmiş kan örneğini eritrositleri çökeltmek için 900 × g'da 1 dakika santrifüjleyin.
- RBC peletini 1 mL C-tamponu (Malzeme Tablosu) ile iki kez yıkayın ve her seferinde 1 dakika boyunca 900 × g'da santrifüjleyin.
- Daha sonra, aynı santrifüjleme koşullarını kullanarak RBC peletini 2x 1 mL Tyrode tamponu ile yıkayın ve ardından yıkanmış stok RBC süspansiyonunu elde etmek için son peleti 1 mL Tyrode tamponunda yeniden süspanse edin.
2. Kalsiyum indikatörü yükleme
- Otomatik hücre sayacı kullanılarak elde edilen hücre sayısına bağlı olarak, yıkanmış stok RBC çözeltisinin konsantrasyonunu Tyrode tamponunda 10 × 106 hücre/mL'ye ayarlayın (Malzeme Tablosu).
- Kalsiyuma duyarlı bir boya olan 16.67 μM Cal-520 ile inkübe ederek ve döner tüplü karıştırıcıda 1 saat çalkalayarak RBC'lerin içindeki kalsiyumu etiketleyin.
- RBC'leri Tyrode'un tamponunda% 0.5 sığır serum albümini (BSA) içeren 1:50 oranında seyreltin. Hücreler artık deneysel kullanıma hazırdır.
3. Mikropipet üretimi
- Borosilikat cam kılcal boruyu (1 mm dış çap x 0.6 mm iç çap) P-1000 mikropipet çektirmesine monte edin ve önceden ayarlanmış çekme programını kullanarak çekme yerinde kapalı uçlu iki karşılık gelen mikropipet üretin. Bu kurulum için aşağıdaki çekme programı değerlerini kullanın: ısı 516, çekme 150, hız 75, zaman 250 ve basınç 500.
NOT: Çekme programında ayarlanan ısıtma ve çekme parametreleri özelleştirilebilir ve deney tasarımının12 istenen ayarlarına bağlıdır. KONTROL NOKTASI (Ek Tablo S1'e bakın). - Mikropipet kesiciye çektikten sonra temin edilen kapalı uçlu mikropipetlerden birini takarak kapalı ucu açın. Isıtma sıcaklığını yaklaşık 50-60 °C'ye ayarlayın.
- 10x göz merceği kullanarak mikropipeti bulun. Ayar düğmelerini kullanarak mikropipeti borosilikat cam boncuğa yaklaştırın.
- Mikropipeti pipet ucunu bükmeden borosilikat cam boncuğa mümkün olduğunca yakın yerleştirmeden önce göz merceğini 30x olarak değiştirin.
- Isıtma pedalına basarak borosilikat cam boncuğu ısı kullanarak yumuşatın. Çiğ kapalı mikropipet ucunu, istenen son noktaya, açıklık çapına ulaşılana kadar yumuşatılmış boncuğa yavaşça sokun.
- Ayak pedalını bırakın ve cam boncuğun soğumasını bekleyin. Mikropipetin ucunun her zaman boncuğun içinde kaldığından emin olun.
NOT: Ucun daha fazla sokulması, daha büyük açıklık çaplarına yol açar. - Mikropipeti nazikçe çıkarın, böylece kapalı mikropipet üzerinde net ve düz bir kesim elde edin. Kılcal damarın son çapının 1 μm olduğunu onaylayın.
NOT: KONTROL NOKTASI (Ek Tablo S1'e bakın)
4. Hücre odası hazırlığı
- Standart 40 mm x 22 mm x 0,17 mm cam lamel üç eşit şeride bölmek için elmas kalem kullanın.
- Kesilmiş cam lamellerin bir parçasını ev yapımı bir hazne tutucunun altına vakumlu gres ile yapıştırın.
NOT: Hazne tutucu, kavisli bir tutamakla birbirine bağlanan iki metal (bakır/alüminyum) kareden oluşur. Kesilen lamellerin paralel bir oda oluşturacak şekilde tutucuya yapışması için metal bloklar arasındaki mesafe 40 mm'den az olmalıdır. - Kesilmiş cam lamellerin ikinci parçasını ev yapımı hazne tutucunun üstüne vakumlu gres ile yapıştırın.
NOT: KONTROL NOKTASI (Ek Tablo S1'e bakın) - 200 μL'lik bir pipet tabancası kullanarak iki lamel arasına 200 μL etiketli RBC süspansiyonu enjekte edin (Şekil 1).
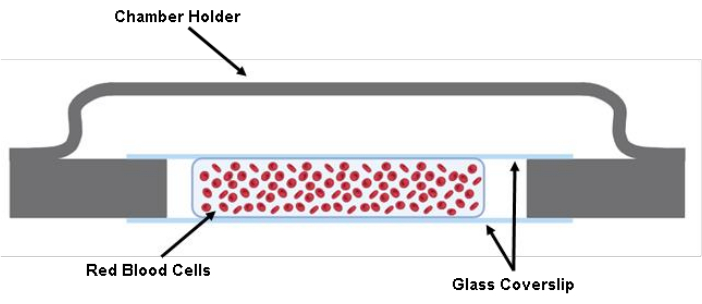
Şekil 1: Hücre odasının çizimi. 40 mm x 22 mm x 0,17 mm boyutlarında bir cam kapak astarının iki kesilmiş parçası, gres kullanılarak hazne tutucuya yapıştırılır. İki kesilmiş cam lamel arasında, Tyrode Tamponundaki hücre çözeltisinin yaklaşık 200 μL'si ekilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Mikropipet aspirasyon tertibatı
- Hücre odasını mikroskop platformunda bulunan tutucu tablaya monte edin. Konumu, hücre odası doğrudan hedefin üzerinde olacak şekilde ayarlayın (Şekil 2B).
- Mikropipet tutucuyu, bağlı su haznesinin sıvı seviyesinin altına indirin.
- Fabrikasyon mikropipete demineralize su veya Tyrode tamponu enjekte edin ve 34 G'lik bir iğne ile birleştirilmiş bir şırınga kullanarak tüm hava kabarcıklarını dikkatlice çıkarın (bkz.
- Mikropipet tutucunun ucunu yarıya kadar sökün ve suyun mikropipet tutucudan birkaç saniye damlamasına izin verin.
NOT: KONTROL NOKTASI (Ek Tablo S1'e bakın) - Mikropipeti tutucu ucuna yerleştirin. Mikropipetin sabitlendiğinden emin olmak için tutucu vidayı sıkın.
- Mikropipeti hücre odasına yerleştirin ve mikropipeti ve RBC'leri mikroskop altında bulun. Konumu ayarlamak için mikromanipülatörü kullanın.
- Ucun bulunan RBC ile aynı hizada olduğundan emin olmak için mikropipet ucunu daha da indirin.
NOT: KONTROL NOKTASI (Ek Tablo S1'e bakın) - Su haznesinin yüksekliğini ayarlayarak mikropipet ucundaki hidrolik basıncı sıfırlayın. Ardından, uçta ince bir pozitif basınç oluşturmak için su haznesini hafifçe kaldırın.
6. Floresan bağlantılı mikropipet aspirasyon testini gerçekleştirin
- 488 nm floresan uyarma ışık kaynağını açın. Foto ağartmayı önlemek için bu aşamada floresan deklanşörü açmayın (Şekil 2C). Floresan kamerayı ve iletilen kamerayı açın.
NOT: Her iki kamera da uygun yazılım kullanılarak çalıştırılır (bkz. Malzeme Tablosu). - Yazılımda her iki kamera için istenen pozlama süresini (bu çalışmada her iki kamera için 100 ms), ilgilenilen bölgeyi (ROI), gruplama boyutunu (bu çalışma için yok) ayarlayın. Alım çerçeve numarasını, bu etüt için 2.000'i ve kaydetme dizinini ayarlamak için çok boyutlu alım panelini açın.
NOT: Alma çerçeve numarası, kaydedilecek istenen aspirasyon olayı sayısına bağlıdır. 1 aspirasyon olayı için, alım sayısının aralığı 100-500 arasında ayarlanmalıdır, bu da yaklaşık 10-50 s'dir. - Mikromanipülatörü kullanarak görüş alanı altındaki mikropipeti bulun.
- Pnömatik basıncı açınamp, kontrol kutusu ve cl dahilamp sistem (Şekil 2A). Kontrol kutusunun EXTRNL modunda olduğundan emin olun. Düğmeyi yavaşça çevirerek sistem içindeki herhangi bir ofset basıncını telafi edin.
- Pnömatik kelepçeyi kontrol eden ayrı yazılımı açın. Yazılım, kelepçe sistemine ayrık analog girişi kontrol etmek için bir elektrik kontrol paneline sahiptir. Basınç, 20 mV/mmHg dönüşüm faktörü ile kontrol edilir.
- Sistem içindeki basıncı sıfırlayın. Mikropipeti dikkatli bir şekilde RBC'lerin yakınına yerleştirin. Mikropipet ucunda hafif bir pozitif basınç fark edilene kadar su haznesi konumunu ayarlayın.
- Kamerayı çalıştırma yazılımında satın alma işlemini başlatın. Floresan deklanşörü açın.
- İstenilen basınca ulaşmak için hesaplanan voltaj büyüklüğünü kontrol paneline yazarak bir RBC'yi aspire edin.
NOT: Bir RBC'yi aspire etme basıncı tipik olarak Δp = -5 ila -40 mmHg aralığındadır. Mikropipet ucunda gözle görülür bir dil uzaması olmalıdır (Şekil 2D). - Basıncı önceden ayarlanmış bir süre tutun; Ardından, basıncı serbest bırakın.
- Bir sonraki hücreyi almak için mikropipeti hareket ettirin ve deneyi tekrarlayın.
7. Floresan yoğunluk analizi
- Kaydedilen floresan görüntülerini analiz yazılımına yükleyin.
- Ekran ayar sekmesini kullanarak yoğunluk eşiğini ayarlayın. Bunu, değerleri manuel olarak girerek veya floresan görüntülerin analiz yazılımında hücrenin net bir kontrastını göstermesini sağlamak için kaydırıcıyı kullanarak yapın (bkz. Ek Dosya 1-Ek Şekil S1).
- Yazılımın altındaki zaman çizelgesine gidin. Belirlenen aspirasyon olayını bulun.
- Yeni yüzeyler ekle'yi tıklayın. Analiz yatırım getirisini tanımlayın.
NOT: Yazılım, segmentasyonu ayarlamak ve tamamlamak için kılavuzlu beş adımlı bir süreç sağlar (bkz. Ek Dosya 1-Ek Şekil S2 ve Ek Şekil S3).
NOT: Hesaplama kaynaklarından tasarruf etmek için yatırım getirisini mümkün olduğunca küçük tutun. - En iyi segmentasyon sonucunu elde etmek için arka plan çıkarma kaydırıcısını kullanın ve kaydırıcıyı kullanarak segmentasyon eşiğini ayarlayın.
NOT: Bu, aspirasyon olayından ayrı olarak, arka planın mümkün olduğunca doğru bir şekilde bölümlere ayrılması gerektiği anlamına gelir (bkz. Ek Dosya 1-Ek Şekil S4 ve Ek Şekil S5). - Arka plan gürültülerini dışlamak için bir alan filtresi ekleyin (bkz. Ek Dosya 1-Ek Şekil S6).
NOT: Bu, işlem sonrası aşamada tamamlanır. - İstatistikler sekmesini seçin | Ayrıntılı Sekme | Ortalama değerler sekmesi. Yoğunluk ortalamasını bulmak ve seçmek için kaydırın (bkz. Ek Dosya 1-Ek Şekil S7).
- Zaman içindeki floresan sinyal izini bir .csv dosyasına aktarın.
- Dışa aktarılan csv dosyasını açın. Arka plan sinyallerini ( Fb) tüm ölçümlerden çıkarın.
- Denklem (1)'i kullanarak kalsiyum yoğunluğu değişimini (ΔFmax) hesaplayın:
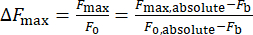 (1)
(1)
ΔFmax maksimum kalsiyum yoğunluğu değişimi, Fb arka plan yoğunluğu ve F0 dinlenme yoğunluğudur.
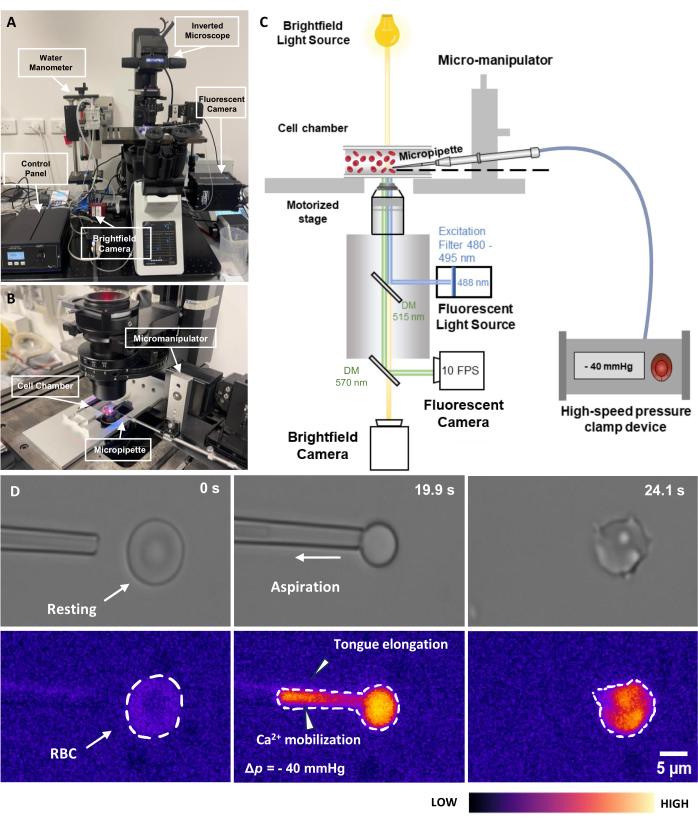
Şekil 2: Floresan bağlantılı mikropipet aspirasyon tertibatı. (A) Parlak alan ve floresan kameralarla birlikte ters çevrilmiş mikroskobu içeren fMPA donanım sistemine genel bakış. Resmin sol tarafı, ev yapımı su manometresini ve pnömatik basınç pompasının basıncını hassas bir şekilde ayarlamaya izin veren kontrol kutusunu göstermektedir. (B) Tek bir mikropipet ile deney hücresi odasını ve mikromanipülatör sistemini gösteren mikroskop aşaması. (C) fMPA sistem kurulumunun şeması. Parlak alan (sarı) ve floresan (mavi emisyon, yeşil uyarma) sinyallerinin, ışık yollarını floresan ışık kaynağından (mavi) hedefe, ardından görüntüleme için kameralara (yeşil) yönlendirmek için iki dikroik ayna kullanarak eşzamanlı görüntülemesi. (D) Üst sıra parlak alan görüntülerini, alt sıra ise floresan görüntüleri gösterir. Sol, RBC hareketsizken mikropipetin aspirasyondan önceki konumunu temsil eder. Orta sütun, RBC'nin -40 mmHg'lik bir negatif basınca maruz kaldığı aspirasyon sürecini anlık olarak gösterir. Sağ, negatif aspirasyon basıncını deneyimledikten sonra hücre morfolojisini gösterir. Ölçek çubuğu = 5 μm. Kısaltmalar: fMPA = Floresan bağlantılı Mikropipet Aspirasyonu; DM = dikroik ayna; RBC = kırmızı kan hücresi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Mikropipet aspirasyon tahlilleri oluşturmak için önce bir sapla birbirine bağlanmış iki metal kareden (bakır/alüminyum) oluşan özel bir hücre odası oluşturduk. Tyrode'un Tamponunda asılı duran 200 μL RBC ile dolu bir oda oluşturmak için iki adet üçüncü kesim cam lamel (40 mm × 7 mm × 0,17 mm) yapıştırıldı. RBC'leri hazneye soktuktan sonra, özel bir borosilikat mikropipet bir tutucuya sabitlendi ve bir mikro manipülatör kullanılarak hazne içine dikkatlice yerleştirildi. Daha sonra, hedef...
Tartışmalar
Mikropipet aspirasyon deneyleri, hücresel biyomekaniğin derin karmaşıklıklarını araştırmak için önemli basınç modülasyonu, tam uzamsal orkestrasyon ve güvenilir zamansal ayırt etme uygulayan rafine bir metodolojiyi somutlaştırır. Bu çalışma, RBC'ler tarafından değişen uyaranlar altında sergilenen nüanslı mekanosensitif tepkileri ortaya çıkarmak için çok önemli bir araç olarak fMPA'nın uygulanmasına özel bir vurgu yapmaktadır. Parlak alan ve floresan sinyallerinin eşzamanlı kullanı...
Açıklamalar
Yazarlar, bu çalışma ile ilgili olarak rapor vermek için herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Nurul Aisha Zainal Abidin ve Laura Moldovan'a ek donör alımı, kan alma ve flebotomi desteği için teşekkür ederiz. Ekipman ve reaktifleri organize ettikleri için Tomas Anderson ve Arian Nasser'e teşekkür ederiz. Bu araştırma, Avustralya Araştırma Konseyi (ARC) Keşif Projesi (DP200101970-L. A.J.); Avustralya Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC) Fikirler Hibesi (APP2003904-L. A.J.); NHMRC Ekipman Hibesi-LAJ; NSW Kardiyovasküler Kapasite Geliştirme Programı (Erken-Orta Kariyer Araştırmacısı Hibesi-LAJ); NSW CVRN-VCCRI Araştırma İnovasyon Hibesi; Küresel ve Araştırma Katılımı Ofisi (Sidney-Glasgow Ortaklık İşbirliği Ödülü-L.A.J.); LAJ, Ulusal Kalp Vakfı Gelecek Lideri Üyesi Seviye 2 (105863) ve Kar Tıbbi Araştırma Vakfı Üyesidir (2022SF176).
Malzemeler
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
Referanslar
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır