È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Test di aspirazione con micropipetta a fluorescenza per studiare il meccanorilevamento dei globuli rossi
In questo articolo
Riepilogo
L'esplorazione del comportamento cellulare sotto stress meccanico è fondamentale per i progressi della meccanica cellulare e della meccanobiologia. Introduciamo la tecnica di aspirazione a fluorescenza con micropipette (fMPA), un nuovo metodo che combina la stimolazione meccanica controllata con l'analisi completa della segnalazione intracellulare nelle singole cellule. Questa tecnica indaga nuovi studi approfonditi sulla meccanobiologia delle cellule vive.
Abstract
I saggi di aspirazione con micropipette sono stati a lungo una pietra miliare per lo studio della meccanica delle cellule vive, offrendo approfondimenti sulle risposte cellulari allo stress meccanico. Questo documento descrive in dettaglio un adattamento innovativo del test di aspirazione con micropipette accoppiate a fluorescenza (fMPA). Il saggio fMPA introduce la capacità di somministrare forze meccaniche precise monitorando contemporaneamente i processi di meccanotrasduzione delle cellule vive mediati dai canali ionici. La sofisticata configurazione incorpora una micropipetta in vetro borosilicato di precisione collegata a un serbatoio d'acqua finemente regolato e a un sistema di aspirazione pneumatica, facilitando l'applicazione a pressione controllata con incrementi fino ± 1 mmHg. Un miglioramento significativo è l'integrazione dell'imaging a epifluorescenza, che consente l'osservazione e la quantificazione simultanee dei cambiamenti morfologici cellulari e dei flussi intracellulari di calcio durante l'aspirazione. Il test fMPA, attraverso la sua combinazione sinergica di imaging a epifluorescenza con aspirazione di micropipette, stabilisce un nuovo standard per lo studio del meccanorilevamento cellulare in ambienti meccanicamente difficili. Questo approccio poliedrico è adattabile a varie configurazioni sperimentali, fornendo informazioni critiche sui meccanismi di meccanorilevamento a singola cellula.
Introduzione
Le scoperte in corso nel mondo dei comportamenti cellulari hanno accentuato il ruolo degli stimoli meccanici, come la tensione, lo sforzo di taglio dei fluidi, la compressione e la rigidità del substrato, nel dettare le attività cellulari dinamiche come l'adesione, la migrazione e la differenziazione. Questi aspetti meccanobiologici sono di fondamentale importanza per chiarire come le cellule interagiscono e rispondono al loro ambiente fisiologico, influenzando vari processi biologici 1,2.
Nell'ultimo decennio, i saggi di aspirazione basati su micropipette si sono distinti come uno strumento versatile nello studio di diverse risposte cellulari a stimoli meccanici. Questa tecnica offre preziose informazioni sulle proprietà meccaniche intrinseche delle cellule viventi a livello di singola cellula, tra cui il modulo elastico cellulare, la rigidità e la tensione corticale. Questi saggi consentono di misurare vari parametri meccanici, come la tensione della membrana cellulare, la pressione esercitata sulla membrana cellulare e la tensione corticale (riassunta nella Tabella 1). Lo studio delle forze aspirazionali ha arricchito la nostra comprensione di come influenzano le funzioni e i processi cellulari, in particolare nell'ambito della dinamica della membrana, tra cui la frammentazione, l'allungamento e la gemmazione 3,4.
| Parametro meccanico | Descrizione | Approcci seminali |
| Rigidità cellulare | Misura della rigidità meccanica e dell'elasticità di una cella. | Aspirazione della membrana cellulare e analisi della risposta deformativa alla pressione negativa20,21. |
| Forza di adesione | Valutazione della forza di adesione delle cellule alle superfici. | Applicazione di aspirazione controllata per staccare le cellule aderenti da un substrato2,22. |
| Tensione della membrana | Valutazione della tensione o dello stress all'interno delle membrane cellulari. | Misura della deformazione della membrana in risposta alla pressione applicata23,24. |
| Proprietà viscoelastiche | Caratterizzazione del comportamento viscoso ed elastico combinato di una cella. | Analisi della risposta deformativa tempo-dipendente all'aspirazione23,25. |
| Deformabilità | Determinazione della facilità con cui una cellula può cambiare forma. | Valutazione dell'entità della deformazione in aspirazione controllata20,24. |
| Tensione superficiale | Misura della tensione sulla superficie della cella. | Valutazione della pressione necessaria per formare una sporgenza della membrana della micropipetta26. |
| Interazione cellula-materiale | Studio delle interazioni tra cellule e materiali o substrati. | Aspirazione di cellule a contatto con materiali diversi e osservazione delle interazioni2,24. |
| Interazione cellula-cellula | Esame delle interazioni tra cellule vicine. | Aspirazione di un gruppo di cellule e analisi delle loro forze intercellulari27. |
Tabella 1: Parametri meccanici caratterizzati dal test di aspirazione con micropipetta.
La tecnica di aspirazione basata su micropipette è stata ampiamente utilizzata per studiare i globuli rossi (RBC), valutando la deformabilità e varie caratteristiche meccaniche dei RBC, che è essenziale per comprendere la loro funzione nel sistema circolatorio. I globuli rossi mostrano una notevole adattabilità, preservando la loro versatilità meccanica contro la deformazione durante la navigazione attraverso l'intricata rete capillare e le fessure interendoteliali 5,6. Durante questo viaggio, i globuli rossi devono attraversare passaggi stretti fino a 0,5-1,0 μm, sottoponendosi a una moltitudine di forze meccaniche, tra cui la tensione e la compressione 7,8,9. Hanno anche un'elevata sensibilità allo stress di taglio generato dal flusso sanguigno durante la circolazione10. Questi processi promuovono l'attivazione di meccanismi regolatori che coinvolgono l'afflusso di calcio, un evento di segnalazione cruciale con ruoli ben consolidati nelle risposte cellulari agli stimoli meccanici11,12. I complessi meccanismi che governano il meccanosensing mediato dal calcio rimangono argomenti interessanti di indagine in corso.
In questo contesto, l'fMPA rappresenta un approccio efficace per rivelare l'entità della mobilizzazione del calcio sotto forze meccaniche controllate con precisione, consentendo l'applicazione simultanea della modulazione meccanica (utilizzando il sistema di aspirazione a micropipetta) e la visualizzazione dell'intensità del calcio (utilizzando indicatori fluorescenti). Imita in particolare lo scenario fisiologico in cui i globuli rossi viaggiano attraverso il restringimento dei vasi sanguigni. Vale la pena notare che il sistema fMPA che abbiamo sviluppato può generare pressione con una risoluzione di 1 mmHg. La telecamera ad alta velocità implementata può raggiungere una risoluzione temporale di 100 ms e una risoluzione spaziale a livello submicrometrico. Queste configurazioni garantiscono l'applicazione precisa delle forze meccaniche alle cellule viventi e contemporaneamente catturano la segnalazione cellulare risultante. Inoltre, grazie alla natura ingegneristica integrativa di questa configurazione, il test di aspirazione con micropipetta può essere facilmente adattato per integrare altre apparecchiature o tecniche, consentendo un'ulteriore esplorazione delle complessità della meccanica cellulare. Questa versatilità rappresenta un ulteriore vantaggio di questo approccio.
Protocollo
Questo protocollo segue le linee guida ed è stato approvato dal Comitato Etico per la Ricerca Umana dell'Università di Sydney. Il consenso informato è stato ottenuto dai donatori per questo studio.
1. Isolamento dei globuli rossi umani
NOTA: La fase 1.1 deve essere eseguita da un flebotomo addestrato utilizzando un protocollo approvato dall'Institutional Review Board.
- Prelevare 5 ml di sangue dalla vena cubitale mediana utilizzando un ago a farfalla da 19 G.
- Trasferire il sangue raccolto in una provetta da 15 mL contenente enoxaparina 1:200 per prevenire la coagulazione.
- Diluire 5 μL di sangue anticoagulato con enoxaparina in 1 mL di tampone carbonato/bicarbonato (tampone C, pH = 8,5-9; Tabella dei materiali).
- Centrifugare il campione di sangue diluito a 900 × g per 1 minuto per sedimentare i globuli rossi. Decantare con cura il surnatante senza disturbare il pellet.
- Eseguire due lavaggi del pellet RBC con 1 mL di tampone C (Tabella dei materiali), centrifugando ogni volta a 900 × g per 1 min.
- Successivamente, lavare il pellet di globuli rossi 2 volte con 1 mL di tampone di Tyrode utilizzando le stesse condizioni di centrifugazione e quindi risospendere il pellet finale in 1 mL di tampone di Tyrode per ottenere la sospensione di globuli rossi lavata.
2. Caricamento dell'indicatore di calcio
- Regolare la concentrazione della soluzione madre di globuli rossi lavata a 10 × 106 cellule/mL nel tampone di Tyrode, in base alla conta delle cellule ottenuta utilizzando un contatore automatico di cellule (Table of Materials).
- Etichettare il calcio all'interno dei globuli rossi incubando con 16,67 μM Cal-520 AM, un colorante sensibile al calcio, agitando su un miscelatore a tubo rotante per 1 ora.
- Diluire i globuli rossi nel tampone di Tyrode contenente lo 0,5% di albumina sierica bovina (BSA) in un rapporto 1:50. Le celle sono ora pronte per l'uso sperimentale.
3. Fabbricazione di micropipette
- Montare il tubo capillare in vetro borosilicato (1 mm di diametro esterno x 0,6 mm di diametro interno) sull'estrattore per micropipette P-1000 per produrre due micropipette corrispondenti con puntali chiusi nel sito di estrazione utilizzando il programma di estrazione preimpostato. Per questa configurazione, utilizzare i seguenti valori del programma di trazione: calore 516, tiro 150, velocità 75, tempo 250 e pressione 500.
NOTA: I parametri di riscaldamento e trazione impostati nel programma di trazione possono essere personalizzati e dipendono dalle impostazioni desiderate del disegno sperimentale12. CHECKPOINT (cfr. tabella supplementare S1). - Aprire il puntale chiuso montando una delle micropipette chiuse acquistate dopo aver tirato la taglierina per micropipette. Regolare la temperatura di riscaldamento a circa 50-60 °C.
- Individuare la micropipetta utilizzando un oculare 10x. Avvicinare la micropipetta alla micropipetta utilizzando le manopole per la regolazione.
- Cambiare l'oculare a 30x prima di posizionare la micropipetta il più vicino possibile alla perla di vetro borosilicato senza piegare la punta della pipetta.
- Ammorbidire la perla di vetro borosilicato usando il calore premendo il pedale del riscaldamento. Inserire delicatamente il puntale della micropipetta grezzo chiuso nel cordone ammorbidito fino a raggiungere il punto finale desiderato, il diametro di apertura.
- Rilasciare il pedale e lasciare raffreddare la perla di vetro. Assicurarsi che la punta della micropipetta rimanga sempre all'interno del micromicrotubo.
NOTA: L'ulteriore inserimento della punta porta a diametri di apertura maggiori. - Estrarre delicatamente la micropipetta, ottenendo un taglio netto e dritto sulla micropipetta chiusa. Verificare che il diametro finale del capillare sia di 1 μm.
NOTA: CHECKPOINT (vedere la Tabella supplementare S1)
4. Preparazione della camera cellulare
- Usa una matita diamantata per dividere un vetrino coprioggetti standard di 40 mm x 22 mm x 0,17 mm in tre strisce uguali.
- Incollare un pezzo del vetrino coprioggetti tagliato sul fondo di un supporto per camera fatto in casa con grasso sottovuoto.
NOTA: Il supporto della camera è costituito da due quadrati di metallo (rame/alluminio) collegati da una maniglia curva. La distanza tra i blocchi metallici deve essere inferiore a 40 mm affinché il vetrino coprioggetto tagliato aderisca al supporto per formare una camera parallela. - Far aderire il secondo pezzo del vetrino coprioggetti tagliato alla parte superiore del supporto della camera fatto in casa con grasso sottovuoto.
NOTA: CHECKPOINT (vedere la Tabella supplementare S1) - Iniettare 200 μL della sospensione di globuli rossi marcata tra due vetrini coprioggetti utilizzando una pistola per pipette da 200 μL (Figura 1).
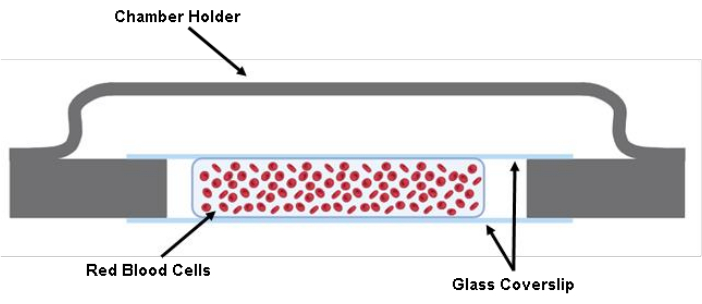
Figura 1: Illustrazione della camera cellulare. Due pezzi tagliati di un vetrino coprioggetto di 40 mm x 22 mm x 0,17 mm vengono incollati al supporto della camera con grasso. Tra i due vetrini coprioggetti tagliati, vengono seminati circa 200 μL della soluzione cellulare nel tampone di Tyrode. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Gruppo di aspirazione della micropipetta
- Montare la camera cellulare sul tavolino di supporto presente sulla piattaforma del microscopio. Regolare la posizione in modo che la camera della cella si trovi direttamente sopra l'obiettivo (Figura 2B).
- Abbassare il supporto della micropipetta al di sotto del livello del fluido del serbatoio dell'acqua collegato.
- Iniettare acqua demineralizzata o tampone Tyrode nella micropipetta fabbricata e rimuovere con cautela tutte le bolle d'aria utilizzando una siringa accoppiata con un ago da 34 G (vedere Tabella dei materiali).
- Svitare l'estremità del supporto della micropipetta a metà e lasciare gocciolare l'acqua dal supporto della micropipetta per alcuni secondi.
NOTA: CHECKPOINT (vedere la Tabella supplementare S1) - Inserire la micropipetta nel puntale di supporto. Serrare la vite di supporto per assicurarsi che la micropipetta sia fissata.
- Inserire la micropipetta nella camera cellulare e posizionare la micropipetta e i globuli rossi sotto il microscopio. Utilizzare il micromanipolatore per regolare la posizione.
- Abbassare ulteriormente il puntale della micropipetta per assicurarsi che il puntale sia livellato con il globulo rosso localizzato.
NOTA: CHECKPOINT (vedere la Tabella supplementare S1) - Azzerare la pressione idraulica sul puntale della micropipetta regolando l'altezza del serbatoio dell'acqua. Quindi, sollevare leggermente il serbatoio dell'acqua per generare una leggera pressione positiva sulla punta.
6. Eseguire il test di aspirazione con micropipetta accoppiata a fluorescenza
- Accendere la sorgente luminosa di eccitazione fluorescente da 488 nm. Non accendere l'otturatore a fluorescenza in questa fase per evitare il fotosbiancamento (Figura 2C). Accendere la telecamera a fluorescenza e la telecamera trasmessa.
NOTA: Entrambe le fotocamere vengono utilizzate utilizzando il software appropriato (vedere la Tabella dei materiali). - Impostare il tempo di esposizione desiderato (100 ms per entrambe le fotocamere in questo studio), la regione di interesse (ROI), la dimensione del binning (nessuna per questo studio) per entrambe le fotocamere nel software. Aprire il pannello di acquisizione multidimensionale per impostare il numero di frame di acquisizione, 2.000 per lo studio, e la directory di salvataggio.
NOTA: Il numero di fotogramma di ripresa dipende dal numero desiderato di eventi di aspirazione che devono essere registrati. Per 1 evento di aspirazione, l'intervallo del numero di acquisizione deve essere impostato tra 100-500, che è circa 10-50 s. - Trova la micropipetta sotto il campo visivo utilizzando il micromanipolatore.
- Accendere la pinza a pressione pneumatica, compresa la scatola di controllo e il sistema di bloccaggio (Figura 2A). Assicurarsi che la scatola di controllo sia in modalità EXTRNL. Compensare l'eventuale pressione di offset all'interno del sistema ruotando lentamente la manopola.
- Attivare il software separato che controlla la morsa pneumatica. Il software dispone di un pannello di controllo elettrico per controllare l'ingresso analogico discreto al sistema di morsetto. La pressione è controllata con un fattore di conversione di 20 mV/mmHg.
- Azzerare la pressione all'interno del sistema. Riposizionare con cautela la micropipetta vicino ai globuli rossi. Regolare la posizione del serbatoio dell'acqua fino a quando non si nota una leggera pressione positiva sulla punta della micropipetta.
- Avviare l'acquisizione nel software operativo della telecamera. Accendere l'otturatore a fluorescenza.
- Aspirare un globulo rosso digitando l'entità della tensione calcolata nel pannello di controllo per raggiungere la pressione desiderata.
NOTA: La pressione per l'aspirazione di un globulo rosso è tipicamente compresa tra Δp = da -5 a -40 mmHg. Dovrebbe esserci un notevole allungamento della lingua all'interno del puntale della micropipetta (Figura 2D). - Mantenere la pressione per un periodo prestabilito; Quindi, rilascia la pressione.
- Muovi la micropipetta per prelevare la cellula successiva e ripeti l'esperimento.
7. Analisi dell'intensità della fluorescenza
- Caricare le immagini di fluorescenza salvate nel software di analisi.
- Regolare la soglia di intensità utilizzando la scheda di regolazione del display . A tale scopo, immettere manualmente i valori o utilizzare il dispositivo di scorrimento per garantire che le immagini a fluorescenza mostrino un chiaro contrasto della cella nel software di analisi (vedere File supplementare 1-Figura supplementare S1).
- Scorri fino alla timeline nella parte inferiore del software. Individua l'evento di aspirazione designato.
- Fate clic su Aggiungi nuove superfici (Add new surfaces). Definire il ROI dell'analisi.
NOTA: Il software fornisce un processo guidato in cinque fasi per regolare e completare la segmentazione (vedere File supplementare 1-Figura supplementare S2 e Figura supplementare S3).
NOTA: mantenere il ROI il più piccolo possibile per risparmiare risorse computazionali. - Utilizza il cursore di sottrazione dello sfondo e regola la soglia di segmentazione utilizzando il cursore per ottenere il miglior risultato di segmentazione.
NOTA: Ciò significa che, a parte l'evento di aspirazione, lo sfondo deve essere segmentato nel modo più accurato possibile (vedere File supplementare 1 - Figura supplementare S4 e Figura supplementare S5). - Aggiungere un filtro di area per escludere i rumori di fondo (vedere File supplementare 1-Figura supplementare S6).
NOTA: Questa operazione viene completata nella fase di post-elaborazione. - Selezionare la scheda Statistiche | Scheda Dettagli | Scheda Valori medi . Scorrere per trovare e selezionare la media dell'intensità (vedere File supplementare 1-Figura supplementare S7).
- Esportare la traccia del segnale di fluorescenza nel tempo in un file .csv.
- Apri il file csv esportato. Sottrarre i segnali di fondo, Fb, da tutte le misurazioni.
- Calcolare la variazione dell'intensità del calcio, ΔFmax, utilizzando l'equazione (1):
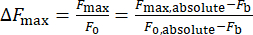 (1)
(1)
Dove ΔFmax è la variazione massima dell'intensità del calcio, Fb, è l'intensità di fondo e F0 è l'intensità a riposo.
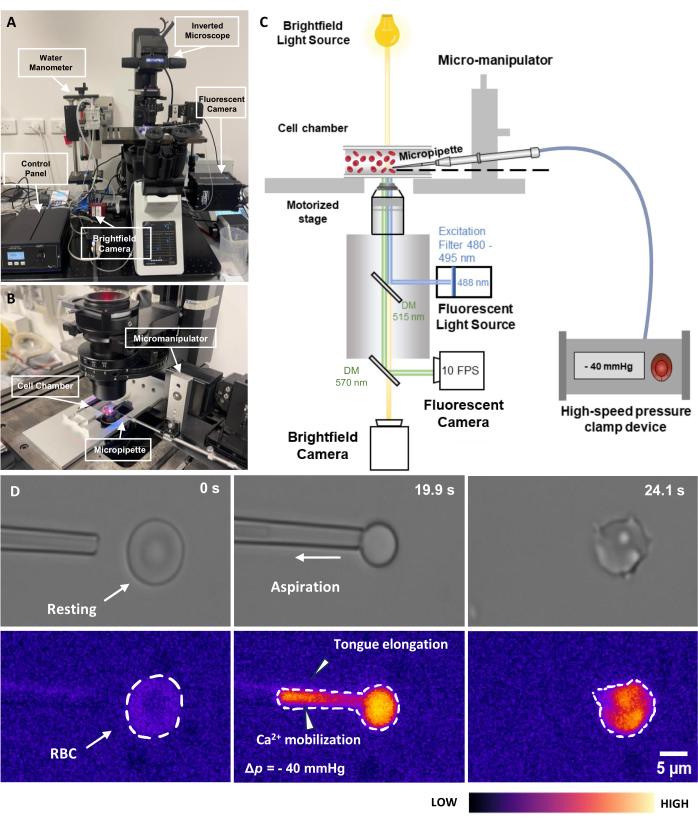
Figura 2: Gruppo di aspirazione della micropipetta accoppiata a fluorescenza. (A) Una panoramica del sistema hardware fMPA che incorpora il microscopio invertito combinato con le telecamere in campo chiaro e a fluorescenza. Il lato sinistro dell'immagine raffigura il manometro dell'acqua fatto in casa e la scatola di controllo che permette di regolare con precisione la pressione della pompa pneumatica a pressione. (B) Il tavolino del microscopio che raffigura la camera cellulare dell'esperimento e il sistema di micromanipolatori con una singola micropipetta. (C) Schema della configurazione del sistema fMPA. Imaging simultaneo di segnali in campo chiaro (giallo) e fluorescenza (emissione blu, eccitazione verde) utilizzando due specchi dicroici per dirigere i percorsi luminosi dalla sorgente luminosa a fluorescenza (blu) al bersaglio, quindi alle telecamere per l'imaging (verde). (D) La riga superiore rappresenta le immagini in campo chiaro, mentre la riga inferiore mostra le immagini a fluorescenza. La parte sinistra rappresenta la posizione della micropipetta prima dell'aspirazione quando i globuli rossi sono a riposo. La colonna centrale mostra il processo di aspirazione in cui il globulo rosso subisce una pressione negativa di -40 mmHg. A destra è raffigurata la morfologia della cellula dopo aver sperimentato la pressione negativa di aspirazione. Barra della scala = 5 μm. Abbreviazioni: fMPA = Fluorescence-coupled Micropipette Aspiration; DM = specchio dicroico; RBC = globuli rossi. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Per stabilire i saggi di aspirazione con micropipette, abbiamo prima costruito una camera cellulare personalizzata composta da due quadrati di metallo (rame/alluminio) collegati da una maniglia. Sono stati apposti due vetrini coprioggetti di terzo taglio (40 mm × 7 mm × 0,17 mm) per creare una camera riempita con 200 μL di globuli rossi sospesi nel tampone di Tyrode. Dopo aver introdotto i globuli rossi nella camera, una micropipetta in borosilicato su misura è stata fissata su un supporto e posizionata con cura all'...
Discussione
I saggi di aspirazione con micropipette incarnano una metodologia raffinata, che impiega una sostanziale modulazione della pressione, un'esatta orchestrazione spaziale e un discernimento temporale affidabile per sondare le profonde complessità della biomeccanica cellulare. Questo studio pone particolare enfasi sull'applicazione della fMPA come strumento cruciale per svelare le risposte meccanosensibili sfumate mostrate dai globuli rossi sotto stimoli variabili. L'uso simultaneo di segnali in campo chiaro e fluorescenza ...
Divulgazioni
Gli autori dichiarano di non avere interessi contrastanti da riferire in merito al presente studio.
Riconoscimenti
Ringraziamo Nurul Aisha Zainal Abidin e Laura Moldovan per il reclutamento di donatori, la raccolta del sangue e il supporto alla flebotomia. Ringraziamo Tomas Anderson e Arian Nasser per aver organizzato l'attrezzatura e i reagenti. Questa ricerca è stata finanziata dall'Australian Research Council (ARC) Discovery Project (DP200101970-L. A.J.); il National Health and Medical Research Council (NHMRC) dell'Australia Ideas Grant (APP2003904-L. A.J.); Sovvenzione per attrezzature NHMRC-L.A.J.; Programma di sviluppo delle capacità cardiovascolari del NSW (Early-Mid Career Researcher Grant-L.A.J.); Sovvenzione per l'innovazione nella ricerca NSW CVRN-VCCRI; Ufficio per l'impegno globale e della ricerca (Sydney-Glasgow Partnership Collaboration Award-L.A.J.); L.A.J. è un Future Leader Fellow della National Heart Foundation di livello 2 (105863) e un borsista della Snow Medical Research Foundation (2022SF176).
Materiali
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
Riferimenti
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon