Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Fluoreszenz-Mikropipetten-Aspirationsassay zur Untersuchung der Mechanosensorik roter Blutkörperchen
In diesem Artikel
Zusammenfassung
Die Erforschung des zellulären Verhaltens unter mechanischer Belastung ist entscheidend für Fortschritte in der Zellmechanik und Mechanobiologie. Wir stellen die Fluoreszenz-Mikropipetten-Aspirationstechnik (fMPA) vor, eine neuartige Methode, die kontrollierte mechanische Stimulation mit einer umfassenden Analyse der intrazellulären Signalübertragung in einzelnen Zellen kombiniert. Diese Technik untersucht neue eingehende Studien der Mechanobiologie lebender Zellen.
Zusammenfassung
Mikropipetten-Aspirationsassays sind seit langem ein Eckpfeiler für die Untersuchung der Mechanik lebender Zellen und bieten Einblicke in die zellulären Reaktionen auf mechanischen Stress. In diesem Artikel wird eine innovative Anpassung des fluoreszenzgekoppelten Mikropipettenaspirationsassays (fMPA) beschrieben. Der fMPA-Assay bietet die Möglichkeit, präzise mechanische Kräfte zu verabreichen und gleichzeitig die durch Ionenkanäle vermittelten Mechanotransduktionsprozesse in lebenden Zellen zu überwachen. Der ausgeklügelte Aufbau umfasst eine präzisionsgefertigte Mikropipette aus Borosilikatglas, die mit einem fein regulierten Wasserreservoir und einem pneumatischen Absaugsystem verbunden ist und eine kontrollierte Druckanwendung mit Schritten von bis zu ± 1 mmHg ermöglicht. Eine wesentliche Verbesserung ist die Integration der Epi-Fluoreszenz-Bildgebung, die die gleichzeitige Beobachtung und Quantifizierung von zellmorphologischen Veränderungen und intrazellulären Kalziumflüssen während der Aspiration ermöglicht. Der fMPA-Assay setzt durch seine synergistische Kombination von Epifluoreszenz-Bildgebung und Mikropipettenaspiration einen neuen Standard für die Untersuchung der Zell-Mechanosensorik in mechanisch anspruchsvollen Umgebungen. Dieser facettenreiche Ansatz ist an verschiedene Versuchsaufbauten anpassbar und bietet wichtige Einblicke in die einzelligen Mechanosensormechanismen.
Einleitung
Die sich entfaltenden Entdeckungen in der Welt des zellulären Verhaltens haben die Rolle mechanischer Reize wie Spannung, Flüssigkeitsscherspannung, Kompression und Substratsteifigkeit bei der Bestimmung dynamischer zellulärer Aktivitäten wie Adhäsion, Migration und Differenzierung akzentuiert. Diese mechanobiologischen Aspekte sind von größter Bedeutung für die Aufklärung, wie Zellen mit ihrer physiologischen Umgebung interagieren und darauf reagieren, was sich auf verschiedene biologische Prozesse auswirkt 1,2.
In den letzten zehn Jahren haben sich Mikropipetten-basierte Aspirationsassays als vielseitiges Werkzeug bei der Untersuchung verschiedener zellulärer Reaktionen auf mechanische Reize erwiesen. Diese Technik bietet wertvolle Einblicke in die intrinsischen mechanischen Eigenschaften lebender Zellen auf Einzelzellebene, einschließlich zellulärem Elastizitätsmodul, Steifigkeit und kortikaler Spannung. Diese Assays ermöglichen die Messung verschiedener mechanischer Parameter, wie z. B. der Zellmembranspannung, des auf die Zellmembran ausgeübten Drucks und der kortikalen Spannung (zusammengefasst in Tabelle 1). Die Untersuchung der Aspirationskräfte hat unser Verständnis darüber bereichert, wie sie zelluläre Funktionen und Prozesse beeinflussen, insbesondere im Bereich der Membrandynamik, einschließlich Fragmentierung, Dehnung und Knospung 3,4.
| Mechanische Parameter | Beschreibung | Wegweisende Ansätze |
| Zellsteifigkeit | Messung der mechanischen Steifigkeit und Elastizität einer Zelle. | Aspiration der Zellmembran und Analyse der Verformungsreaktion auf den Unterdruck20,21. |
| Haftfestigkeit | Bewertung, wie stark Zellen an Oberflächen haften. | Anwendung einer kontrollierten Absaugung zum Ablösen anhaftender Zellen von einem Substrat2,22. |
| Membranspannung | Beurteilung der Spannung oder Spannung innerhalb der Zellmembranen. | Messung der Membranverformung als Reaktion auf angelegten Druck23,24. |
| Viskoelastische Eigenschaften | Charakterisierung des kombinierten viskosen und elastischen Verhaltens einer Zelle. | Analyse der zeitabhängigen Verformungsreaktion auf Aspiration23,25. |
| Verformbarkeit | Bestimmung, wie leicht eine Zelle ihre Form ändern kann. | Bewertung des Ausmaßes der Verformung unter kontrollierter Absaugung20,24. |
| Oberflächenspannung | Messung der Spannung an der Zelloberfläche. | Beurteilung des Drucks, der erforderlich ist, um einen Membranvorsprung der Mikropipettezu bilden 26. |
| Zell-Material-Interaktion | Untersuchung der Wechselwirkungen zwischen Zellen und Materialien oder Substraten. | Aspiration von Zellen in Kontakt mit verschiedenen Materialien und Beobachtung von Wechselwirkungen2,24. |
| Zell-Zell-Interaktion | Untersuchung der Wechselwirkungen zwischen benachbarten Zellen. | Aspiration einer Gruppe von Zellen und Analyse ihrer interzellulären Kräfte27. |
Tabelle 1: Mechanische Parameter, die durch den Mikropipetten-Aspirationsassay charakterisiert werden.
Die auf Mikropipetten basierende Aspirationstechnik wird häufig zur Untersuchung roter Blutkörperchen (RBCs) eingesetzt, um die Verformbarkeit und verschiedene mechanische Eigenschaften von Erythrozyten zu bewerten, was für das Verständnis ihrer Funktion im Kreislaufsystem unerlässlich ist. Erythrozyten weisen eine bemerkenswerte Anpassungsfähigkeit auf und bewahren ihre mechanische Vielseitigkeit gegen Verformung beim Navigieren durch das komplizierte Kapillarnetzwerk und die interendothelialen Spalten 5,6. Während dieser Reise müssen RBCs Passagen von nur 0,5 bis 1,0 μm durchqueren und sich dabei einer Vielzahl mechanischer Kräfte aussetzen, einschließlich Zug und Druck 7,8,9. Sie haben auch eine hohe Empfindlichkeit gegenüber der Scherspannung, die durch den Blutfluss während des Kreislaufs erzeugtwird 10. Diese Prozesse fördern die Aktivierung von Regulationsmechanismen, die den Kalziumeinstrom betreffen, ein entscheidendes Signalereignis mit einer gut etablierten Rolle bei der zellulären Reaktion auf mechanische Reize11,12. Die komplexen Mechanismen, die die Kalzium-vermittelte Mechanosensorik steuern, sind nach wie vor Gegenstand anhaltender Untersuchungen.
In diesem Zusammenhang stellt die fMPA einen effektiven Ansatz dar, um das Ausmaß der Calciummobilisierung unter genau kontrollierten mechanischen Kräften aufzudecken und gleichzeitig die mechanische Modulation (mit dem Mikropipetten-Aspirationssystem) und die Visualisierung der Calciumintensität (mit Fluoreszenzindikatoren) zu ermöglichen. Es ahmt insbesondere das physiologische Szenario nach, wenn die Erythrozyten durch verengte Blutgefäße wandern. Es ist erwähnenswert, dass das von uns entwickelte fMPA-System Druck mit einer Auflösung von 1 mmHg erzeugen kann. Die implementierte Hochgeschwindigkeitskamera kann eine zeitliche Auflösung von 100 ms und eine räumliche Auflösung im Submikrometerbereich erreichen. Diese Konfigurationen gewährleisten die präzise Anwendung mechanischer Kräfte auf lebende Zellen und erfassen gleichzeitig die resultierende zelluläre Signalübertragung. Darüber hinaus kann der Mikropipetten-Aspirationsassay aufgrund des integrativen technischen Charakters dieses Aufbaus leicht an andere Geräte oder Techniken angepasst werden, was eine weitere Erforschung der Feinheiten der Zellmechanik ermöglicht. Diese Vielseitigkeit ist ein zusätzlicher Vorteil dieses Ansatzes.
Protokoll
Dieses Protokoll folgt den Richtlinien des Ethikausschusses für die Humanforschung der Universität Sydney und wurde von diesem genehmigt. Für diese Studie wurde von den Spendern eine Einverständniserklärung eingeholt.
1. Isolierung menschlicher Erythrozyten
HINWEIS: Schritt 1.1 sollte von einem ausgebildeten Phlebotomiker unter Verwendung eines vom Institutional Review Board genehmigten Protokolls durchgeführt werden.
- Entnehmen Sie 5 ml Blut aus der mittleren Kubitalvene mit einer 19-G-Schmetterlingsnadel.
- Übertragen Sie das gesammelte Blut in ein 15-ml-Röhrchen mit 1:200 Enoxaparin, um eine Gerinnung zu verhindern.
- Verdünnen Sie 5 μl Enoxaparin-antikoaguliertes Blut in 1 ml Karbonat/Bicarbonat-Puffer (C-Puffer, pH = 8,5-9; Tabelle der Materialien).
- Die verdünnte Blutprobe wird 1 Minute lang bei 900 × g zentrifugiert, um die Erythrozyten zu sedimentieren. Dekantieren Sie den Überstand vorsichtig, ohne das Pellet zu stören.
- Führen Sie zwei Waschgänge des RBC-Pellets mit 1 ml C-Puffer (Materialtabelle) durch und zentrifugieren Sie jedes Mal bei 900 × g für 1 min.
- Anschließend wird das RBC-Pellet 2x mit 1 ml Tyrode-Puffer unter den gleichen Zentrifugationsbedingungen gewaschen und das endgültige Pellet dann in 1 ml Tyrode-Puffer resuspendiert, um die gewaschene RBC-Suspension zu erhalten.
2. Laden des Kalziumindikators
- Die Konzentration der gewaschenen Erythrozytenlösung wird auf 10 × 106 Zellen/ml im Tyrode-Puffer eingestellt, basierend auf der Zellzahl, die mit einem automatischen Zellzähler (Materialtabelle) ermittelt wurde.
- Markieren Sie das Kalzium in den Erythrozyten, indem Sie es mit 16,67 μM Cal-520 AM, einem kalziumempfindlichen Farbstoff, inkubieren, während Sie 1 h lang auf einem Rotationsrohrmischer gerührt werden.
- Verdünnen Sie die Erythrozyten im Tyrode-Puffer mit 0,5 % Rinderserumalbumin (BSA) im Verhältnis 1:50. Die Zellen sind nun bereit für den experimentellen Einsatz.
3. Herstellung von Mikropipetten
- Montieren Sie das Borosilikatglas-Kapillarrohr (1 mm Außendurchmesser x 0,6 mm Innendurchmesser) auf den P-1000 Mikropipettenabzieher, um zwei entsprechende Mikropipetten mit geschlossenen Spitzen an der Entnahmestelle mit dem voreingestellten Zugprogramm herzustellen. Verwenden Sie für dieses Setup die folgenden Werte für das Zugprogramm: Hitze 516, Zug 150, Geschwindigkeit 75, Zeit 250 und Druck 500.
Anmerkungen: Die im Zugprogramm eingestellten Heiz- und Zugparameter können angepasst werden und sind abhängig von den gewünschten Einstellungen des Versuchsplans12. CHECKPOINT (siehe Ergänzende Tabelle S1). - Öffnen Sie die geschlossene Spitze, indem Sie eine der Mikropipetten mit geschlossenem Ende montieren, die Sie nach dem Ziehen auf den Mikropipettenschneider beschafft haben. Stellen Sie die Heiztemperatur auf ca. 50-60 °C ein.
- Lokalisieren Sie die Mikropipette mit einem 10-fach-Okular. Bewegen Sie die Mikropipette mit den Drehknöpfen in die Nähe der Borosilikatglasperle.
- Wechseln Sie das Okular auf 30x, bevor Sie die Mikropipette so nah wie möglich an der Borosilikatglasperle positionieren, ohne die Pipettenspitze zu verbiegen.
- Erweichen Sie die Borosilikatglasperle mit Wärme, indem Sie auf das Heizpedal treten. Führen Sie die rohe geschlossene Mikropipettenspitze vorsichtig in die erweichte Perle ein, bis der gewünschte Endpunkt, der Öffnungsdurchmesser, erreicht ist.
- Lassen Sie das Fußpedal los und lassen Sie die Glasperle abkühlen. Achten Sie darauf, dass die Spitze der Mikropipette immer in der Perle bleibt.
HINWEIS: Ein weiteres Einsetzen der Spitze führt zu größeren Öffnungsdurchmessern. - Ziehen Sie die Mikropipette vorsichtig heraus, was zu einem klaren, geraden Schnitt auf der geschlossenen Mikropipette führt. Vergewissern Sie sich, dass der Enddurchmesser der Kapillare 1 μm beträgt.
HINWEIS: CHECKPOINT (siehe Ergänzende Tabelle S1)
4. Vorbereitung der Zellkammer
- Verwenden Sie einen Diamantstift, um ein Standard-Deckglas von 40 mm x 22 mm x 0,17 mm in drei gleiche Streifen zu teilen.
- Kleben Sie ein Stück des geschnittenen Glasdeckglases mit Vakuumfett auf den Boden eines selbstgebauten Kammerhalters.
HINWEIS: Der Kammerhalter besteht aus zwei Metallquadraten (Kupfer/Aluminium), die durch einen gebogenen Griff verbunden sind. Der Abstand zwischen den Metallblöcken muss weniger als 40 mm betragen, damit das geschnittene Deckglas am Halter haftet und eine parallele Kammer bildet. - Kleben Sie das zweite Stück des geschliffenen Glasdeckglases mit Vakuumfett auf die Oberseite des selbstgemachten Kammerhalters.
HINWEIS: CHECKPOINT (siehe Ergänzende Tabelle S1) - Injizieren Sie 200 μl der markierten Erythrozytensuspension mit einer 200-μl-Pipettenpistole zwischen zwei Deckgläser (Abbildung 1).
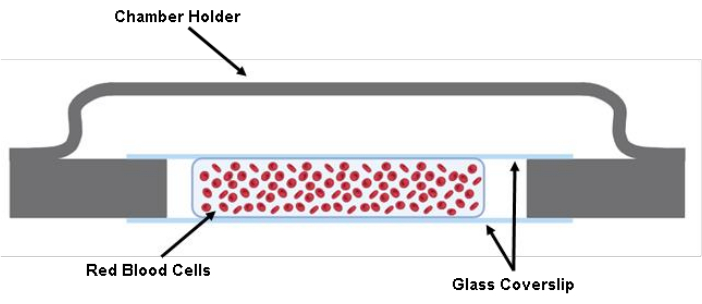
Abbildung 1: Illustration der Zellkammer. Zwei geschnittene Stücke eines 40 mm x 22 mm x 0,17 mm großen Glasdeckglases werden mit Fett auf den Kammerhalter geklebt. Zwischen den beiden geschliffenen Glasdeckgläsern werden etwa 200 μl der Zelllösung in Tyrode's Buffer ausgesät. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Mikropipetten-Aspirationsbaugruppe
- Montieren Sie die Zellkammer auf dem Haltertisch auf der Mikroskopplattform. Stellen Sie die Position so ein, dass sich die Zellkammer direkt über dem Objektiv befindet (Abbildung 2B).
- Senken Sie den Mikropipettenhalter unter den Flüssigkeitsstand des angeschlossenen Wasserbehälters.
- Injizieren Sie entweder demineralisiertes Wasser oder Tyrode-Puffer in die hergestellte Mikropipette und entfernen Sie vorsichtig alle Luftblasen mit einer Spritze, die mit einer 34-G-Nadel gekoppelt ist (siehe Materialtabelle).
- Schrauben Sie das Ende des Mikropipettenhalters halb ab und lassen Sie das Wasser einige Sekunden lang aus dem Mikropipettenhalter tropfen.
HINWEIS: CHECKPOINT (siehe Ergänzende Tabelle S1) - Führen Sie die Mikropipette in die Halterspitze ein. Ziehen Sie die Halterschraube fest, um sicherzustellen, dass die Mikropipette fixiert ist.
- Führen Sie die Mikropipette in die Zellkammer ein und suchen Sie die Mikropipette und die Erythrozyten unter dem Mikroskop. Verwenden Sie den Mikromanipulator, um die Position einzustellen.
- Senken Sie die Mikropipettenspitze weiter ab, um sicherzustellen, dass die Spitze mit der Position der RBC übereinstimmt.
HINWEIS: CHECKPOINT (siehe Ergänzende Tabelle S1) - Stellen Sie den Hydraulikdruck an der Spitze der Mikropipette auf Null, indem Sie die Höhe des Wasserbehälters einstellen. Heben Sie dann den Wasserbehälter leicht an, um einen subtilen Überdruck an der Spitze zu erzeugen.
6. Führen Sie den fluoreszenzgekoppelten Mikropipetten-Aspirationsassay durch
- Schalten Sie die 488-nm-Leuchtstoffröhren-Anregungslichtquelle ein. Schalten Sie den Fluoreszenzverschluss zu diesem Zeitpunkt nicht ein, um ein Photobleichen zu vermeiden (Abbildung 2C). Schalten Sie die Fluoreszenzkamera und die übertragene Kamera ein.
HINWEIS: Beide Kameras werden mit der entsprechenden Software bedient (siehe Materialtabelle). - Richten Sie die gewünschte Belichtungszeit (100 ms für beide Kameras in dieser Studie), den Bereich of Interest (ROI) und die Binning-Größe (keine für diese Studie) für beide Kameras in der Software ein. Öffnen Sie das multidimensionale Erfassungsfenster , um die Erfassungsrahmennummer 2.000 für diese Studie und das Speicherverzeichnis einzurichten.
HINWEIS: Die Erfassungsrahmennummer hängt von der gewünschten Anzahl von Aspirationsereignissen ab, die aufgezeichnet werden sollen. Für 1 Aspirationsereignis sollte der Bereich der Erfassungszahl innerhalb von 100-500 eingestellt werden, was ungefähr 10-50 s entspricht. - Finden Sie die Mikropipette mit dem Mikromanipulator unter dem Sichtfeld.
- Schalten Sie die pneumatische Druckklemme ein, einschließlich des Schaltkastens und des Klemmsystems (Abbildung 2A). Stellen Sie sicher, dass sich die Steuerbox im EXTRNL-Modus befindet. Kompensieren Sie den Offsetdruck im System, indem Sie den Knopf langsam drehen.
- Schalten Sie die separate Software ein, die die pneumatische Klemme steuert. Die Software verfügt über ein elektrisches Bedienfeld zur Steuerung des diskreten Analogeingangs zum Klemmensystem. Der Druck wird mit einem Umrechnungsfaktor von 20 mV/mmHg geregelt.
- Setzen Sie den Druck im System auf Null. Platzieren Sie die Mikropipette vorsichtig in der Nähe der Erythrozyten. Passen Sie die Position des Wasserbehälters an, bis ein subtiler Überdruck an der Spitze der Mikropipette zu spüren ist.
- Starten Sie die Erfassung in der Kamera-Bediensoftware. Schalten Sie den Fluoreszenzshutter ein.
- Saugen Sie eine RBC an, indem Sie die berechnete Spannungsgröße in das Bedienfeld eingeben, um den gewünschten Druck zu erreichen.
HINWEIS: Der Druck zum Ansaugen einer Erythrozyten liegt typischerweise im Bereich von Δp = -5 bis -40 mmHg. Es sollte eine spürbare Zungenverlängerung innerhalb der Mikropipettenspitze auftreten (Abbildung 2D). - Halten Sie den Druck für einen voreingestellten Zeitraum; Lassen Sie dann den Druck ab.
- Bewegen Sie die Mikropipette, um die nächste Zelle aufzunehmen, und wiederholen Sie das Experiment.
7. Analyse der Fluoreszenzintensität
- Laden Sie die gespeicherten Fluoreszenzbilder in die Analysesoftware.
- Passen Sie den Intensitätsschwellenwert über die Registerkarte "Anzeigeanpassung" an. Geben Sie dazu entweder die Werte manuell ein oder verwenden Sie den Schieberegler, um sicherzustellen, dass die Fluoreszenzbilder einen klaren Kontrast der Zelle in der Analysesoftware zeigen (siehe Ergänzungsdatei 1 - Ergänzende Abbildung S1).
- Scrollen Sie zur Zeitleiste am unteren Rand der Software. Suchen Sie das angegebene Aspirationsereignis.
- Klicken Sie auf Neue Flächen hinzufügen. Definieren Sie den ROI der Analyse.
HINWEIS: Die Software bietet einen geführten fünfstufigen Prozess zum Anpassen und Abschließen der Segmentierung (siehe Ergänzungsdatei 1 - Ergänzende Abbildung S2 und Ergänzende Abbildung S3).
HINWEIS: Halten Sie den ROI so gering wie möglich, um Rechenressourcen zu sparen. - Verwenden Sie den Schieberegler für die Hintergrundsubtraktion und passen Sie den Segmentierungsschwellenwert mit dem Schieberegler an, um das beste Segmentierungsergebnis zu erzielen.
HINWEIS: Dies bedeutet, dass abgesehen vom Aspirationsereignis der Hintergrund so genau wie möglich segmentiert werden sollte (siehe Zusatzdatei 1 - Ergänzende Abbildung S4 und Ergänzende Abbildung S5). - Fügen Sie einen Flächenfilter hinzu, um Hintergrundgeräusche auszuschließen (siehe Ergänzungsdatei 1-Ergänzende Abbildung S6).
HINWEIS: Dies wird in der Nachbearbeitungsphase abgeschlossen. - Wählen Sie die Registerkarte Statistik | Registerkarte "Detailliert" | Registerkarte Durchschnittswerte . Scrollen Sie, um den Intensitätsmittelwert zu finden und auszuwählen (siehe Ergänzungsdatei 1 - Ergänzende Abbildung S7).
- Exportieren Sie die Fluoreszenzsignalspur im Zeitverlauf in eine .csv Datei.
- Öffnen Sie die exportierte CSV-Datei. Subtrahieren Sie die Hintergrundsignale Fb von allen Messungen.
- Berechnen Sie die Änderung der Kalziumintensität, ΔFmax, mit Gleichung (1):
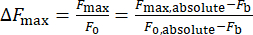 (1)
(1)
Wobei ΔFmax die maximale Änderung der Kalziumintensität ist, Fb die Hintergrundintensität und F0 die Ruheintensität.
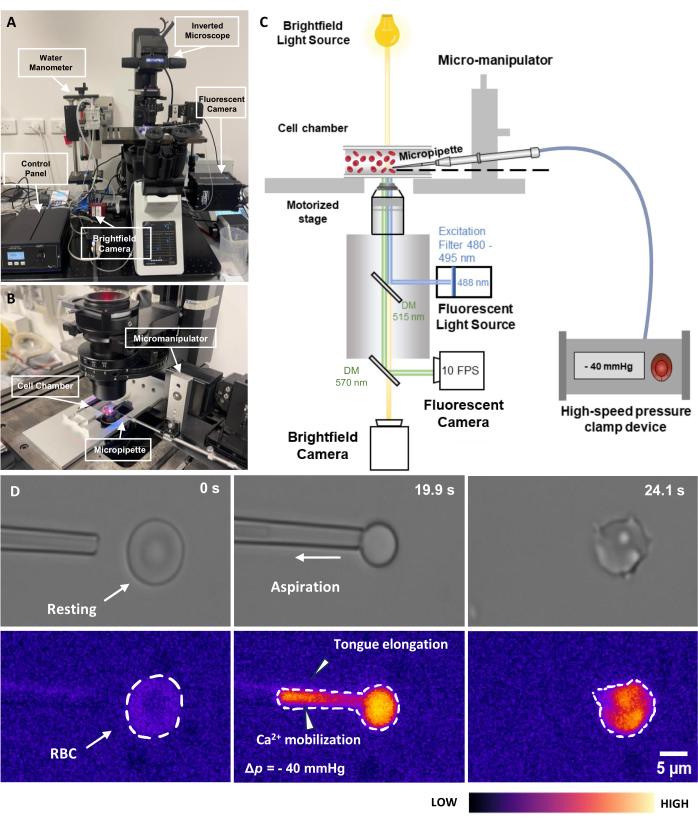
Abbildung 2: Fluoreszenzgekoppelte Mikropipetten-Aspirationsanordnung. (A) Ein Überblick über das fMPA-Hardwaresystem, das das inverse Mikroskop in Kombination mit den Hellfeld- und Fluoreszenzkameras umfasst. Die linke Seite des Bildes zeigt das selbstgebaute Wassermanometer und den Schaltkasten, mit dem der Druck der pneumatischen Druckpumpe präzise eingestellt werden kann. (B) Der Mikroskoptisch, der die Experimentzellkammer und das Mikromanipulatorsystem mit einer einzigen Mikropipette darstellt. (C) Schematische Darstellung des fMPA-Systemaufbaus. Gleichzeitige Bildgebung von Hellfeld- (gelb) und Fluoreszenzsignalen (blaue Emission, grüne Anregung) unter Verwendung von zwei dichroitischen Spiegeln, um die Lichtwege von der Fluoreszenzlichtquelle (blau) zum Ziel und dann zu den Kameras zur Bildgebung (grün) zu lenken. (D) Die obere Reihe zeigt die Hellfeldbilder, während die untere Reihe die Fluoreszenzbilder zeigt. Die linke Seite stellt die Position der Mikropipette vor der Aspiration dar, wenn die Erythrozyten ruhen. Die mittlere Spalte zeigt den Aspirationsprozess, bei dem die Erythrozyten einem Unterdruck von -40 mmHg ausgesetzt sind. Die rechte Seite zeigt die Zellmorphologie nach dem negativen Aspirationsdruck. Maßstabsleiste = 5 μm. Abkürzungen: fMPA = Fluoreszenzgekoppelte Mikropipettenaspiration; DM = dichroitischer Spiegel; RBC = rote Blutkörperchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Um Mikropipetten-Aspirationsassays zu etablieren, konstruierten wir zunächst eine kundenspezifische Zellkammer aus zwei Metallquadraten (Kupfer/Aluminium), die durch einen Griff verbunden waren. Zwei Deckgläser aus Glas im dritten Schnitt (40 mm × 7 mm × 0,17 mm) wurden angebracht, um eine Kammer zu schaffen, die mit 200 μl Erythrozyten gefüllt ist, die im Tyrode-Puffer suspendiert sind. Nach dem Einbringen von Erythrozyten in die Kammer wurde eine maßgeschneiderte Borosilikat-Mikropipette auf einem Halter befesti...
Diskussion
Mikropipetten-Aspirationsassays verkörpern eine verfeinerte Methodik, die eine erhebliche Druckmodulation, eine exakte räumliche Orchestrierung und ein zuverlässiges zeitliches Unterscheidungsvermögen einsetzt, um die tiefgreifenden Feinheiten der zellulären Biomechanik zu untersuchen. Diese Studie legt besonderen Wert auf die Anwendung von fMPA als entscheidendes Werkzeug zur Enthüllung der nuancierten mechanosensitiven Reaktionen, die von Erythrozyten unter unterschiedlichen Stimuli gezeigt werden. Die gleichzeit...
Offenlegungen
Die Autoren erklären, dass sie in Bezug auf die vorliegende Studie keine konkurrierenden Interessen zu berichten haben.
Danksagungen
Wir danken Nurul Aisha Zainal Abidin und Laura Moldovan für die zusätzliche Spenderrekrutierung, Blutentnahme und Unterstützung bei der Phlebotomie. Wir danken Tomas Anderson und Arian Nasser für die Organisation der Ausrüstung und Reagenzien. Diese Forschung wurde vom Australian Research Council (ARC) Discovery Project (DP200101970-L. A.J.); der National Health and Medical Research Council (NHMRC) of Australia Ideas Grant (APP2003904-L. A.J.); NHMRC-Ausrüstungszuschuss-L.A.J.; NSW Programm zum Aufbau kardiovaskulärer Kapazitäten (Early-Mid Career Researcher Grant-L.A.J.); NSW CVRN-VCCRI Forschungsinnovationszuschuss; Büro für globales und wissenschaftliches Engagement (Sydney-Glasgow Partnership Collaboration Award-L.A.J.); L.A.J. ist ein National Heart Foundation Future Leader Fellow Level 2 (105863) und ein Snow Medical Research Foundation Fellow (2022SF176).
Materialien
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
Referenzen
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten