需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
荧光微量移液器抽吸法研究红细胞机械传感
摘要
探索机械应力下的细胞行为对于细胞力学和机械生物学的进步至关重要。我们介绍了荧光微量移液器抽吸(fMPA)技术,这是一种将受控机械刺激与单细胞细胞内信号传导综合分析相结合的新方法。该技术研究了活细胞机械生物学的新深入研究。
摘要
长期以来,微量移液器抽吸法一直是研究活细胞力学的基石,为细胞对机械应力的反应提供了见解。本文详细介绍了荧光偶联微量移液器抽吸 (fMPA) 测定的创新应用。fMPA 检测引入了管理精确机械力的能力,同时监测由离子通道介导的活细胞机械转导过程。精密的装置包括一个精密设计的硼硅酸盐玻璃微量移液器,连接到一个精细调节的储水器和气动吸气系统,便于以± 1 mmHg的增量进行受控压力的应用。一个显著的改进是落射荧光成像的集成,允许在抽吸过程中同时观察和定量细胞形态变化和细胞内钙通量。fMPA检测通过其落射荧光成像与微量移液器抽吸的协同组合,为在具有挑战性的机械环境中研究细胞机械传感设定了新标准。这种多方面的方法适用于各种实验设置,为单细胞机械传感机制提供了重要的见解。
引言
细胞行为领域的不断发现强调了机械刺激(如张力、流体剪切应力、压缩和基质刚度)在决定动态细胞活动(如粘附、迁移和分化)中的作用。这些机械生物学方面对于阐明细胞如何与其生理环境相互作用并对其做出反应至关重要,从而影响各种生物过程 1,2。
在过去十年中,基于微量移液器的抽吸检测已成为研究各种细胞对机械刺激反应的多功能工具。该技术为单细胞水平上活细胞的内在机械特性提供了有价值的见解,包括细胞弹性模量、刚度和皮质张力。这些测定可以测量各种机械参数,例如细胞膜张力、施加在细胞膜上的压力和皮质张力(总结在表 1 中)。研究吸力丰富了我们对它们如何影响细胞功能和过程的理解,特别是在膜动力学领域,包括碎裂、伸长和萌芽 3,4。
| 机械参数 | 描述 | 开创性方法 |
| 电池刚度 | 测量电池的机械刚度和弹性。 | 细胞膜的抽吸和对负压的变形响应分析20,21。 |
| 粘接强度 | 评估细胞粘附在表面的强度。 | 应用受控抽吸将粘附的细胞从底物上分离2,22。 |
| 膜张力 | 评估细胞膜内的张力或应力。 | 膜变形响应的测量23,24. |
| 粘弹性 | 表征细胞的粘性和弹性组合行为。 | 抽吸时变形响应分析23,25. |
| 变形 | 确定细胞改变形状的难易程度。 | 受控吸力下变形程度的评估20,24. |
| 表面张力 | 测量电池表面的张力。 | 评估形成微量移液器膜突起所需的压力26. |
| 细胞-材料相互作用 | 研究细胞与材料或底物之间的相互作用。 | 与不同材料接触的细胞抽吸和相互作用的观察2,24。 |
| 细胞间相互作用 | 检查相邻细胞之间的相互作用。 | 一组细胞的抽吸及其细胞间力的分析27. |
表1:微量移液器抽吸法表征的机械参数。
基于微量移液器的抽吸技术已被广泛用于研究红细胞 (RBC),评估红细胞的变形性和各种机械特性,这对于了解它们在循环系统中的功能至关重要。红细胞表现出非凡的适应性,在穿过复杂的毛细血管网络和内皮间裂隙时保持其机械多功能性,防止变形5,6。在这个过程中,红细胞必须穿过狭窄至0.5-1.0μm的通道,承受多种机械力,包括拉伸和压缩7,8,9。它们对循环过程中血流产生的剪切应力也具有高度敏感性 10。这些过程促进了涉及钙内流的调节机制的激活,钙内流是一种关键的信号转导事件,在细胞对机械刺激的反应中具有公认的作用11,12。控制钙介导的机械感应的复杂机制仍然是正在进行的研究的引人注目的主题。
在这种情况下,fMPA是一种有效的方法,可以揭示在精确控制的机械力下钙的动员程度,允许同时应用机械调节(使用微量移液器抽吸系统)和可视化钙强度(使用荧光指示剂)。它特别模仿红细胞穿过狭窄血管时的生理场景。值得注意的是,我们开发的fMPA系统可以产生分辨率为1 mmHg的压力。实现的高速相机可以实现 100 毫秒的时间分辨率和亚微米级的空间分辨率。这些配置确保了对活细胞精确施加机械力,并同时捕获由此产生的细胞信号。此外,由于这种设置的集成工程性质,微量移液器抽吸法可以很容易地适应其他设备或技术,从而进一步探索细胞力学的复杂性。这种多功能性是这种方法的另一个优势。
研究方案
该协议遵循悉尼大学人类研究伦理委员会的指南并已获得批准。本研究已获得捐赠者的知情同意。
1. 人红细胞分离
注意:步骤 1.1 应由训练有素的抽血师使用机构审查委员会批准的方案执行。
- 使用 19 G 蝴蝶针从肘正中静脉抽取 5 mL 血液。
- 将收集的血液转移到含有 1:200 依诺肝素的 15 mL 试管中以防止凝血。
- 在 1 mL 碳酸盐/碳酸氢盐缓冲液(C 缓冲液,pH = 8.5-9; 材料表)。
- 将稀释的血液样品以900× g 离心1分钟以沉淀红细胞。 小心地倾析上清液而不干扰沉淀。
- 用 1 mL C 缓冲液(材料表)洗涤 RBC 沉淀两次,每次以 900 × g 离心 1 分钟。
- 随后,使用相同的离心条件用 1 mL Tyrode 缓冲液洗涤 RBC 沉淀 2 次,然后将最终沉淀重悬于 1 mL Tyrode 缓冲液中以获得洗涤后的原液 RBC 悬浮液。
2.钙指示剂负荷
- 根据使用自动细胞计数器(材料表)获得的细胞计数,将洗涤原液 RBC 溶液的浓度在 Tyrode 缓冲液中调节至 10 ×10 6 个细胞/mL。
- 通过与16.67μM Cal-520AM(一种钙敏感染料)一起孵育,同时在旋转管混合器上搅拌1小时,标记RBC内的钙。
- 在含有 0.5% 牛血清白蛋白 (BSA) 的 Tyrode 缓冲液中以 1:50 的比例稀释红细胞。这些细胞现在已准备好用于实验。
3. 微量移液器制造
- 将硼硅酸盐玻璃毛细管(外径 1 mm x 内径 0.6 mm)安装到 P-1000 微量移液器拉拔器上,以使用预设的拉拔程序在拉拔部位产生两个相应的带有闭塞吸头的微量移液器。对于此设置,请使用以下拉动程序值:热量 516、拉力 150、速度 75、时间 250 和 压力 500。
注:在拉动程序中设置的加热和拉动参数可以定制,并且取决于实验设计12的所需设置。 CHECKPOINT (参见 补充表 S1)。 - 通过安装拉到微量移液器切割器上后获得的封闭式微量移液器之一来打开封闭的吸头。将加热温度调节至约50-60°C。
- 使用10倍目镜定位微量移液器。使用旋钮进行调整,将微量移液器靠近硼硅酸盐玻璃珠。
- 将目镜更换至 30 倍,然后将微量移液器放置在尽可能靠近硼硅酸盐玻璃珠的位置,而无需弯曲移液器尖端。
- 踩在加热踏板上,用热量软化硼硅酸盐玻璃珠。轻轻地将未密封的微量移液器吸头插入软化的微珠中,直到达到所需的终点,即开口直径。
- 松开脚踏板,让玻璃珠冷却下来。确保微量移液器的尖端始终留在珠子内。
注意: 进一步插入尖端会导致更大的开口直径。 - 轻轻抽出微量移液器,在封闭的微量移液器上形成清晰的直切口。确认毛细管的最终直径为1μm。
注: CHECKPOINT (参见 补充表 S1)
4. 细胞室制备
- 使用金刚石铅笔将标准的 40 mm x 22 mm x 0.17 mm 玻璃盖玻片分成三个相等的条带。
- 用真空润滑脂将一块切割好的玻璃盖玻片粘贴到自制腔室支架的底部。
注意: 腔室支架由两个金属(铜/铝)正方形组成,它们通过弯曲的手柄连接。金属块之间的距离必须小于 40 毫米,切割的盖玻片才能粘附在支架上以形成平行腔室。 - 用真空润滑脂将切割玻璃盖玻片的第二块粘附在自制腔室支架的顶部。
注: CHECKPOINT (参见 补充表 S1) - 使用 200 μL 移液管枪在两个盖玻片之间注入 200 μL 标记的 RBC 悬浮液(图 1)。
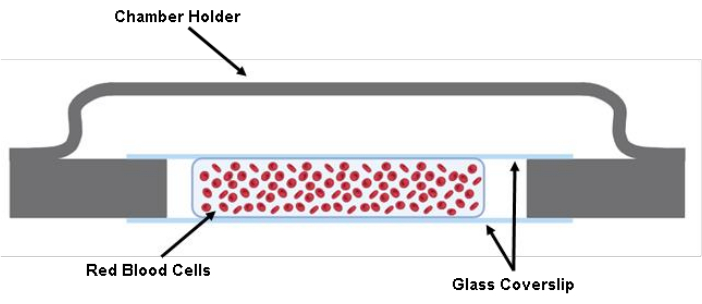
图 1:细胞室的图示。 使用润滑脂将两块 40 mm x 22 mm x 0.17 mm 玻璃盖玻片的切割件粘附在腔室支架上。在两个切割的玻璃盖玻片之间,接种约200μLTyrode缓冲液中的细胞溶液。 请点击这里查看此图的较大版本.
5. 微量移液器抽吸组件
- 将细胞室安装到显微镜平台上的支架上。调整位置,使细胞室位于物镜正上方(图2B)。
- 将微量移液器支架降低到所连接储水器的液位以下。
- 将软化水或Tyrode缓冲液注入制备的微量移液器中,并使用带有34G针头的注射器小心地除去所有气泡(参见材料表)。
- 将微量移液器支架的末端拧下一半,让水从微量移液器支架上滴落几秒钟。
注: CHECKPOINT (参见 补充表 S1) - 将微量移液器插入支架吸头。拧紧支架螺钉,确保微量移液器固定。
- 将微量移液器插入细胞室,并在显微镜下定位微量移液器和红细胞。使用显微操纵器调整位置。
- 进一步降低微量移液器吸头,以确保吸头与位于的红细胞齐平。
注: CHECKPOINT (参见 补充表 S1) - 通过调节储水器的高度,将微量移液器吸头处的液压归零。然后,稍微抬高储水器,在尖端产生微妙的正压。
6. 进行荧光偶联微量移液器抽吸测定
- 打开 488 nm 荧光激发光源。在此阶段不要打开荧光快门以避免光漂白(图2C)。打开荧光相机和透射相机。
注意: 两台相机均使用适当的软件进行操作(参见 材料表)。 - 在软件中为两台相机设置所需的 曝光时间 (本研究中两台相机均为 100 毫秒 )、感兴趣区域 (ROI)、像素合并大小(本研究中无)。打开 多维采集面板 ,设置 采集帧号,本研究2000个,保存目录。
注意:采集帧数取决于要记录的所需抽吸事件数量。对于 1 次抽吸事件,采集数的范围应设置在 100-500 以内,约为 10-50 s。 - 使用显微操纵器在视野下找到微量移液器。
- 打开气动压力夹,包括控制箱和夹具系统(图 2A)。确保 控制箱 处于 EXTRNL 模式。通过缓慢旋转旋钮来补偿系统内的任何偏移压力。
- 打开控制气动夹的单独软件amp。该软件具有一个电气控制面板,用于控制钳位系统的离散模拟输入。压力控制在20 mV/mmHg转换系数上。
- 将系统内部的压力归零。小心地将微量移液器靠近红细胞的位置。 调整储水器位置,直到在微量移液器尖端注意到微妙的正压。
- 在相机操作软件中开始采集。打开 荧光快门。
- 通过在控制面板中输入计算出的电压大小来吸出红细胞以达到所需的压力。
注意:抽吸红细胞的压力通常在 Δp = -5 至 -40 mmHg 的范围内。微量移液器吸头内应有明显的舌伸长(图2D)。 - 在预设的时间内保持压力;然后,释放压力。
- 移动微量移液器拾取下一个细胞并重复实验。
7. 荧光强度分析
- 将保存的荧光图像加载到分析软件中。
- 使用显示调整选项卡调整强度阈值。为此,可以手动输入值,也可以使用滑块,以确保荧光图像在分析软件中显示细胞的清晰对比度(参见补充文件1-补充图S1)。
- 滚动到软件底部的时间线。找到指定的抽吸事件。
- 单击 添加新曲面。定义分析 ROI。
注意:该软件提供了一个指导性的五步过程来调整和完成分割(参见 补充文件 1 - 补充图 S2 和 补充图 S3)。
注意:保持尽可能小的 ROI 以节省计算资源。 - 使用背景减法滑块并使用滑块调整分割阈值,以获得最佳分割结果。
注意:这意味着除了抽吸事件外,应尽可能准确地分割背景(参见 补充文件 1 - 补充图 S4 和 补充图 S5)。 - 添加 区域 滤波器以排除背景噪声(请参阅 补充文件 1 - 补充图 S6)。
注意:这是在后期处理阶段完成的。 - 选择 统计 信息选项卡 | "详细 "选项卡 | "平均值 "选项卡。滚动以查找并选择强度平均值(请参阅 补充文件 1-补充图 S7)。
- 将随时间变化的荧光信号迹线导出到.csv文件。
- 打开导出的 csv 文件。从所有测量值中减去背景信号 Fb。
- 使用公式(1)计算钙强度变化,ΔFmax:
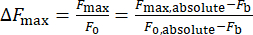 (一)
(一)
其中 ΔFmax 是最大钙强度变化, Fb 是背景强度, F0 是静息强度。
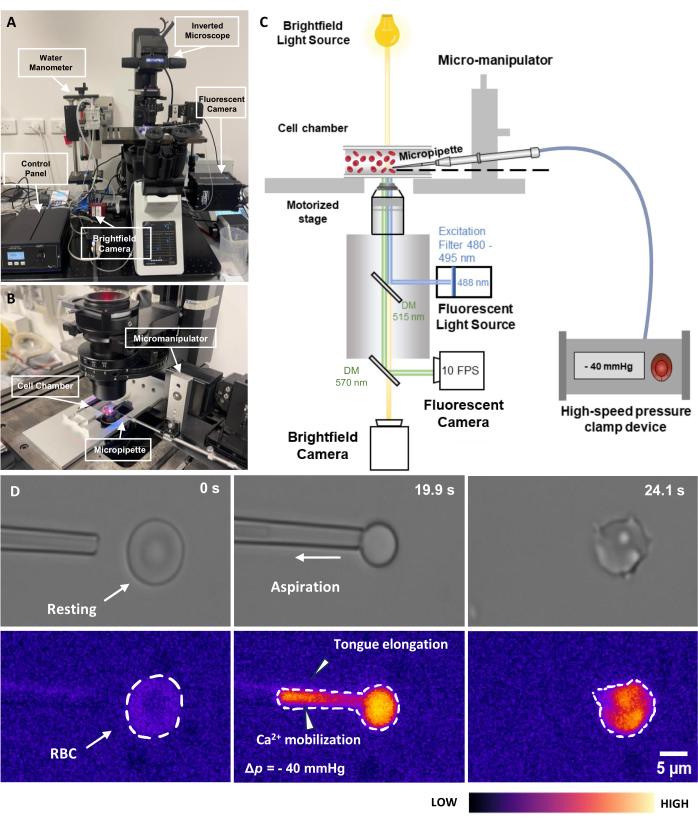
图 2:荧光偶联微量移液器抽吸组件。 (A) fMPA硬件系统概述,该系统将倒置显微镜与明场和荧光相机相结合。图像的左侧描绘了自制的水压计和控制箱,可以精确调节气动压力泵的压力。(B) 显微镜载物台,描绘了实验室和带有单个微量移液器的显微操纵器系统。(C) fMPA系统设置示意图。利用两个二向色镜对明场(黄色)和荧光(蓝色发射,绿色激发)信号进行同步成像,将光路从荧光光源(蓝色)引导到目标,然后引导到相机进行成像(绿色)。(D) 顶行表示明场图像,底行表示荧光图像。左图表示红细胞静止时微量移液器在抽吸前的位置。中间一栏记录了红细胞承受 -40 mmHg 负压的抽吸过程。右图描绘了经历负吸气压后的细胞形态。比例尺 = 5 μm。缩写:fMPA = 荧光耦合微量移液器抽吸;DM = 二向色镜;红细胞=红细胞。 请点击这里查看此图的较大版本.
结果
为了建立微量移液器抽吸测定,我们首先构建了一个定制的细胞室,该室由两个金属方块(铜/铝)组成,通过手柄连接。粘贴两个第三切割的玻璃盖玻片(40 mm × 7 mm × 0.17 mm),以创建一个充满悬浮在 Tyrode 缓冲液中的 200 μL RBC 的腔室。将红细胞引入腔室后,将定制的硼硅酸盐微量移液器固定在支架上,并使用微量操纵器小心地放置在腔室内。随后,将微量移液器拉近以捕获目标红细胞。
讨论
微量移液器抽吸法体现了一种精细的方法,部署了大量的压力调节、精确的空间协调和可靠的时间辨别,以探索细胞生物力学的深刻复杂性。本研究特别强调 fMPA 作为揭示红细胞在不同刺激下表现出的细微机械敏感反应的关键工具的应用。同时使用明场和荧光信号可以对细胞现象进行多方面的探索,从而推进细胞内钙流入的实时监测和检测。这种方法为红细胞的复杂机械传感反应提供了综合见解?...
披露声明
作者声明,他们没有关于本研究的竞争利益报告。
致谢
我们感谢 Nurul Aisha Zainal Abidin 和 Laura Moldovan 为献血者招募、采血和放血提供额外支持。我们感谢托马斯·安德森(Tomas Anderson)和阿里安·纳赛尔(Arian Nasser)组织设备和试剂。这项研究由澳大利亚研究委员会(ARC)发现项目(DP200101970-L)资助。A.J.);澳大利亚国家健康与医学研究委员会 (NHMRC) 创意资助 (APP2003904-L.A.J.);NHMRC 设备补助金-LAJ;新南威尔士州心血管能力建设计划(Early-Mid Career Researcher Grant-LAJ);新南威尔士州CVRN-VCCRI研究创新补助金;全球和研究参与办公室(悉尼-格拉斯哥伙伴关系合作奖-LAJ);L.A.J. 是美国国家心脏基金会未来领袖研究员 2 级 (105863) 和斯诺医学研究基金会研究员 (2022SF176)。
材料
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
参考文献
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。