A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בדיקת שאיפת מיקרופיפטה פלואורסצנטית לחקר מכנוסנסינג של תאי דם אדומים
In This Article
Summary
חקר ההתנהגות התאית תחת לחץ מכני הוא חיוני להתקדמות במכניקה התאית ובמכנוביולוגיה. אנו מציגים את טכניקת Fluorescence Micropipette Aspiration (fMPA), שיטה חדשנית המשלבת גירוי מכני מבוקר עם ניתוח מקיף של איתות תוך תאי בתאים בודדים. טכניקה זו חוקרת מחקרים מעמיקים חדשים של מכנוביולוגיה של תאים חיים.
Abstract
מבחני שאיפת מיקרופיפטה מהווים מזה זמן רב אבן פינה לחקר מכניקת התא החי, ומציעים תובנות לגבי תגובות תאיות לעקה מכנית. מאמר זה מפרט התאמה חדשנית של בדיקת שאיפת מיקרופיפטה מצומדת פלואורסצנטית (fMPA). בדיקת fMPA מציגה את היכולת לנהל כוחות מכניים מדויקים תוך ניטור בו זמנית של תהליכי מכנוטרנסדוקציה של תאים חיים המתווכים על ידי תעלות יונים. המערך המתוחכם משלב מיקרופיפטה מזכוכית בורוסיליקט מהונדסת בדייקנות המחוברת למאגר מים מווסת דק ולמערכת שאיפות פנאומטית, המאפשרת הפעלת לחץ מבוקרת במרווחים מעודנים עד ± 1 מ"מ כספית. שיפור משמעותי הוא שילוב של דימות אפי-פלואורסצנטי, המאפשר תצפית וכימות בו זמנית של שינויים מורפולוגיים בתאים ושטפי סידן תוך תאיים במהלך השאיפה. בדיקת fMPA, באמצעות השילוב הסינרגטי של דימות אפי-פלואורסצנטי עם שאיפת מיקרופיפטה, מציבה סטנדרט חדש לחקר חישה של תאים בסביבות מאתגרות מבחינה מכנית. גישה רב-גונית זו ניתנת להתאמה למערכי ניסוי שונים, ומספקת תובנות קריטיות לגבי מנגנוני המכנוסנסינג החד-תאיים.
Introduction
התגליות המתגלות בעולם ההתנהגויות התאיות הדגישו את תפקידם של גירויים מכניים, כגון מתח, לחץ גזירה נוזלי, דחיסה ונוקשות המצע, בהכתבת פעילויות תאיות דינמיות כגון הידבקות, נדידה והתמיינות. היבטים מכנוביולוגיים אלה הם בעלי חשיבות עליונה בהבהרת האופן שבו תאים מתקשרים עם סביבתם הפיזיולוגית ומגיבים אליה, ומשפיעים על תהליכים ביולוגיים שונים 1,2.
במהלך העשור האחרון, מבחני שאיפה מבוססי מיקרופיפטה בלטו ככלי רב-תכליתי בחקר תגובות תאיות מגוונות לגירויים מכניים. טכניקה זו מציעה תובנות חשובות על התכונות המכניות המהותיות של תאים חיים ברמת התא היחיד, כולל מודולוס אלסטי תאי, נוקשות ומתח קליפת המוח. בדיקות אלה מאפשרות מדידה של פרמטרים מכניים שונים, כגון מתח בקרום התא, לחץ המופעל על קרום התא ומתח קליפת המוח (מסוכם בטבלה 1). חקר הכוחות השאפתניים העשיר את הבנתנו כיצד הם משפיעים על תפקודים ותהליכים תאיים, במיוחד בתחום הדינמיקה של הממברנה, כולל קיטוע, התארכות וניצנים 3,4.
| פרמטר מכני | תיאור | גישות ראשוניות |
| קשיחות תאים | מדידת הקשיחות המכנית והגמישות של התא. | שאיפת קרום התא וניתוח תגובת דפורמציה ללחץ שלילי20,21. |
| חוזק הדבקה | הערכה של מידת החוזק שבה תאים נצמדים למשטחים. | יישום יניקה מבוקרת לניתוק תאים דבוקים ממצע2,22. |
| מתח הממברנה | הערכת המתח או הלחץ בתוך קרום התא. | מדידת עיוות הממברנה בתגובה ללחץ מופעל23,24. |
| תכונות ויסקו-אלסטיות | אפיון ההתנהגות הצמיגית והאלסטית המשולבת של התא. | ניתוח תגובת העיוות תלוית הזמן לשאיפה23,25. |
| עיוות | קביעת הקלות שבה תא יכול לשנות צורה. | הערכת מידת העיוות תחת יניקה מבוקרת20,24. |
| מתח פנים | מדידת המתח על פני התא. | הערכת הלחץ הנדרש ליצירת בליטת קרום מיקרופיפטה26. |
| אינטראקציה בין תא לחומר | חקר אינטראקציות בין תאים וחומרים או מצעים. | שאיפת תאים במגע עם חומרים שונים ותצפית על אינטראקציות2,24. |
| אינטראקציה בין תא לתא | בחינת אינטראקציות בין תאים שכנים. | שאיפה של קבוצת תאים וניתוח הכוחות הבין-תאיים שלהם27. |
טבלה 1: פרמטרים מכניים המאופיינים בבדיקת שאיפת מיקרופיפטה.
טכניקת השאיפה המבוססת על מיקרופיפטה נמצאת בשימוש נרחב לחקר תאי דם אדומים (RBCs), להערכת העיוות והמאפיינים המכניים השונים של RBCs, החיוניים להבנת תפקודם במערכת הדם. RBCs מפגינים יכולת הסתגלות יוצאת דופן, ושומרים על הרבגוניות המכנית שלהם נגד עיוות בעת ניווט דרך רשת הנימים המורכבת ושסעים בין-אנדותליים 5,6. במהלך מסע זה, RBCs חייבים לחצות מעברים צרים כמו 0.5-1.0 מיקרומטר, לחשוף את עצמם למספר רב של כוחות מכניים, כולל מתח ודחיסה 7,8,9. יש להם גם רגישות גבוהה ללחץ הגזירה שנוצר על ידי זרימת הדם במהלך מחזורהדם 10. תהליכים אלה מקדמים את ההפעלה של מנגנוני ויסות המערבים זרימת סידן, אירוע איתות מכריע עם תפקידים מבוססים היטב בתגובות תאיות לגירויים מכניים11,12. המנגנונים המורכבים השולטים במכנוסנסינג בתיווך סידן נותרו נושאים משכנעים לחקירה מתמשכת.
בהקשר זה, ה-fMPA מהווה גישה יעילה לחשיפת היקף ניוד הסידן תחת כוחות מכניים מבוקרים במדויק, ומאפשר יישום סימולטני של אפנון מכני (באמצעות מערכת שאיפת מיקרופיפטה) והדמיה של עוצמת הסידן (באמצעות אינדיקטורים פלואורסצנטיים). זה מחקה במיוחד את התרחיש הפיזיולוגי כאשר RBC עובר דרך כלי דם מצטמצמים. ראוי לציין כי מערכת fMPA שפיתחנו יכולה ליצור לחץ ברזולוציה של 1 מ"מ כספית. המצלמה המיושמת במהירות גבוהה יכולה להשיג רזולוציה זמנית של 100 אלפיות השנייה ורזולוציה מרחבית ברמת התת-מיקרון-מטר. תצורות אלה מבטיחות הפעלה מדויקת של כוחות מכניים לתאים חיים ובו זמנית לוכדות את האיתות התאי המתקבל. יתר על כן, בשל האופי ההנדסי האינטגרטיבי של מערך זה, ניתן להתאים בקלות את בדיקת שאיפת המיקרופיפטה כדי להשלים ציוד או טכניקות אחרות, מה שמאפשר חקירה נוספת של המורכבויות של מכניקת התא. רבגוניות זו מהווה יתרון נוסף של גישה זו.
Protocol
פרוטוקול זה עוקב אחר ההנחיות של ועדת האתיקה של המחקר האנושי של אוניברסיטת סידני ואושר על ידה. התקבלה הסכמה מדעת מהתורמים למחקר זה.
1. בידוד RBC אנושי
הערה: שלב 1.1 צריך להתבצע על ידי פלבוטומיסט מיומן באמצעות פרוטוקול שאושר על ידי מועצת הביקורת המוסדית.
- למשוך 5 מ"ל של דם מן הווריד cubital החציוני באמצעות מחט פרפר 19 גרם.
- העבר את הדם שנאסף לתוך צינור 15 מ"ל המכיל 1:200 enoxaparin כדי למנוע קרישה.
- לדלל 5 μL של דם enoxaparin-anticoagulatated ב 1 מ"ל של חיץ פחמתי/ביקרבונט (C-buffer, pH = 8.5-9; טבלת חומרים).
- צנטריפוגה את דגימת הדם המדולל ב 900 × גרם במשך 1 דקה כדי לשקע את RBCs. בזהירות decant supernatant מבלי להפריע את הכדור.
- בצע שתי שטיפות של גלולת RBC עם 1 מ"ל של C-buffer (טבלה של חומרים), צנטריפוגה בכל פעם ב 900 × גרם במשך 1 דקה.
- לאחר מכן, שטפו את גלולת RBC 2x עם 1 מ"ל של החיץ של Tyrode באמצעות אותם תנאי צנטריפוגה ולאחר מכן השעו מחדש את הגלולה האחרונה ב 1 מ"ל של החיץ של Tyrode כדי לקבל את מתלה RBC מלאי שטוף.
2. העמסת מחוון סידן
- התאימו את ריכוז תמיסת RBC ל-10 ×10 6 תאים/מ"ל במאגר של Tyrode, בהתבסס על ספירת התאים המתקבלת באמצעות מונה תאים אוטומטי (Table of Materials).
- תייגו את הסידן בתוך RBCs על ידי דגירה עם 16.67 μM Cal-520 AM, צבע רגיש לסידן, תוך כדי תסיסה על מערבל צינור סיבובי למשך שעה אחת.
- לדלל את RBCs במאגר של Tyrode המכיל 0.5% אלבומין בסרום בקר (BSA) ביחס של 1:50. התאים מוכנים כעת לשימוש ניסיוני.
3. ייצור מיקרופיפטה
- הרכיבו את צינור נימי זכוכית בורוסיליקט (קוטר חיצוני של 1 מ"מ x קוטר פנימי של 0.6 מ"מ) על מושך המיקרופיפטה P-1000 כדי לייצר שתי מיקרופיפטות תואמות עם קצוות סגורים באתר המשיכה באמצעות תוכנית המשיכה שנקבעה מראש. עבור הגדרה זו, השתמש בערכי תוכנית המשיכה הבאים: חום 516, משיכה 150, מהירות 75, זמן 250 ולחץ 500.
הערה: פרמטרי חימום ומשיכה שנקבעו בתוכנית המשיכה ניתנים להתאמה אישית ותלויים בהגדרות הרצויות של תכנון הניסוי12. CHECKPOINT (ראה טבלה משלימה S1). - פתח את הקצה הסגור על ידי הרכבת אחד המיקרופיפטות הסגורות שנרכשו לאחר משיכה על חותך המיקרופיפטה. כוונן את טמפרטורת החימום לכ- 50-60 מעלות צלזיוס.
- אתר את המיקרופיפטה באמצעות עינית 10x. קרבו את המיקרופיפטה לחרוז הזכוכית של הבורוסיליקט באמצעות הידיות לצורך כוונון.
- החליפו את העינית ל-30x לפני שתמקמו את המיקרופיפטה קרוב ככל האפשר לחרוז זכוכית בורוסיליקט מבלי לכופף את קצה הפיפטה.
- רככו את חרוז זכוכית הבורוסיליקט באמצעות חום על ידי לחיצה על דוושת החימום. מכניסים בעדינות את קצה המיקרופיפטה הסגור הגולמי לחרוז המרוכך עד שמגיעים לנקודת הקצה הרצויה, קוטר הפתיחה.
- שחררו את דוושת הרגל ותנו לחרוז הזכוכית להתקרר. ודא שקצה המיקרופיפטה נשאר תמיד בתוך החרוז.
הערה: הכנסת הקצה מובילה לקטר פתיחה גדול יותר. - מוציאים בעדינות את המיקרופיפטה, מה שמוביל לחתך ישר ושקוף על המיקרופיפטה הסגורה. אשר כי הקוטר הסופי של נימי הוא 1 מיקרומטר.
הערה: נקודת ביקורת (ראה טבלה משלימה S1)
4. הכנת תא התא
- השתמש בעיפרון יהלום כדי לחלק כיסוי זכוכית סטנדרטי בגודל 40 מ"מ x 22 מ"מ x 0.17 מ"מ לשלוש רצועות שוות.
- הדביקו חתיכה אחת של כיסוי הזכוכית החתוכה לתחתית מחזיק תא תוצרת בית עם שומן ואקום.
הערה: מחזיק התא מורכב משני ריבועי מתכת (נחושת/אלומיניום) המחוברים באמצעות ידית מעוקלת. המרחק בין גושי המתכת חייב להיות פחות מ -40 מ"מ כדי שהכיסוי החתוך ייצמד למחזיק כדי ליצור תא מקביל. - הדביקו את החתיכה השנייה של כיסוי הזכוכית החתוכה לחלק העליון של מחזיק התא תוצרת בית עם שומן ואקום.
הערה: נקודת ביקורת (ראה טבלה משלימה S1) - הזריקו 200 μL של מתלה RBC המסומן בין שני כיסויים באמצעות אקדח פיפטה 200 μL (איור 1).
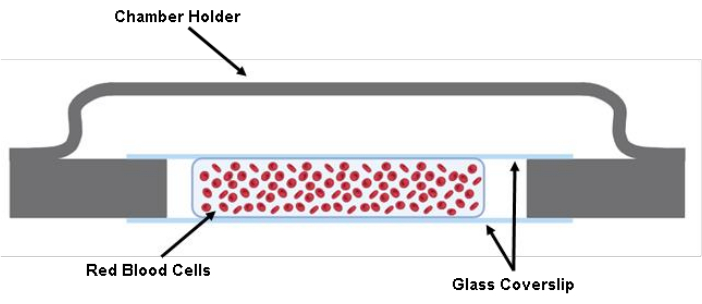
איור 1: איור של תא התא. שתי חתיכות חתוכות של משטח כיסוי זכוכית בגודל 40 מ"מ x 22 מ"מ x 0.17 מ"מ מודבקות למחזיק התא באמצעות גריז. בין שתי כיסויי הזכוכית החתוכים, נזרעים כ-200 מיקרוליטר מתמיסת התא בחיץ של טירוד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הרכבת שאיפת מיקרופיפטה
- הרכיבו את תא התא על במת המחזיק הקיימת על משטח המיקרוסקופ. התאימו את המיקום כך שתא התא יהיה ישירות מעל המטרה (איור 2B).
- מנמיכים את מחזיק המיקרופיפטה אל מתחת לרמת הנוזל של מאגר המים המחובר.
- הזריקו מים נטולי מינרלים או את החיץ של טיירוד לתוך המיקרופיפטה המיוצרת והסירו בזהירות את כל בועות האוויר באמצעות מזרק יחד עם מחט 34 גרם (ראו טבלת חומרים).
- שחררו את קצה מחזיק המיקרופיפטה באמצע הדרך ואפשרו למים לטפטף ממחזיק המיקרופיפטה למשך מספר שניות.
הערה: נקודת ביקורת (ראה טבלה משלימה S1) - הכנס את המיקרופיפטה לקצה המחזיק. הדקו את בורג המחזיק כדי לוודא שהמיקרופיפטה קבועה.
- הכנס את המיקרופיפטה לתא התא ואתר את המיקרופיפטה וה- RBCs מתחת למיקרוסקופ. השתמש micromanipulator כדי להתאים את המיקום.
- הורידו את קצה המיקרופיפטה עוד יותר כדי לוודא שהקצה מפולס עם ה-RBC הממוקם.
הערה: נקודת ביקורת (ראה טבלה משלימה S1) - אפס את הלחץ ההידראולי בקצה המיקרופיפטה על ידי התאמת גובה מאגר המים. לאחר מכן, הרימו מעט את מאגר המים כדי ליצור לחץ חיובי עדין בקצה.
6. בצע את בדיקת שאיפת מיקרופיפטה מצומדת פלואורסצנטית
- הפעל את מקור אור העירור הפלואורסצנטי 488 ננומטר. אל תפעילו את תריס הפלואורסצנטיות בשלב זה כדי למנוע הלבנה (איור 2C). הפעל את מצלמת הפלואורסצנטיות ואת המצלמה המשודרת.
הערה: שתי המצלמות מופעלות באמצעות התוכנה המתאימה (ראה טבלת חומרים). - הגדר את זמן החשיפה הרצוי (100 מילישניות עבור שתי המצלמות במחקר זה), אזור עניין (ROI), גודל binning (אין עבור מחקר זה) עבור שתי המצלמות בתוכנה. פתח את פאנל הרכישה הרב-ממדי כדי להגדיר את מספר מסגרת הרכישה, 2,000 עבור מחקר זה, ואת ספריית השמירה.
הערה: מספר מסגרת הרכישה תלוי במספר הרצוי של אירועי שאיפה שיש לתעד. עבור אירוע שאיפה אחד, טווח מספר הרכישה צריך להיות מוגדר בתוך 100-500, שהוא בערך 10-50 שניות. - מצא את micropipette מתחת לשדה הראייה באמצעות micromanipulator.
- הפעילו את מהדק הלחץ הפנאומטי, כולל תיבת הבקרה ומערכת המהדק (איור 2A). ודא שתיבת הבקרה נמצאת במצב EXTRNL. פצה כל לחץ היסט בתוך המערכת על ידי סיבוב איטי של הידית.
- הפעל את התוכנה הנפרדת השולטת במהדק הפנאומטי. התוכנה כוללת לוח בקרה חשמלי כדי לשלוט על הקלט אנלוגי נפרד למערכת מהדק. הלחץ נשלט באמצעות מקדם המרה של 20 mV / mmHg.
- אפס את הלחץ בתוך המערכת. מקם בזהירות את המיקרופיפטה קרוב ל- RBCs. התאם את מיקום מאגר המים עד שיבחינו בלחץ חיובי עדין בקצה המיקרופיפטה.
- התחל את הרכישה בתוכנת הפעלת המצלמה. הפעל את התריס הפלואורסצנטי.
- שאפו RBC על ידי הקלדת גודל המתח המחושב בלוח הבקרה כדי להגיע ללחץ הרצוי.
הערה: הלחץ לשאיפת RBC הוא בדרך כלל בטווח של Δp = -5 עד -40 מ"מ כספית. צריכה להיות התארכות לשון ניכרת בתוך קצה המיקרופיפטה (איור 2D). - להחזיק את הלחץ לתקופה מוגדרת מראש; לאחר מכן, שחררו את הלחץ.
- הזיזו את המיקרופיפטה כדי להרים את התא הבא ולחזור על הניסוי.
7. ניתוח עוצמת פלואורסצנטיות
- טען את תמונות הפלואורסצנטיות שנשמרו בתוכנת הניתוח.
- כוונן את סף העוצמה באמצעות כרטיסיית התאמת התצוגה . בצע זאת על-ידי הזנה ידנית של הערכים או שימוש במחוון כדי להבטיח שהתמונות הפלואורסצנטיות יציגו ניגודיות ברורה של התא בתוכנת הניתוח (ראה קובץ משלים 1 - איור S1).
- גלול אל ציר הזמן בתחתית התוכנה. אתר את אירוע השאיפה המיועד.
- לחץ על הוסף משטחים חדשים. הגדר את החזר ההשקעה על הניתוח.
הערה: התוכנה מספקת תהליך מונחה בן חמישה שלבים כדי להתאים ולהשלים את הפילוח (ראה קובץ משלים 1 - איור משלים S2 ואיור משלים S3).
הערה: שמור על החזר השקעה קטן ככל האפשר כדי לחסוך במשאבים חישוביים. - השתמש במחוון החיסור ברקע והתאם את סף הפילוח באמצעות המחוון כדי לקבל את תוצאת הפילוח הטובה ביותר.
הערה: משמעות הדבר היא שמלבד אירוע השאיפה, יש לפלח את הרקע בצורה מדויקת ככל האפשר (ראה קובץ משלים 1 - איור משלים S4 ואיור משלים S5). - הוסף מסנן אזור כדי למנוע רעשי רקע (ראה קובץ משלים 1 - איור S6 משלים).
הערה: פעולה זו הושלמה בשלב שלאחר התהליך. - בחר בכרטיסיה סטטיסטיקה | כרטיסייה מפורטת | הכרטיסיה ערכים ממוצעים . גלול כדי למצוא ולבחור את ממוצע העוצמה (ראה קובץ משלים 1 - איור S7).
- יצא את מעקב האות הפלואורסצנטי לאורך זמן לקובץ .csv.
- פתח את קובץ ה- csv המיוצא. החסר את אותות הרקע, Fb, מכל המדידות.
- חשב את השינוי בעוצמת הסידן, ΔFmax, באמצעות משוואה (1):
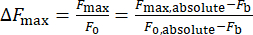 (1)
(1)
כאשר ΔFmax היא השינוי המרבי בעוצמת הסידן, Fb היא עוצמת הרקע, ו-F0 היא עוצמת המנוחה.
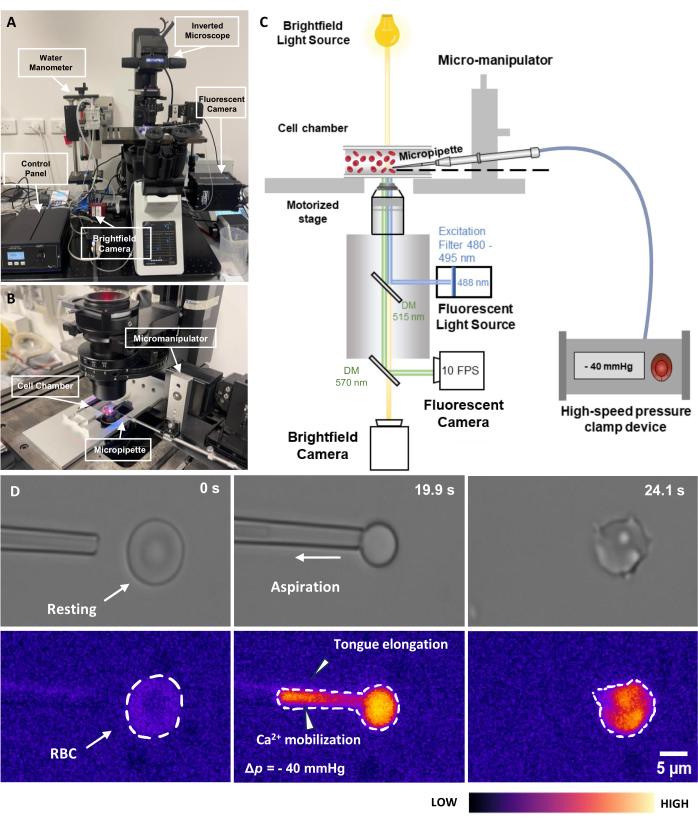
איור 2: מכלול שאיפת מיקרופיפטה מצומדת פלואורסצנטית. (A) סקירה כללית של מערכת החומרה fMPA המשלבת את המיקרוסקופ ההפוך בשילוב עם מצלמות שדה בהיר ומצלמות פלואורסצנטיות. הצד השמאלי של התמונה מתאר את מנומטר המים תוצרת בית ואת תיבת הבקרה המאפשרת לכוונן במדויק את הלחץ של משאבת הלחץ הפנאומטית. (B) שלב המיקרוסקופ המתאר את תא הניסוי ואת מערכת המיקרומניפולטור עם מיקרופיפטה אחת. (C) סכימה של הגדרת מערכת fMPA. הדמיה בו-זמנית של אותות שדה בהיר (צהוב) ופלואורסצנטי (פליטה כחולה, עירור ירוק) באמצעות שתי מראות דיכרואיות כדי לכוון את נתיבי האור ממקור האור הפלואורסצנטי (כחול) אל המטרה, ולאחר מכן למצלמות לצורך הדמיה (ירוק). (D) השורה העליונה מציגה את תמונות השדה הבהיר ואילו השורה התחתונה מדגימה את התמונות הפלואורסצנטיות. השמאלי מייצג את מיקום המיקרופיפטה לפני השאיפה כאשר RBC נמצא במנוחה. העמודה האמצעית מצלמת את תהליך השאיפה שבו RBC חווה לחץ שלילי של -40 מ"מ כספית. מימין מתאר את המורפולוגיה של התא לאחר שחווה את לחץ השאיפה השלילי. סרגל קנה מידה = 5 מיקרומטר. קיצורים: fMPA = שאיפת מיקרופיפטה מצומדת פלואורסצנטית; DM = מראה דיכרואית; RBC = תא דם אדום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
כדי לבסס מבחני שאיפת מיקרופיפטה, בנינו תחילה תא תא מותאם אישית המורכב משני ריבועי מתכת (נחושת/אלומיניום) המחוברים באמצעות ידית. שני כיסויי זכוכית חתוכים שלישית (40 מ"מ × 7 מ"מ × 0.17 מ"מ) הודבקו כדי ליצור תא מלא ב-200 מיקרוליטר RBCs התלויים בחיץ של טירוד. לאחר החדרת RBCs לתא, מיקרופיפטה בורוסיליקט מותא?...
Discussion
מבחני שאיפת מיקרופיפטה מגלמים מתודולוגיה מעודנת, הפורסת אפנון לחץ משמעותי, תזמור מרחבי מדויק והבחנה טמפורלית אמינה כדי לחקור את המורכבויות העמוקות של ביומכניקה תאית. מחקר זה שם דגש מיוחד על היישום של fMPA ככלי חיוני לחשיפת התגובות המכנואנסיות הרגישות לניואנסים המוצגות על ידי RBCs תחת גירויי...
Disclosures
המחברים מצהירים כי אין להם אינטרסים מתחרים לדווח על המחקר הנוכחי.
Acknowledgements
אנו מודים לנורול עאישה זינאל אבידין ולורה מולדובן על גיוס תורמים נוספים, איסוף דם ותמיכה בפלבוטומיה. אנו מודים לתומס אנדרסון ואריאן נאסר על ארגון הציוד והריאגנטים. מחקר זה מומן על ידי פרויקט גילוי מועצת המחקר האוסטרלית (ARC) (DP200101970-L. א.ג.); המועצה הלאומית לבריאות ומחקר רפואי (NHMRC) של אוסטרליה Ideas Grant (APP2003904-L. א.ג.); מענק ציוד NHMRC-L.A.J.; תוכנית בניית יכולת קרדיווסקולרית של NSW (חוקר קריירה מוקדמת-בינונית Grant-L.A.J.); מענק חדשנות מחקר NSW CVRN-VCCRI; המשרד למעורבות גלובלית ומחקרית (פרס שיתוף הפעולה בין סידני לגלזגו - L.A.J.); L.A.J. הוא עמית מנהיג העתיד של קרן הלב הלאומית רמה 2 (105863), ועמית קרן המחקר הרפואי בשלג (2022SF176).
Materials
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
References
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved