JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
적혈구 메카노센싱을 조사하기 위한 형광 마이크로피펫 흡인 분석
요약
기계적 스트레스 하에서의 세포 거동에 대한 탐구는 세포 역학 및 기계생물학의 발전에 중추적인 역할을 합니다. 당사는 단일 세포에서 세포 내 신호의 포괄적인 분석과 제어된 기계적 자극을 결합하는 새로운 방법인 형광 마이크로피펫 흡인(fMPA) 기법을 소개합니다. 이 기술은 살아있는 세포 기계생물학에 대한 새로운 심층 연구를 조사합니다.
초록
마이크로피펫 흡인 분석은 오랫동안 살아있는 세포 역학 연구의 초석이 되어 왔으며, 기계적 스트레스에 대한 세포 반응에 대한 통찰력을 제공합니다. 이 백서는 형광 결합 마이크로피펫 흡인(fMPA) 분석의 혁신적인 적응에 대해 자세히 설명합니다. fMPA 분석은 이온 채널에 의해 매개되는 살아있는 세포 기계적 전달 과정을 동시에 모니터링하면서 정밀한 기계적 힘을 투여할 수 있는 기능을 도입합니다. 정교한 설정에는 정밀하게 설계된 붕규산 유리 마이크로피펫이 미세하게 조절되는 물 저장조와 공압 흡입 시스템에 연결되어 있어 ± 1mmHg까지 정제된 증분으로 제어된 압력 적용이 용이합니다. 중요한 개선 사항은 epi-fluorescence 이미징의 통합으로, 흡인 중 세포 형태학적 변화와 세포 내 칼슘 플럭스를 동시에 관찰하고 정량화할 수 있습니다. fMPA 분석은 epi-fluorescence 이미징과 마이크로피펫 흡인의 시너지 효과를 통해 기계적으로 까다로운 환경에서 세포 메카노센싱 연구를 위한 새로운 표준을 제시합니다. 이 다면적 접근 방식은 다양한 실험 설정에 적용할 수 있어 단일 세포 메카노센싱 메커니즘에 대한 중요한 통찰력을 제공합니다.
서문
세포 행동의 세계에서 펼쳐지는 발견은 접착, 이동 및 분화와 같은 동적 세포 활동을 지시하는 데 있어 장력, 유체 전단 응력, 압축 및 기판 강성과 같은 기계적 자극의 역할을 강조했습니다. 이러한 기계생물학적 측면은 세포가 생리적 환경과 상호 작용하고 반응하여 다양한 생물학적 과정에 영향을 미치는 방식을 설명하는 데 가장 중요합니다 1,2.
지난 10년 동안 마이크로피펫 기반 흡인 분석은 기계적 자극에 대한 다양한 세포 반응을 연구하는 다목적 도구로 두각을 나타냈습니다. 이 기술은 세포 탄성 계수, 강성 및 피질 장력을 포함하여 단일 세포 수준에서 살아있는 세포의 고유한 기계적 특성에 대한 귀중한 통찰력을 제공합니다. 이러한 분석을 통해 세포막 장력, 세포막에 가해지는 압력 및 피질 장력과 같은 다양한 기계적 매개변수를 측정할 수 있습니다(표 1에 요약됨). 열망하는 힘을 연구하는 것은 특히 단편화, 신장 및 발아를 포함한 막 역학 영역에서 세포 기능과 과정에 어떻게 영향을 미치는지에 대한 우리의 이해를 풍부하게 했습니다 3,4.
| 기계적 매개 변수 | 묘사 | 중요한 접근법 |
| 셀 강성 | 셀의 기계적 강성 및 탄성 측정. | 세포막의 흡인 및 음압에 대한 변형 반응 분석20,21. |
| 접착 강도 | 세포가 표면에 얼마나 강하게 부착되는지에 대한 평가. | 기판2,22에서 부착된 세포를 분리하기 위한 제어된 흡입의 적용. |
| 멤브레인 장력 | 세포막 내의 장력 또는 응력 평가. | 적용된 압력에 대한 멤브레인 변형 측정23,24. |
| 점탄성 특성 | 세포의 결합된 점성 및 탄성 거동의 특성화. | 흡인에 대한 시간 의존적 변형 반응 분석23,25. |
| 변형성 | 세포가 얼마나 쉽게 모양을 바꿀 수 있는지에 대한 결정. | 제어된 흡입 하에서의 변형 정도 평가20,24. |
| 표면 장력 | 셀 표면의 장력 측정. | 마이크로피펫 멤브레인 돌출부를 형성하는 데 필요한 압력 평가26. |
| 세포-물질 상호작용 | 세포와 재료 또는 기질 간의 상호 작용에 대한 연구. | 다른 물질과 접촉하는 세포의 흡인 및 상호 작용 관찰2,24. |
| 세포-세포 상호작용 | 인접 세포 간의 상호 작용 검사. | 세포 그룹의 흡인 및 세포 간 힘 분석27. |
표 1: 마이크로피펫 흡인 분석으로 특징지어지는 기계적 파라미터.
마이크로피펫 기반 흡인 기법은 적혈구(RBC)를 연구하는 데 널리 사용되어 왔으며, 순환계에서 적혈구의 기능을 이해하는 데 필수적인 적혈구의 변형성과 다양한 기계적 특성을 평가합니다. 적혈구는 놀라운 적응성을 나타내며, 복잡한 모세혈관 네트워크와 내피 간 틈새를 통과할 때 변형에 대한 기계적 다양성을 보존합니다 5,6. 이 여정 동안 적혈구는 0.5-1.0 μm의 좁은 통로를 통과해야 하며 장력 및 압축을 포함한 다양한 기계적 힘을 받아야 합니다 7,8,9. 또한 순환 중 혈류에 의해 발생하는 전단 응력에 대한 민감도가 높다10. 이러한 과정은 기계적 자극에 대한 세포 반응에서 잘 확립된 역할을 하는 중요한 신호 이벤트인 칼슘 유입과 관련된 조절 메커니즘의 활성화를 촉진합니다11,12. 칼슘 매개 메카노센싱을 지배하는 복잡한 메커니즘은 여전히 지속적인 연구의 강력한 주제로 남아 있습니다.
이러한 맥락에서 fMPA는 정밀하게 제어되는 기계적 힘 하에서 칼슘 동원의 정도를 밝히는 효과적인 접근 방식으로, 기계적 조절(마이크로피펫 흡입 시스템 사용)과 칼슘 강도 시각화(형광 표시기 사용)를 동시에 적용할 수 있습니다. 특히 적혈구가 좁아지는 혈관을 통과할 때의 생리학적 시나리오를 모방합니다. 우리가 개발한 fMPA 시스템은 1mmHg의 분해능으로 압력을 생성할 수 있다는 점은 주목할 가치가 있습니다. 구현된 고속 카메라는 100ms의 시간 해상도와 서브미크론 미터 수준의 공간 해상도를 달성할 수 있습니다. 이러한 구성은 살아있는 세포에 기계적 힘을 정밀하게 적용하고 동시에 그 결과로 발생하는 세포 신호를 포착합니다. 또한, 이 설정의 통합적 엔지니어링 특성으로 인해 마이크로피펫 흡인 분석은 다른 장비나 기술을 보완하기 위해 쉽게 조정할 수 있어 세포 역학의 복잡성을 더 깊이 탐구할 수 있습니다. 이러한 다양성은 이 접근 방식의 또 다른 장점입니다.
프로토콜
이 프로토콜은 시드니 대학교의 인간 연구 윤리 위원회의 지침을 따르며 승인을 받았습니다. 이 연구를 위해 기증자로부터 정보에 입각한 동의를 얻었습니다.
1. 인간 적혈구 분리
참고: 1.1단계는 Institutional Review Board에서 승인한 프로토콜을 사용하여 훈련된 정맥 전문의가 수행해야 합니다.
- 19G 나비 바늘을 사용하여 정중 입방 정맥에서 5mL의 혈액을 채취합니다.
- 채취한 혈액을 1:200 에녹사파린이 들어 있는 15mL 튜브에 넣어 응고를 방지합니다.
- 에녹사파린 항응고 혈액 5μL를 탄산염/중탄산염 완충액 1mL에 희석합니다(C-완충액, pH = 8.5-9; 재료 목차).
- 희석된 혈액 샘플을 900× g 에서 1분 동안 원심분리하여 적혈구를 침전시킵니다. 펠릿을 방해하지 않고 상층액을 조심스럽게 디캔팅합니다.
- 1mL의 C-완충액(재료 표)으로 RBC 펠릿을 2회 세척하고 매번 900× g 에서 1분 동안 원심분리합니다.
- 그 후, 동일한 원심분리 조건을 사용하여 Tyrode 완충액 1mL로 RBC 펠릿을 2배 세척한 다음 최종 펠릿을 Tyrode 완충액 1mL에 재현탁시켜 세척된 스톡 RBC 현탁액을 얻습니다.
2. 칼슘 지시약 로딩
- 자동 세포 계수기를 사용하여 얻은 세포 수를 기준으로 Tyrode의 완충액에서 세척된 원액 RBC 용액의 농도를 10 × 106 cells/mL로 조정합니다(재료 표).
- 칼슘에 민감한 염료인 16.67μM Cal-520 AM으로 배양하고 회전식 튜브 믹서에서 1시간 동안 교반하여 적혈구 내부의 칼슘을 라벨링합니다.
- 0.5% 소 혈청 알부민(BSA)을 함유한 Tyrode의 완충액에 적혈구를 1:50 비율로 희석합니다. 이제 세포를 실험적으로 사용할 준비가 되었습니다.
3. 마이크로피펫 제작
- 붕규산 유리 모세관(외경 1mm x 내경 0.6mm)을 P-1000 마이크로피펫 풀러에 장착하면 사전 설정된 당김 프로그램을 사용하여 당김 부위에 팁이 닫힌 두 개의 해당 마이크로피펫을 생성합니다. 이 설정에서는 열 516, 당기기 150, 속도 75, 시간 250 및 압력 500과 같은 당기기 프로그램 값을 사용합니다.
알림: 풀링 프로그램에 설정된 가열 및 풀링 매개변수는 사용자 정의할 수 있으며 실험 설계12의 원하는 설정에 따라 다릅니다. CHECKPOINT ( 보충 표 S1 참조). - 마이크로피펫 커터에 당긴 후 조달한 폐쇄형 마이크로피펫 중 하나를 장착하여 닫힌 팁을 엽니다. 가열 온도를 약 50-60 °C로 조정하십시오.
- 10x 접안렌즈를 사용하여 마이크로피펫을 찾습니다. 조절을 위해 손잡이를 사용하여 마이크로피펫을 붕규산 유리 비드 가까이로 이동합니다.
- 피펫 팁을 구부리지 않고 마이크로피펫을 붕규산 유리 비드에 최대한 가깝게 배치하기 전에 접안렌즈를 30배로 변경합니다.
- 가열 페달을 밟아 열을 사용하여 붕규산 유리 구슬을 부드럽게합니다. 원하는 종말점인 개방 직경에 도달할 때까지 원시 폐쇄형 마이크로피펫 팁을 연화된 비드에 부드럽게 삽입합니다.
- 풋 페달에서 손을 떼고 유리 구슬을 식히십시오. 마이크로피펫의 팁이 항상 비드 내부에 남아 있는지 확인하십시오.
알림: 팁을 더 삽입하면 개구부 직경이 커집니다. - 마이크로피펫을 부드럽게 빼내어 닫힌 마이크로피펫을 선명하게 직선으로 절단합니다. 모세관의 최종 직경이 1μm인지 확인합니다.
참고: 체크포인트 ( 보충 표 S1 참조)
4. 세포실 준비
- 다이아몬드 연필을 사용하여 표준 40mm x 22mm x 0.17mm 유리 커버슬립을 세 개의 동일한 스트립으로 나눕니다.
- 절단된 유리 커버슬립 한 조각을 진공 그리스로 수제 챔버 홀더 바닥에 부착합니다.
알림: 챔버 홀더는 구부러진 손잡이로 연결된 두 개의 금속(구리/알루미늄) 사각형으로 구성됩니다. 금속 블록 사이의 거리는 절단된 커버슬립이 홀더에 부착되어 평행 챔버를 형성하기 위해 40mm 미만이어야 합니다. - 절단된 유리 커버슬립의 두 번째 조각을 진공 그리스로 수제 챔버 홀더 상단에 부착합니다.
참고: 체크포인트 ( 보충 표 S1 참조) - 200μL 피펫 건을 사용하여 라벨링된 RBC 현탁액 200μL를 두 개의 커버슬립 사이에 주입합니다(그림 1).
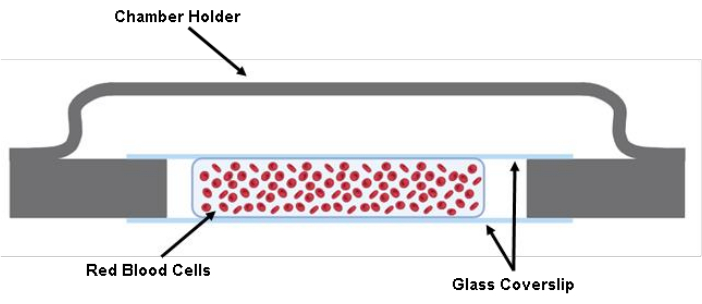
그림 1: 감방 그림. 40 mm x 22 mm x 0.17 mm 유리 커버 슬립의 두 절단 조각은 그리스를 사용하여 챔버 홀더에 부착됩니다. 두 개의 절단된 유리 커버슬립 사이에 Tyrode's Buffer의 약 200μL의 세포 용액이 파종됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 마이크로피펫 흡인 조립
- 세포 챔버를 홀더 스테이지에 장착합니다.tage 현미경 플랫폼에 있습니다. 셀 챔버가 대물렌즈 바로 위에 오도록 위치를 조정합니다(그림 2B).
- 마이크로피펫 홀더를 연결된 물통의 유체 레벨 아래로 내립니다.
- 탈염수 또는 Tyrode의 완충액을 제조된 마이크로피펫에 주입하고 34G 바늘과 결합된 주사기를 사용하여 모든 기포를 조심스럽게 제거합니다(재료 표 참조).
- 마이크로피펫 홀더의 끝을 반쯤 풀고 마이크로피펫 홀더에서 물이 몇 초 동안 떨어지도록 합니다.
참고: 체크포인트 ( 보충 표 S1 참조) - 마이크로피펫을 홀더 팁에 삽입합니다. 홀더 나사를 조여 마이크로피펫이 고정되었는지 확인합니다.
- 마이크로피펫을 세포 챔버에 삽입하고 현미경으로 마이크로피펫과 적혈구를 찾습니다. 마이크로 매니퓰레이터를 사용하여 위치를 조정하십시오.
- 마이크로피펫 팁을 더 내려 팁이 있는 RBC와 수평이 되도록 합니다.
참고: 체크포인트 ( 보충 표 S1 참조) - 물통의 높이를 조정하여 마이크로피펫 팁의 유압을 영점으로 조정합니다. 그런 다음 물통을 약간 들어 올려 팁에 미묘한 양압을 생성합니다.
6. 형광 결합 마이크로피펫 흡인 분석 수행
- 488nm 형광 여기 광원을 켭니다. 이 단계에서 형광 셔터를 켜지 마십시오.tage 광표백을 방지하기 위해(그림 2C). 형광 카메라와 전송된 카메라를 켭니다.
알림: 두 카메라 모두 적절한 소프트웨어를 사용하여 작동됩니다( 자료표 참조). - 소프트웨어에서 두 카메라에 대해 원하는 노출 시간 (이 연구의 두 카메라에 대해 100ms ), 관심 영역(ROI), 비닝 크기(이 연구에서는 없음)를 설정합니다. 다차원 획득 패널 을 열어 획득 프레임 번호, 이 연구를 위한 2,000 및 저장 디렉토리를 설정합니다.
참고: 획득 프레임 번호는 기록할 원하는 흡인 이벤트 수에 따라 다릅니다. 1개의 흡인 이벤트의 경우 획득 번호의 범위는 약 10-50초인 100-500 이내로 설정해야 합니다. - 마이크로 매니퓰레이터를 사용하여 시야 아래에서 마이크로피펫을 찾으십시오.
- 제어 상자와 cl을 포함한 공압 압력 cl을 켭니다.amp 시스템(그림 2A). 컨트롤 박스 가 EXTRNL 모드인지 확인하십시오. 손잡이를 천천히 돌려 시스템 내부의 오프셋 압력을 보상합니다.
- 공압 클램프를 제어하는 별도의 소프트웨어를 켭니다. 이 소프트웨어에는 클램프 시스템에 대한 개별 아날로그 입력을 제어하는 전기 제어 패널이 있습니다. 압력은 20mV/mmHg 변환 계수로 제어됩니다.
- 시스템 내부의 압력을 제로화합니다. 마이크로피펫을 적혈구 가까이에 조심스럽게 재배치합니다. 마이크로피펫 팁에 미묘한 양압이 감지될 때까지 물통 위치를 조정합니다.
- 카메라 작동 소프트웨어에서 수집을 시작합니다. 형광 셔터를 켭니다.
- 계산된 전압 크기를 제어판에 입력하여 RBC를 흡입하여 원하는 압력에 도달합니다.
참고: 적혈구 흡입 압력은 일반적으로 Δp = -5 - -40mmHg 범위입니다. 마이크로피펫 팁 내에 눈에 띄는 텅 신장이 있어야 합니다(그림 2D). - 미리 설정된 기간 동안 압력을 유지하십시오. 그런 다음 압력을 해제하십시오.
- 마이크로피펫을 움직여 다음 세포를 집어 들고 실험을 반복합니다.
7. 형광 강도 분석
- 저장된 형광 이미지를 분석 소프트웨어에 로드합니다.
- 디스플레이 조정 탭을 사용하여 강도 임계값을 조정합니다. 값을 수동으로 입력하거나 슬라이더를 사용하여 형광 이미지가 분석 소프트웨어에서 세포의 명확한 대비를 표시하도록 하여 이를 수행합니다(보충 파일 1-보충 그림 S1 참조).
- 소프트웨어 하단의 타임라인으로 스크롤합니다. 지정된 흡인 이벤트를 찾습니다.
- Add new surfaces(새 표면 추가)를 클릭합니다. 분석 ROI를 정의합니다.
참고: 소프트웨어는 세그멘테이션을 조정하고 완료하기 위한 안내식 5단계 프로세스를 제공합니다( 보충 파일 1-보충 그림 S2 및 보충 그림 S3 참조).
참고: 계산 리소스를 절약하기 위해 ROI를 가능한 한 작게 유지합니다. - 배경 빼기 슬라이더를 사용하고 슬라이더를 사용하여 분할 임계값을 조정하면 최상의 분할 결과를 얻을 수 있습니다.
알림: 이는 흡인 이벤트와는 별도로 배경을 가능한 한 정확하게 분할해야 함을 의미합니다( 보충 파일 1-보충 그림 S4 및 보충 그림 S5 참조). - 배경 소음을 제외하기 위해 영역 필터를 추가합니다( 보충 파일 1-보충 그림 S6 참조).
참고: 이 작업은 포스트 프로세스 단계에서 완료됩니다. - 통계 탭 | 상세 탭 | 평균값 탭을 클릭합니다. 스크롤하여 강도 평균을 찾아 선택합니다(보충 파일 1-보충 그림 S7 참조).
- 시간 경과에 따른 형광 신호 트레이스를 .csv 파일로 내보낼 수 있습니다.
- 내보낸 csv 파일을 엽니다. 모든 측정값에서 배경 신호 Fb를 뺍니다.
- 방정식 (1)을 사용하여 칼슘 강도 변화 ΔFmax를 계산합니다.
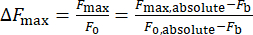 (1)
(1)
여기서 ΔFmax 는 최대 칼슘 강도 변화, Fb는 배경 강도, F0 는 휴식 강도입니다.
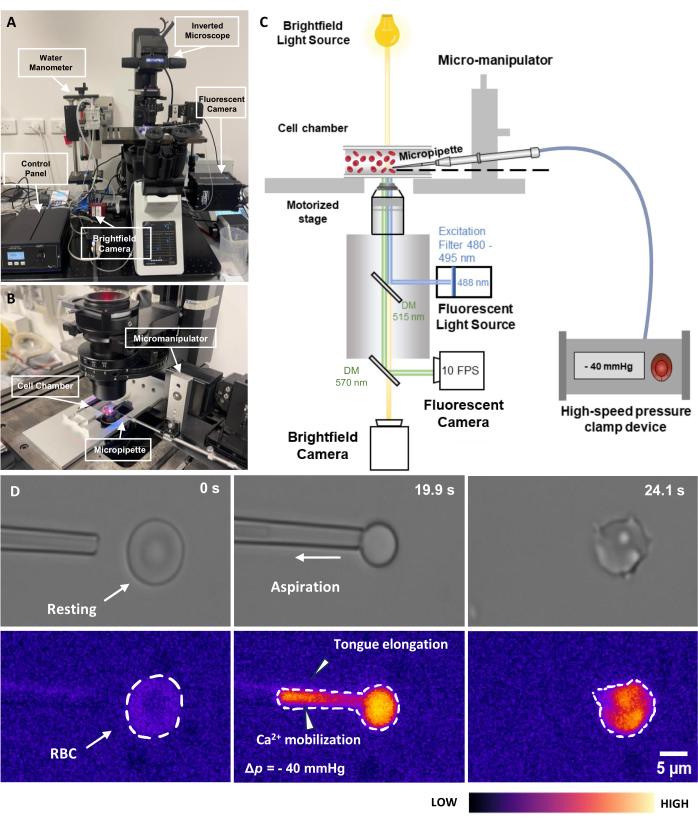
그림 2: 형광 결합 마이크로피펫 흡인 어셈블리. (A) 명시야 및 형광 카메라와 결합된 도립 현미경을 통합한 fMPA 하드웨어 시스템의 개요. 이미지의 왼쪽은 수제 수압계와 공압 압력 펌프의 압력을 정밀하게 조정할 수 있는 컨트롤 박스를 보여줍니다. (B) 단일 마이크로피펫이 있는 실험 세포 챔버 및 미세 조작기 시스템을 묘사한 현미경 단계. (C) fMPA 시스템 설정의 개략도. 두 개의 dichroic mirror를 사용하여 brightfield(노란색) 및 형광(청색 방출, 녹색 여기) 신호의 동시 이미징을 통해 형광 광원(파란색)에서 대상으로, 그리고 이미징을 위해 카메라(녹색)로 광 경로를 지정합니다. (D) 맨 윗줄은 명시야 이미지를 나타내고 맨 아래 줄은 형광 이미지를 보여줍니다. 왼쪽은 적혈구가 정지해 있을 때 흡인 전 마이크로피펫의 위치를 나타냅니다. 중간 컬럼은 적혈구가 -40mmHg의 음압을 경험하는 흡인 과정을 보여줍니다. 오른쪽은 음의 흡인 압력을 경험한 후의 세포 형태를 나타냅니다. 눈금 막대 = 5μm. 약어: fMPA = 형광 결합 마이크로피펫 흡인; DM = 이색성 거울; RBC = 적혈구. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
마이크로피펫 흡인 분석을 확립하기 위해 먼저 손잡이로 연결된 두 개의 금속 사각형(구리/알루미늄)으로 구성된 맞춤형 셀 챔버를 구성했습니다. 두 개의 3차 절단 유리 커버슬립(40mm × 7mm × 0.17mm)을 부착하여 Tyrode의 완충액에 부유하는 200μL의 적혈구로 채워진 챔버를 만들었습니다. 적혈구를 챔버에 도입한 후 맞춤형 붕규산 마이크로피펫을 홀더에 고정하고 마이크로 매니퓰레이터를 사용하여 ...
토론
마이크로피펫 흡인 분석은 세포 생체 역학의 심오한 복잡성을 조사하기 위해 상당한 압력 조절, 정확한 공간 오케스트레이션 및 신뢰할 수 있는 시간적 식별을 배치하는 정교한 방법론을 구현합니다. 이 연구는 다양한 자극 하에서 적혈구가 나타내는 미묘한 기계적 민감성 반응을 밝히기 위한 중요한 도구로서 fMPA의 적용에 특히 중점을 둡니다. 명시야 신호와 형광 신호를 동시에 사용하면 세포 ?...
공개
저자들은 본 연구와 관련하여 보고할 경쟁 이해관계가 없음을 선언합니다.
감사의 말
추가 기증자 모집, 혈액 수집 및 정맥 절개술 지원에 대해 Nurul Aisha Zainal Abidin과 Laura Moldovan에게 감사드립니다. 장비와 시약을 정리해 주신 Tomas Anderson과 Arian Nasser에게 감사드립니다. 이 연구는 호주 연구 위원회(ARC) 디스커버리 프로젝트(DP200101970-L. A.J.); 호주 국립 보건 및 의료 연구 위원회(NHMRC) 아이디어 보조금(APP2003904-L. A.J.); NHMRC 장비 보조금-LAJ; NSW 심혈관 역량 강화 프로그램(초중기 경력 연구원 보조금-LAJ); NSW CVRN-VCCRI 연구 혁신 보조금; 글로벌 및 연구 참여 사무국(시드니-글래스고 파트너십 협력상-LAJ); L.A.J.는 National Heart Foundation Future Leader Fellow Level 2(105863)이자 Snow Medical Research Foundation Fellow(2022SF176)입니다.
자료
| Name | Company | Catalog Number | Comments |
| µManager | Micro-Manager | Version 2.0.0 | |
| 1 mL Syringe | Terumo | 210320D | Cooperate with the Microfil |
| 200 µL Pipette | Eppendorf | 3123000055 | Red clood cell preparation |
| 22 x 40 mm Cover Slips | Knittel Glass | MS0014 | Cell chamber assembly |
| 50 mL Syringe | Terumo | 220617E | Connect to the water tower |
| Calcium Chloride (CaCl2) | Sigma-Aldrich | C1016 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Centrifuge 5425 | Eppendorf | 5405000280 | Red clood cell preparation |
| Clexane | Sigma-Aldrich | 1235820 | To prevent clotting of the collected blood. 10,000 U/mL |
| DAQami | Diligent | ||
| Fluorescence light source | CoolLED | pE-300 | Micropipette aspiration hardware system |
| Glass capillary | Narishige | G-1 | Micropipette manufacture |
| Glucose | Sigma-Aldrich | G8270 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Hepes | Thermo Fisher | 15630080 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| High speed GigE camera | Manta | G-040B | Micropipette aspiration hardware system |
| High speed pressure clamp | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| High speed pressure clamp head stage | Scientific Instrument | HSPC-2-SB | Cooperate with the pressure pump |
| Imaris | Oxford Instruments | ||
| Inverted Microscopy | Olympus | Olympus IX83 | Micropipette aspiration hardware system |
| Microfil | World Precision Instruments | MF34G-5 | 34 G (67 mm Long) Revome air bubble in the cut micropipette and test the opening of the pipette tip |
| Micropipette Puller | Sutter instrument | P1000 | Micropipette manufacture |
| Milli Q EQ 7000 Ultrapure Water Purification System | Merck Millipore | ZEQ7000T0C | Carbonate/bicarbonate buffer & Tryode's buffer preparation |
| Pipette microforge | Narishige | MF-900 | Micropipette manufacture |
| Potassium Chloride (KCl) | Sigma-Aldrich | P9541 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Pressue Pump | Scientific Instrument | PV-PUMP | Induce controlled pressure during experiment |
| Prime 95B Camera | Photometrics | Prime 95B sCMOS | Flourscent imaging |
| Rotary wheel remote unit | Sensapex | uM-RM3 | Control panel for micropipette position adjustment |
| Scepter 3.0 Handheld Cell Counter | Merck Millipore | PHCC340KIT | Automatic cell counter |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation - 2.65 g of NaHCO3 with 2.1 g of Na2CO3 in 250 mL of Mili Q water - Final pH = 8-9. |
| Sodium Chloride (NaCl) | Sigma-Aldrich | S7653 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Tryode's buffer preparation - 12 mM NaHCO3, 10 mM HEPES, 0.137 M NaCl, 2.7 mM KCl, and 5.5 mM D-glucose supplemented with 1 mM CaCl2. Final pH = 7.2 |
| Touch screen control unit | Sensapex | uM-TSC | Control panel for micropipette position adjustment |
| X dry Objective | Olympus | Olympus 60x/0.70 LUCPlanFL | Micropipette aspiration hardware system |
참고문헌
- González-Bermúdez, B., Guinea, G. V., Plaza, G. R. Advances in micropipette aspiration: applications in cell biomechanics, models, and extended studies. Biophysical Journal. 116 (4), 587-594 (2019).
- Mierke, C. T. . Physics of Cancer, Volume 3 (Second Edition): Experimental biophysical techniques in cancer research. , (2021).
- Chen, Y., et al. Loss of the F-BAR protein CIP4 reduces platelet production by impairing membrane-cytoskeleton remodeling. Blood. 122 (10), 1695-1706 (2013).
- Shin, J. -. W., Swift, J., Spinler, K. R., Discher, D. E. Myosin-II inhibition and soft 2D matrix maximize multinucleation and cellular projections typical of platelet-producing megakaryocytes. Proceedings of the National Academy of Sciences. 108 (28), 11458-11463 (2011).
- Liapis, H., Foster, K., Miner, J. H. Red cell traverse through thin glomerular basement membrane. Kidney International. 61 (2), 762-763 (2002).
- Wang, H., et al. Fluorescence-coupled micropipette aspiration assay to examine calcium mobilization caused by red blood cell mechanosensing. European Biophysics Journal. 51 (2), 135-146 (2022).
- Danielczok, J. G., et al. Red blood cell passage of small capillaries is associated with transient Ca2+-mediated adaptations. Frontiers in Physiology. 8, 979 (2017).
- Diez-Silva, M., Dao, M., Han, J., Lim, C. -. T., Suresh, S. Shape and biomechanical characteristics of human red blood cells in health and disease. MRS Bulletin. 35 (5), 382-388 (2010).
- Maître, J. -. L., Niwayama, R., Turlier, H., Nédélec, F., Hiiragi, T. Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology. 17 (7), 849-855 (2015).
- Ju, L., Chen, Y., Xue, L., Du, X., Zhu, C. Cooperative unfolding of distinctive mechanoreceptor domains transduces force into signals. eLife. 5, e15447 (2016).
- Bogdanova, A., Makhro, A., Wang, J., Lipp, P., Kaestner, L. Calcium in red blood cells-a perilous balance. International Journal of Molecular Sciences. 14 (5), 9848-9872 (2013).
- . Pipette Cookbook 2018 Available from: https://www.sutter.com/PDFs/cookbook.pdf (2018)
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Sforna, L., et al. Piezo1 controls cell volume and migration by modulating swelling-activated chloride current through Ca2+ influx. Journal of Cellular Physiology. 237 (3), 1857-1870 (2022).
- High speed pressure clamp. ALA Scientific Instruments Available from: https://alascience.com/products/hspc-2sb/ (2023)
- . Teledyne Imaging Prime 95BTM Scientific CMOS Camera Datasheet Available from: https://www.photometrics.com/wp-content/uploads/2019/10/Prime-95B-Datasheet-07172020.pdf (2020)
- Lee, L. M., Lee, J. W., Chase, D., Gebrezgiabhier, D., Liu, A. P. Development of an advanced microfluidic micropipette aspiration device for single cell mechanics studies. Biomicrofluidics. 10 (5), 054105 (2016).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Current Opinion in Biotechnology. 25, 114-123 (2014).
- Zhou, E. H., Lim, C. T., Quek, S. T. Finite element simulation of the micropipette aspiration of a living cell undergoing large viscoelastic deformation. Mechanics of Advanced Materials and Structures. 12 (6), 501-512 (2005).
- Oh, M. -. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette aspiration of substrate-attached cells to estimate cell stiffness. Journal of Visualized Experiments. (67), e3886 (2012).
- Rand, R. P., Burton, A. C. Mechanical properties of the red cell membrane. Biophysical journal. 4 (4), 303-316 (1964).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Henriksen, J. R., Ipsen, J. H. Measurement of membrane elasticity by micro-pipette aspiration. The European Physical Journal E. 14 (2), 149-167 (2004).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33 (1), 15-22 (2000).
- Pu, H., et al. Micropipette aspiration of single cells for both mechanical and electrical characterization. IEEE Transactions on Biomedical Engineering. 66 (11), 3185-3191 (2019).
- Guevorkian, K., Maître, J. -. L. Chapter 10 - Micropipette aspiration: A unique tool for exploring cell and tissue mechanics in vivo. Methods in Cell Biology. , 187-201 (2017).
- Biro, M., Maître, J. -. L. Chapter 14 - Dual pipette aspiration: A unique tool for studying intercellular adhesion. Methods in Cell Biology. 125, 255-267 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유