A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نموذج فأر ورم غرفة النافذة الظهرية لفحص مجهري داخل الجسم وتصوير بالرنين المغناطيسي في أبحاث السرطان الانتقالية
* These authors contributed equally
In This Article
Summary
تواجه ترجمة نتائج الفحص المجهري داخل الجسم تحديا من خلال اختراقه الضحل للعمق في الأنسجة. هنا نصف نموذج فأر غرفة النافذة الظهرية الذي يتيح التسجيل المشترك للفحص المجهري داخل الجسم وطرق التصوير المطبقة سريريا (على سبيل المثال ، التصوير المقطعي المحوسب ، التصوير بالرنين المغناطيسي) للارتباط المكاني المباشر ، مما قد يؤدي إلى تبسيط الترجمة السريرية لنتائج الفحص المجهري داخل الجسم.
Abstract
أثبت التصوير قبل السريري داخل الجسم مثل الفحص المجهري والتصوير المقطعي للتماسك البصري أنه أدوات قيمة في أبحاث السرطان لتصور البيئة المكروية للورم واستجابته للعلاج. تتميز طرق التصوير هذه بدقة مقياس ميكرون ولكن استخدامها محدود في العيادة بسبب عمق اختراقها الضحل في الأنسجة. تتمتع طرق التصوير الأكثر قابلية للتطبيق سريريا مثل التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي والتصوير المقطعي بالإصدار البوزيتروني بعمق اختراق أكبر بكثير ولكن لها دقة مكانية أقل نسبيا (مقياس مم).
لترجمة نتائج التصوير داخل الجسم قبل السريري إلى العيادة ، يجب تطوير طرق جديدة لسد هذه الفجوة في الدقة الدقيقة إلى الكلية . هنا نصف نموذج فأر ورم غرفة النافذة الظهرية المصممة لتمكين التصوير قبل السريري داخل الجسم والقابل للتطبيق سريريا (CT و MR) في نفس ، ومنصة تحليل الصور التي تربط بين هاتين الطريقتين المختلفتين للتصور. الأهم من ذلك ، أن نهج غرفة النافذة الموصوف يتيح تسجيل طرق التصوير المختلفة في 3D باستخدام علامات إيمانية على غرفة النافذة للتوافق المكاني المباشر. يمكن استخدام هذا النموذج للتحقق من صحة طرق التصوير السريري الحالية ، وكذلك لتطوير طرق جديدة من خلال الارتباط المباشر مع "الحقيقة الأساسية" النتائج عالية الدقة داخل الجسم.
أخيرا ، يمكن مراقبة استجابة الورم لمختلف العلاجات - العلاج الكيميائي والعلاج الإشعاعي والعلاج الضوئي الديناميكي - طوليا باستخدام هذه المنهجية باستخدام طرق التصوير قبل السريرية والقابلة للتطبيق سريريا. وبالتالي يمكن استخدام نموذج فأر الورم في غرفة النافذة الظهرية ومنصات التصوير الموصوفة هنا في مجموعة متنوعة من دراسات أبحاث السرطان ، على سبيل المثال ، في ترجمة نتائج الفحص المجهري داخل الجسم قبل السريري إلى طرق تصوير أكثر قابلية للتطبيق سريريا مثل التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي.
Introduction
يعد الأوعية الدموية الدقيقة للورم مكونا مهما في البيئة المكروية للورم التي يمكن أن تكون هدفا للعلاج ومحددا للاستجابة للعلاج. في الإعداد قبل السريري ، تتم دراسة الأوعية الدموية الدقيقة عادة باستخدام الفحص المجهري داخل الجسم في النماذج الحيوانية لغرفة النافذة التقويمية أو غير المتجانسة1،2. هذا له العديد من المزايا على الدراسات النسيجية حيث يتم التصوير في الأنسجة الحية ويمكن مراقبة الورم طوليا على مدى عدة أسابيع أو حتىأشهر 2,3. يمكن لهذه الدراسات الاستفادة من قدرات التصوير عالية الدقة للفحص المجهري داخل الجسم لدراسة توصيل العلاجات إلى الورم 4,5 ، وأسباب مقاومة العلاج6 ، واستجابة الأوعية الدقيقة للعلاجات مثل العلاج المضاد لتولد الأوعية 7,8 والعلاج الإشعاعي 2,9.
من الواضح أن الفحص المجهري داخل الجسم يلعب دورا مهما في أبحاث السرطان قبل السريرية. ومع ذلك ، كيف يمكن قياس السمات البيئية الدقيقة للورم في العيادة؟ ستكون معلومات الأوعية الدموية الدقيقة مفيدة في العيادة لقياس إمدادات الدم ونقص الأكسجة في الخلايا السرطانية ، وهو أمر مهم لتحديد مقاومة العلاج في العلاج الإشعاعي10 ، وكذلك قدرة الأوعية الدموية الدقيقة على توصيل عوامل العلاج الكيميائي إلى الخلايا السرطانية المحيطة11. على سبيل المثال ، في العلاج الإشعاعي ، قد تساعد المعلومات المكانية حول بنية ووظيفة الأوعية الدموية الدقيقة للورم في تخصيص خطة علاج المريض عن طريق تعديل جدول التجزئة أو عن طريق زيادة الجرعة بشكل تفضيلي إلى المناطق اللاوعائية ونقص الأكسجين المحتمل12.
يمكن للفحص المجهري داخل الجسم قياس هذه الميزات الوعائية الدقيقة المهمة لأنه يحتوي على دقة عالية جدا (مقياس μمتر) ؛ ومع ذلك ، فإن تغلغلها العميق في الأنسجة يقتصر على عدة مئات من الميكرونات أو بضعة ملليمترات ، مما يجعل التنفيذ السريري أمرا صعبا على الأكثر. في الواقع ، هناك بعض التطبيقات الجديدة للفحص المجهري داخل الجسم في العيادة13 ؛ ومع ذلك ، لا تزال هذه تقتصر على فحوصات الأنسجة القريبة من السطح مثل الجلد14 أو البطانات المخاطية / البطانية لمختلف تجاويف الجسم عبر القسطرة / المناظير المرنة15،16.
بشكل أكثر شيوعا ، تتم دراسة الأوعية الدموية الدقيقة باستخدام طرق التصوير مثل CT17 أو MRI18. يمكن لطرق التصوير السريري هذه أن تصور إلى أي عمق داخل الجسم ، ولكن لها دقة مكانية أقل بكثير (مقياس مم). وبالتالي ، هناك حاجة لسد فجوة الدقة هذه بين الفحص المجهري داخل الجسم قبل السريري وطرق التصوير السريري لجلب معلومات الأوعية الدموية الدقيقة عالية الدقة والتفصيلية إلى العيادة19. تم تطوير العديد من طرق التصوير الوظيفي لتحسين قدرات تصوير الأوعية الدموية الدقيقة لطرق التصوير السريري مثل التصوير بالرنين المغناطيسي الديناميكي المعزز بالتباين (DCE) والتصوير المقطعي المحوسب20 والحركة غير المتماسكة Intravoxel (IVIM) التصوير بالرنين المغناطيسي21. ومع ذلك ، فهذه طرق قائمة على النماذج توفر قياسات غير مباشرة للأوعية الدموية الدقيقة ، وبالتالي ، يجب التحقق من صحتها بقياسات "الحقيقة الأرضية" المناسبة للأوعية الدموية الدقيقة19,22.
لقد طورنا نموذج فأر ورم غرفة نافذة طيات الجلد الظهرية (DSFC) لسد هذه الفجوة بين الفحص المجهري داخل الجسم قبل السريري وطرق التصوير المطبقة سريريا مثل التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي. يوفر DSFC وصولا مباشرا إلى الورم للتصوير المجهري عالي الدقة داخل الجسم من خلال نافذة زجاجية ولكن أيضا التصوير القابل للتطبيق سريريا مثل التصوير بالرنين المغناطيسي لأنه مصنوع من مواد متوافقة مع التصوير بالرنين المغناطيسي (البلاستيك والزجاج). علاوة على ذلك ، يقوم رمز MATLAB المضمن بإجراء تسجيل مشترك متعدد الوسائط 3D للارتباطات المكانية المباشرة بين الفحص المجهري داخل الجسم قبل السريري وطرق التصوير المطبقة سريريا. سنصف هنا التصميم والجراحة لتثبيت DSFC بالإضافة إلى إجراء التسجيل المشترك للفحص المجهري داخل الجسم وطرق التصوير المطبقة سريريا.
Protocol
تم تنفيذ جميع الإجراءات الحيوانية وفقا لدليل رعاية واستخدام التجارب الذي وضعه المجلس الكندي لرعاية. تم إجراء التجارب وفقا لبروتوكول معتمد من قبل لجنة رعاية واستخدام المؤسسية التابعة لشبكة الصحة الجامعية في تورنتو ، كندا.
1. معلم تلقيح الورم
ملاحظة: يشير "المعلم" إلى عملية وضع علامات على جلد الفأر للإشارة إلى المكان الذي يجب حقن الخلايا السرطانية فيه لتحسين وضع DSFC. يجب أن يتم إجراء هذا المعلمة في نفس اليوم أو 1 يوم قبل التلقيح. NOD نقص المناعة. تم استخدام الفأر الأنثوي Cg-Rag1tm1Mom Il2rgtm1Wjl / SzJ (NRG) لهذا العمل.
- تخدير الماوس باستخدام 5٪ إيزوفلوران للحث و 2٪ إيزوفلوران للصيانة (معدل تدفق الأكسجين مضبوط على 0.5 لتر / دقيقة). حافظ على درجة حرارة الجسم عن طريق وضع الماوس على وسادة تدفئة ملفوفة في حصيرة جراحية معقمة.
- تحضير الماوس لتلقيح الخلايا السرطانية عن طريق الحلاقة تليها تطبيق كريم إزالة الشعر الطبي. قم بإزالة كريم إزالة الشعر جيدا بعد 30-60 ثانية باستخدام منشفة ورقية معقمة مبللة. تطبيق زيوت التشحيم العين البيطرية لمنع الجفاف.
- تطهير الجلد بمسحة الكحول.
- قم بتصويب جسم الماوس برفق وارفع الجلد على طول العمود الفقري للماوس. باستخدام علامة جراحية ، ارسم نقطة واحدة على جانب واحد من الماوس في وسط جلد الخيام. يجب أن تكون النقطة موجودة في مركز العمود الفقري الصدري للماوس تقريبا.
ملاحظة: سيكون هذا هو الموقع المطلوب للورم.
2. تلقيح الورم
ملاحظة: في هذه الدراسة ، نستخدم خط خلايا سرطان البنكرياس البشري (BxPC3). يمكن أيضا استخدام خطوط الخلايا الأخرى ؛ ومع ذلك ، قد تختلف خطوات زراعة الخلايا المحددة عبر خطوط الخلايا المختلفة. راجع الإرشادات المرفقة مع الخلايا لإجراء تعديلات على الإجراء أدناه.
- تنمو الخلايا بدءا من أسبوعين قبل التلقيح باستخدام وسائط نمو كاملة (معهد روزويل بارك التذكاري 1640 متوسط مع مصل بقري جنيني 10٪ و 1٪ بنسلين / ستربتومايسين) في قارورة 75 مل عند 37 درجة مئوية و 5٪ CO2. تأكد من الحفاظ على الخلايا في مرحلة النمو الأسي.
ملاحظة: يجب أن يقتصر رقم المرور على 10-15x ويجب أن تحتوي القارورة 75 مل على ما يقرب من 6 ملايين خلية (~ 70٪ التقاء) في وقت التلقيح. - نضح الوسائط وغسل الخلايا ب 5 مل من محلول ملحي مخزن بالفوسفات (PBS) بدون الكالسيوم أو المغنيسيوم.
- أضف 5 مل من عامل تفكك الخلايا واحتضانه عند 37 درجة مئوية و 5٪ CO2 لمدة 6-7 دقائق. تأكد من انفصال الخلايا باستخدام المجهر وإضافة 5 مل من وسائط النمو الكاملة.
ملاحظة: يمكن أن يساعد النقر برفق على جانب القارورة في فصل الخلايا. - انقل التعليق إلى أنبوب طرد مركزي سعة 15 مل وجهاز طرد مركزي عند 500 × جم لمدة 5 دقائق لتكوير الخلايا. نضح الوسائط وإعادة تعليق الخلايا في 5 مل من وسائط النمو الكاملة.
- تحديد تركيز الخلية وعدد الخلايا الكلي باستخدام مقياس الدم.
- أجهزة الطرد المركزي في 500 × غرام لمدة 5 دقائق لخلايا الحبيبات ونضح الوسائط.
- استنادا إلى إجمالي عدد الخلايا الذي تم الحصول عليه من الخطوة 2.5 ، أضف الكمية المناسبة من وسائط النمو الكاملة للوصول إلى تركيز
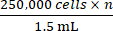 حيث n هو العدد الإجمالي للفئران المراد تلقيحها. أعد تعليق الخلايا.
حيث n هو العدد الإجمالي للفئران المراد تلقيحها. أعد تعليق الخلايا.
ملاحظة: العدد المستهدف للخلايا المراد تلقيحها لكل فأر هو 250,000. - نقل 1.5 مل تحتوي على 250000 خلية × n إلى أنبوب طرد مركزي دقيق سعة 1.5 مل. جهاز طرد مركزي أنبوب الطرد المركزي 1.5 مل عند 500 × جم لمدة 5 دقائق ونضح الوسائط.
ملاحظة: يمكن الاحتفاظ بأي معلق خلوي زائد في حمام ماء ساخن بدرجة حرارة 37 درجة مئوية لاستخدامه في عمليات التلقيح الإضافية إذا لزم الأمر. - أعد تعليق الخلايا في 10 ميكرولتر × n من PBS. ضع الخلايا على الثلج لتبريد التعليق.
ملاحظة: بمجرد تبريد الخلايا على الجليد ، يجب حقنها في الماوس في غضون 20 دقيقة. - أضف 10 ميكرولتر × n من الغشاء القاعدي القابل للذوبان باستخدام أطراف ماصة مبردة. قم بتحميل إبر الأنسولين المبردة بقياس 29 مع 20 ميكرولتر لكل تعليق من الخلايا. الحفاظ على المحاقن على الجليد.
- تخدير الماوس باستخدام 5٪ إيزوفلوران للحث و 2٪ إيزوفلوران للصيانة (معدل تدفق الأكسجين مضبوط على 0.5 لتر / دقيقة).
- ضع الماوس على وسادة تدفئة ملفوفة في حصيرة جراحية معقمة.
- تطهير الجلد في موقع الحقن بمسحة الكحول.
- أدخل الإبرة ~ 1 سم قبل النقطة المحددة وحرك الإبرة تحت الجلد حتى تصل إلى المعلم. ضع الجانب المائل من الإبرة لأعلى وحقن 20 ميكرولتر من تعليق الخلية.
- انتظر 45 ثانية للسماح للغشاء القاعدي القابل للذوبان بالتصلب قبل إزالة المحقنة.
- أخرج الفأر من التخدير ، وانتظر حتى يصبح الفأر متنقلا ، وأعده إلى قفصه مع الفئران الأخرى.
- راقب الورم يوميا عن طريق الجس واسمح للورم بالنمو لمدة 4 أسابيع أو حتى يصل قطر الورم إلى 4-8 مم. القتل الرحيم للفأر إذا تم استيفاء أي من الشروط التالية: حجم الورم يتجاوز 1.5 سم ، ورم متقرح ، أو أي علامات لمرض جهازي (السبات العميق ، فقدان الوزن يتجاوز 20٪ من وزن الجسم الطبيعي ، ضعف الإسعاف ، عدم القدرة على تنظيم درجة حرارة الجسم ، فقدان الشهية ، الموقف المنحني ، علامات الألم المرئية (تعبيرات الوجه ، إلخ) أو الجفاف).
3. جراحة غرفة النافذة
ملاحظة: يتكون DSFC من أربعة أجزاء مطبوعة 3D كما هو موضح في الشكل 1. يتم تضمين مخططات كل جزء في الملف التكميلي 1. تتم طباعة جميع الأجزاء براتنج بلاستيكي شفاف متوافق حيويا. تتكون مجموعة غرفة النافذة الرئيسية من ثلاثة أجزاء (الشكل 1A-C) مع حلقة علامة إيمانية إضافية (الشكل 1D) يمكن تثبيتها أثناء التصوير بالرنين المغناطيسي أو التصوير المقطعي المحوسب.
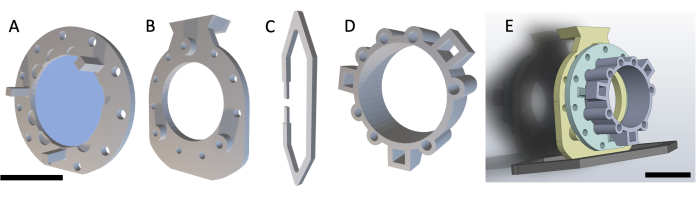
الشكل 1: تخطيطي لغرفة النافذة الظهرية ذات الطيات الجلدية. تحتوي غرفة النافذة الرئيسية على ثلاثة أجزاء. أولا ، (أ) يتم خياطة الإطار الأمامي تحت جلد الفأر ويحتوي على غطاء زجاجي مثبت باستخدام غراء معالج بالأشعة فوق البنفسجية. (ب) يخيط الإطار الخلفي بالإطار الأمامي على الجزء الخارجي من الجلد. ( C) يتم تثبيت مشبك الدعم في الجزء السفلي من الإطار الخلفي ويحافظ على DSFC في وضع مستقيم على جسم الماوس. (د) تحتوي حلقة العلامة الائتمانية على سبعة "آبار" حيث يمكن إدخال علامات إيمانية. يمكن تثبيت حلقة العلامة الائتمانية على الإطار الأمامي ل DSFC باستخدام أعمدة الدعم الثلاثة. (ه) يتم عرض مجموعة DSFC الكاملة مع حلقة تحديد ائتمانية. أشرطة المقياس = 1 سم (A-D ، في أسفل اليسار ؛ E). الاختصار: DSFC = غرفة نافذة طية الجلد الظهرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- يتم تطبيق 1 ملغ/ كغ من البوبرينورفين المستدام الإطلاق 0.6 ملغ/مل تحت الجلد قبل 1-3 ساعات من الجراحة. تأكد من أن الفأرة ذات حجم ووزن كافيين لتحمل DSFC دون انقباض الصدر.
- تعقيم أجزاء غرفة النافذة الرئيسية (الشكل 1A-C) في مطهر سائل عالي المستوى لمدة 12 دقيقة متبوعا بالنقع في كحول الأيزوبروبيل لمدة 5 دقائق على الأقل.
- تخدير الماوس باستخدام 5٪ إيزوفلوران للحث و 2٪ إيزوفلوران للصيانة (معدل تدفق الأكسجين مضبوط على 0.5 لتر / دقيقة).
- نقل الماوس إلى حصيرة جراحية معقمة مع وسادة التدفئة تحتها.
- حلق الفأر وضع كريم إزالة الشعر الطبي إذا كان الشعر موجودا. بعد 30-60 ثانية ، قم بإزالة كريم إزالة الشعر باستخدام مناشف ورقية مبللة معقمة.
- تطبيق زيوت التشحيم العين البيطرية لمنع الجفاف. أعيدي وضعه كل 30 دقيقة أو حسب الحاجة طوال الجراحة.
- تطهير الجلد عن طريق تطبيق 7.5٪ فرك البوفيدون اليود والشطف مع 70٪ كحول الأيزوبروبيل. اترك الجلد يجف في الهواء.
- ضع محلول بوفيدون يود بنسبة 10٪ على الجلد واتركه يجف في الهواء (الشكل 2 أ).
- استبدل الحصيرة الجراحية بسجادة معقمة جديدة.
- تأكد من أن الماوس قد وصل إلى المستوى الجراحي للتخدير باستخدام قرصة إصبع القدم.
- ارفع جلد الفأر على طول العمود الفقري وابحث عن الورم الذي ينمو على إحدى طيات الجلد الجانبية. ضع الإطار الخلفي ل DSFC (الشكل 2B) على نفس الجانب من الجلد الذي ينمو عليه الورم ، مع التأكد من توسيط الورم في الإطار.
- أضف ثلاث خيوط إلى كل من الثقوب الثلاثة العلوية في DSFC والدليل الجراحي لإصلاح موضع الإطار الخلفي (الشكل 2B).
- أدخل ثلاث إبر من خلال الإطار الخلفي ل DSFC في الثقوب التي تحتوي على الفواصل (الشكل 2 ب).
ملاحظة: هناك ثلاثة "فواصل" على الإطار الخلفي ل DSFC للحفاظ على فجوة بين الإطارين الأمامي والخلفي لضمان عدم تقييد تدفق الدم على الأنسجة داخل DSFC. الفواصل مرئية في الشكل 1B. - باستخدام علامة جراحية ، حدد النقاط الست حيث سيتم وضع فواصل الإطار الخلفي DSFC على جانبي الجلد (النقاط 1-6 في الشكل 2C ، D).
ملاحظة: يجب استخدام الإبر المدرجة كدليل للموقع الدقيق لهذه النقاط. - ارسم دائرة قطرها 1 سم للإشارة إلى الجلد الذي سيتم إزالته على الجانب المقابل للإطار الخلفي (الشكل 2 د).
- قم بإزالة الإبر والإطار الخلفي من الجلد عن طريق قطع الغرز.
- اقطع الفتحة التي يبلغ قطرها 1 سم في الجلد والتي تم تمييزها في الخطوة 3.15 باستخدام مقص جراحي دقيق (الشكل 2E).
- ضع الخيط المؤقت لتثبيت جميع أجزاء حجرة النافذة على الجلد. أدخل خيطا من خلال النقطة 4 ، من خلال الفتحة العلوية للإطار الأمامي ل DSFC ، ثم من خلال النقطة 1 على الجانب الآخر من الماوس (الشكل 2F والخطوات 1-2 في الشكل التكميلي S1).
- قم بتمرير الخيط من خلال عمود الدعم العلوي للإطار الخلفي ثم الرجوع من خلال عمود الدعم الموجود على الإطار الخلفي الأقرب إلى رأس الماوس (الشكل 2F).
- أدخل الخيط من خلال النقطة 2. بعد ذلك ، قم بتمرير الخيط من خلال الفتحة المقابلة في الإطار الأمامي (الشكل 2G والخطوة 3 في الشكل التكميلي S1).
- من داخل الجلد ، قم بتمرير الخيط عبر النقطة 6 كما هو موضح في الشكل 2H والخطوات 3-4 في الشكل التكميلي S1.
- خيط الخيط من خلال النقطة 5 كما هو موضح في الشكل 2I والخطوة 4 في الشكل التكميلي S1.
- أحضر الخيط من خلال الإطار الأمامي ، النقطة 3 ، ثم من خلال الإطار الخلفي كما هو موضح في الشكل 2J والخطوة 5 في الشكل التكميلي S1.
- أعد الخيط من خلال النقطة 1 ، الإطار الأمامي ل DSFC ، ثم أخرج من خلال النقطة 4 كما هو موضح في الشكل 2K والخطوة 6 في الشكل التكميلي S1.
- شد المجموعة بأكملها باستخدام هذا الخيط وانزلق الإطار الأمامي تحت الجلد من خلال الفتحة التي تم إنشاؤها في الخطوة 3.17 (الشكل 2L ، M).
- اربط طرفي هذا الخيط معا واقطع أي خيط زائد.
- قم بإجراء خيوط دائمة من خلال الثقوب حول محيط الإطارات الأمامية والخلفية ل DSFC. خيط الإطارين معا في النمط الموضح في الشكل 2N والشكل التكميلي S2.
- قطع وإزالة خياطة مؤقتة.
- قم بتثبيت مشبك الدعم على الإطار الخلفي ل DSFC عن طريق تحريكه في النتوء من الإطار الخلفي (الشكل 2O).
ملاحظة: تظهر صورة للفأر بعد أسبوعين من الجراحة في الشكل 2P ، Q. يتم استخدام مشبك الدعم للحفاظ على DSFC في وضع مستقيم على الماوس لتقليل توتر الجلد وعدم الراحة. - تطبيق 5 ملغ/ كغ من وزن الجسم ميلوكسيكام، وهو دواء مضاد للالتهابات غير الستيرويدية، تحت الجلد لتقليل الألم والالتهاب.
- أخرج الماوس من التخدير ، وانتظر حتى يصبح الماوس متنقلا ، وأعده إلى قفصه.
- تحقق من الماوس 2-3 ساعات بعد الجراحة ثم يوميا لمدة 1 أسبوع على الأقل. ضع في اعتبارك نقطة النهاية التي تم الوصول إليها بعد شهرين من جراحة غرفة النافذة أو إذا تم استيفاء أي من الشروط الواردة في الخطوة 2.17 (أيهما يحدث أولا).
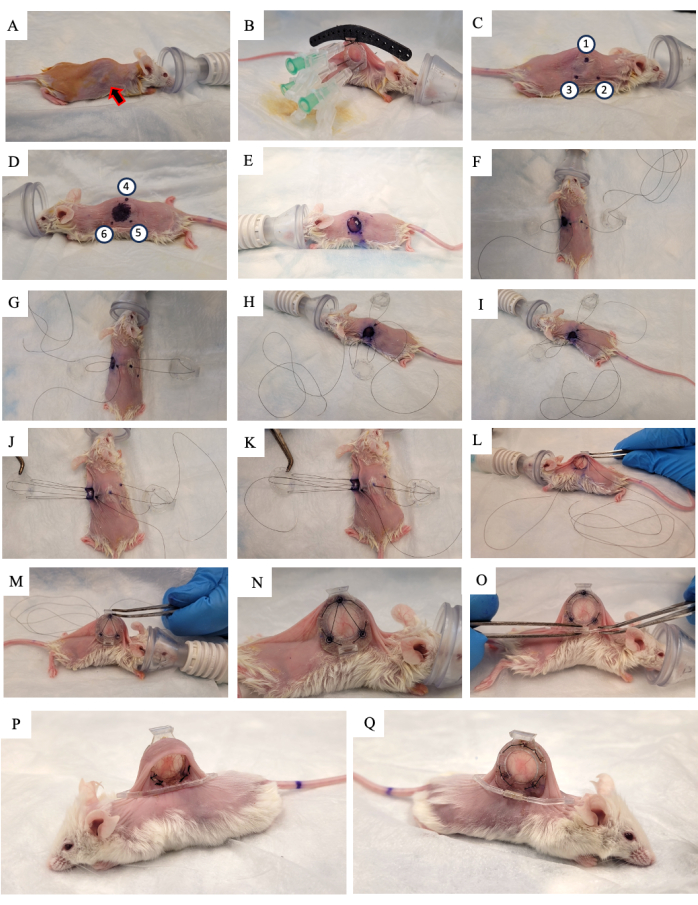
الشكل 2: إجراء جراحة DSFC. (أ) يتم تحضير الفأر للجراحة عن طريق إزالة الشعر وتطهير الجلد. يشار إلى الورم تحت الجلد بواسطة السهم. (ب) يوضع الإطار الخلفي في الموضع المناسب ويتم تثبيته بثلاث محاقن بالإضافة إلى خيوط مؤقتة مثبتة على الدليل الجراحي الأسود. (ج، د) يتم تمييز مواقع المباعد (النقاط 1-6) والثقب على جانبي الجلد. ه: إزالة الجلد. (إف كيه) يتم تمرير خياطة مؤقتة عبر طبقتين من الجلد ، الإطارات الأمامية والخلفية ل DSFC لتأمين جميع الأجزاء معا. (ل، م) يتم شد الخيط المؤقت ، ويتم إدخال الإطار الأمامي تحت الجلد. (ن) يتم وضع ثمانية خيوط دائمة لتأمين DSFC. (O) أخيرا ، تتم إزالة الخيط المؤقت ، ويتم إرفاق مشبك الدعم. (ف ، س) يظهر نفس الماوس 2 أسابيع بعد الجراحة من كلا الجانبين. اختصار: DSFC = غرفة نافذة جلدية ظهرية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التصوير البصري
- اسمح للفأر بالشفاء وانخفاض الالتهاب لمدة 5 أيام على الأقل بعد الجراحة قبل التصوير.
- تخدير الماوس باستخدام 5٪ إيزوفلوران للحث و 2٪ إيزوفلوران للصيانة (معدل تدفق الأكسجين مضبوط على 0.5 لتر / دقيقة).
- تطبيق زيوت التشحيم العين البيطرية لمنع الجفاف. يعاد وضعه كل 30 دقيقة أو حسب الحاجة.
- قم بتأمين الماوس في مرحلة التصوير باستخدام ملحق تخدير الغاز كما هو موضح في الشكل التكميلي S3.
- احصل على مجال رؤية واسع (عرض >1.5 سم) صورة مجهرية برايت فيلد. تأكد من أن علامات التحديد الإيمانية على الإطار الأمامي ل DSFC مرئية.
ملاحظة: هناك سبعة divots حول محيط الزجاج على الإطار الأمامي التي تتماشى مع آبار العلامات الإيمانية السبعة على ملحق حلقة العلامة الائتمانية. هذه الانقسامات مرئية في الشكل 1 أ. - في نفس اليوم ، احصل على صورة الأوعية الدموية الدقيقة باستخدام طريقة الفحص المجهري داخل الجسم التي تختارها. استخدم نفس مرحلة التصوير من الخطوة 4.4 (الشكل التكميلي S3) لهذا الغرض. أخرج الماوس من التخدير ، وانتظر حتى يصبح الماوس متنقلا ، وأعده إلى قفصه.
ملاحظة: نحن نستخدم التصوير المقطعي للتماسك البصري لتباين البقع (svOCT) للحصول على صور الأوعية الدموية الدقيقة 3D عالية الدقة.
5. التصوير بالرنين المغناطيسي
- ضع قفص الماوس تحت مصباح حراري لتدفئة الفئران لمدة 15 دقيقة تقريبا قبل تخدير الماوس.
ملاحظة: يعزز الاحترار توسع الأوعية ، مما يساعد في وضع قسطرة الوريد الذيل. - تخدير الماوس باستخدام 5٪ إيزوفلوران للحث و 2٪ إيزوفلوران للصيانة (معدل تدفق الأكسجين مضبوط على 0.5 لتر / دقيقة).
- سجل وزن الماوس باستخدام مقياس إلكتروني لجرعات الدواء الصحيحة.
ملاحظة: للحصول على قياسات دقيقة لوزن الجسم، تأكد من طرح وزن مجموعة DSFC (0.83 جم). - ضع الماوس على سرير التصوير بالرنين المغناطيسي واستخدم مواد تشحيم بيطرية للعين لمنع الجفاف.
- الحفاظ على درجة حرارة جسم الماوس باستخدام سخان المياه ونظام المضخة.
- ضع وسادة مراقبة تنفسية أسفل الحجاب الحاجز للفأر وحافظ عليها عند 30 ± 5 أنفاس / دقيقة.
- في حالة استخدام عامل تباين ، أدخل إبرة فراشة 27 جم في وريد الذيل مع توصيل الأنابيب الدقيقة (30 ميكرولتر من الحجم الميت مملوء مسبقا بمحلول ملحي 1٪ من الهيرابين). ثبت الإبرة والأنابيب الدقيقة في سرير التصوير بالرنين المغناطيسي بشريط جراحي.
- قم بتأمين حجرة النافذة في "جهاز تثبيت" مطبوع ثلاثي الأبعاد كما هو موضح في الشكل 3.
- باستخدام إبرة 18 G ، قم بحقن مادة تشحيم العين البيطرية في الأنابيب السبعة الموجودة على علامة التصوير بالرنين المغناطيسي الائتمانية.
- قم بتثبيت العلامة الائتمانية على DSFC عن طريق محاذاة الموصلات المربعة الثلاثة مع الدعامات الثلاثة البارزة من الإطار الأمامي (الشكل 3).
- قم بتوصيل قسطرة الوريد الخلفي بخط توصيل الدواء والمحقنة في المضخة الأوتوماتيكية. أدخل السرير في ماسح التصوير بالرنين المغناطيسي قبل السريري 7 تسلا.
- احصل على مجموعات صور إكليلية ومحورية T2 مرجحة (T2w) لتصور مستوى حجرة النافذة (وقت الصدى TE = 25 مللي ثانية ؛ وقت التكرار TR = 2500 مللي ثانية ؛ مجال رؤية 40 × 40 مم مع مصفوفة 64 × 64 بدقة 0.5 × 0.5 مم داخل الطائرة ؛ سمك شريحة 0.5 مم ؛ 25 ثانية). يصف مجموعة سهمية مرجحة T2 (TE = 25 مللي ثانية ؛ TR = 2500 مللي ثانية ؛ مجال رؤية 32 × 32 مم مع مصفوفة 128 × 128 بدقة 0.25 × 0.25 مم داخل الطائرة ؛ ما لا يقل عن 11 شريحة تصوير ؛ سمك شريحة 0.5 مم ؛ 87 ثانية) ، والتي يتم تدويرها بعد ذلك في مستوى DSFC والعلامات الائتمانية ، بناء على المناظر الإكليلية والمحورية ، كما هو موضح في الشكل 4. أعد توجيه المجموعة السهمية ووضعها بشكل متكرر حتى تتم محاذاة شرائح التصوير بالكامل بحيث تحتوي الشريحة 5 بالكامل على إشارة الأنسجة في DSFC ولا تحتوي الشريحة 6 على إشارة الأنسجة في DSFC.
- قم بإجراء تصوير الأوعية الدموية الدقيقة باستخدام طريقة التصوير بالرنين المغناطيسي للأوعية الدموية الدقيقة التي تختارها.
ملاحظة: بالنسبة لعمليات الاستحواذ على التصوير بالرنين المغناطيسي للأوعية الدموية الدقيقة ، لا يلزم تصوير شرائح العلامة الائتمانية حيث يتم الحصول على الصور في نفس الإطار المرجعي للتصوير مثل صور تسجيل T2w.- احصل على جميع عمليات الاستحواذ المفصلة في الخطوتين 5.12 و 5.13 على مجال رؤية 32 × 32 مم مع مصفوفة 64 × 64 بدقة 0.5 × 0.5 مم داخل الطائرة. بالنسبة لجميع عمليات الاستحواذ على التصوير بالرنين المغناطيسي ، استخدم نبضات RF متسقة لتحسين الاتساق الهندسي عبر المستوى (إثارة sinc ؛ إعادة تركيز sinc3 ؛ عرض النطاق الترددي 2,484 هرتز).
- لتصوير DCE:
- إذا كانت قياسات تركيز الجادولينيوم مطلوبة ، احصل على خرائط T1 باستخدام صور 2D-RARE التي تم الحصول عليها في أوقات تكرار متغيرة (TE = 7 مللي ثانية ؛ عامل نادر = 2 ؛ TR = 350 و 500 و 750 و 1,000 و 1,500 و 2,500 و 4,000 مللي ثانية ؛ 8 دقائق و 28 ثانية).
- إجراء تصوير السلاسل الزمنية باستخدام صور 2D RARE (TE = 8.1 مللي ثانية ؛ عامل نادر = 2 ؛ TR = 200 مللي ثانية ؛ زاوية الوجه = 90 درجة ؛ الدقة الزمنية = 12.8 ثانية ؛ 188 التكرار ؛ إجمالي وقت المراقبة = 40 دقيقة و 6 ثوان).
- حقن 0.75 مليمول/كغ من وزن الجسم جادوبوترول أكثر من 10 ثوان عبر الوريد الخلفي بعد الانتهاء من خمس مرات تكرار للصور باستخدام مضخة حقنة آلية متوافقة مع التصوير بالرنين المغناطيسي.
- للتصوير بالرنين المغناطيسي IVIM:
- قم بإجراء التصوير المرجح بالانتشار باستخدام قيم B التالية: 0 ، 20 ، 40 ، 60 ، 80 ، 100 ، 150 ، 200 ، 400 ، 600 ، 800 ، 1000 s / mm2 مع ثلاثة متوسطات من B = 0 s / mm2 وأخذ العينات الخواص (TE = 16 مللي ثانية ؛ TR = 800 مللي ثانية ؛ مدة التدرج = 2.2 مللي ثانية ؛ فصل التدرج = 9 مللي ثانية ؛ 61 دقيقة).
ملاحظة: يتم الحصول على التصوير المرجح بالانتشار باستخدام قراءة تحويل 2D Fourier ، بدلا من التصوير المستوي بالصدى المعرض للتشويه ، لضمان الاتساق الهندسي للورم وإشارات الأنسجة المحيطة داخل DSFC عبر مجموعات الصور ومع صور الفحص المجهري داخل الجسم.
- قم بإجراء التصوير المرجح بالانتشار باستخدام قيم B التالية: 0 ، 20 ، 40 ، 60 ، 80 ، 100 ، 150 ، 200 ، 400 ، 600 ، 800 ، 1000 s / mm2 مع ثلاثة متوسطات من B = 0 s / mm2 وأخذ العينات الخواص (TE = 16 مللي ثانية ؛ TR = 800 مللي ثانية ؛ مدة التدرج = 2.2 مللي ثانية ؛ فصل التدرج = 9 مللي ثانية ؛ 61 دقيقة).
- أخرج الماوس من التخدير ، وانتظر حتى يصبح الماوس متنقلا ، وأعده إلى قفصه.
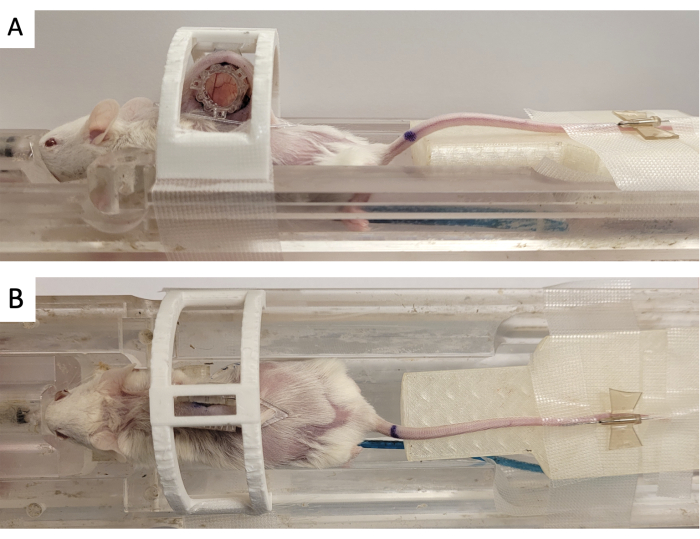
الشكل 3: إعداد التصوير بالرنين المغناطيسي DSFC. (أ) منظر جانبي و (ب) منظر علوي للماوس الموضوع على سرير التصوير بالرنين المغناطيسي مع تثبيت DSFC وتثبيته. يحتوي الماوس على قسطرة الوريد الخلفي لحقن عامل التباين ويتم تثبيت حلقة صانع fiducial على الإطار الأمامي ل DSFC. الاختصارات: DSFC = غرفة نافذة جلدية ظهرية. MR = التصوير بالرنين المغناطيسي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
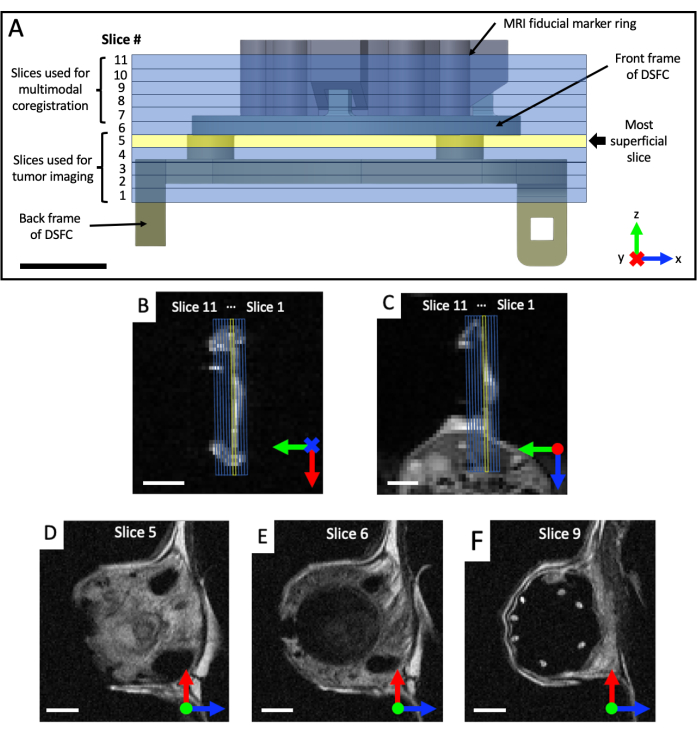
الشكل 4: مواقع شرائح التصوير بالرنين المغناطيسي فيما يتعلق بالعلامات الائتمانية وغرفة النافذة. (أ) رسم تخطيطي ل DSFC مع ملحق حلقة علامة إيمانية مع 11 شريحة تصوير بالرنين المغناطيسي متراكبة. يجب الحصول على العديد من الصور المرجحة T2 لضمان محاذاة الشرائح بشكل صحيح مع DSFC والأنسجة. (ب، ج) الموضع الصحيح للشرائح ال 11 فيما يتعلق بالأنسجة في DSFC من اتجاهات مختلفة. (د) الشريحة 5 هي الشريحة الأكثر سطحية حيث سيتم إجراء تحليل الارتباط متعدد الوسائط. (ه) لا تحتوي الشريحة 6 على إشارة نسيجية تشير إلى أنها محاذاة بشكل صحيح مع DSFC. (F) أخيرا ، تظهر العلامات الائتمانية ال 7 بوضوح في الشريحة 9. قضبان المقياس = 5 مم. تشير علامة "X" على المحور إلى أن المحور يدخل الصفحة وتشير الدائرة إلى أن المحور يخرج من الصفحة. الاختصارات: DSFC = غرفة نافذة جلدية ظهرية. التصوير بالرنين المغناطيسي = التصوير بالرنين المغناطيسي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. التصوير بالرنين المغناطيسي للتسجيل المشترك للفحص المجهري داخل الجسم
- في MATLAB ، افتح ملف Multimodal_Image_Register.m الموجود في الملف التكميلي 2.
- إلى مساحة العمل ، قم بتحميل صورة الأوعية الدموية الدقيقة (الشكل 5 أ) ، وصورة الفحص المجهري برايت فيلد (الشكل 5 ب) ، وبيانات التصوير بالرنين المغناطيسي للأوعية الدموية الدقيقة (خرائط معلمات التصوير بالرنين المغناطيسي IVIM و / أو DCE).
- انقر فوق الزر "تشغيل ".
- باستخدام مكتشف الملفات المنبثق ، انتقل إلى الملف الذي يحتوي على شرائح التصوير بالرنين المغناطيسي T2w.
- حدد ما يصل إلى أربع شرائح T2w MRI تعرض بوضوح العلامات الائتمانية (الشكل 5C).
- سيتم عرض واجهة مستخدم تعرض صورة الفحص المجهري (الشكل 5B) وشرائح التصوير بالرنين المغناطيسي T2w ذات متوسط العمق (الشكل 5C). ضع نقطة على كل علامة من العلامات الإيمانية السبعة في صورة التصوير بالرنين المغناطيسي وقم بمطابقتها مع النقطة المقابلة لها على صورة الفحص المجهري (علامات ثنائية حول محيط الزجاج على الإطار الأمامي ل DSFC) كما هو موضح بالنقاط الخضراء في الشكل 5B ، C.
- أغلق النافذة.
- سيظهر شكل يحتوي على صور التصوير بالرنين المغناطيسي والمجهر المتراكبة للمساعدة في تقييم جودة التسجيل بين مجموعتي البيانات. إذا كان التسجيل كافيا ، فتابع الرمز عن طريق كتابة y ، ثم الضغط على Enter في نافذة الأوامر. بخلاف ذلك ، أعد محاولة هذه الخطوة عن طريق كتابة n في نافذة الأوامر والضغط على Enter.
ملاحظة: التسجيل المشترك الناجح لمجموعة بيانات التصوير بالرنين المغناطيسي مع الصورة المجهرية يعني أن العلامات الإيمانية السبعة الساطعة من مجموعة بيانات التصوير بالرنين المغناطيسي يتم توسيطها واحتواؤها بالكامل داخل المفردات المقابلة لها على الإطار الأمامي ل DSFC. - سيتم عرض واجهة مستخدم تعرض صورة الفحص المجهري (الشكل 5B) ومجموعة بيانات تصوير الأوعية الدموية الدقيقة svOCT (الشكل 5A). حدد ما لا يقل عن ثلاث نقاط بارزة للأوعية الدموية الدقيقة على صورة الأوعية الدموية الدقيقة svOCT والنقاط المقابلة في صورة الفحص المجهري كما هو موضح بالنقاط الزرقاء في الشكل 5A ، B.
- أغلق النافذة.
- سيظهر شكل يحتوي على صور svOCT المتراكبة والمجهرية للمساعدة في تقييم جودة التسجيل المشترك بين مجموعتي البيانات. إذا كان التسجيل كافيا ، فتابع الرمز عن طريق كتابة y ، ثم الضغط على Enter في نافذة الأوامر. بخلاف ذلك ، أعد محاولة هذه الخطوة عن طريق كتابة n في نافذة الأوامر والضغط على Enter.
ملاحظة: التسجيل المشترك الناجح لمجموعة بيانات svOCT مع صورة الفحص المجهري يعني أن الأوعية من كلتا مجموعتي البيانات متراكبة تماما مع بعضها البعض. - أغلق النافذة.
- ستظهر بعد ذلك صورة النسخة المصغرة المسجلة بشكل مشترك. حدد الورم في هذه الصورة.
- أغلق النافذة.
- سيتم بعد ذلك عرض العديد من الأشكال: مجموعة بيانات الأوعية الدموية الدقيقة svOCT (الشكل 5D) ، وصورة الفحص المجهري المسجلة بشكل مشترك (الشكل 5E) ، وخرائط معلمات التصوير بالرنين المغناطيسي المسجلة بشكل مشترك (الشكل 5F). احفظ الخرائط لتحليلها لاحقا.
ملاحظة: تقتصر خرائط التصوير بالرنين المغناطيسي المعروضة على محيط الورم الذي يرسمه المستخدم (الشكل 5F).
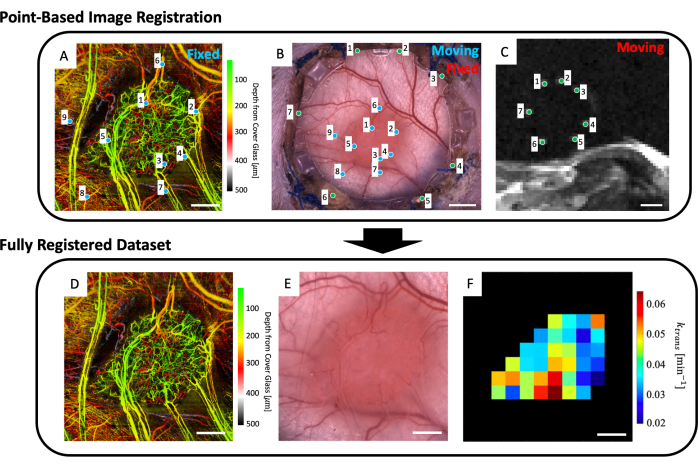
الشكل 5: التسجيل المشترك القائم على النقاط المتعددة الوسائط. (أ) مجموعة بيانات svOCT الوعائية الدقيقة المشفرة بعمق اللون؛ شريط المقياس = 1 مم. (B) صورة مجهرية برايتفيلد لغرفة النافذة ؛ شريط المقياس = 2 مم. (C) متوسط شرائح التصوير بالرنين المغناطيسي T2w 8-11 التي تظهر العلامات الإيمانية السبعة الموجودة في حلقة العلامة الائتمانية ؛ شريط المقياس = 5 مم. (C) أولا ، يتم تسجيل مجموعة بيانات التصوير بالرنين المغناطيسي T2w "المتحركة" بشكل مشترك في صورة الفحص المجهري برايت فيلد "الثابتة" باستخدام العلامات الخضراء التي يدخلها المستخدم على كلتا مجموعتي الصور. بعد ذلك ، يتم تسجيل صورة المجهر "المتحركة" للحقل الساطع وصورة التصوير بالرنين المغناطيسي المسجلة بشكل مشترك في "مجموعة بيانات svOCT الثابتة" باستخدام العلامات الزرقاء في A و B. تتضمن مجموعة البيانات النهائية المسجلة بشكل مشترك (D) svOCT و (E) صورة مجهر برايت فيلد و (F) خريطة معلمات التصوير بالرنين المغناطيسي الوظيفي. تقع الفوكسل السوداء في F خارج الورم وبالتالي لا يتم أخذها في الاعتبار في التحليل. بالنسبة إلى D-F ، شريط المقياس = 1 مم. الاختصارات: svOCT = التصوير المقطعي للتماسك البصري لتباين البقع ؛ التصوير بالرنين المغناطيسي = التصوير بالرنين المغناطيسي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
تم إجراء التصوير المقطعي للتماسك البصري لتباين البقع (svOCT) للحصول على صور الأوعية الدموية الدقيقة ثلاثية الأبعاد لمجال الرؤية (FOV) (6 × 6 مم2 الجانبي × عمق 1 مم). للحصول على هذه الصور ، تم استخدام نظام OCT المصدر الموصوف سابقا على أساس مقياس التداخل التربيعي23. تم الحصول على صور ...
Discussion
في هذا العمل ، قمنا بتطوير سير عمل لإجراء كل من الفحص المجهري داخل الجسم والتصوير المطبق سريريا (CT و MRI و PET) في نفس. وقد تم ذلك بهدف ترجمة نتائج الفحص المجهري قبل السريري إلى العيادة من خلال الارتباط المباشر للفحص المجهري داخل الجسم مع طرق التصوير السريري مثل التصوير بالرنين المغناطيسي. على ...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نشكر الدكتورة كارلا كالتشادا (زميلة ما بعد الدكتوراه، مركز الأميرة مارغريت للسرطان) والدكتور تيموثي صموئيل (طالب دكتوراه، مركز الأميرة مارغريت للسرطان) للمساعدة في زراعة الخلايا السرطانية وتطوير بروتوكول التلقيح. ساعدت الدكتورة كاثلين ما والدكتورة آنا بيتراسيك والدكتورة أليسا غولدشتاين (مركز أبحاث ، مركز الأميرة مارغريت للسرطان) في تطوير بروتوكول الجراحة. قام جاكوب بروسكي (تقني الهندسة الطبية ، مركز الأميرة مارغريت للسرطان) وواين كيلر (مدير تنفيذي لعميل الأجهزة ، Javelin Technologies - إحدى شركات مجموعة TriMech) بطباعة غرف النوافذ 3D. قدم جيمس جونكمان (مرفق الفحص المجهري البصري المتقدم ، شبكة الصحة الجامعية) إرشادات قيمة للحصول على صور المجهر الساطع والفلوري.
Materials
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
References
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved