Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein Mausmodell eines dorsalen Hautfaltenfensterkammertumors für die kombinierte Intravitalmikroskopie und Magnetresonanztomographie in der translationalen Krebsforschung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Translation von Befunden der Intravitalmikroskopie wird durch das geringe Eindringen in das Gewebe erschwert. Hier beschreiben wir ein Mausmodell mit dorsaler Fensterkammer, das die Co-Registrierung der Intravitalmikroskopie und klinisch anwendbarer Bildgebungsmodalitäten (z. B. CT, MRT) für eine direkte räumliche Korrelation ermöglicht und so die klinische Translation von Befunden der Intravitalmikroskopie möglicherweise rationalisiert.
Zusammenfassung
Präklinische intravitale Bildgebung wie Mikroskopie und optische Kohärenztomographie haben sich in der Krebsforschung als wertvolle Werkzeuge erwiesen, um die Mikroumgebung des Tumors und sein Ansprechen auf die Therapie sichtbar zu machen. Diese bildgebenden Verfahren haben eine Auflösung im Mikrometerbereich, werden aber in der Klinik aufgrund ihrer geringen Eindringtiefe in das Gewebe nur begrenzt eingesetzt. Klinisch anwendbarere Bildgebungsmodalitäten wie CT, MRT und PET haben eine viel größere Eindringtiefe, aber eine vergleichsweise geringere räumliche Auflösung (mm-Skala).
Um präklinische Befunde aus der intravitalen Bildgebung in die Klinik zu übertragen, müssen neue Methoden entwickelt werden, um diese Lücke zwischen Mikro- und Makroauflösung zu schließen. Hier beschreiben wir ein Mausmodell mit dorsaler Hautfaltenfensterkammer, das entwickelt wurde, um präklinische intravitale und klinisch anwendbare (CT und MR) Bildgebung im selben Tier zu ermöglichen, und die Bildanalyseplattform, die diese beiden unterschiedlichen Visualisierungsmethoden miteinander verbindet. Wichtig ist, dass der beschriebene Fensterkammeransatz es ermöglicht, die verschiedenen Bildgebungsmodalitäten in 3D unter Verwendung von Passermarken auf der Fensterkammer für eine direkte räumliche Übereinstimmung zu koregistrieren. Dieses Modell kann sowohl für die Validierung bestehender klinischer Bildgebungsverfahren als auch für die Entwicklung neuer Verfahren durch direkte Korrelation mit "Ground Truth"-Hochauflösungsbefunden im Intravital verwendet werden.
Schließlich kann das Ansprechen des Tumors auf verschiedene Behandlungen - Chemotherapie, Strahlentherapie, photodynamische Therapie - mit dieser Methodik unter Verwendung präklinischer und klinisch anwendbarer Bildgebungsmodalitäten longitudinal überwacht werden. Das hier beschriebene Modell des dorsalen Hautfaltenfensterkammertumors und die Bildgebungsplattformen können daher in einer Vielzahl von Krebsforschungsstudien verwendet werden, beispielsweise bei der Übertragung präklinischer intravitaler Mikroskopie-Befunde in klinisch anwendbarere Bildgebungsmodalitäten wie CT oder MRT.
Einleitung
Die Mikrogefäße des Tumors sind ein wichtiger Bestandteil der Tumormikroumgebung, der ein Ziel für die Therapie und eine Determinante für das Ansprechen auf die Behandlung sein kann. Im präklinischen Umfeld wird das Mikrogefäßsystem typischerweise mittels Intravitalmikroskopie in orthotopen oder heterotopen Fensterkammer-Tiermodellen untersucht 1,2. Dies hat mehrere Vorteile gegenüber histologischen Untersuchungen, da die Bildgebung in lebendem Gewebe erfolgt und der Tumor über mehrere Wochen oder sogar Monate longitudinal überwacht werden kann 2,3. Diese Studien können die hochauflösenden Bildgebungsmöglichkeiten der Intravitalmikroskopie nutzen, um die Verabreichung von Therapeutika an den Tumor 4,5, die Ursachen der Behandlungsresistenz6 und das Ansprechen der Mikrogefäße auf Therapien wie die antiangiogene Behandlung 7,8 und die Strahlentherapie 2,9 zu untersuchen.
Die Intravitalmikroskopie spielt in der präklinischen Krebsforschung eine wichtige Rolle; Doch wie können Merkmale der Mikroumgebung von Tumoren in der Klinik gemessen werden? Mikrovaskuläre Informationen wären in der Klinik nützlich für die Messung der Blutversorgung und der Tumorzellhypoxie, die für die Bestimmung der Behandlungsresistenz in der Strahlentherapiewichtig ist 10, sowie für die Fähigkeit des Mikrogefäßsystems, Chemotherapeutika an die umgebenden Tumorzellen abzugeben11. Beispielsweise können in der Strahlentherapie räumliche Informationen über die Struktur und Funktion des Tumormikrogefäßsystems dazu beitragen, den Behandlungsplan eines Patienten zu personalisieren, indem der Fraktionierungsplan angepasst oder die Dosis bevorzugt in avaskulären und wahrscheinlich hypoxischen Regionen erhöhtwird 12.
Die Intravitalmikroskopie kann diese wichtigen mikrovaskulären Merkmale messen, da sie eine sehr hohe Auflösung (μ-m-Skala) aufweist. Die Eindringtiefe in das Gewebe ist jedoch auf einige hundert Mikrometer oder wenige Millimeter begrenzt, was die klinische Umsetzung allenfalls erschwert. In der Tat gibt es einige neuartige Anwendungen der Intravitalmikroskopie in der Klinik13; Diese beschränken sich jedoch nach wie vor auf die Untersuchung von oberflächennahem Gewebe wie der Haut14 oder der Schleimhaut/Endothelschleimhaut verschiedener Körperhöhlen mittels flexibler Katheter/Endoskope15,16.
Häufiger wird die Mikrogefäße mit bildgebenden Verfahren wie CT17 oder MRT18 untersucht. Diese klinischen Bildgebungsmodalitäten können bis in jede Tiefe im Körper abgebildet werden, haben jedoch eine viel geringere räumliche Auflösung (mm-Skala). Daher besteht die Notwendigkeit, diese Auflösungslücke zwischen der präklinischen Intravitalmikroskopie und den klinischen Bildgebungsmodalitäten zu schließen, um hochauflösende und detaillierte mikrovaskuläre Informationen in die Klinik zu bringen19. Es wurden mehrere funktionelle Bildgebungsverfahren entwickelt, um die mikrovaskulären Bildgebungsmöglichkeiten klinischer Bildgebungsmodalitäten wie der dynamischen kontrastverstärkten (DCE) MRT und CT20 und der Intravoxel-MRT mit inkohärenter Bewegung (IVIM)21 zu verbessern. Hierbei handelt es sich jedoch um modellbasierte Methoden, die indirekte Messungen der Mikrogefäße liefern und daher mit geeigneten "Ground-Truth"-Messungen der Mikrogefäße validiert werdenmüssen 19,22.
Wir haben ein dorsales Hautfaltenfensterkammer-Tumormausmodell (DSFC) entwickelt, um diese Lücke zwischen der präklinischen Intravitalmikroskopie und klinisch anwendbaren Bildgebungsmodalitäten wie CT und MRT zu schließen. Die DSFC bietet einen direkten Zugang zum Tumor für hochauflösende, intravitale Mikroskopie-Bildgebung durch ein Glasfenster, aber auch für klinisch anwendbare Bildgebung wie die MRT, da sie aus MRT-kompatiblen Materialien (Kunststoff und Glas) besteht. Darüber hinaus führt ein mitgelieferter MATLAB-Code eine multimodale 3D-Co-Registrierung für direkte räumliche Korrelationen zwischen der präklinischen Intravitalmikroskopie und klinisch anwendbaren Bildgebungsmodalitäten durch. Hier beschreiben wir das Design und die Chirurgie zur Installation des DSFC sowie das Verfahren zur Co-Registrierung der Intravitalmikroskopie und klinisch anwendbarer Bildgebungsmodalitäten.
Protokoll
Alle tierischen Verfahren wurden in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Versuchstieren durchgeführt, der vom Canadian Council on Animal Care herausgegeben wurde. Die Experimente wurden nach einem Protokoll durchgeführt, das vom University Health Network Institutional Animal Care and Use Committee in Toronto, Kanada, genehmigt wurde.
1. Landmarkierung der Tumorinokulation
HINWEIS: "Landmarkierung" bezieht sich auf den Prozess der Markierung der Haut der Maus, um anzuzeigen, wo die Tumorzellen injiziert werden sollten, um die DSFC-Platzierung zu optimieren. Diese Landmarkierung sollte am selben Tag oder 1 Tag vor der Impfung durchgeführt werden. Die immungeschwächte NOD. Für diese Arbeit wurde die weibliche Maus Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) verwendet.
- Anästhesieren Sie die Maus mit 5 % Isofluran zur Induktion und 2 % Isofluran zur Aufrechterhaltung (Sauerstoffflussrate auf 0,5 l/min eingestellt). Halten Sie die Körpertemperatur aufrecht, indem Sie die Maus auf ein Heizkissen legen, das in eine autoklavierte OP-Matte eingewickelt ist.
- Bereiten Sie die Maus auf die Inokulation von Tumorzellen vor, indem Sie sich rasieren und anschließend eine medizinische Haarentfernungscreme auftragen. Entfernen Sie die Haarentfernungscreme nach 30-60 s gründlich mit einem nassen, sterilisierten Papiertuch. Tragen Sie Veterinär-Augenschmiermittel auf, um Trockenheit zu vermeiden.
- Desinfizieren Sie die Haut mit einem Alkoholtupfer.
- Richten Sie den Körper der Maus vorsichtig auf und heben Sie die Haut entlang der Wirbelsäule der Maus an. Zeichnen Sie mit einem chirurgischen Marker einen einzelnen Punkt auf einer Seite der Maus in der Mitte der Zelthaut. Der Punkt sollte sich ungefähr in der Mitte der Brustwirbelsäule der Maus befinden.
HINWEIS: Dies ist der gewünschte Ort des Tumors.
2. Tumor-Inokulation
HINWEIS: In dieser Studie verwenden wir eine humane Bauchspeicheldrüsenkrebs-Zelllinie (BxPC3). Andere Zelllinien können ebenfalls verwendet werden; Spezifische Zellkulturschritte können jedoch je nach Zelllinie variieren. Lesen Sie die Anweisungen, die den Zellen beiliegen, um Änderungen an der folgenden Prozedur vorzunehmen.
- Die Zellen werden ab 2 Wochen vor der Inokulation unter Verwendung eines vollständigen Wachstumsmediums (Roswell Park Memorial Institute 1640 Medium mit 10 % fötalem Rinderserum und 1 % Penicillin/Streptomycin) in einem 75-ml-Kolben bei 37 °C und 5 % CO2 gezüchtet. Stellen Sie sicher, dass die Zellen in der exponentiellen Wachstumsphase gehalten werden.
HINWEIS: Die Anzahl der Passagen sollte auf 10-15x begrenzt werden und der 75-ml-Kolben sollte zum Zeitpunkt der Inokulation etwa 6 Millionen Zellen (~70% Konfluenz) enthalten. - Aspirieren Sie das Medium und waschen Sie die Zellen mit 5 ml phosphatgepufferter Kochsalzlösung (PBS) ohne Kalzium oder Magnesium.
- 5 ml Zelldissoziationsmittel zugeben und bei 37 °C und 5 % CO2 6-7 min inkubieren. Bestätigen Sie mit einem Mikroskop, dass sich die Zellen abgelöst haben, und fügen Sie 5 ml vollständiges Wachstumsmedium hinzu.
HINWEIS: Leichtes Klopfen auf die Seite des Kolbens kann helfen, die Zellen zu lösen. - Die Suspension wird in ein 15-mL-Zentrifugenröhrchen umgefüllt und 5 Minuten lang bei 500 × g zentrifugiert, um die Zellen zu pelletieren. Aspirieren Sie das Medium und resuspendieren Sie die Zellen in 5 ml vollständigem Wachstumsmedium.
- Bestimmen Sie die Zellkonzentration und die Gesamtzellzahl mit einem Hämozytometer.
- Zentrifugieren Sie 5 Minuten lang bei 500 × g , um die Zellen zu pelletieren und das Medium anzusaugen.
- Basierend auf der in Schritt 2.5 erhaltenen Gesamtzellzahl wird die entsprechende Menge des vollständigen Wachstumsmediums zugegeben, um eine Konzentration zu erreichen, bei der
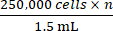 n die Gesamtzahl der zu inokulierenden Mäuse ist. Resuspendieren Sie die Zellen.
n die Gesamtzahl der zu inokulierenden Mäuse ist. Resuspendieren Sie die Zellen.
HINWEIS: Die Zielanzahl der pro Maus zu beimpfenden Zellen beträgt 250.000. - Übertragen Sie 1,5 mL mit 250.000 Zellen × n in ein 1,5 mL Mikrozentrifugenröhrchen. Zentrifugieren Sie das 1,5 ml Mikrozentrifugenröhrchen bei 500 × g für 5 min und saugen Sie das Medium an.
HINWEIS: Überschüssige Zellsuspension kann in einem heißen, auf 37 °C erwärmten Wasserbad aufbewahrt werden, um bei Bedarf für zusätzliche Impfungen verwendet zu werden. - Resuspendieren Sie die Zellen in 10 μL × n PBS. Lege die Zellen auf Eis, um die Suspension abzukühlen.
HINWEIS: Nachdem die Zellen auf Eis abgekühlt wurden, müssen sie innerhalb von 20 Minuten in die Maus injiziert werden. - 10 μl × n gelöste Basalmembran mit gekühlten Pipettenspitzen zugeben. Laden Sie gekühlte 29-Gauge-Insulinnadeln mit jeweils 20 μl Zellsuspensionen. Bewahren Sie die Spritzen auf Eis auf.
- Anästhesieren Sie die Maus mit 5 % Isofluran zur Induktion und 2 % Isofluran zur Aufrechterhaltung (Sauerstoffflussrate auf 0,5 l/min eingestellt).
- Legen Sie die Maus auf ein Heizkissen, das in eine sterilisierte OP-Matte eingewickelt ist.
- Desinfizieren Sie die Haut an der Injektionsstelle mit einem Alkoholtupfer.
- Führen Sie die Nadel ~1 cm vor dem markierten Punkt ein und bewegen Sie die Nadel unter die Haut, bis sie sich am Orientierungspunkt befindet. Positionieren Sie die abgeschrägte Seite der Nadel nach oben und injizieren Sie die 20 μl Zellsuspension.
- Warten Sie 45 s, bis sich die gelöste Basalmembran verfestigt hat, bevor Sie die Spritze entfernen.
- Nehmen Sie die Maus aus der Narkose, warten Sie, bis die Maus gehfähig wird, und bringen Sie sie mit den anderen Mäusen in ihren Käfig zurück.
- Überwachen Sie den Tumor täglich durch Abtasten und lassen Sie den Tumor 4 Wochen lang wachsen oder bis der Tumor einen Durchmesser von 4-8 mm hat. Euthanasieren Sie die Maus, wenn eine der folgenden Bedingungen erfüllt ist: Tumorgröße von mehr als 1,5 cm, ulzerierter Tumor oder Anzeichen einer systemischen Erkrankung (Lethargie, Gewichtsverlust von mehr als 20 % des normalen Körpergewichts, eingeschränkte Gehfähigkeit, Unfähigkeit, die Körpertemperatur zu regulieren, Magersucht, gebeugte Haltung, sichtbare Anzeichen von Schmerzen (Gesichtsausdrücke usw.) oder Dehydration).
3. Fensterkammer-Chirurgie
HINWEIS: Der DSFC besteht aus vier 3D-gedruckten Teilen, wie in Abbildung 1 gezeigt. Die Schaltpläne der einzelnen Teile sind in der Zusatzdatei 1 enthalten. Alle Teile sind mit einem biokompatiblen klaren Kunststoffharz bedruckt. Die Hauptfensterkammer besteht aus drei Teilen (Abbildung 1A-C) mit einem zusätzlichen Markierungsring (Abbildung 1D), der während der MRT- oder CT-Bildgebung angebracht werden kann.
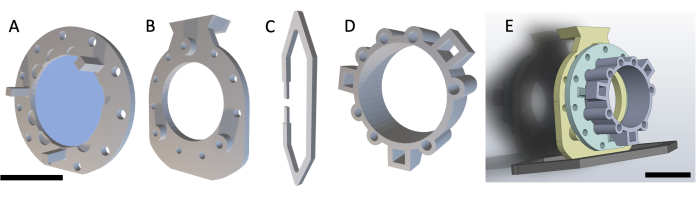
Abbildung 1: Schema der dorsalen Hautfaltenfensterkammer. Die Hauptfensterkammer besteht aus drei Teilen. Zunächst wird (A) der vordere Rahmen unter die Haut der Maus vernäht und enthält ein Deckglas aus Glas, das mit UV-gehärtetem Klebstoff befestigt ist. (B) Der hintere Rahmen wird an der Außenseite der Haut mit dem vorderen Rahmen vernäht. (C) Der Stützclip wird an der Unterseite des hinteren Rahmens befestigt und hält die DSFC aufrecht auf dem Mausgehäuse. (D) Der Markierungsring enthält sieben "Vertiefungen", in die Passermarken eingefügt werden können. Der Markierungsring kann mit den drei Stützpfosten am vorderen Rahmen des DSFC befestigt werden. (E) Die vollständige DSFC-Baugruppe mit einem Markierungsring ist dargestellt. Maßstabsbalken = 1 cm (A-D, unten links; E). Abkürzung: DSFC = dorsale hautgefaltete Fensterkammer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- 1 mg/kg 0,6 mg/ml Buprenorphin mit verzögerter Freisetzung subkutan 1-3 h vor der Operation verabreichen. Stellen Sie sicher, dass die Maus eine ausreichende Körpergröße und ein ausreichendes Gewicht hat, um die DSFC ohne Thoraxverengung zu tolerieren.
- Sterilisieren Sie die Hauptteile der Fensterkammer (Abbildung 1A-C) 12 Minuten lang in einem hochgradigen flüssigen Desinfektionsmittel und weichen Sie sie anschließend mindestens 5 Minuten lang in Isopropylalkohol ein.
- Anästhesieren Sie die Maus mit 5 % Isofluran zur Induktion und 2 % Isofluran zur Aufrechterhaltung (Sauerstoffflussrate auf 0,5 l/min eingestellt).
- Übertragen Sie die Maus auf eine sterile OP-Matte mit einem Heizkissen darunter.
- Rasieren Sie die Maus und tragen Sie medizinische Haarentfernungscreme auf, wenn Haare vorhanden sind. Entfernen Sie die Haarentfernungscreme nach 30-60 s mit sterilen, feuchten Papiertüchern.
- Tragen Sie Veterinär-Augenschmiermittel auf, um Trockenheit zu vermeiden. Alle 30 Minuten oder nach Bedarf während der Operation erneut auftragen.
- Desinfizieren Sie die Haut, indem Sie ein 7,5%iges Povidon-Jod-Peeling auftragen und mit 70%igem Isopropylalkohol abspülen. Lassen Sie die Haut an der Luft trocknen.
- Tragen Sie 10% ige Povidon-Jod-Lösung auf die Haut auf und lassen Sie sie an der Luft trocknen (Abbildung 2A).
- Ersetzen Sie die OP-Matte durch eine neue sterilisierte Matte.
- Stellen Sie sicher, dass die Maus die chirurgische Ebene der Anästhesie erreicht hat, indem Sie einen Zehenkneif verwenden.
- Heben Sie die Haut der Maus entlang der Wirbelsäule an und suchen Sie nach dem Tumor, der an einer der beiden seitlichen Hautfalten wächst. Platzieren Sie den hinteren Rahmen der DSFC (Abbildung 2B) auf der gleichen Seite der Haut, auf der der Tumor wächst, und achten Sie darauf, den Tumor im Rahmen zu zentrieren.
- Fügen Sie jeweils drei Nähte an den oberen drei Löchern der DSFC und der Bohrschablone hinzu, um die Position des Rückenrahmens zu fixieren (Abbildung 2B).
- Führen Sie drei Nadeln durch den hinteren Rahmen des DSFC in die Löcher mit den Abstandshaltern ein (Abbildung 2B).
HINWEIS: Am hinteren Rahmen des DSFC befinden sich drei "Abstandshalter", um einen Spalt zwischen dem vorderen und dem hinteren Rahmen zu erhalten und sicherzustellen, dass der Blutfluss zum Gewebe im Inneren des DSFC nicht eingeschränkt wird. Die Abstandshalter sind in Abbildung 1B zu sehen. - Markieren Sie mit einem chirurgischen Marker die sechs Punkte, an denen sich die DSFC-Abstandshalter auf beiden Seiten der Haut befinden (Punkte 1-6 in Abbildung 2C, D).
HINWEIS: Die eingeführten Nadeln sollten als Leitfaden für die genaue Position dieser Punkte verwendet werden. - Zeichnen Sie einen Kreis mit einem Durchmesser von 1 cm, um die Haut zu markieren, die auf der Seite entfernt wird, die dem hinteren Rahmen gegenüberliegt (Abbildung 2D).
- Entfernen Sie die Nadeln und den Rückenrahmen von der Haut, indem Sie die Nähte durchschneiden.
- Schneiden Sie das Loch mit einem Durchmesser von 1 cm in die Haut, das in Schritt 3.15 markiert wurde, mit einer chirurgischen Mikroschere (Abbildung 2E).
- Legen Sie die provisorische Naht an, um alle Teile der Fensterkammer an der Haut zu befestigen. Führen Sie eine Naht durch Punkt 4, durch das obere Loch des vorderen Rahmens der DSFC und dann durch Punkt 1 auf der gegenüberliegenden Seite der Maus ein (Abbildung 2F und die Schritte 1-2 in der ergänzenden Abbildung S1).
- Führen Sie die Naht durch den oberen Stützpfosten des hinteren Rahmens und dann wieder zurück durch den Stützpfosten am hinteren Rahmen, der dem Kopf der Maus am nächsten ist (Abbildung 2F).
- Führen Sie die Naht durch Punkt 2 ein. Führen Sie dann die Naht durch das entsprechende Loch im vorderen Rahmen (Abbildung 2G und Schritt 3 in Abbildung S1).
- Führen Sie die Naht von der Innenseite der Haut durch Punkt 6 ein, wie in Abbildung 2H und den Schritten 3-4 in der ergänzenden Abbildung S1 gezeigt.
- Führen Sie die Naht durch Punkt 5, wie in Abbildung 2I und Schritt 4 in der ergänzenden Abbildung S1 gezeigt.
- Führen Sie die Naht durch den vorderen Rahmen, Punkt 3, und dann durch den hinteren Rahmen, wie in Abbildung 2J und Schritt 5 in der ergänzenden Abbildung S1 gezeigt.
- Führen Sie die Naht wieder durch Punkt 1, den vorderen Rahmen des DSFC, und dann durch Punkt 4 heraus, wie in Abbildung 2K und Schritt 6 in der ergänzenden Abbildung S1 gezeigt.
- Ziehen Sie die gesamte Verbindung mit dieser Naht fest und schieben Sie den vorderen Rahmen unter die Haut durch das Loch, das in Schritt 3.17 erstellt wurde (Abbildung 2L,M).
- Binden Sie die beiden Enden dieser Naht zusammen und schneiden Sie überschüssige Schnur ab.
- Führen Sie dauerhafte Nähte durch die Löcher um den Umfang des vorderen und hinteren Rahmens des DSFC durch. Nähen Sie die beiden Rahmen in dem Muster zusammen, das in Abbildung 2N und in der ergänzenden Abbildung S2 gezeigt ist.
- Schneiden Sie die provisorische Naht ab und entfernen Sie sie.
- Befestigen Sie den Stützclip am hinteren Rahmen des DSFC, indem Sie ihn in den Vorsprung des hinteren Rahmens schieben (Abbildung 2O).
HINWEIS: Ein Bild der Maus 2 Wochen nach der Operation ist in Abbildung 2P, Q dargestellt. Der Stützclip wird verwendet, um die DSFC aufrecht auf der Maus zu halten, um Hautspannungen und Beschwerden zu reduzieren. - Verabreichen Sie 5 mg/kg Körpergewicht Meloxicam, ein nichtsteroidales entzündungshemmendes Medikament, subkutan zur Schmerz- und Entzündungslinderung.
- Nehmen Sie die Maus aus der Narkose, warten Sie, bis die Maus gehfähig wird, und bringen Sie sie in ihren Käfig zurück.
- Kontrollieren Sie die Maus 2-3 Stunden nach der Operation und dann täglich für mindestens 1 Woche. Berücksichtigen Sie, dass der Endpunkt 2 Monate nach der Fensterkammeroperation erreicht wurde oder ob eine der Bedingungen in Schritt 2.17 erfüllt ist (je nachdem, was zuerst eintritt).
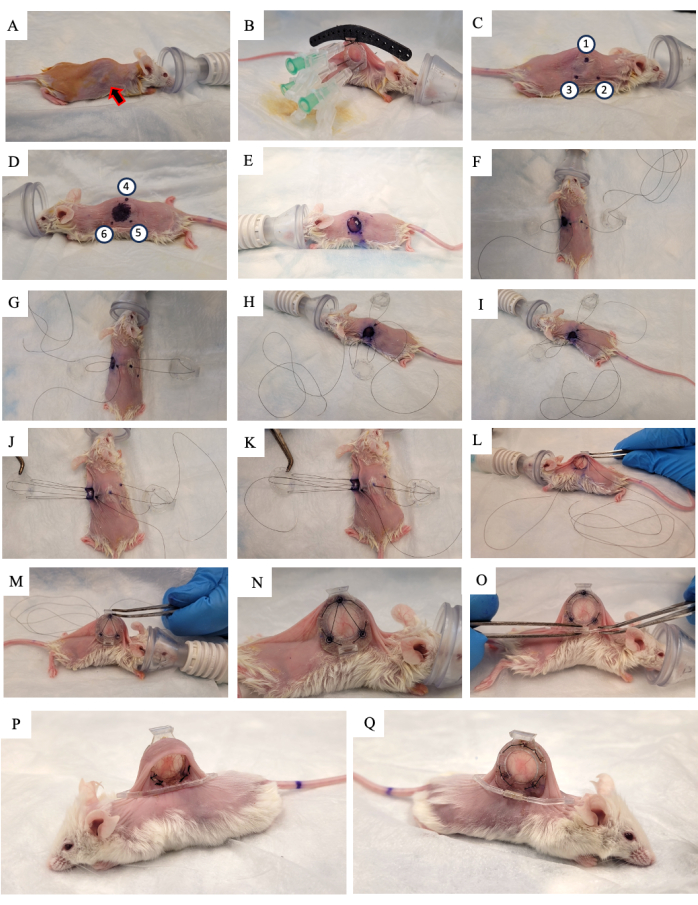
Abbildung 2: Ablauf der DSFC-Operation. (A) Die Maus wird auf die Operation vorbereitet, indem die Haare entfernt und die Haut desinfiziert werden. Der subkutane Tumor ist durch den Pfeil gekennzeichnet. (B) Der Rückenrahmen wird in die entsprechende Position gebracht und durch drei Spritzen sowie provisorische Nähte, die an der schwarzen Bohrschablone befestigt sind, gesichert. (C,D) Die Abstandshalterpositionen (Punkte 1-6) und das Loch sind auf beiden Seiten der Haut markiert. (E) Die Haut wird entfernt. (F-K) Eine provisorische Naht wird durch die beiden Hautschichten, den vorderen und hinteren Rahmen des DSFC, gefädelt, um alle Teile miteinander zu verbinden. (L,M) Die provisorische Naht wird gestrafft und der vordere Rahmen unter die Haut eingeführt. (N) Acht bleibende Nähte werden gelegt, um die DSFC zu sichern. (O) Zum Schluss wird die provisorische Naht entfernt und der Stützclip angebracht. (P,Q) Die gleiche Maus wird 2 Wochen nach der Operation von beiden Seiten gezeigt. Abkürzung: DSFC = dorsale Hautfaltenfensterkammer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Optische Bildgebung
- Lassen Sie die Maus mindestens 5 Tage nach der Operation heilen und die Entzündung zurückgehen, bevor Sie die Bildgebung durchführen.
- Anästhesieren Sie die Maus mit 5 % Isofluran zur Induktion und 2 % Isofluran zur Aufrechterhaltung (Sauerstoffflussrate auf 0,5 l/min eingestellt).
- Tragen Sie Veterinär-Augenschmiermittel auf, um Trockenheit zu vermeiden. Alle 30 Minuten oder nach Bedarf erneut auftragen.
- Sichern Sie die Maus in einem Bildgebungstisch mit einem Gasanästhesieaufsatz, wie in der ergänzenden Abbildung S3 gezeigt.
- Erhalten Sie ein Hellfeldmikroskopiebild mit großem Sichtfeld (>1,5 cm Breite). Stellen Sie sicher, dass die Passermarken-Vertiefungen am vorderen Rahmen des DSFC sichtbar sind.
HINWEIS: Um den Umfang des Glases am vorderen Rahmen befinden sich sieben Vertiefungen, die mit den sieben Markierungsschächten an der Markierungsringbefestigung ausgerichtet sind. Diese Vertiefungen sind in Abbildung 1A zu sehen. - Am selben Tag erhalten Sie ein mikrovaskuläres Bild mit der Intravitalmikroskopie-Modalität Ihrer Wahl. Verwenden Sie dazu den gleichen Bildgebungstisch aus Schritt 4.4 (Ergänzende Abbildung S3). Nehmen Sie die Maus aus der Narkose, warten Sie, bis die Maus gehfähig wird, und bringen Sie sie in ihren Käfig zurück.
HINWEIS: Wir verwenden die optische Kohärenztomographie (svOCT) mit Speckle-Varianz-Technologie (svOCT) für hochauflösende mikrovaskuläre 3D-Bilder.
5. Magnetresonanztomographie
- Stellen Sie den Mäusekäfig unter eine Wärmelampe, um die Mäuse etwa 15 Minuten lang zu erwärmen, bevor Sie die Maus betäuben.
HINWEIS: Die Erwärmung fördert die Vasodilatation, was die Platzierung des Schwanzvenenkatheters erleichtert. - Anästhesieren Sie die Maus mit 5 % Isofluran zur Induktion und 2 % Isofluran zur Aufrechterhaltung (Sauerstoffflussrate auf 0,5 l/min eingestellt).
- Erfassen Sie das Gewicht der Maus mit einer elektronischen Waage für die korrekte Medikamentendosierung.
HINWEIS: Um das Körpergewicht genau zu messen, stellen Sie sicher, dass Sie das Gewicht der DSFC-Baugruppe (0,83 g) abziehen. - Legen Sie die Maus auf das MRT-Bett und tragen Sie veterinärmedizinisches Augenschmiermittel auf, um Trockenheit zu vermeiden.
- Halten Sie die Körpertemperatur der Maus mit einem Warmwasserbereiter- und Pumpensystem aufrecht.
- Positionieren Sie ein Atemüberwachungskissen unter dem Zwerchfell der Maus und halten Sie es bei 30 ± 5 Atemzügen/min.
- Wenn Sie ein Kontrastmittel verwenden, führen Sie eine 27-G-Schmetterlingsnadel in die Schwanzvene ein, an der ein Mikroschlauch befestigt ist (30 μl Totvolumen, vorgefüllt mit 1 %iger Herapin-Kochsalzlösung). Befestigen Sie die Nadel und den Mikroschlauch mit chirurgischem Klebeband am MRT-Bett.
- Befestigen Sie die Fensterkammer in einer 3D-gedruckten "Wegfahrsperre", wie in Abbildung 3 gezeigt.
- Injizieren Sie mit einer 18-G-Nadel veterinärmedizinisches Augengleitmittel in die sieben Röhrchen auf dem MRT-Referenzmarker.
- Befestigen Sie die Passermarkenmarkierung an der DSFC, indem Sie die drei quadratischen Verbinder an den drei Pfosten ausrichten, die aus dem vorderen Rahmen herausragen (Abbildung 3).
- Schließen Sie den Schwanzvenenkatheter an die Medikamentenabgabeleitung an und spritzen Sie ihn in die automatische Pumpe. Setzen Sie das Bett in einen präklinischen 7-Tesla-MRT-Scanner ein.
- Erfassen Sie koronale und axiale T2-gewichtete (T2w) Bildsätze, um die Ebene der Fensterkammer zu visualisieren (Echozeit TE = 25 ms; Wiederholzeit TR = 2.500 ms; 40 x 40 mm Sichtfeld mit einer 64 x 64-Matrix für eine Auflösung von 0,5 x 0,5 mm in der Ebene; 0,5 mm Schichtdicke; 25 s). Verschreiben Sie ein sagittales T2-gewichtetes Set (TE = 25 ms; TR = 2.500 ms; 32 x 32 mm Sichtfeld mit 128 x 128 Matrix für eine Auflösung von 0,25 x 0,25 mm in der Ebene; mindestens 11 bildgebende Schichten; 0,5 mm Schichtdicke; 87 s), die dann in die Ebene der DSFC- und Referenzmarker gedreht wird, basierend auf den koronalen und axialen Ansichten, wie in Abbildung 4 gezeigt. Richten Sie das sagittale Set iterativ neu aus und positionieren Sie es, bis die Bildgebungsschnitte vollständig ausgerichtet sind, sodass Scheibe 5 vollständig das Gewebesignal in der DSFC und Scheibe 6 kein Gewebesignal in der DSFC enthält.
- Führen Sie mikrovaskuläre Bildgebung mit der mikrovaskulären MRT-Methode Ihrer Wahl durch.
HINWEIS: Für die mikrovaskulären MRT-Aufnahmen müssen die Markerschnitte nicht abgebildet werden, da die Bilder im selben Bildgebungsrahmen wie die T2w-Registrierungsbilder aufgenommen werden.- Erfassen Sie alle in den Schritten 5.12 und 5.13 beschriebenen Erfassungen über ein Sichtfeld von 32 x 32 mm mit einer 64 x 64-Matrix für eine Auflösung von 0,5 x 0,5 mm in der Ebene. Verwenden Sie für alle MRT-Aufnahmen konsistente HF-Impulse, um die geometrische Konsistenz durch die Ebene zu verbessern (sinc-Anregung; sinc3-Refokussierung; 2.484 Hz Bandbreite).
- Für die DCE-Bildgebung:
- Wenn Messungen der Gadoliniumkonzentration gewünscht werden, erhalten Sie T1-Karten mit 2D-RAR-Bildern, die bei unterschiedlichen Wiederholungszeiten (TE = 7 ms; SELTENHEITSFAKTOR = 2; TR = 350, 500, 750, 1.000, 1.500, 2.500 und 4.000 ms; 8 min 28 s).
- Durchführung von Zeitreihenaufnahmen mit 2D-RAR-Bildern (TE = 8,1 ms; SELTENHEITSFAKTOR = 2; TR = 200 ms; Flip-Winkel = 90°; zeitliche Auflösung = 12,8 s; 188 Wiederholungen; Gesamtüberwachungszeit = 40 min 6 s).
- Injektion von 0,75 mmol/kg Körpergewicht Gadobutrol über 10 s über die Schwanzvene nach Abschluss von fünf Bildwiederholungen mit einer automatisierten MRT-kompatiblen Spritzenpumpe.
- Für IVIM-MRT:
- Durchführung einer diffusionsgewichteten Bildgebung mit den folgenden B-Werten: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2 mit drei Mittelwerten von B = 0 s/mm2 und isotroper Abtastung (TE = 16 ms; TR = 800 ms; Dauer des Gradienten = 2,2 ms; Gradiententrennung = 9 ms; 61 Minuten).
HINWEIS: Die diffusionsgewichtete Bildgebung wird mit einer 2D-Fourier-Transformationsauslesung und nicht mit verzerrungsanfälliger echoplanarer Bildgebung aufgenommen, um die geometrische Konsistenz des Tumors und der umgebenden Gewebesignale innerhalb der DSFC über die Bildsätze und mit den intravitalen Mikroskopiebildern sicherzustellen.
- Durchführung einer diffusionsgewichteten Bildgebung mit den folgenden B-Werten: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2 mit drei Mittelwerten von B = 0 s/mm2 und isotroper Abtastung (TE = 16 ms; TR = 800 ms; Dauer des Gradienten = 2,2 ms; Gradiententrennung = 9 ms; 61 Minuten).
- Nehmen Sie die Maus aus der Narkose, warten Sie, bis die Maus gehfähig wird, und bringen Sie sie in ihren Käfig zurück.
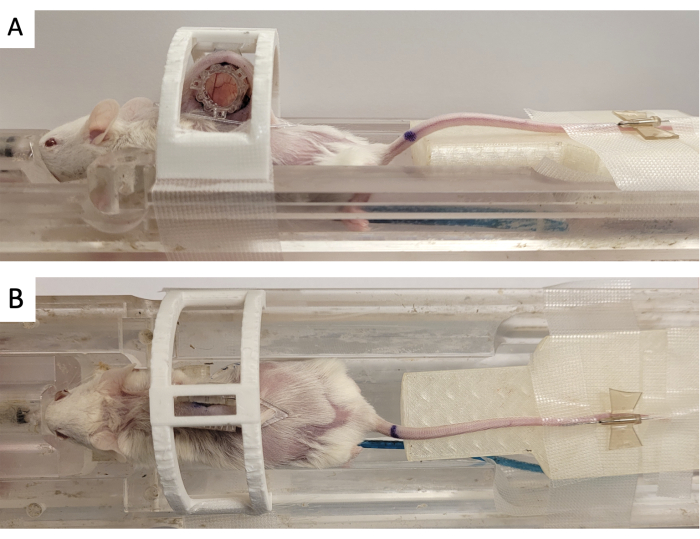
Abbildung 3: DSFC-MRT-Bildgebungsaufbau. (A) Seiten- und (B) Draufsicht auf die Maus, die auf dem MRT-Bett positioniert ist, mit gesichertem und immobilisiertem DSFC. Die Maus verfügt über einen Schwanzvenenkatheter für die Kontrastmittelinjektion und der Fiducial-Maker-Ring ist am vorderen Rahmen der DSFC befestigt. Abkürzungen: DSFC = dorsale Hautfaltenfensterkammer; MR = Magnetresonanztomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
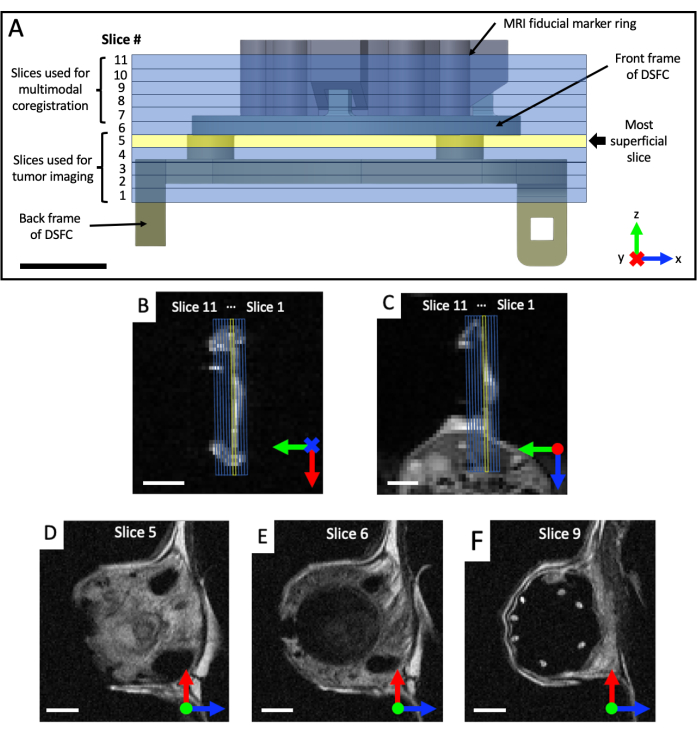
Abbildung 4: MRT-Schnittpositionen in Bezug auf Passermarkenmarker und Fensterkammer. (A) Ein Diagramm der DSFC mit Passermarkerringbefestigung mit den 11 überlagerten MRT-Schnitten. Es müssen mehrere T2-gewichtete Bilder aufgenommen werden, um sicherzustellen, dass die Scheiben korrekt mit der DSFC und dem Gewebe ausgerichtet sind. (B,C) Korrekte Positionierung der 11 Scheiben in Bezug auf das Gewebe in der DSFC aus verschiedenen Ausrichtungen. (D) Schicht 5 ist die oberflächlichste Schicht, in der eine intermodale Korrelationsanalyse durchgeführt wird. (E) Scheibe 6 enthält kein Gewebesignal, das darauf hinweist, dass sie richtig mit dem DSFC ausgerichtet ist. (F) Schließlich sind die 7 Passermarken in Scheibe 9 deutlich sichtbar. Maßstabsleisten = 5 mm. Ein "X" auf der Achse zeigt an, dass die Achse in die Seite hineingeht, und ein Kreis zeigt an, dass die Achse aus der Seite herausragt. Abkürzungen: DSFC = dorsale Hautfaltenfensterkammer; MRT = Magnetresonanztomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Co-Registrierung von MRT und Intravitalmikroskopie
- Öffnen Sie in MATLAB die Datei Multimodal_Image_Register.m, die in der Zusatzdatei 2 enthalten ist.
- Laden Sie in den Arbeitsbereich das mikrovaskuläre Bild (Abbildung 5A), das Hellfeldmikroskopiebild (Abbildung 5B) und die mikrovaskulären MRT-Daten (IVIM- und/oder DCE-MRT-Parameterkarten).
- Klicken Sie auf die Schaltfläche Ausführen .
- Navigieren Sie mit dem Popup-Dateifinder zu der Datei, die die T2w-MRT-Slices enthält.
- Wählen Sie bis zu vier T2w-MRT-Schichten aus, die die Passermarkenmarker deutlich darstellen (Abbildung 5C).
- Eine Benutzeroberfläche mit dem Mikroskopiebild (Abbildung 5B) und den tiefengemittelten T2w-MRT-Schichten (Abbildung 5C) wird angezeigt. Platzieren Sie einen Punkt auf jedem der sieben Passermarken im MRT-Bild und ordnen Sie sie dem entsprechenden Punkt auf dem Mikroskopiebild zu (Markerverdienungen um den Umfang des Glases am vorderen Rahmen des DSFC), wie durch die grünen Punkte in Abbildung 5B, C angezeigt.
- Schließen Sie das Fenster.
- Eine Abbildung mit den überlagerten MRT- und Mikroskopiebildern wird erscheinen, um die Qualität der Registrierung zwischen den beiden Datensätzen zu beurteilen. Wenn die Registrierung ausreichend ist, setzen Sie den Code fort, indem Sie y eingeben und dann im Befehlsfenster die Eingabetaste drücken. Andernfalls wiederholen Sie diesen Schritt, indem Sie n in das Befehlsfenster eingeben und die Eingabetaste drücken.
HINWEIS: Die erfolgreiche Co-Registrierung des MRT-Datensatzes mit dem Mikroskopiebild bedeutet, dass die sieben hellen Passermarken aus dem MRT-Datensatz zentriert und vollständig in ihren entsprechenden Divots auf dem vorderen Rahmen des DSFC enthalten sind. - Es wird eine Benutzeroberfläche angezeigt, auf der das Mikroskopiebild (Abbildung 5B) und der Datensatz der mikrovaskulären Bildgebung svOCT (Abbildung 5A) angezeigt werden. Wählen Sie mindestens drei mikrovaskuläre Orientierungspunkte auf dem mikrovaskulären svOCT-Bild und die entsprechenden Punkte im Mikroskopiebild aus, wie durch die blauen Punkte in Abbildung 5A, B dargestellt.
- Schließen Sie das Fenster.
- Eine Abbildung mit den überlagerten svOCT- und Mikroskopiebildern wird erscheinen, um die Qualität der Koregistrierung zwischen den beiden Datensätzen zu beurteilen. Wenn die Registrierung ausreichend ist, setzen Sie den Code fort, indem Sie y eingeben und dann im Befehlsfenster die Eingabetaste drücken. Andernfalls wiederholen Sie diesen Schritt, indem Sie n in das Befehlsfenster eingeben und die Eingabetaste drücken.
HINWEIS: Die erfolgreiche Co-Registrierung des svOCT-Datensatzes mit dem Mikroskopiebild bedeutet, dass die Gefäße aus beiden Datensätzen perfekt miteinander überlagert sind. - Schließen Sie das Fenster.
- Das mitregistrierte Mikrokopie-Bild wird dann angezeigt. Konturieren Sie den Tumor in diesem Bild.
- Schließen Sie das Fenster.
- Anschließend werden mehrere Abbildungen angezeigt: der mikrovaskuläre Datensatz svOCT (Abbildung 5D), das mitregistrierte Mikroskopiebild (Abbildung 5E) und die mitregistrierten MRT-Parameterkarten (Abbildung 5F). Speichern Sie die Karten für die spätere Analyse.
HINWEIS: Die angezeigten MRT-Karten sind auf die vom Benutzer gezeichnete Tumorkontur beschränkt (Abbildung 5F).
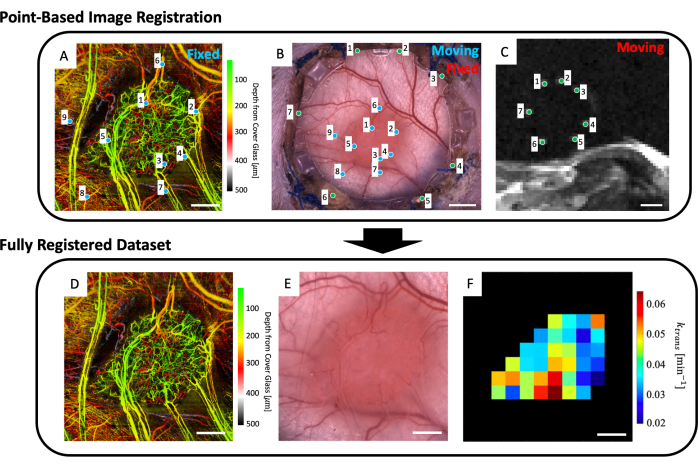
Abbildung 5: Multimodale punktbasierte Co-Registrierung. (A) Farbtiefenkodierter mikrovaskulärer svOCT-Datensatz; Maßstabsbalken = 1 mm. (B) Hellfeldmikroskopische Aufnahme der Fensterkammer; Maßstabsbalken = 2 mm. (C) Mittelwert der T2w-MRT-Schnitte 8-11, die die sieben im Referenzmarkerring enthaltenen Passermarken zeigen; Maßstabsleiste = 5 mm. (C) Zunächst wird der "bewegliche" T2w-MRT-Datensatz mit dem "festen" Hellfeldmikroskopie-Bild unter Verwendung der vom Benutzer eingegebenen grünen Marker auf beiden Bildsätzen co-registriert. Als nächstes werden das "bewegte" Hellfeldmikroskopiebild und das co-registrierte MRT-Bild unter Verwendung der blauen Marker in A und B in den "festen svOCT-Datensatz" aufgenommen. Der endgültige co-registrierte Datensatz enthält das (D) svOCT, (E) das Hellfeldmikroskopie-Bild und (F) die funktionelle MRT-Parameterkarte. Die schwarzen Voxel in F befinden sich außerhalb des Tumors und werden daher in der Analyse nicht berücksichtigt. Für D-F ist die Maßstabsleiste = 1 mm. Abkürzungen: svOCT = Speckle-Varianz-optische Kohärenztomographie; MRT = Magnetresonanztomographie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Die optische Kohärenztomographie (svOCT) wurde durchgeführt, um mikrovaskuläre 3D-Bilder mit großem Sichtfeld (FOV) (6 x 6 mm,2 lateral x 1 mm Tiefe) zu erhalten. Um diese Bilder zu erhalten, wurde ein zuvor beschriebenes Sweep-Source-OCT-System verwendet, das auf einem Quadraturinterferometer basiert23. OCT-Bilder wurden aufgenommen, indem zwei seitlich benachbarte 3 x 6 mm 2-FOV-Scans zusammengefügt wurden. Jeder B-Scan bestand aus 400 A-Scans und wurde 24x pro Stelle ...
Diskussion
In dieser Arbeit haben wir einen Workflow entwickelt, um sowohl intravitale Mikroskopie als auch klinisch anwendbare Bildgebung (CT, MRT und PET) am selben Tier durchzuführen. Dies geschah mit dem Ziel, präklinische Mikroskopie-Befunde durch direkte Korrelation der Intravitalmikroskopie mit klinischen Bildgebungsmodalitäten wie der MRT in die Klinik zu übertragen. Obwohl herkömmliche DSFC-Konstruktionen aus Metall 2,3 bestehen, haben wir die DSFC durch die V...
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken Dr. Carla Calçada (Postdoktorandin, Princess Margaret Cancer Center) und Dr. Timothy Samuel (Ph.D. Student, Princess Margaret Cancer Centre) für ihre Hilfe bei der Kultivierung von Tumorzellen und der Entwicklung des Impfprotokolls. Dr. Kathleen Ma, Dr. Anna Pietraszek und Dr. Alyssa Goldstein (Animal Research Centre, Princess Margaret Cancer Centre) halfen bei der Entwicklung des Operationsprotokolls. Jacob Broske (Medizintechniker, Princess Margaret Cancer Centre) und Wayne Keller (Hardware Client Executive, Javelin Technologies – ein Unternehmen der TriMech Group) druckten die Fensterkammern in 3D. James Jonkman (Advanced Optical Microscopy Facility, University Health Network) lieferte wertvolle Hinweise für die Bildaufnahme in der Hellfeld- und Fluoreszenzmikroskopie.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
Referenzen
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten