JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
중개 암 연구에서 생체 내 현미경 및 자기 공명 영상의 결합을 위한 Dorsal Skinfold Window Chamber 종양 마우스 모델
* 이 저자들은 동등하게 기여했습니다
요약
Intravital microscopy 결과의 번역은 조직에 대한 얕은 깊이 침투로 인해 어려움을 겪고 있습니다. 여기에서는 직접적인 공간 상관 관계를 위해 생체 내 현미경 검사와 임상적으로 적용 가능한 이미징 양식(예: CT, MRI)을 함께 정합할 수 있는 등쪽 창 챔버 마우스 모델에 대해 설명하며, 이를 통해 생체 내 현미경 검사 결과의 임상 번역을 간소화할 수 있습니다.
초록
현미경 및 광간섭 단층 촬영과 같은 전임상 생체 내 이미징은 종양 미세환경과 치료에 대한 반응을 시각화하기 위한 암 연구에서 유용한 도구임이 입증되었습니다. 이러한 이미징 방식은 미크론 규모의 해상도를 가지고 있지만 조직에 대한 얕은 침투 깊이로 인해 클리닉에서 사용이 제한적입니다. CT, MRI 및 PET와 같이 임상적으로 적용 가능한 이미징 방식은 침투 깊이가 훨씬 더 크지만 공간 해상도(mm 스케일)가 상대적으로 낮습니다.
전임상 생체 내 이미징 결과를 임상에 적용하려면 이러한 미시적 대 거시 적 해상도 격차를 해소할 수 있는 새로운 방법을 개발해야 합니다. 여기에서는 동일한 동물에서 전임상 생체 내 및 임상적으로 적용 가능한(CT 및 MR) 이미징을 가능하게 하도록 설계된 등쪽 스킨폴드 창 챔버 종양 마우스 모델과 이 두 가지 이질적인 시각화 방법을 연결하는 이미지 분석 플랫폼에 대해 설명합니다. 중요한 것은 설명된 창 챔버 접근 방식을 통해 직접 공간 일치를 위해 창 챔버의 기준 마커를 사용하여 다양한 이미징 양식을 3D로 공동 등록할 수 있다는 것입니다. 이 모델은 기존 임상 이미징 방법의 검증뿐만 아니라 "실측 자료" 고해상도 생체 내 소견과의 직접적인 상관 관계를 통해 새로운 방법을 개발하는 데 사용할 수 있습니다.
마지막으로, 화학 요법, 방사선 요법, 광역학 요법 등 다양한 치료에 대한 종양 반응은 전임상 및 임상적으로 적용 가능한 이미징 양식을 사용하여 이 방법론으로 종단적으로 모니터링할 수 있습니다. 따라서 여기에 설명된 등쪽 피부주름창 챔버 종양 마우스 모델 및 이미징 플랫폼은 다양한 암 연구 연구에서 사용될 수 있으며, 예를 들어 전임상 생체 내 현미경 결과를 CT 또는 MRI와 같은 보다 임상적으로 적용 가능한 이미징 양식으로 변환하는 데 사용할 수 있습니다.
서문
종양 미세혈관은 종양 미세환경의 중요한 구성 요소로서 치료의 표적이 될 수 있고 치료 반응의 결정 요인이 될 수 있습니다. 전임상 환경에서 미세혈관은 일반적으로 orthotopic 또는 heterotopic window chamber 동물 모델에서 생체 내 현미경을 사용하여 연구됩니다 1,2. 이는 이미징이 살아있는 조직에서 수행되고 종양을 몇 주 또는 몇 개월에 걸쳐 종단적으로 모니터링할 수 있기 때문에 조직학적 연구에 비해 몇 가지 장점이 있습니다 2,3. 이러한 연구는 생체 내 현미경의 고해상도 이미징 기능을 활용하여 종양에 대한 치료제의 전달 4,5, 치료 내성6의 원인, 항혈관 신생 치료 7,8 및 방사선 요법 2,9와 같은 치료에 대한 미세 혈관의 반응을 연구할 수 있습니다.
생체 내 현미경 검사는 분명히 전임상 암 연구에서 중요한 역할을 합니다. 그러나 임상에서 종양 미세환경 특징을 어떻게 측정할 수 있습니까? 미세혈관 정보는 방사선 요법10에서 치료 저항성을 결정하는 데 중요한 혈액 공급 및 종양 세포 저산소증을 측정하기 위해 클리닉에서 유용할 뿐만 아니라 주변 종양 세포에 화학요법제를 전달하는 미세혈관의 능력(11)을 측정하는 데 유용할 것입니다. 예를 들어, 방사선 치료에서 종양 미세혈관의 구조 및 기능에 대한 공간 정보는 분획 일정을 조정하거나 무혈성 및 저산소 가능성 있는 영역으로 선량을 우선적으로 증가시킴으로써 환자의 치료 계획을 개인화하는 데 도움이 될 수 있다12.
Intravital Microscopy는 매우 높은 해상도(μm 스케일)를 가지고 있기 때문에 이러한 중요한 미세혈관 기능을 측정할 수 있습니다. 그러나 조직에 대한 깊이 침투는 수백 미크론 또는 몇 밀리미터로 제한되어 임상 구현이 어렵습니다. 실제로, 클리닉에서 생체 내 현미경 검사의 몇 가지 새로운 응용 프로그램이 있습니다13; 그러나, 이는 여전히 피부(14)와 같은 표면 근처의 조직을 검사하거나 유연한 카테터/내시경(flexible catheters/endoscopes)을 통해 다양한 체강의 점막/내피 내벽을 검사하는 것으로 제한된다(15,16).
더 일반적으로, 미세혈관은 CT17 또는 MRI18과 같은 영상 양식을 사용하여 연구됩니다. 이러한 임상 이미징 기법은 신체 내부의 모든 깊이까지 이미징할 수 있지만 공간 해상도(mm 스케일)가 훨씬 낮습니다. 따라서, 고해상도의 상세한 미세혈관 정보를 임상에 도입하기 위해 전임상 활력내 현미경 검사와 임상 이미징 양식 사이의 이러한 해상도 격차를 해소할 필요가 있다19. DCE(Dynamic Contrast-Enhanced) MRI 및 CT20, IVIM(Intravoxel incoherent motion) MRI21과 같은 임상 영상 양식의 미세혈관 영상 기능을 개선하기 위해 여러 기능적 영상 방법이 개발되었습니다. 그러나, 이들은 미세혈관의 간접 측정을 제공하는 모델-기반 방법이며, 따라서, 미세혈관구조(19,22)의 적절한 "실측 자료" 측정으로 검증되어야 한다.
당사는 전임상 생체 내 현미경 검사와 CT 및 MRI와 같이 임상적으로 적용 가능한 이미징 양식 간의 이러한 격차를 해소하기 위해 DSFC(dorsal skinfold window chamber) 종양 마우스 모델을 개발했습니다. DSFC는 유리창을 통해 고해상도 생체 내 현미경 이미징을 위해 종양에 직접 접근할 수 있을 뿐만 아니라 MR 호환 재료(플라스틱 및 유리)로 만들어졌기 때문에 MRI와 같이 임상적으로 적용 가능한 이미징도 제공합니다. 또한 포함된 MATLAB 코드는 전임상 생체 내 현미경 검사와 임상적으로 적용 가능한 이미징 양식 간의 직접적인 공간 상관 관계를 위해 다중 모드 3D 공동 정합을 수행합니다. 여기에서는 DSFC를 설치하기 위한 설계 및 수술뿐만 아니라 생체 내 현미경 및 임상적으로 적용 가능한 이미징 양식을 공동 등록하는 절차에 대해 설명합니다.
프로토콜
모든 동물 시술은 캐나다 동물 보호 위원회(Canadian Council on Animal Care)에서 정한 실험 동물의 관리 및 사용 가이드(Guide to the Care and Use of Experimental Animals)에 따라 수행되었습니다. 실험은 캐나다 토론토에 있는 University Health Network Institutional Animal Care and Use Committee에서 승인한 프로토콜에 따라 수행되었습니다.
1. 종양 접종 랜드마크
참고: "랜드마크(landmarking)"는 DSFC 배치를 최적화하기 위해 종양 세포를 주입해야 하는 위치를 나타내기 위해 쥐의 피부를 표시하는 과정을 말합니다. 이 랜드마크 절차는 접종 당일 또는 1일 전에 이루어져야 합니다. 면역력이 저하된 NOD. 이 작업에는 Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) 암컷 마우스가 사용되었습니다.
- 유도를 위해 5% 이소플루란을 사용하고 유지를 위해 2% 이소플루란을 사용하여 마우스를 마취합니다(산소 유량은 0.5L/min으로 설정). 오토클레이브 수술 매트로 감싼 가열 패드에 마우스를 올려 체온을 유지합니다.
- 종양 세포 접종을 위해 마우스를 면도 한 다음 의료용 제모 크림을 바르십시오. 젖은 멸균 종이 타월을 사용하여 30-60초 후에 제모 크림을 철저히 제거하십시오. 건조를 방지하기 위해 수의학 눈 윤활제를 바르십시오.
- 알코올 면봉으로 피부를 소독하십시오.
- 마우스의 몸을 부드럽게 곧게 펴고 마우스의 척추를 따라 피부를 들어 올립니다. 수술용 마커를 사용하여 쥐의 한쪽 면에 텐트 피부의 중앙에 단일 점을 그립니다. 점은 쥐의 흉추 대략 중앙에 위치해야 합니다.
참고: 이것은 종양의 원하는 위치입니다.
2. 종양 접종
참고: 이 연구에서는 인간 췌장암 세포주(BxPC3)를 사용하고 있습니다. 다른 세포주도 사용할 수 있습니다. 그러나 특정 세포 배양 단계는 세포주마다 다를 수 있습니다. 아래 절차에 대한 수정 사항은 셀에 포함된 지침을 참조하십시오.
- 37 ° C 및 5 % CO2 에서 75 mL 플라스크에 완전한 성장 매체 (Roswell Park Memorial Institute 1640 배지, 10 % 소 태아 혈청 및 1 % 페니실린 / 스트렙토 마이신)를 사용하여 접종 2 주 전부터 세포를 성장시킵니다. 세포가 기하급수적 성장 단계에서 유지되도록 합니다.
참고: 통로 수는 10-15배로 제한되어야 하며 75mL 플라스크에는 접종 시 약 600만 개의 세포(~70% 합류)가 포함되어야 합니다. - 배지를 흡인하고 칼슘이나 마그네슘이 없는 인산염 완충 식염수(PBS) 5mL로 세포를 세척합니다.
- 5mL의 세포 분리제를 추가하고 37°C 및 5%CO2 에서 6-7분 동안 배양합니다. 현미경을 사용하여 세포가 분리되었는지 확인하고 5mL의 완전 성장 배지를 추가합니다.
알림: 플라스크의 측면을 가볍게 두드리면 셀을 분리하는 데 도움이 될 수 있습니다. - 현탁액을 15mL 원심분리기 튜브로 옮기고 500× g 에서 5분 동안 원심분리하여 세포를 펠트합니다. 배지를 흡입하고 세포를 5mL의 완전 성장 배지에 재현탁시킵니다.
- 혈구계를 사용하여 세포 농도와 총 세포 수를 측정합니다.
- 500× g 에서 5분 동안 원심분리하여 세포를 펠릿하고 배지를 흡인합니다.
- 2.5단계에서 얻은 총 세포 수를 기반으로 적절한 양의 완전 성장 배지를 추가하여 n이 접종할 마우스의 총 수인 농도
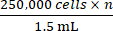 에 도달합니다. 셀을 다시 중단합니다.
에 도달합니다. 셀을 다시 중단합니다.
참고: 마우스 한 마리당 접종할 목표 세포 수는 250,000개입니다. - 250,000개의 세포가 들어 있는 1.5mL를 × n 으로 1.5mL 미세 원심분리기 튜브에 넣습니다. 1.5ml 마이크로 원심분리기 튜브를 500× g 에서 5분 동안 원심분리하고 매체를 흡입합니다.
알림: 과도한 세포 현탁액은 필요한 경우 추가 접종에 사용하기 위해 37°C로 가열된 온수 수조에 보관할 수 있습니다. - PBS의 10 μL × n 에 세포를 재현탁시킵니다. 셀을 얼음 위에 놓아 현탁액을 식힙니다.
알림: 세포를 얼음에서 식힌 후에는 20분 이내에 마우스에 주입해야 합니다. - 냉각된 피펫 팁을 사용하여 10 μL × n 의 용해성 기저막을 추가합니다. 냉각된 29게이지 인슐린 바늘에 각각 20μL 의 세포 현탁액을 로드합니다. 주사기를 얼음 위에 두십시오.
- 유도를 위해 5% 이소플루란을 사용하고 유지를 위해 2% 이소플루란을 사용하여 마우스를 마취합니다(산소 유량은 0.5L/min으로 설정).
- 멸균된 수술 매트로 감싼 가열 패드에 마우스를 놓습니다.
- 주사 부위의 피부를 알코올 면봉으로 소독합니다.
- 랜드마크 지점 전~1cm 전에 바늘을 삽입하고 랜드마크에 올 때까지 바늘을 피부 아래로 움직입니다. 바늘의 경사면을 위쪽으로 놓고 20μL의 세포 현탁액을 주입합니다.
- 주사기를 제거하기 전에 용해된 기저막이 응고될 때까지 45초 동안 기다립니다.
- 마우스를 마취에서 제거하고 마우스가 보행할 수 있을 때까지 기다렸다가 다른 마우스와 함께 케이지로 되돌립니다.
- 촉진을 통해 매일 종양을 모니터링하고 4주 동안 또는 종양의 직경이 4-8mm가 될 때까지 종양이 자라도록 둡니다. 종양 크기가 1.5cm를 초과하거나, 궤양이 있는 종양 또는 전신 질환의 징후(무기력, 정상 체중의 20%를 초과하는 체중 감소, 보행 장애, 체온 조절 불능, 식욕 부진, 구부정한 자세, 눈에 띄는 통증 징후(얼굴 표정 등) 또는 탈수)가 충족되는 경우 마우스를 안락사시킵니다.
3. 창실 수술
참고: DSFC는 그림 1과 같이 4개의 3D 프린팅 부품으로 구성됩니다. 각 부품의 회로도는 보충 파일 1에 포함되어 있습니다. 모든 부품은 생체 적합성이 있는 투명 플라스틱 수지로 인쇄됩니다. 메인 윈도우 챔버 어셈블리는 MRI 또는 CT 이미징 중에 부착할 수 있는 추가 기준 마커 링(그림 1D)과 함께 세 부분(그림 1A-C)으로 구성됩니다.
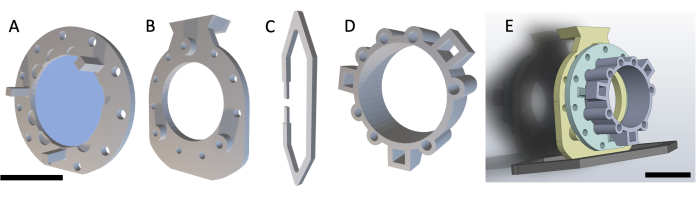
그림 1: Dorsal skinfold window chamber 개략도. 주 창 챔버는 세 부분으로 구성됩니다. 먼저, (A) 전면 프레임은 마우스 피부 아래에 봉합되고 UV 경화 접착제를 사용하여 부착된 유리 커버슬립이 포함되어 있습니다. (B) 후면 프레임은 피부 바깥쪽의 전면 프레임에 봉합됩니다. (C) 지지 클립은 후면 프레임의 하단에 부착되고 DSFC를 마우스 본체에 똑바로 유지합니다. (D) 기준 마커 링에는 기준 마커를 삽입할 수 있는 7개의 '웰'이 포함되어 있습니다. 기준 마커 링은 3개의 지지대를 사용하여 DSFC의 전면 프레임에 부착할 수 있습니다. (E) 기준 마커 링이 있는 전체 DSFC 어셈블리가 표시됩니다. 눈금 막대 = 1cm(AD, 왼쪽 하단; E). 약어 : DSFC = dorsal skinfold window chamber. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 수술 1-3시간 전에 0.6mg/mL 서방형 부프레노르핀 1mg/kg을 피하로 투여합니다. 마우스가 흉부 수축 없이 DSFC를 견딜 수 있는 충분한 신체 크기와 무게인지 확인하십시오.
- 메인 윈도우 챔버 부품(그림 1A-C)을 고농도 액체 소독제로 12분 동안 살균한 다음 이소프로필 알코올에 최소 5분 동안 담가둡니다.
- 유도를 위해 5% 이소플루란을 사용하고 유지를 위해 2% 이소플루란을 사용하여 마우스를 마취합니다(산소 유량은 0.5L/min으로 설정).
- 마우스를 아래에 가열 패드가 있는 멸균 수술 매트로 옮깁니다.
- 마우스를 면도하고 머리카락이 있는 경우 의료용 제모 크림을 바르십시오. 30-60초 후 멸균 젖은 종이 타월을 사용하여 제모 크림을 제거합니다.
- 건조를 방지하기 위해 수의학 눈 윤활제를 바르십시오. 30분마다 또는 수술 중 필요에 따라 덧바르십시오.
- 7.5% 포비돈-요오드 스크럽을 바르고 70% 이소프로필 알코올로 헹구어 피부를 소독합니다. 피부를 자연 건조시키십시오.
- 10% 포비돈-요오드 용액을 피부에 바르고 자연 건조시킵니다(그림 2A).
- 수술용 매트를 멸균된 새 매트로 교체하십시오.
- 발가락 꼬집기를 사용하여 마우스가 마취 수술 평면에 도달했는지 확인합니다.
- 척추를 따라 쥐의 피부를 들어 올리고 두 개의 측면 피부 주름 중 하나에서 자라는 종양을 찾습니다. DSFC의 뒤쪽 프레임(그림 2B)을 종양이 자라는 피부의 같은 쪽에 놓고 종양이 프레임의 중앙에 오도록 합니다.
- DSFC의 상단 3개 구멍과 수술 가이드에 각각 3개의 봉합사를 추가하여 백 프레임의 위치를 고정합니다(그림 2B).
- DSFC의 후면 프레임을 통해 스페이서가 들어 있는 구멍에 세 개의 바늘을 삽입합니다(그림 2B).
알림: DSFC의 후면 프레임에는 혈류가 DSFC 내부 조직으로 제한되지 않도록 전면 프레임과 후면 프레임 사이의 간격을 유지하기 위해 3개의 '스페이서'가 있습니다. 스페이서는 그림 1B에서 볼 수 있습니다. - 수술용 마커를 사용하여 DSFC 백 프레임 스페이서가 피부 양쪽에 위치할 6개 지점을 표시합니다(그림 1C,D의 6-2점 ).
알림: 삽입된 바늘은 이러한 지점의 정확한 위치에 대한 가이드로 사용해야 합니다. - 1cm 직경의 원을 그려 후면 프레임 반대쪽에서 제거할 피부를 나타냅니다(그림 2D).
- 봉합사를 절단하여 피부에서 바늘과 뒷부분을 제거합니다.
- 수술용 마이크로 가위를 사용하여 1단계에서 표시한 피부의 직경 3.15cm 구멍을 자릅니다(그림 2E).
- 임시 봉합사를 배치하여 창실의 모든 부분을 피부에 고정합니다. DSFC 전면 프레임의 상단 구멍을 통해 지점 4를 통해 봉합사를 삽입한 다음 마우스 반대쪽에 있는 지점 1을 통해 봉합사를 삽입합니다(그림 2F 및 보충 그림 S1의 단계 1-2).
- 후면 프레임의 상단 지지대를 통해 봉합사를 끼운 다음 마우스 머리에 가장 가까운 후면 프레임의 지지대를 통해 다시 끼웁니다(그림 2F).
- 점 2를 통해 봉합사를 삽입합니다. 그런 다음 전면 프레임의 해당 구멍을 통해 봉합사를 끼웁니다(그림 2G 및 보충 그림 S1의 3단계).
- 피부 안쪽에서 그림 6H 에 표시된 대로 지점 2와 보충 그림 S3의 단계 4-1을 통해 봉합사를 끼웁니다.
- 그림 5I에 표시된 대로 지점 2와 보충 그림 S4의 단계 1을 통해 봉합사를 끼웁니다.
- 그림 2J와 보충 그림 S5의 단계 1에 표시된 대로 전면 프레임, 포인트 3을 통해 봉합사를 가져온 다음 후면 프레임을 통해 가져옵니다.
- 그림 2K와 보충 그림 S1의 단계 6과 같이 DSFC의 전면 프레임인 지점 1을 통해 봉합사를 다시 가져온 다음 지점 4를 통해 빼냅니다.
- 이 봉합사로 전체 어셈블리를 조이고 3.17단계에서 만든 구멍을 통해 피부 아래의 전면 프레임을 밀어 넣습니다(그림 2L,M).
- 이 봉합사의 두 끝을 함께 묶고 여분의 끈을 자릅니다.
- DSFC의 전면 및 후면 프레임 둘레 주변의 구멍을 통해 영구 봉합을 수행합니다. 그림 2N 및 보충 그림 S2에 표시된 패턴으로 두 프레임을 함께 봉합합니다.
- 임시 봉합사를 잘라 제거합니다.
- 지지 클립을 DSFC의 후면 프레임에서 돌출부로 밀어 넣어 DSFC의 후면 프레임에 부착합니다(그림 2O).
참고: 수술 후 2주 후의 마우스 이미지는 그림 2P,Q에 나와 있습니다. 지지 클립은 피부의 긴장과 불편함을 줄이기 위해 DSFC를 마우스에 똑바로 세우는 데 사용됩니다. - 통증 및 염증 감소를 위해 비스테로이드성 항염증제인 체중 5mg/kg Meloxicam을 피하로 투여합니다.
- 마우스를 마취에서 제거하고 마우스가 보행할 수 있을 때까지 기다렸다가 케이지로 되돌립니다.
- 수술 후 2-3시간 후에 마우스를 점검하고 최소 1주일 동안 매일 점검하십시오. 창실 수술 후 2개월이 경과한 시점 또는 2.17단계의 조건 중 하나라도 충족되는지(둘 중 먼저 발생하는 것)에 도달한 경우를 고려합니다.
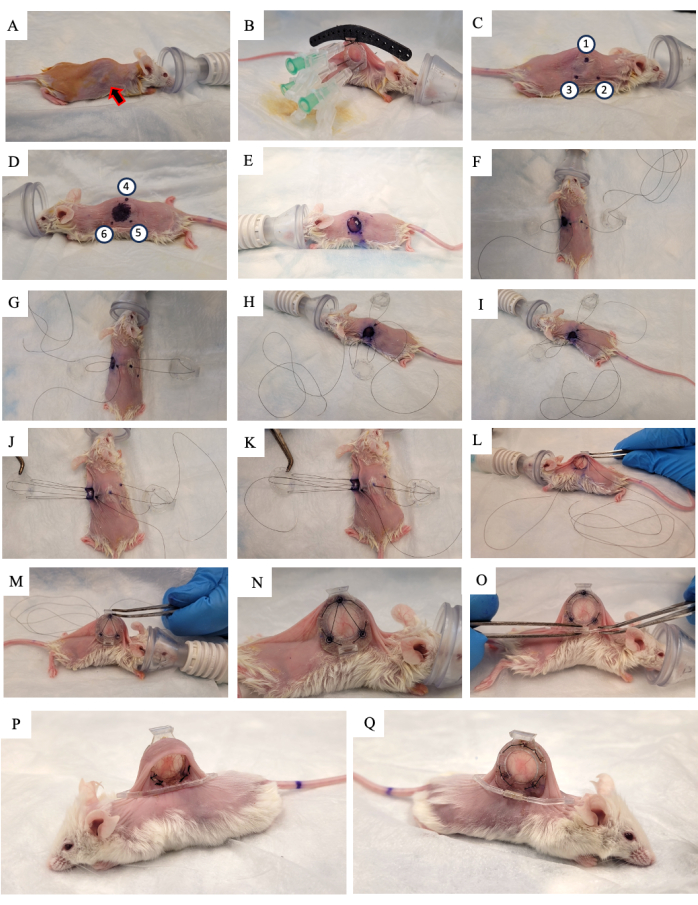
그림 2: DSFC 수술 절차. (A) 마우스는 털을 제거하고 피부를 소독하여 수술을 준비합니다. 피하 종양은 화살표로 표시됩니다. (B) 후면 프레임을 적절한 위치에 놓고 3개의 주사기와 검은색 수술 가이드에 부착된 임시 봉합사로 고정합니다. (씨,디) 스페이서 위치(포인트 1-6)와 구멍은 스킨의 양쪽에 표시되어 있습니다. (E) 피부가 제거됩니다. (F-K) 임시 봉합사는 DSFC의 두 층의 피부, 전면 및 후면 프레임을 통해 나사산을 끼워 모든 부분을 함께 고정합니다. (좌,남) 임시 봉합사를 조이고 전면 프레임을 피부 아래에 삽입합니다. (N) DSFC를 고정하기 위해 8개의 영구 봉합사가 배치됩니다. (O) 마지막으로 임시 봉합사를 제거하고 지지 클립을 부착합니다. (피,큐) 수술 후 2주 후에 동일한 마우스가 양쪽에서 보입니다. 약어: DSFC = dorsal skinfold window chamber. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 광학 이미징
- 이미징 전에 수술 후 최소 5일 동안 쥐가 치유되고 염증이 감소하도록 하십시오.
- 유도를 위해 5% 이소플루란을 사용하고 유지를 위해 2% 이소플루란을 사용하여 마우스를 마취합니다(산소 유량은 0.5L/min으로 설정).
- 건조를 방지하기 위해 수의학 눈 윤활제를 바르십시오. 30분마다 또는 필요에 따라 덧바르십시오.
- 보충 그림 S3과 같이 가스 마취 부착물이 있는 이미징 스테이지에 마우스를 고정합니다.
- 넓은 시야(>1.5cm 너비)의 명시야 현미경 이미지를 얻을 수 있습니다. DSFC의 전면 프레임에 있는 기준 마커 디봇이 보이는지 확인합니다.
참고: 전면 프레임의 유리 둘레에는 기준 마커 링 부착물에 있는 7개의 기준 마커 웰과 정렬되는 7개의 디봇이 있습니다. 이러한 디봇은 그림 1A에서 볼 수 있습니다. - 같은 날, 선택한 생체 내 현미경 검사 방식을 사용하여 미세혈관 이미지를 얻습니다. 이를 위해 4.4단계(보충 그림 S3)와 동일한 이미징 단계를 사용합니다. 마우스를 마취에서 제거하고 마우스가 보행할 수 있을 때까지 기다렸다가 케이지로 되돌립니다.
참고: 고해상도 3D 미세혈관 이미지에는 스페클 분산 광학 간섭 단층 촬영(svOCT)을 사용합니다.
5. 자기공명영상(MRI)
- 마우스 케이지를 열 램프 아래에 놓아 마우스를 마취하기 전에 약 15분 동안 마우스를 따뜻하게 합니다.
참고: 온난화는 혈관 확장을 촉진하여 꼬리 정맥 카테터 배치에 도움이 됩니다. - 유도를 위해 5% 이소플루란을 사용하고 유지를 위해 2% 이소플루란을 사용하여 마우스를 마취합니다(산소 유량은 0.5L/min으로 설정).
- 정확한 약물 투여를 위해 전자 저울을 사용하여 마우스의 무게를 기록하십시오.
알림: 정확한 체중 측정을 위해 DSFC 어셈블리의 무게(0.83g)를 빼야 합니다. - 마우스를 MRI 침대에 놓고 건조를 방지하기 위해 수의학 눈 윤활제를 바릅니다.
- 온수기와 펌프 시스템을 사용하여 마우스의 체온을 유지합니다.
- 호흡 모니터링 베개를 마우스의 횡격막 아래에 놓고 분당 30± 5회 호흡을 유지합니다.
- 조영제를 사용하는 경우 마이크로튜브가 부착된 상태에서 27G의 나비 바늘을 꼬리 정맥에 삽입합니다(1% 헤라핀 식염수 용액으로 미리 채워진 30μL의 데드 볼륨). 수술용 테이프로 바늘과 마이크로튜브를 MRI 침대에 고정합니다.
- 그림 3과 같이 3D 프린팅된 '고정 장치'에 창 챔버를 고정합니다.
- 18G 바늘을 사용하여 MRI 기준 마커의 7개 튜브에 동물용 눈 윤활제를 주입합니다.
- 3개의 정사각형 커넥터를 전면 프레임에서 돌출된 3개의 포스트에 맞춰 기준 마커를 DSFC에 부착합니다(그림 3).
- 꼬리 정맥 카테터를 약물 전달 라인과 자동 펌프의 주사기에 연결합니다. 침대를 7-테슬라 전임상 MRI 스캐너에 삽입합니다.
- 코로나 및 축 T2 가중(T2w) 이미지 세트를 획득하여 창 챔버의 평면을 시각화합니다(에코 시간 TE = 25ms, 반복 시간 TR = 2,500ms, 0.5 x 0.5mm 평면 해상도의 경우 64 x 64 매트릭스 를 사용한 40 x 40mm 시야, 0.5mm 슬라이스 두께, 25초). 시상 T2 가중 세트(TE = 25ms; TR = 2,500밀리초; 32 x 32mm 시야각 , 128 x 128 매트릭스 , 0.25 x 0.25mm 평면 해상도; 적어도 11개의 이미징 슬라이스; 0.5 mm 슬라이스 두께; 87 s), 그런 다음 그림 4와 같이 코로나 및 축 보기를 기반으로 DSFC 및 기준 마커의 평면으로 회전됩니다. 이미징 슬라이스가 완전히 정렬될 때까지 시상 세트를 반복적으로 재배치하여 슬라이스 5가 DSFC의 조직 신호를 완전히 포함하고 슬라이스 6이 DSFC에 조직 신호를 포함하지 않도록 합니다.
- 선택한 미세혈관 MRI 방법을 사용하여 미세혈관 영상을 수행합니다.
참고: 미세혈관 MR 획득의 경우, 이미지가 T2w 정합 이미지와 동일한 이미징 참조 프레임에서 획득되기 때문에 기준 마커 슬라이스를 이미징할 필요가 없습니다.- 5.12 및 5.13 단계에서 자세히 설명한 모든 획득을 32 x 32 mm 시야 각과 64 x 64 매트릭스 에서 0.5 x 0.5 mm 평면 해상도로 획득합니다. 모든 MRI 수집에 일관된 RF 펄스를 사용하여 평면 통과 기하학적 일관성(sinc excitation, sinc3 refocusing, 2,484Hz 대역폭)을 개선합니다.
- DCE 이미징의 경우:
- 가돌리늄 농도 측정이 필요한 경우 다양한 반복 시간(TE = 7ms; 희귀 계수 = 2; TR = 350, 500, 750, 1,000, 1,500, 2,500 및 4,000ms, 8분 28초).
- 2D 희귀 이미지(TE = 8.1ms; 희귀 계수 = 2; TR = 200 밀리초; 플립 각도 = 90°; 시간 해상도 = 12.8초; 188회 반복; 총 모니터링 시간 = 40분 6초).
- 자동 MR 호환 주사기 펌프를 사용하여 5회 이미지 반복이 완료된 후 꼬리 정맥을 통해 10초 이상 체중 0.75mmol/kg Gadobutrol을 주입합니다.
- IVIM MRI의 경우:
- 다음 B 값으로 확산 가중 이미징을 수행합니다: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1,000 s/mm2 B = 0 s/mm2의 3개 평균과 등방성 샘플링(TE = 16 ms; TR = 800 밀리세; 그래디언트 지속 시간 = 2.2ms; 그래디언트 분리 = 9ms; 61분).
참고: 확산 가중 이미징은 왜곡이 발생하기 쉬운 에코 평면 이미징이 아닌 2D 푸리에 변환 판독값을 사용하여 획득하여 이미지 세트 및 생체 내 현미경 이미지와 함께 DSFC 내의 종양 및 주변 조직 신호의 기하학적 일관성을 보장합니다.
- 다음 B 값으로 확산 가중 이미징을 수행합니다: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1,000 s/mm2 B = 0 s/mm2의 3개 평균과 등방성 샘플링(TE = 16 ms; TR = 800 밀리세; 그래디언트 지속 시간 = 2.2ms; 그래디언트 분리 = 9ms; 61분).
- 마우스를 마취에서 제거하고 마우스가 보행할 수 있을 때까지 기다렸다가 케이지로 되돌립니다.
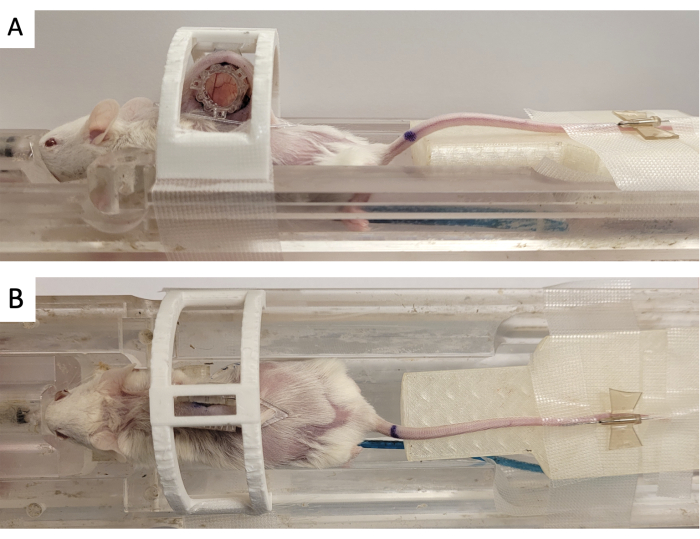
그림 3: DSFC MR 이미징 설정. (A) DSFC가 고정되고 고정된 MRI 베드에 놓인 마우스의 측면 및 (B) 상단 모습. 마우스에는 조영제 주입을 위한 꼬리 정맥 카테터가 있으며 기준 메이커 링은 DSFC의 전면 프레임에 부착되어 있습니다. 약어: DSFC = dorsal skinfold window chamber; MR = 자기 공명 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
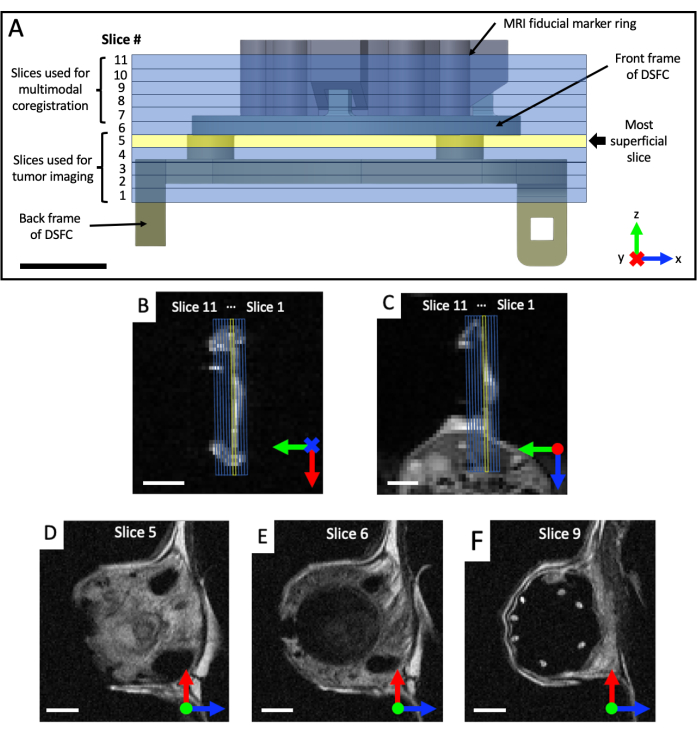
그림 4: 기준 마커 및 창 챔버에 대한 MRI 슬라이스 위치. (A) 11개의 오버레이된 MRI 슬라이스가 있는 기준 마커 링이 부착된 DSFC의 다이어그램. 슬라이스가 DSFC 및 조직과 올바르게 정렬되었는지 확인하기 위해 여러 T2 가중 이미지를 획득해야 합니다. (나,씨) 다른 방향에서 DSFC의 조직과 관련하여 11개 슬라이스의 올바른 위치. (D) Slice 5는 Intermodality 상관 관계 분석이 수행될 가장 피상적인 Slice입니다. (E) 슬라이스 6에는 DSFC와 적절하게 정렬되었음을 나타내는 조직 신호가 포함되어 있지 않습니다. (F) 마지막으로, 7개의 기준 마커가 슬라이스 9에서 명확하게 볼 수 있습니다. 눈금 막대 = 5mm. 축의 'X'는 축이 페이지로 들어간다는 것을 나타내고 원은 축이 페이지 밖으로 나오고 있음을 나타냅니다. 약어: DSFC = dorsal skinfold window chamber; MRI = 자기 공명 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. MRI에서 생체 내 현미경 공동 등록
- MATLAB에서 보충 파일 2에 포함된 Multimodal_Image_Register.m 파일을 엽니다.
- 작업 공간에 미세혈관 이미지(그림 5A), 명시야 현미경 이미지(그림 5B) 및 미세혈관 MRI 데이터(IVIM 및/또는 DCE MRI 파라미터 맵)를 로드합니다.
- 실행 버튼을 클릭합니다.
- 팝업 파일 찾기를 사용하여 T2w MRI 슬라이스가 포함된 파일로 이동합니다.
- 기준 마커를 명확하게 표시하는 T2w MRI 슬라이스를 최대 4개까지 선택할 수 있습니다(그림 5C).
- 현미경 이미지(그림 5B)와 깊이 평균 T2w MRI 슬라이스(그림 5C)를 보여주는 사용자 인터페이스가 표시됩니다. MRI 이미지의 7개 기준 마커 각각에 점을 놓고 그림 5B,C의 녹색 점으로 표시된 대로 현미경 이미지의 해당 지점(DSFC 전면 프레임의 유리 둘레에 있는 기준 마커 디봇)과 일치시킵니다.
- 창을 닫습니다.
- 오버레이된 MRI 및 현미경 이미지가 포함된 그림은 두 데이터 세트 간의 정합 품질을 평가하는 데 도움이 되는 것으로 나타납니다. 등록이 적절하면 y를 입력한 다음 명령 창에서 Enter 키를 눌러 코드를 계속합니다. 그렇지 않으면 명령 창에 n 을 입력하고 Enter 키를 눌러 이 단계를 다시 시도합니다.
참고: MRI 데이터 세트와 현미경 이미지의 성공적인 동시 정합은 MRI 데이터 세트의 7개의 밝은 기준 마커가 DSFC 전면 프레임의 해당 디봇 내에 중앙에 있고 완전히 포함됨을 의미합니다. - 현미경 이미지(그림 5B)와 svOCT 미세혈관 이미징 데이터 세트(그림 5A)를 보여주는 사용자 인터페이스가 표시됩니다. 그림 5A,B의 파란색 점으로 표시된 대로 svOCT 미세혈관 이미지에서 최소 3개의 미세혈관 랜드마크 지점을 선택하고 현미경 이미지에서 해당 지점을 선택합니다.
- 창을 닫습니다.
- 오버레이된 svOCT 및 현미경 이미지가 포함된 그림은 두 데이터 세트 간의 공동 정합 품질을 평가하는 데 도움이 됩니다. 등록이 적절하면 y를 입력한 다음 명령 창에서 Enter 키를 눌러 코드를 계속합니다. 그렇지 않으면 명령 창에 n 을 입력하고 Enter 키를 눌러 이 단계를 다시 시도합니다.
참고: svOCT 데이터 세트와 현미경 이미지의 성공적인 동시 정합은 두 데이터 세트의 용기가 서로 완벽하게 중첩되었음을 의미합니다. - 창을 닫습니다.
- 그러면 공동 등록된 microcopy 이미지가 나타납니다. 이 이미지에서 종양의 윤곽을 그립니다.
- 창을 닫습니다.
- 그런 다음 svOCT 미세혈관 데이터 세트(그림 5D), 공동 등록된 현미경 이미지(그림 5E) 및 공동 등록된 MRI 매개변수 맵(그림 5F)과 같은 여러 그림이 표시됩니다. 나중에 분석할 수 있도록 맵을 저장합니다.
참고: 표시된 MRI 맵은 사용자가 그린 종양 윤곽으로 제한됩니다(그림 5F).
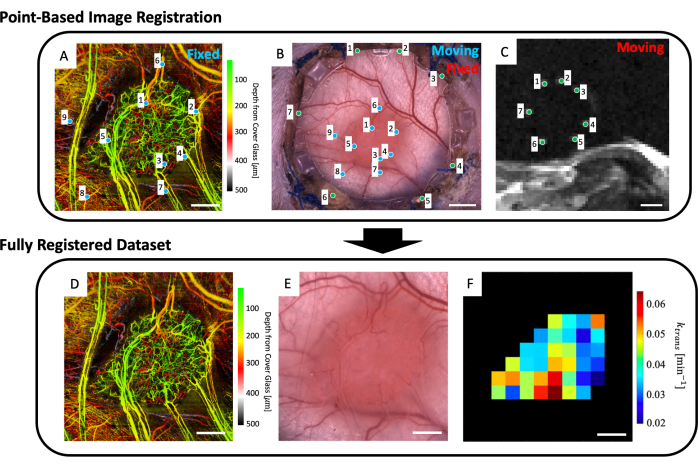
그림 5: Multimodal point-based co-registration. (A) 색상 깊이 인코딩된 미세혈관 svOCT 데이터 세트; 눈금 막대 = 1mm. (B) 창 챔버의 명시야 현미경 이미지; 눈금 막대 = 2mm. (C) 기준 마커 링에 포함된 7개의 기준 마커를 보여주는 T2w MRI 슬라이스 8-11의 평균; 척도 막대 = 5mm. (C) 먼저, '이동' T2w MRI 데이터 세트는 두 이미지 세트에서 사용자 입력 녹색 마커를 사용하여 '고정' 명시야 현미경 이미지에 공동 등록됩니다. 다음으로, '이동' 명시야 현미경 이미지와 공동 등록된 MRI 이미지는 A 와 B의 파란색 마커를 사용하여 'fixed svOCT 데이터 세트'에 공동 등록됩니다. 최종 공동 등록된 데이터 세트에는 (D) svOCT, (E) 명시야 현미경 이미지 및 (F) 기능적 MRI 매개변수 맵이 포함됩니다. F 의 검은색 복셀은 종양 외부에 있으므로 분석에서 고려되지 않습니다. DF의 경우 눈금 막대 = 1mm. 약어: svOCT = speckle variance optical coherence tomography; MRI = 자기 공명 영상. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
스페클 분산 광학 간섭 단층 촬영(svOCT)을 수행하여 넓은 시야(FOV) 3D 미세혈관 이미지(6 x 6mm, 측면2 개 x 깊이 1mm)를 얻었습니다. 이러한 이미지를 획득하기 위해, 직교 간섭계를 기반으로 하는 앞서 설명된 스윕 소스 OCT 시스템이사용되었다 23. OCT 이미지는 측면으로 인접한 두 개의 3 x 6mm2 FOV 스캔을 스티칭하여 획득했습니다. 각 B-스캔은 400개의 A-스캔으로 구성되?...
토론
이 작업에서는 동일한 동물에서 생체 내 현미경 검사와 임상적으로 적용 가능한 이미징(CT, MRI 및 PET)을 모두 수행할 수 있는 워크플로우를 개발했습니다. 이는 생체 내 현미경 검사와 MRI와 같은 임상 영상 양식의 직접적인 상관 관계를 통해 전임상 현미경 검사 결과를 클리닉에 적용하는 것을 목표로 수행되었습니다. 기존의 DSFC 설계는 금속 2,3으로 만?...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
종양 세포 배양 및 접종 프로토콜 개발에 도움을 주신 Carla Calçada 박사(Princess Margaret Cancer Centre 박사후 연구원)와 Timothy Samuel 박사(Princess Margaret Cancer Centre 박사 과정 학생)에게 감사드립니다. Kathleen Ma 박사, Anna Pietraszek 박사, Alyssa Goldstein 박사(Princess Margaret Cancer Centre 동물 연구 센터)가 수술 프로토콜 개발을 도왔습니다. 제이콥 브로스케(Jacob Broske, 프린세스 마가렛 암 센터(Princess Margaret Cancer Centre) 의료 엔지니어링 기술자)와 웨인 켈러(Wayne Keller, TriMech 그룹 회사 자벨린 테크놀로지스(Javelin Technologies) 하드웨어 클라이언트 책임자)는 창문 챔버를 3D 프린팅했습니다. James Jonkman(Advanced Optical Microscopy Facility, University Health Network)은 명시야 및 형광 현미경 이미지 획득에 대한 귀중한 지침을 제공했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
참고문헌
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유