É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo de camundongo tumoral de câmara de janela de dobra cutânea dorsal para microscopia intravital combinada e ressonância magnética na pesquisa translacional do câncer
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A tradução dos achados da microscopia intravital é desafiada por sua penetração em profundidade rasa no tecido. Aqui, descrevemos um modelo de camundongo com câmara de janela dorsal que permite o co-registro de microscopia intravital e modalidades de imagem clinicamente aplicáveis (por exemplo, TC, RM) para correlação espacial direta, potencialmente simplificando a tradução clínica dos achados da microscopia intravital.
Resumo
Imagens intravitais pré-clínicas, como microscopia e tomografia de coerência óptica, provaram ser ferramentas valiosas na pesquisa do câncer para visualizar o microambiente tumoral e sua resposta à terapia. Essas modalidades de imagem têm resolução em escala de mícron, mas têm uso limitado na clínica devido à sua profundidade de penetração rasa no tecido. Modalidades de imagem mais clinicamente aplicáveis, como TC, RM e PET, têm profundidade de penetração muito maior, mas têm resolução espacial comparativamente menor (escala de mm).
Para traduzir os achados de imagem intravital pré-clínica para a clínica, novos métodos devem ser desenvolvidos para preencher essa lacuna de resolução micro a macro . Aqui, descrevemos um modelo de camundongo com tumor de câmara de janela de dobra cutânea dorsal projetado para permitir imagens intravitais pré-clínicas e clinicamente aplicáveis (TC e RM) no mesmo animal, e a plataforma de análise de imagem que liga esses dois métodos de visualização díspares. É importante ressaltar que a abordagem da câmara de janela descrita permite que as diferentes modalidades de imagem sejam co-registradas em 3D usando marcadores fiduciais na câmara da janela para concordância espacial direta. Este modelo pode ser usado para validação de métodos de imagem clínica existentes, bem como para o desenvolvimento de novos por meio de correlação direta com achados intravitais de alta resolução "ground truth".
Finalmente, a resposta do tumor a vários tratamentos - quimioterapia, radioterapia, terapia fotodinâmica - pode ser monitorada longitudinalmente com esta metodologia usando modalidades de imagem pré-clínicas e clinicamente aplicáveis. O modelo de camundongo de tumor de câmara de dobra cutânea dorsal e as plataformas de imagem descritas aqui podem, portanto, ser usados em uma variedade de estudos de pesquisa de câncer, por exemplo, na tradução de achados de microscopia intravital pré-clínica para modalidades de imagem mais clinicamente aplicáveis, como tomografia computadorizada ou ressonância magnética.
Introdução
A microvasculatura tumoral é um componente importante do microambiente tumoral que pode ser um alvo para terapia e um determinante da resposta ao tratamento. No cenário pré-clínico, a microvasculatura é tipicamente estudada usando microscopia intravital em modelos animais ortotópicos ou heterotópicos de câmara de janela 1,2. Isso tem várias vantagens em relação aos estudos histológicos, uma vez que a imagem é feita em tecidos vivos e o tumor pode ser monitorado longitudinalmente por várias semanas ou até meses 2,3. Esses estudos podem aproveitar os recursos de imagem de alta resolução da microscopia intravital para estudar a administração terapêutica ao tumor 4,5, as causas da resistência ao tratamento6 e a resposta dos microvasos a terapias como tratamento antiangiogênico 7,8 e radioterapia 2,9.
A microscopia intravital claramente desempenha um papel importante na pesquisa pré-clínica do câncer; no entanto, como as características microambientais do tumor podem ser medidas na clínica? As informações microvasculares seriam úteis na clínica para medir o suprimento sanguíneo e a hipóxia das células tumorais, o que é importante para determinar a resistência ao tratamento em radioterapia10, bem como a capacidade da microvasculatura de fornecer agentes quimioterápicos às células tumorais circundantes11. Por exemplo, na radioterapia, informações espaciais sobre a estrutura e função da microvasculatura tumoral podem ajudar a personalizar o plano de tratamento de um paciente, ajustando o esquema de fracionamento ou aumentando preferencialmente a dose para regiões avasculares e provavelmente hipóxicas12.
A microscopia intravital pode medir essas importantes características microvasculares, pois tem uma resolução muito alta (escala de μm); no entanto, sua penetração em profundidade no tecido é limitada a várias centenas de mícrons ou alguns milímetros, no máximo tornando a implementação clínica desafiadora. De fato, existem algumas novas aplicações da microscopia intravital na clínica13; no entanto, estes ainda estão limitados a exames de tecido próximo à superfície, como a pele14 ou revestimentos mucosos/endoteliais de várias cavidades corporais por meio de cateteres/endoscópios flexíveis15,16.
Mais comumente, a microvasculatura é estudada usando modalidades de imagem como TC17 ou RM18. Essas modalidades de imagem clínica podem obter imagens em qualquer profundidade dentro do corpo, mas têm uma resolução espacial muito menor (escala de mm). Assim, há a necessidade de preencher essa lacuna de resolução entre a microscopia intravital pré-clínica e as modalidades de imagem clínica para trazer informações microvasculares detalhadas e de alta resolução para a clínica19. Vários métodos de imagem funcional foram desenvolvidos para melhorar as capacidades de imagem microvascular das modalidades de imagem clínica, como ressonância magnética com contraste dinâmico (DCE) e TC20 e ressonância magnética de movimento incoerente intravoxel (IVIM)21. No entanto, esses são métodos baseados em modelos que fornecem medições indiretas da microvasculatura e, portanto, devem ser validados com medições apropriadas de "verdade fundamental" da microvasculatura19,22.
Desenvolvemos um modelo de camundongo tumoral de câmara de janela de dobras cutâneas dorsais (DSFC) para preencher essa lacuna entre a microscopia intravital pré-clínica e as modalidades de imagem clinicamente aplicáveis, como tomografia computadorizada e ressonância magnética. O DSFC fornece acesso direto ao tumor para imagens de microscopia intravital de alta resolução através de uma janela de vidro, mas também imagens clinicamente aplicáveis, como ressonância magnética, pois é feito de materiais compatíveis com RM (plástico e vidro). Além disso, um código MATLAB incluído realiza o co-registro 3D multimodal para correlações espaciais diretas entre microscopia intravital pré-clínica e modalidades de imagem clinicamente aplicáveis. Aqui descreveremos o desenho e a cirurgia para instalar o DSFC, bem como o procedimento para co-registrar a microscopia intravital e as modalidades de imagem clinicamente aplicáveis.
Protocolo
Todos os procedimentos em animais foram realizados de acordo com o Guia para o Cuidado e Uso de Animais Experimentais, estabelecido pelo Conselho Canadense de Cuidados com Animais. Os experimentos foram realizados de acordo com um protocolo aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da University Health Network em Toronto, Canadá.
1. Marcação de inoculação de tumor
NOTA: "Landmarking" refere-se ao processo de marcação da pele do camundongo para indicar onde as células tumorais devem ser injetadas para otimizar a colocação do DSFC. Este procedimento de marcação deve ser feito no mesmo dia ou 1 dia antes da inoculação. O NOD imunocomprometido. Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) camundongo fêmea foi usado para este trabalho.
- Anestesiar o camundongo com isoflurano a 5% para indução e isoflurano a 2% para manutenção (vazão de oxigênio definida para 0,5 L/min). Mantenha a temperatura corporal colocando o mouse em uma almofada de aquecimento envolta em um tapete cirúrgico autoclavado.
- Prepare o camundongo para a inoculação de células tumorais por barbear seguido da aplicação de creme depilatório médico. Remova completamente o creme depilatório após 30-60 s usando uma toalha de papel esterilizada úmida. Aplique lubrificante veterinário para os olhos para evitar o ressecamento.
- Desinfete a pele com um cotonete embebido em álcool.
- Endireite suavemente o corpo do mouse e levante a pele ao longo da coluna do mouse. Usando um marcador cirúrgico, desenhe um único ponto em um lado do mouse no centro da pele da tenda. O ponto deve estar localizado aproximadamente no centro da coluna torácica do mouse.
NOTA: Este será o local desejado do tumor.
2. Inoculação de tumor
NOTA: Neste estudo, estamos usando uma linha celular de câncer de pâncreas humano (BxPC3). Outras linhagens celulares também podem ser usadas; no entanto, as etapas específicas da cultura de células podem variar entre diferentes linhagens celulares. Consulte as instruções incluídas nas células para modificações no procedimento abaixo.
- Cultive as células começando 2 semanas antes da inoculação usando meios de crescimento completos (meio Roswell Park Memorial Institute 1640 com 10% de soro fetal bovino e 1% de penicilina/estreptomicina) em um frasco de 75 mL a 37 ° C e 5% de CO2. Certifique-se de que as células sejam mantidas na fase de crescimento exponencial.
NOTA: O número de passagens deve ser restrito a 10-15x e o frasco de 75 mL deve conter aproximadamente 6 milhões de células (~ 70% de confluência) no momento da inoculação. - Aspire o meio e lave as células com 5 mL de solução salina tamponada com fosfato (PBS) sem cálcio ou magnésio.
- Adicione 5 mL de agente de dissociação celular e incube a 37 ° C e 5% de CO2 por 6-7 min. Confirme se as células se desprenderam usando um microscópio e adicione 5 mL de meio de crescimento completo.
NOTA: Bater suavemente na lateral do frasco pode ajudar a destacar as células. - Transfira a suspensão para um tubo de centrífuga de 15 mL e centrifugue a 500 × g por 5 min para peletar as células. Aspire o meio e ressuspenda as células em 5 mL de meio de crescimento completo.
- Determine a concentração celular e a contagem total de células usando um hemocitômetro.
- Centrifugue a 500 × g por 5 min para granular as células e aspirar o meio.
- Com base na contagem total de células obtida na etapa 2.5, adicione a quantidade apropriada de meio de crescimento completo para atingir uma concentração em
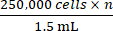 que n é o número total de camundongos a serem inoculados. Ressuspenda as células.
que n é o número total de camundongos a serem inoculados. Ressuspenda as células.
NOTA: O número alvo de células a serem inoculadas por camundongo é 250.000. - Transfira 1,5 mL contendo 250.000 células × n para um tubo de microcentrífuga de 1,5 mL. Centrifugar o tubo de microcentrífuga de 1,5 ml a 500 × g durante 5 min e aspirar o meio.
NOTA: Qualquer excesso de suspensão celular pode ser mantido em banho-maria quente aquecido a 37 °C para ser usado para inoculações adicionais, se necessário. - Ressuspenda as células em 10 μL × n de PBS. Coloque as células no gelo para esfriar a suspensão.
NOTA: Uma vez que as células tenham sido resfriadas no gelo, elas devem ser injetadas no camundongo em 20 minutos. - Adicione 10 μL × n de membrana basal solubilizada usando pontas de pipeta resfriadas. Carregue agulhas de insulina de calibre 29 resfriadas com 20 μL de cada uma das suspensões celulares. Mantenha as seringas no gelo.
- Anestesiar o camundongo com isoflurano a 5% para indução e isoflurano a 2% para manutenção (vazão de oxigênio definida para 0,5 L/min).
- Coloque o mouse em uma almofada de aquecimento envolta em um tapete cirúrgico esterilizado.
- Desinfete a pele no local da injeção com um cotonete embebido em álcool.
- Insira a agulha ~1 cm antes do ponto de referência e mova a agulha sob a pele até que esteja no ponto de referência. Posicione o lado chanfrado da agulha para cima e injete os 20 μL de suspensão celular.
- Aguarde 45 s para permitir que a membrana basal solubilizada solidifique antes de remover a seringa.
- Remova o camundongo da anestesia, espere até que o camundongo se torne deambulatório e devolva-o à gaiola com os outros camundongos.
- Monitore o tumor diariamente por palpação e permita que o tumor cresça por 4 semanas ou até que o tumor tenha 4-8 mm de diâmetro. Eutanasiar o camundongo se qualquer uma das seguintes condições for atendida: tamanho do tumor exceder 1,5 cm, tumor ulcerado ou quaisquer sinais de doença sistêmica (letárgico, perda de peso superior a 20% do peso corporal normal, deambulação prejudicada, incapacidade de regular a temperatura corporal, anorexia, postura curvada, sinais visíveis de dor (expressões faciais, etc.) ou desidratação).
3. Cirurgia de câmara de janela
NOTA: O DSFC consiste em quatro peças impressas em 3D, conforme mostrado na Figura 1. Os esquemas de cada peça estão incluídos no Arquivo Suplementar 1. Todas as peças são impressas com uma resina plástica transparente biocompatível. O conjunto da câmara da janela principal consiste em três partes (Figura 1A-C) com um anel marcador fiducial adicional (Figura 1D) que pode ser afixado durante a ressonância magnética ou tomografia computadorizada.
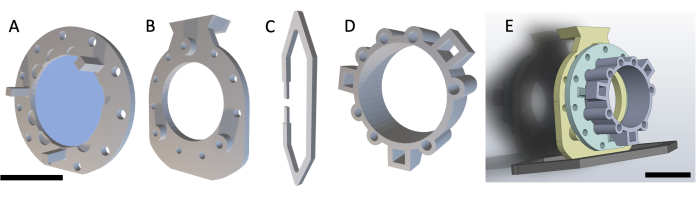
Figura 1: Esquema da câmara da janela de dobras cutâneas dorsais. A câmara da janela principal contém três partes. Primeiro, (A) a estrutura frontal é suturada sob a pele do camundongo e contém uma lamínula de vidro afixada com cola curada por UV. (B) A estrutura traseira é suturada à estrutura frontal na parte externa da pele. (C) O clipe de suporte é fixado na parte inferior da estrutura traseira e mantém o DSFC na posição vertical no corpo do mouse. (D) O anel marcador fiducial contém sete 'poços' onde os marcadores fiduciais podem ser inseridos. O anel marcador fiducial pode ser afixado na estrutura frontal do DSFC usando os três postes de suporte. (E) O conjunto DSFC completo com um anel marcador fiducial é mostrado. Barras de escala = 1 cm (A-D, no canto inferior esquerdo; E). Abreviatura: DSFC = câmara de janela de dobras cutâneas dorsais. Clique aqui para ver uma versão maior desta figura.
- Administre 1 mg / kg de buprenorfina de liberação sustentada 0,6 mg / mL por via subcutânea 1-3 h antes da cirurgia. Certifique-se de que o mouse tenha tamanho e peso corporal suficientes para tolerar o DSFC sem constrição torácica.
- Esterilize as partes da câmara da janela principal (Figura 1A-C) em um desinfetante líquido de alto nível por 12 minutos, seguido de imersão em álcool isopropílico por pelo menos 5 minutos.
- Anestesiar o camundongo com isoflurano a 5% para indução e isoflurano a 2% para manutenção (vazão de oxigênio definida para 0,5 L/min).
- Transfira o mouse para um tapete cirúrgico estéril com uma almofada de aquecimento embaixo.
- Raspe o mouse e aplique creme depilatório médico se houver pelos. Após 30-60 s, remova o creme depilatório usando toalhas de papel úmidas estéreis.
- Aplique lubrificante veterinário para os olhos para evitar o ressecamento. Reaplique a cada 30 minutos ou conforme necessário durante a cirurgia.
- Desinfete a pele aplicando esfoliante com iodopovidona a 7,5% e enxaguando com álcool isopropílico a 70%. Deixe a pele secar ao ar.
- Aplique a solução de iodopovidona a 10% na pele e deixe secar ao ar (Figura 2A).
- Substitua o tapete cirúrgico por um novo tapete esterilizado.
- Certifique-se de que o mouse atingiu o plano cirúrgico da anestesia usando uma pitada no dedo do pé.
- Levante a pele do camundongo ao longo da coluna e procure o tumor crescendo em uma das duas dobras laterais da pele. Coloque a estrutura traseira do DSFC (Figura 2B) no mesmo lado da pele em que o tumor está crescendo, certificando-se de centralizar o tumor na estrutura.
- Adicione três pontos a cada um dos três orifícios superiores do DSFC e ao guia cirúrgico para fixar a posição da estrutura traseira (Figura 2B).
- Insira três agulhas através da estrutura traseira do DSFC nos orifícios que contêm os espaçadores (Figura 2B).
NOTA: Existem três 'espaçadores' na estrutura traseira do DSFC para manter um espaço entre as estruturas frontal e traseira para garantir que o fluxo sanguíneo não seja restrito ao tecido dentro do DSFC. Os espaçadores são visíveis na Figura 1B. - Usando um marcador cirúrgico, marque os seis pontos onde os espaçadores da estrutura traseira do DSFC estarão localizados em ambos os lados da pele (pontos 1-6 na Figura 2C, D).
NOTA: As agulhas inseridas devem ser usadas como guia para a localização precisa desses pontos. - Desenhe um círculo de 1 cm de diâmetro para indicar a pele que será removida no lado oposto à moldura traseira (Figura 2D).
- Remova as agulhas e a estrutura traseira da pele cortando as suturas.
- Corte o orifício de 1 cm de diâmetro na pele que foi marcado no passo 3.15 usando uma microtesoura cirúrgica (Figura 2E).
- Coloque a sutura temporária para prender todas as partes da câmara da janela à pele. Insira uma sutura através do ponto 4, através do orifício superior da estrutura frontal do DSFC e, em seguida, através do ponto 1 no lado oposto do mouse (Figura 2F e etapas 1-2 na Figura Suplementar S1).
- Passe a sutura pelo poste de suporte superior da estrutura traseira e, em seguida, de volta pelo poste de suporte na estrutura traseira mais próxima da cabeça do mouse (Figura 2F).
- Insira a sutura através do ponto 2. Em seguida, passe a sutura pelo orifício correspondente na estrutura frontal (Figura 2G e etapa 3 na Figura Suplementar S1).
- De dentro da pele, passe a sutura pelo ponto 6 conforme indicado na Figura 2H e nas etapas 3-4 na Figura Suplementar S1.
- Passe a sutura pelo ponto 5 conforme indicado na Figura 2I e na etapa 4 na Figura Suplementar S1.
- Passe a sutura pela estrutura frontal, ponto 3, e depois pela estrutura traseira, conforme indicado na Figura 2J e na etapa 5 da Figura Suplementar S1.
- Traga a sutura de volta pelo ponto 1, a estrutura frontal do DSFC e, em seguida, pelo ponto 4, conforme indicado na Figura 2K e na etapa 6 na Figura Suplementar S1.
- Aperte todo o conjunto com esta sutura e deslize a estrutura frontal por baixo da pele através do orifício que foi criado na etapa 3.17 (Figura 2L,M).
- Amarre as duas extremidades desta sutura e corte o excesso de barbante.
- Realize suturas permanentes através dos orifícios ao redor do perímetro das estruturas frontal e traseira do DSFC. Suturar as duas armações juntas no padrão mostrado na Figura 2N e na Figura Suplementar S2.
- Corte e remova a sutura temporária.
- Fixe o clipe de suporte na estrutura traseira do DSFC deslizando-o na saliência da estrutura traseira (Figura 2O).
NOTA: Uma imagem do camundongo 2 semanas após a cirurgia é mostrada na Figura 2P, Q. O clipe de suporte é usado para manter o DSFC na posição vertical do mouse para reduzir a tensão e o desconforto da pele. - Administre 5 mg / kg de peso corporal Meloxicam, um anti-inflamatório não esteróide, por via subcutânea para redução da dor e da inflamação.
- Remova o camundongo da anestesia, espere até que o camundongo fique deambulatório e devolva-o à gaiola.
- Verifique o mouse 2-3 h após a cirurgia e depois diariamente por pelo menos 1 semana. Considere o ponto final atingido 2 meses após a cirurgia da câmara de janela ou se alguma das condições da etapa 2.17 for atendida (o que ocorrer primeiro).
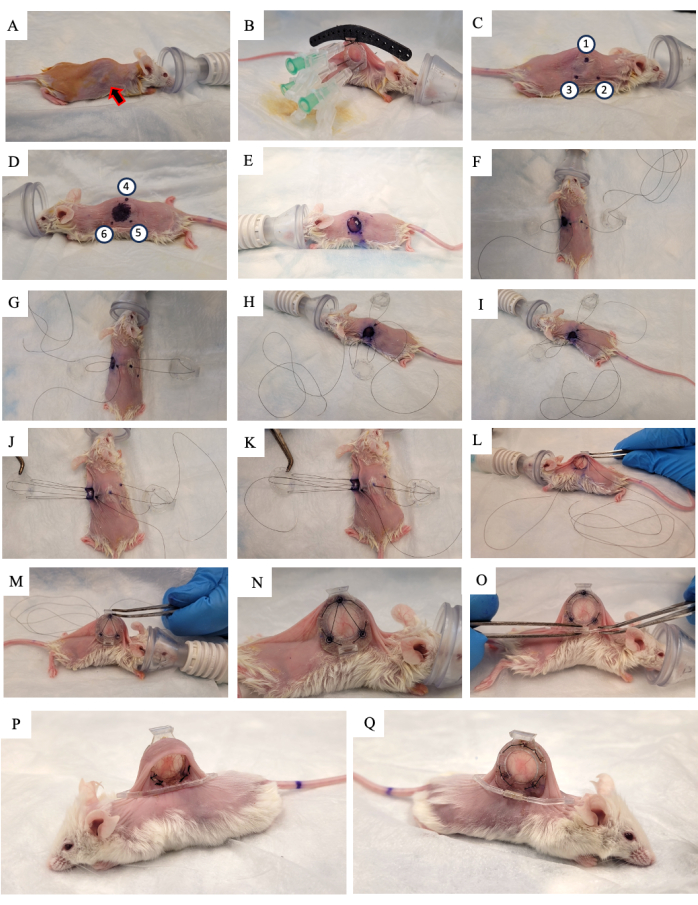
Figura 2: Procedimento cirúrgico DSFC. (A) O camundongo é preparado para a cirurgia removendo os pelos e desinfetando a pele. O tumor subcutâneo é indicado pela seta. (B) A estrutura traseira é colocada na posição apropriada e presa por três seringas, bem como suturas temporárias afixadas no guia cirúrgico preto. (C, D) Os locais do espaçador (pontos 1-6) e o orifício são marcados em ambos os lados da pele. (E) A pele é removida. (F-K) Uma sutura temporária é enfiada nas duas camadas de pele, estruturas frontal e traseira do DSFC para prender todas as partes juntas. (L, M) A sutura temporária é apertada e a estrutura frontal é inserida sob a pele. (N) Oito suturas permanentes são colocadas para proteger o DSFC. (O) Finalmente, a sutura temporária é removida e o clipe de suporte é fixado. (P, Q) O mesmo camundongo é mostrado 2 semanas após a cirurgia de ambos os lados. Abreviatura: DSFC = câmara de janela de dobras cutâneas dorsais. Clique aqui para ver uma versão maior desta figura.
4. Imagem óptica
- Deixe o camundongo cicatrizar e a inflamação diminuir por pelo menos 5 dias após a cirurgia antes da imagem.
- Anestesiar o camundongo com isoflurano a 5% para indução e isoflurano a 2% para manutenção (vazão de oxigênio definida para 0,5 L/min).
- Aplique lubrificante veterinário para os olhos para evitar o ressecamento. Reaplique a cada 30 minutos ou conforme necessário.
- Prenda o mouse em um estágio de imagem com um acessório de anestesia gasosa, conforme mostrado na Figura S3 suplementar.
- Obtenha uma imagem de microscopia de campo claro de campo claro de amplo campo de visão (>1,5 cm de largura). Certifique-se de que os divots do marcador fiducial na estrutura frontal do DSFC estejam visíveis.
NOTA: Existem sete divots ao redor do perímetro do vidro na moldura frontal que se alinham com os sete poços marcadores fiduciais na fixação do anel marcador fiducial. Esses divots são visíveis na Figura 1A. - No mesmo dia, obter uma imagem microvascular usando a modalidade de microscopia intravital de escolha. Use o mesmo estágio de imagem da etapa 4.4 (Figura Suplementar S3) para isso. Remova o camundongo da anestesia, espere até que o camundongo fique deambulatório e devolva-o à gaiola.
NOTA: Usamos tomografia de coerência óptica de variação de manchas (svOCT) para imagens microvasculares 3D de alta resolução.
5. Ressonância magnética
- Coloque a gaiola do mouse sob uma lâmpada de calor para aquecer os ratos por aproximadamente 15 minutos antes de anestesiar o mouse.
NOTA: O aquecimento promove a vasodilatação, o que ajudará na colocação do cateter da veia da cauda. - Anestesiar o camundongo com isoflurano a 5% para indução e isoflurano a 2% para manutenção (vazão de oxigênio definida para 0,5 L/min).
- Registre o peso do mouse usando uma balança eletrônica para dosagem correta do medicamento.
NOTA: Para medições precisas do peso corporal, certifique-se de subtrair o peso do conjunto DSFC (0.83 g). - Coloque o mouse na cama de ressonância magnética e aplique lubrificante veterinário para os olhos para evitar o ressecamento.
- Mantenha a temperatura corporal do mouse usando um aquecedor de água e um sistema de bomba.
- Posicione uma almofada de monitoramento respiratório embaixo do diafragma do mouse e mantenha a 30 ± 5 respirações/min.
- Se estiver usando um agente de contraste, insira uma agulha borboleta 27 G na veia da cauda com microtubos conectados (30 μL de volume morto pré-preenchido com solução salina de herapina a 1%). Prenda a agulha e o microtubo ao leito de ressonância magnética com fita cirúrgica.
- Prenda a câmara da janela em um 'dispositivo de imobilização' impresso em 3D, conforme mostrado na Figura 3.
- Usando uma agulha de 18 G, injete lubrificante ocular veterinário nos sete tubos do marcador fiducial de ressonância magnética.
- Afixe o marcador fiducial ao DSFC alinhando os três conectores quadrados aos três postes que se projetam da estrutura frontal (Figura 3).
- Conecte o cateter da veia caudal à linha de administração do medicamento e à seringa na bomba automática. Insira a cama em um scanner de ressonância magnética pré-clínica de 7 tesla.
- Adquira conjuntos de imagens coronais e axiais ponderadas em T2 (T2w) para visualizar o plano da câmara da janela (tempo de eco TE = 25 ms; tempo de repetição TR = 2.500 ms; campo de visão de 40 x 40 mm com matriz de 64 x 64 para resolução no plano de 0,5 x 0,5 mm; espessura de corte de 0,5 mm; 25 s). Prescrever uma série sagital ponderada em T2 (TE = 25 ms; TR = 2.500 ms; Campo de visão de 32 x 32 mm com matriz de 128 x 128 para resolução no plano de 0,25 x 0,25 mm; pelo menos 11 cortes de imagem; 0,5 mm de espessura do corte; 87 s), que é então rodado para o plano da DSFC e marcadores fiduciais, com base nas incidências coronal e axial, conforme mostrado na Figura 4. Reoriente e posicione iterativamente o conjunto sagital até que os cortes de imagem estejam totalmente alinhados para que o corte 5 contenha totalmente o sinal de tecido no DSFC e o corte 6 não contenha sinal de tecido no DSFC.
- Realize imagens microvasculares usando o método de ressonância magnética microvascular de sua escolha.
NOTA: Para as aquisições de RM microvascular, as fatias de marcadores fiduciais não precisam ser visualizadas, pois as imagens são adquiridas no mesmo quadro de referência de imagem que as imagens de registro T2w.- Adquira todas as aquisições detalhadas nas etapas 5.12 e 5.13 em um campo de visão de 32 x 32 mm com uma matriz de 64 x 64 para resolução no plano de 0,5 x 0,5 mm. Para todas as aquisições de ressonância magnética, use pulsos de RF consistentes para melhorar a consistência geométrica através do plano (excitação sinc; refocalização sinc3; largura de banda de 2.484 Hz).
- Para imagens DCE:
- Se as medições da concentração de gadolínio forem desejadas, obter mapas T1 usando imagens 2D-RARE adquiridas em tempos de repetição variáveis (TE = 7 ms; Fator RARO = 2; TR = 350, 500, 750, 1.000, 1.500, 2.500 e 4.000 ms; 8 min 28 s).
- Realizar imagens de séries temporais usando imagens 2D RARE (TE = 8,1 ms; Fator RARO = 2; TR = 200 ms; ângulo de inversão = 90°; resolução temporal = 12,8 s; 188 repetições; tempo total de monitoramento = 40 min 6 s).
- Injete 0,75 mmol / kg de peso corporal Gadobutrol por 10 s através da veia da cauda após a conclusão de cinco repetições de imagem usando uma bomba de seringa automatizada compatível com RM.
- Para ressonância nuclear magnética (RNM) do IVIM:
- Realize imagens ponderadas em difusão com os seguintes valores B: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2 com três médias de B = 0 s/mm2 e amostragem isotrópica (TE = 16 ms; TR = 800 ms; duração do gradiente = 2,2 ms; separação do gradiente = 9 ms; 61 min).
NOTA: A imagem ponderada por difusão é adquirida usando uma leitura de transformada de Fourier 2D, em vez de imagens ecoplanares propensas a distorção, para garantir a consistência geométrica do tumor e dos sinais do tecido circundante dentro do DSFC nos conjuntos de imagens e com as imagens de microscopia intravital.
- Realize imagens ponderadas em difusão com os seguintes valores B: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2 com três médias de B = 0 s/mm2 e amostragem isotrópica (TE = 16 ms; TR = 800 ms; duração do gradiente = 2,2 ms; separação do gradiente = 9 ms; 61 min).
- Remova o camundongo da anestesia, espere até que o camundongo fique deambulatório e devolva-o à gaiola.
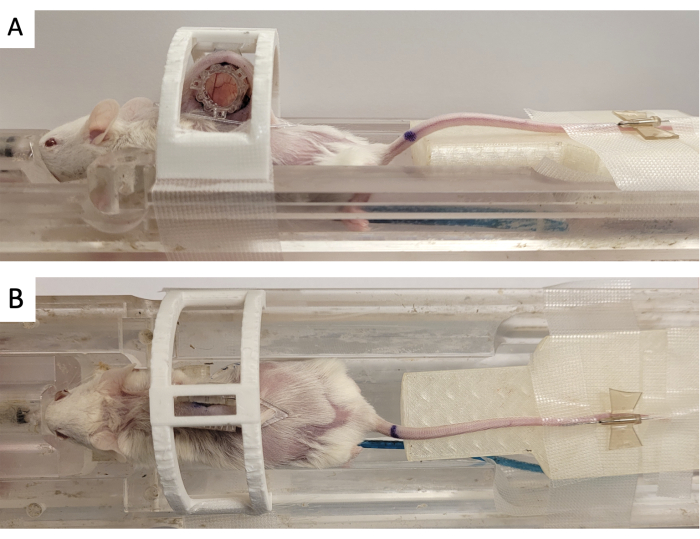
Figura 3: Configuração de imagem de RM DSFC. (A) Vistas laterais e (B) superior do mouse posicionado no leito de ressonância magnética com DSFC preso e imobilizado. O mouse possui um cateter de veia caudal para injeção de agente de contraste e o anel fiducial é afixado na estrutura frontal do DSFC. Abreviaturas: DSFC = câmara de janela de dobras cutâneas dorsais; RM = ressonância magnética. Clique aqui para ver uma versão maior desta figura.
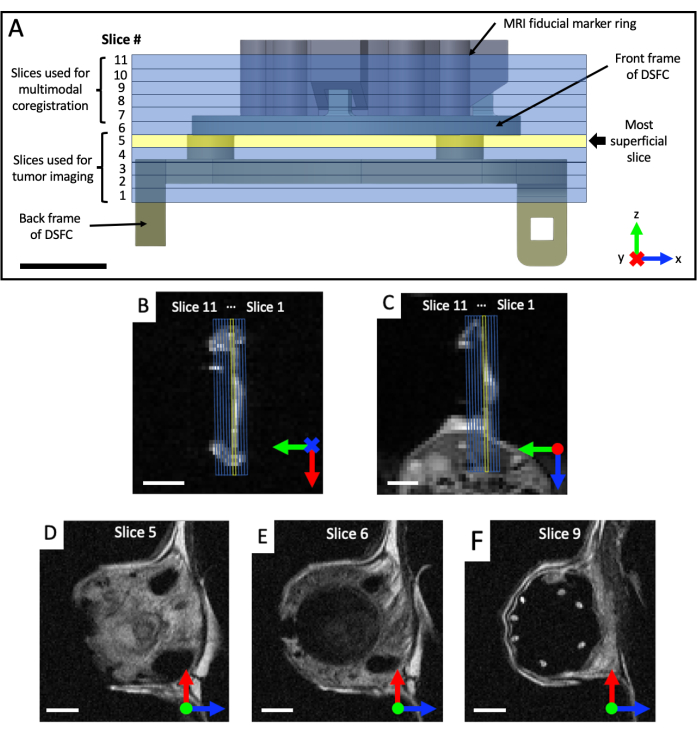
Figura 4: Locais dos cortes de ressonância magnética em relação aos marcadores fiduciais e à câmara da janela. (A) Um diagrama do DSFC com fixação do anel marcador fiducial com os 11 cortes de ressonância magnética sobrepostos. Várias imagens ponderadas em T2 devem ser adquiridas para garantir que os cortes estejam corretamente alinhados com a DSFC e o tecido. (B, C) Posicionamento correto dos 11 cortes em relação ao tecido no DSFC de diferentes orientações. (D) A fatia 5 é a fatia mais superficial onde será realizada a análise de correlação da intermodalidade. (E) A fatia 6 não contém nenhum sinal tecidual indicando que está devidamente alinhada com o DSFC. (F) Finalmente, os 7 marcadores fiduciais são claramente visíveis na fatia 9. Barras de escala = 5 mm. Um 'X' no eixo indica que o eixo está indo para a página e um círculo indica que o eixo está saindo da página. Abreviaturas: DSFC = câmara de janela de dobras cutâneas dorsais; RM = ressonância magnética. Clique aqui para ver uma versão maior desta figura.
6. Co-registro de ressonância magnética para microscopia intravital
- No MATLAB, abra o arquivo Multimodal_Image_Register.m contido no Arquivo Suplementar 2.
- Para o espaço de trabalho, carregue a imagem microvascular (Figura 5A), imagem de microscopia de campo claro (Figura 5B) e dados de ressonância magnética microvascular (mapas de parâmetros de ressonância magnética IVIM e/ou DCE).
- Clique no botão Executar .
- Usando o localizador de arquivos pop-up, navegue até o arquivo que contém as fatias de ressonância magnética T2w.
- Selecione até quatro cortes de ressonância magnética T2w que exibam claramente os marcadores fiduciais (Figura 5C).
- Uma interface de usuário mostrando a imagem da microscopia (Figura 5B) e os cortes de ressonância magnética T2w com média de profundidade (Figura 5C) será exibida. Coloque um ponto em cada um dos sete marcadores fiduciais na imagem de ressonância magnética e combine-os com o ponto correspondente na imagem de microscopia (o marcador fiducial se divide ao redor do perímetro do vidro na moldura frontal do DSFC) conforme indicado pelos pontos verdes na Figura 5B, C.
- Feche a janela.
- Uma figura contendo as imagens de ressonância magnética e microscopia sobrepostas aparecerá para ajudar a avaliar a qualidade do registro entre os dois conjuntos de dados. Se o registro for adequado, continue o código digitando y e pressionando enter na janela de comando. Caso contrário, repita esta etapa digitando n na janela de comando e pressionando Enter.
NOTA: O co-registro bem-sucedido do conjunto de dados de ressonância magnética com a imagem de microscopia significa que os sete marcadores fiduciais brilhantes do conjunto de dados de ressonância magnética estão centralizados e totalmente contidos em seus divots correspondentes na estrutura frontal do DSFC. - Uma interface de usuário mostrando a imagem da microscopia (Figura 5B) e o conjunto de dados de imagens microvasculares svOCT (Figura 5A) será exibida. Selecione pelo menos três pontos de referência microvasculares na imagem microvascular svOCT e os pontos correspondentes na imagem microscópica, conforme indicado pelos pontos azuis na Figura 5A, B.
- Feche a janela.
- Uma figura contendo as imagens svOCT e microscópicas sobrepostas aparecerá para ajudar a avaliar a qualidade do co-registro entre os dois conjuntos de dados. Se o registro for adequado, continue o código digitando y e pressionando enter na janela de comando. Caso contrário, repita esta etapa digitando n na janela de comando e pressionando Enter.
NOTA: O co-registro bem-sucedido do conjunto de dados svOCT com a imagem de microscopia significa que os vasos de ambos os conjuntos de dados estão perfeitamente sobrepostos um ao outro. - Feche a janela.
- A imagem de microcópia co-registrada aparecerá então. Contorne o tumor nesta imagem.
- Feche a janela.
- Várias figuras serão exibidas: o conjunto de dados microvasculares svOCT (Figura 5D), a imagem de microscopia co-registrada (Figura 5E) e os mapas de parâmetros de ressonância magnética co-registrados (Figura 5F). Salve os mapas para análise posterior.
NOTA: Os mapas de ressonância magnética exibidos são restritos ao contorno do tumor desenhado pelo usuário (Figura 5F).
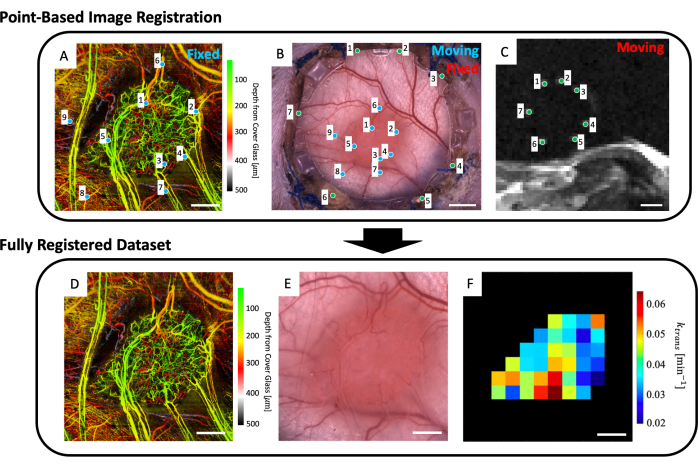
Figura 5: Co-registro multimodal baseado em pontos. (A) Conjunto de dados svOCT microvascular codificado em profundidade de cor; barra de escala = 1 mm. (B) Imagem de microscopia de campo claro da câmara da janela; barra de escala = 2 mm. (C) Média dos cortes de RM T2w 8-11 mostrando os sete marcadores fiduciais contidos no anel marcador fiducial; barra de escala = 5 mm. (C) Primeiro, o conjunto de dados de ressonância magnética T2w 'em movimento' é co-registrado na imagem de microscopia de campo claro 'fixa' usando os marcadores verdes inseridos pelo usuário em ambos os conjuntos de imagens. Em seguida, a imagem de microscopia de campo claro 'em movimento' e a imagem de ressonância magnética co-registrada são co-registradas no 'conjunto de dados svOCT fixo' usando os marcadores azuis em A e B. O conjunto de dados co-registrado final inclui o (D) svOCT, (E) imagem de microscopia de campo claro e (F) mapa de parâmetros de ressonância magnética funcional. Os voxels pretos em F estão fora do tumor e, portanto, não são considerados na análise. Para D-F, barra de escala = 1 mm. Abreviaturas: svOCT = tomografia de coerência óptica de variância speckle; RM = ressonância magnética. Clique aqui para ver uma versão maior desta figura.
Resultados
A tomografia de coerência óptica de variância de speckle (svOCT) foi realizada para obter imagens microvasculares 3D de grande campo de visão (FOV) (6 x 6 mm,2 laterais x 1 mm de profundidade). Para obter essas imagens, foi utilizado um sistema OCT de fonte varrida previamente descrito baseado em um interferômetro de quadratura23. As imagens de OCT foram adquiridas pela junção de duas varreduras de 3 x 6 mm2 FOV adjacentes lateralmente. Cada B-scan consistiu em 400 A-s...
Discussão
Neste trabalho, desenvolvemos um fluxo de trabalho para realizar microscopia intravital e imagens clinicamente aplicáveis (TC, RM e PET) no mesmo animal. Isso foi feito com o objetivo de traduzir os achados da microscopia pré-clínica para a clínica por correlação direta da microscopia intravital com modalidades de imagem clínica, como ressonância magnética. Embora os designs convencionais do DSFC sejam feitos de metal 2,3, adaptamos o DSFC para ser compa...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Agradecemos à Dra. Carla Calçada (pós-doutoranda, Princess Margaret Cancer Centre) e ao Dr. Timothy Samuel (Ph.D. Student, Princess Margaret Cancer Center) pela ajuda na cultura de células tumorais e no desenvolvimento do protocolo de inoculação. A Dra. Kathleen Ma, a Dra. Anna Pietraszek e a Dra. Alyssa Goldstein (Animal Research Centre, Princess Margaret Cancer Center) ajudaram no desenvolvimento do protocolo de cirurgia. Jacob Broske (Tecnólogo de Engenharia Médica, Princess Margaret Cancer Center) e Wayne Keller (Executivo de Clientes de Hardware, Javelin Technologies – Uma Empresa do Grupo TriMech) imprimiram em 3D as câmaras das janelas. James Jonkman (Advanced Optical Microscopy Facility, University Health Network) forneceu orientações valiosas para a aquisição de imagens de microscopia de campo claro e fluorescência.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
Referências
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados