需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
背侧皮褶窗室肿瘤小鼠模型在转化癌症研究中用于联合活体显微镜和磁共振成像
* 这些作者具有相同的贡献
摘要
活体显微镜检查结果的转化因其对组织的浅深度渗透而受到挑战。在这里,我们描述了一种背窗腔小鼠模型,该模型能够共同配准活体显微镜和临床适用的成像模式(例如,CT、MRI)以实现直接的空间相关性,从而可能简化活体显微镜检查结果的临床转化。
摘要
临床前活体成像(如显微镜和光学相干断层扫描)已被证明是癌症研究中用于可视化肿瘤微环境及其对治疗反应的宝贵工具。这些成像模式具有微米级分辨率,但由于它们对组织的穿透深度较浅,因此在临床上的使用受到限制。更临床适用的成像方式,如 CT、MRI 和 PET,具有更大的穿透深度,但空间分辨率(毫米级)相对较低。
为了将临床前活体影像学检查结果转化为临床,必须开发新方法来弥合这种 微观到巨集 分辨率的差距。在这里,我们描述了一种背侧皮褶窗室肿瘤小鼠模型,该模型旨在在同一只动物中实现临床前活体 和 临床应用(CT和MR)成像,以及将这两种不同的可视化方法联系起来的图像分析平台。重要的是,所描述的窗口室方法使得可以使用窗口室上的基准标记在3D中共同配准不同的成像模式,以实现直接的空间一致性。该模型可用于验证现有的临床成像方法,以及通过与"地面真相"高分辨率生命体检结果直接关联来开发新的临床成像方法。
最后,可以使用这种方法使用临床前和临床适用的成像方式纵向监测肿瘤对各种治疗(化疗、放疗、光动力疗法)的反应。因此,本文描述的背侧皮褶窗口室肿瘤小鼠模型和成像平台可用于各种癌症研究,例如,将临床前活体显微镜检查结果转化为更临床适用的成像模式,如CT或MRI。
引言
肿瘤微血管系统是肿瘤微环境的重要组成部分,可以作为治疗的靶点和治疗反应的决定因素。在临床前环境中,通常使用原位或异位窗口室动物模型中的活体显微镜研究微血管系统 1,2。与组织学研究相比,这有几个优点,因为成像是在活组织中进行的,并且肿瘤可以在数周甚至数月内进行纵向监测2,3。这些研究可以利用活体显微镜的高分辨率成像能力来研究向肿瘤输送治疗药物 4,5、治疗耐药的原因6 以及微血管对抗血管生成治疗 7,8 和放疗 2,9 等疗法的反应。
活体显微镜在临床前癌症研究中显然发挥着重要作用;然而,如何在临床上测量肿瘤微环境特征呢?微血管信息在临床上可用于测量血液供应和肿瘤细胞缺氧,这对于确定放疗中的治疗耐药性10 以及微血管系统将化疗药物输送到周围肿瘤细胞的能力11 很重要。例如,在放射治疗中,关于肿瘤微血管系统结构和功能的空间信息可以通过调整分割时间表或优先将剂量增加到缺血性和可能的缺氧区域来帮助个性化患者的治疗计划12。
活体显微镜可以测量这些重要的微血管特征,因为它具有非常高的分辨率(μm 刻度);然而,它对组织的渗透深度限制在几百微米或几毫米,最多使临床实施具有挑战性。事实上,活体显微镜在临床上有一些新的应用13;然而,这些仍然仅限于通过柔性导管/内窥镜15,16 检查近表面水平组织,例如皮肤14 或各种体腔的粘膜/内皮衬里。
更常见的是,使用 CT17 或 MRI18 等成像方式研究微血管系统。这些临床成像方式可以成像到体内的任何深度,但它们的空间分辨率(毫米刻度)要低得多。因此,有必要弥合临床前活体显微镜检查和临床成像模式之间的分辨率差距,以将高分辨率和详细的微血管信息带入临床19。已经开发了几种功能成像方法来提高临床成像模式的微血管成像能力,例如动态对比增强 (DCE) MRI和 CT 20 以及体素内不相干运动 (IVIM) MRI21。然而,这些都是基于模型的方法,提供微血管系统的间接测量,因此,必须通过微血管系统的适当"地面实况"测量来验证19,22。
我们开发了一种背侧皮褶窗室 (DSFC) 肿瘤小鼠模型,以弥合临床前活体显微镜检查与临床适用的成像方式(如 CT 和 MRI)之间的这一差距。DSFC 通过玻璃窗提供直接进入肿瘤的途径,以进行高分辨率的活体显微镜成像,但也提供临床适用的成像,例如 MRI,因为它由 MR 兼容材料(塑料和玻璃)制成。此外,随附的 MATLAB 代码可执行多模态 3D 共配准,以实现临床前活体显微镜检查与临床适用的成像模式之间的直接空间相关性。在这里,我们将描述安装 DSFC 的设计和手术,以及共同配准活体显微镜和临床适用的成像模式的程序。
研究方案
所有动物程序均按照加拿大动物护理委员会制定的《实验动物护理和使用指南》进行。实验是根据加拿大多伦多大学健康网络机构动物护理和使用委员会批准的协议进行的。
1. 肿瘤接种里程碑
注意:"地标"是指在小鼠皮肤上标记的过程,以指示应将肿瘤细胞注射到何处以优化 DSFC 放置。该里程碑式程序应在接种前一天或接种前 1 天进行。免疫功能低下的 NOD。本研究采用Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ(NRG)雌性小鼠。
- 使用5%异氟烷进行诱导,使用2%异氟烷进行维持(氧气流速设置为0.5L / min)麻醉小鼠。通过将鼠标放在包裹在高压灭菌手术垫中的加热垫上来保持体温。
- 通过剃须准备小鼠进行肿瘤细胞接种,然后施用医用脱毛膏。30-60 秒后,使用湿的消毒纸巾彻底去除脱毛膏。使用兽用眼部润滑剂以防止干燥。
- 用酒精棉签对皮肤进行消毒。
- 轻轻地拉直鼠标的身体,并沿着鼠标的脊柱提起皮肤。使用手术记号笔,在小鼠的一侧帐篷皮肤中心画一个点。该点应位于小鼠胸椎的中心。
注意:这将是肿瘤的所需位置。
2.肿瘤接种
注意:在这项研究中,我们使用人类胰腺癌细胞系 (BxPC3)。也可以使用其他细胞系;然而,不同细胞系的特定细胞培养步骤可能有所不同。请参阅单元格附带的说明,以修改以下过程。
- 在接种前2周开始,使用完全生长培养基(Roswell Park Memorial Institute 1640培养基,含10%胎牛血清和1%青霉素/链霉素)在75mL烧瓶中,在37°C和5%CO2下培养细胞。确保细胞保持在指数生长阶段。
注:传代次数应限制为 10-15 次,接种时 75 mL 烧瓶应包含约 600 万个细胞(~70% 汇合度)。 - 吸出培养基并用不含钙或镁的 5 mL 磷酸盐缓冲盐水 (PBS) 洗涤细胞。
- 加入 5 mL 细胞解离剂,并在 37 °C 和 5% CO2 下孵育 6-7 分钟。使用显微镜确认细胞已分离,并加入 5 mL 完全生长培养基。
注意:轻轻敲击烧瓶的侧面有助于分离细胞。 - 将悬浮液转移到 15 mL 离心管中,并以 500 × g 离心 5 分钟以沉淀细胞。吸出培养基并将细胞重悬于 5 mL 完全生长培养基中。
- 使用血细胞计数器确定细胞浓度和总细胞计数。
- 以 500 × g 离心 5 分钟以沉淀细胞并吸出培养基。
- 根据从步骤2.5获得的总细胞计数,加入适量的完全生长培养基以达到浓度,
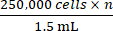 其中 n 是要接种的小鼠总数。重悬细胞。
其中 n 是要接种的小鼠总数。重悬细胞。
注:每只小鼠接种的目标细胞数为250,000。 - 将含有 250,000 个 细胞的 1.5 mL × n 转移到 1.5 mL 微量离心管中。将1.5ml微量离心管以500× g 离心5分钟并吸出培养基。
注意:任何多余的细胞悬浮液都可以保存在加热至37°C的热水浴中,以便在需要时用于额外的接种。 - 将细胞重悬于 10 μL × n 的 PBS 中。将细胞放在冰上以冷却悬浮液。
注意:一旦细胞在冰上冷却,必须在20分钟内将它们注射到小鼠中。 - 使用冷冻移液器吸头加入 10 μL × n 的溶解基底膜。用每个细胞悬浮液 20 μL 加载冷却的 29 号胰岛素针。将注射器放在冰上。
- 使用5%异氟烷进行诱导,使用2%异氟烷进行维持(氧气流速设置为0.5L / min)麻醉小鼠。
- 将鼠标放在包裹在无菌手术垫中的加热垫上。
- 用酒精棉签对注射部位的皮肤进行消毒。
- 将针头插入地标点前 ~1 厘米处,然后将针头移动到皮肤下,直到它位于地标处。将针头的斜面朝上放置,并注射 20 μL 细胞悬液。
- 等待 45 秒,让溶解的基底膜凝固,然后取出注射器。
- 将小鼠从麻醉中取出,等到小鼠可以走动,然后将其与其他小鼠一起放回笼子里。
- 每天通过触诊监测肿瘤,让肿瘤生长 4 周或直到肿瘤直径为 4-8 毫米。如果满足以下任何条件,则对小鼠实施安乐死:肿瘤大小超过 1.5 厘米、肿瘤溃疡或任何全身性疾病的迹象(昏昏欲睡、体重减轻超过正常体重的 20%、行走障碍、无法调节体温、厌食、驼背姿势、明显的疼痛迹象(面部表情等)或脱水)。
3. 窗室手术
注意:DSFC 由四个 3D 打印部件组成,如图 1 所示。每个部件的原理图都包含在补充文件1中。所有部件均采用生物相容性透明塑料树脂印刷。主窗室组件由三个部分(图1A-C)和一个额外的基准标记环(图1D)组成,可以在MRI或CT成像期间固定。
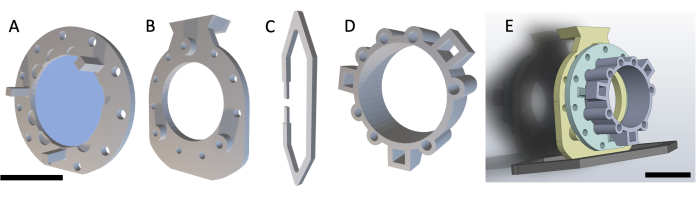
图 1:背侧皮褶窗室示意图。主窗室由三个部分组成。首先,(A)将前框架缝合在小鼠的皮肤下方,并包含一个使用UV固化胶粘住的玻璃盖玻片。(B) 将后框架缝合到皮肤外侧的前框架上。(C) 支撑夹固定在背框的底部,并使 DSFC 保持直立在鼠标身体上。(D) 基准标记环包含七个"孔",可以插入基准标记。基准标记环可以使用三个支撑柱固定在 DSFC 的前框架上。(E) 图中显示了带有基准标记环的完整 DSFC 组件。比例尺 = 1 厘米(A-D,左下角;E).缩写:DSFC=背侧皮褶窗室。请点击这里查看此图的较大版本.
- 手术前 1-3 小时皮下注射 1 mg/kg 0.6 mg/mL 缓释丁丙诺啡。确保小鼠具有足够的体型和体重,以耐受 DSFC 而不会引起胸部收缩。
- 在高浓度液体消毒剂中对主要窗户室部件(图1A-C)消毒12分钟,然后在异丙醇中浸泡至少5分钟。
- 使用5%异氟烷进行诱导,使用2%异氟烷进行维持(氧气流速设置为0.5L / min)麻醉小鼠。
- 将小鼠转移到无菌手术垫上,下面有一个加热垫。
- 如果有毛发,请剃掉鼠标并涂抹医用脱毛膏。30-60 秒后,使用无菌湿纸巾去除脱毛膏。
- 使用兽用眼部润滑剂以防止干燥。每 30 分钟重新涂抹一次,或在整个手术过程中根据需要重新涂抹。
- 使用 7.5% 聚维酮碘磨砂膏并用 70% 异丙醇冲洗干净,对皮肤进行消毒。让皮肤风干。
- 将10%聚维酮碘溶液涂抹在皮肤上,并使其风干(图2A)。
- 用新的消毒垫替换手术垫。
- 确保小鼠已使用脚趾捏达到麻醉的手术平面。
- 沿着脊柱提起小鼠的皮肤,并寻找在两个侧面皮肤褶皱之一上生长的肿瘤。将DSFC的后框架(图2B)放在肿瘤生长的同一侧皮肤上,确保将肿瘤置于框架的中心。
- 在DSFC和手术导板的顶部三个孔中的每一个上添加三根缝合线,以固定背架的位置(图2B)。
- 将三根针穿过DSFC的后框架插入包含垫片的孔中(图2B)。
注意: DSFC 的后框架上有三个"垫片",用于保持前后框架之间的间隙,以确保血液流动不受限于 DSFC 内部的组织。垫片在 图1B中可见。 - 使用手术标记,标记DSFC背框垫片位于皮肤两侧的六个点(图1C,D中的点6-2)。
注意: 插入的针应用作这些点精确定位的指南。 - 画一个直径为 1 厘米的圆圈,表示将在与后框架相对的一侧去除的皮肤(图 2D)。
- 通过切断缝合线从皮肤上取下针头和背架。
- 使用外科微型剪刀在步骤3.15中标记的皮肤上剪下1厘米直径的孔(图2E)。
- 放置临时缝合线,将窗室的所有部分固定在皮肤上。将缝合线插入点 4,穿过 DSFC 前框架的顶部孔,然后穿过鼠标另一侧的点 1(图 2F 和 补充图 S1 中的步骤 1-1)。
- 将缝合线穿过背架的顶部支撑柱,然后穿过最靠近鼠标头部的背架上的支撑柱(图2F)。
- 将缝合线插入点 2。然后,将缝合线穿过前框架中的相应孔(图2G 和 补充图S1中的步骤3)。
- 从皮肤内部,将缝合线穿过点 6,如图 2H 和 补充图 S3 中的步骤 3-1 所示。
- 如图 5I 所示将缝合线穿过点 2I 和 补充图 S1 中的步骤 4。
- 将缝合线穿过前框架,点 3,然后穿过后框架,如图 2J 和 补充图 S5 中的步骤 1 所示。
- 将缝合线带回点 1,即 DSFC 的前框架,然后通过点 4 取出,如图 2K 所示,以及 补充图 S1 中的步骤 1。
- 用这种缝合线拧紧整个组件,并通过步骤3.17中创建的孔将前框架滑到皮肤下方(图2L,M)。
- 将此缝合线的两端绑在一起,并剪断多余的绳子。
- 通过 DSFC 前后框架周边的孔进行永久性缝合。将两个框架按照 图 2N 和 补充图 S2 中所示的模式缝合在一起。
- 剪切并移除临时缝合线。
- 通过将支撑夹滑入后框架的突出部分,将支撑夹固定在 DSFC 的后框架上(图 2O)。
注意:手术后2周小鼠的图像如图2P,Q所示。支撑夹用于将 DSFC 直立在鼠标上,以减少皮肤紧张和不适。 - 皮下注射 5 mg/kg 体重的美洛昔康(一种非甾体抗炎药)以减轻疼痛和炎症。
- 将小鼠从麻醉中取出,等到小鼠可以走动,然后将其放回笼子里。
- 手术后2-3小时检查小鼠,然后每天检查至少1周。考虑在窗室手术后 2 个月达到的终点,或者如果满足步骤 2.17 中的任何条件(以先发生者为准)。
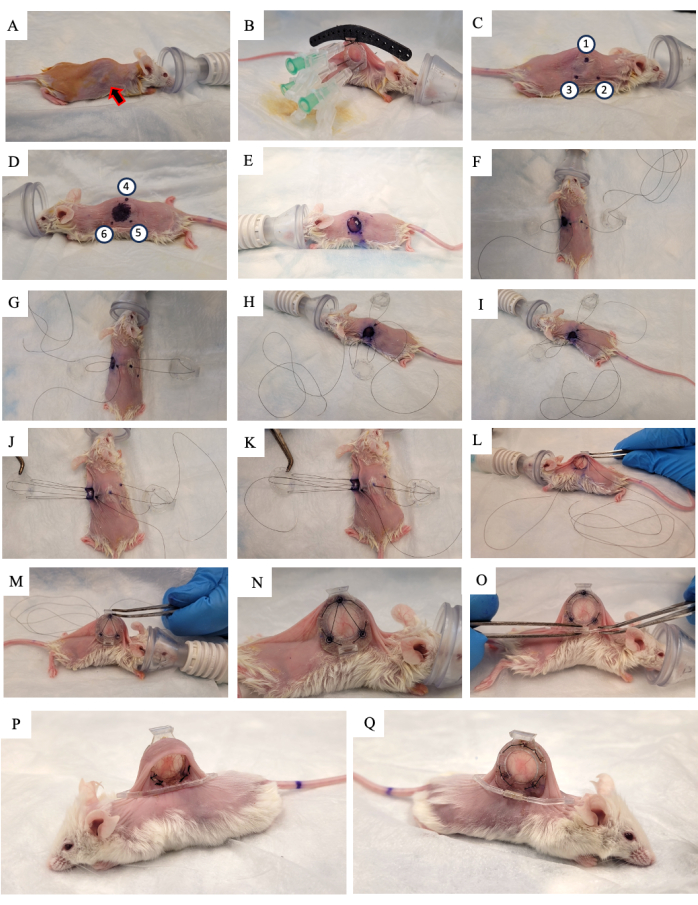
图 2:DSFC 手术程序。 (A) 通过去除毛发和消毒皮肤来准备小鼠进行手术。皮下肿瘤用箭头表示。(B) 将后架放置在适当的位置,并用三个注射器以及固定在黑色手术导板上的临时缝合线固定。(C,D)垫片位置(点 1-6)和孔标记在皮肤的两侧。(E) 皮肤被去除。(F-K)将临时缝合线穿过 DSFC 的两层皮肤、前框架和后框架,以将所有部件固定在一起。(长,米)将临时缝合线收紧,并将前框架插入皮肤下方。(N) 放置八条永久性缝合线以固定 DSFC。(O) 最后,取下临时缝合线,并连接支撑夹。(P,Q)手术后2周,从两侧显示同一只小鼠。缩写:DSFC = 背侧皮褶窗室。请点击这里查看此图的较大版本.
4. 光学成像
- 手术后让小鼠愈合并炎症减轻至少 5 天,然后再进行成像。
- 使用5%异氟烷进行诱导,使用2%异氟烷进行维持(氧气流速设置为0.5L / min)麻醉小鼠。
- 使用兽用眼部润滑剂以防止干燥。每 30 分钟重新涂抹一次,或根据需要重新涂抹。
- 用气体麻醉附件将小鼠固定在成像台上,如 补充图S3所示。
- 获得宽视场(>1.5 cm 宽)明场显微镜图像。确保 DSFC 前框架上的基准标记凹陷可见。
注意: 前框架上的玻璃周边有七个凹槽,与基准标记环附件上的七个基准标记孔对齐。这些凹凸在 图1A中可见。 - 在同一天,使用所选的活体显微镜方式获得微血管图像。为此,请使用步骤4.4(补充图S3)中的相同成像台。将小鼠从麻醉中取出,等到小鼠可以走动,然后将其放回笼子里。
注意:我们使用散斑变异光学相干断层扫描 (svOCT) 进行高分辨率 3D 微血管图像。
5. 磁共振成像
- 将小鼠笼置于加热灯下,使小鼠加热约15分钟,然后再麻醉小鼠。
注意:变暖会促进血管舒张,这将有助于尾静脉导管的放置。 - 使用5%异氟烷进行诱导,使用2%异氟烷进行维持(氧气流速设置为0.5L / min)麻醉小鼠。
- 使用电子秤记录小鼠的体重,以便正确给药。
注意: 为了准确测量体重,请务必减去 DSFC 组件的重量 (0.83 g)。 - 将鼠标放在MRI床上,并涂抹兽用眼部润滑剂以防止干燥。
- 使用热水器和泵系统保持鼠标的体温。
- 将呼吸监测枕放在鼠标横膈膜下方,并保持在 30 ± 5 次呼吸/分钟。
- 如果使用造影剂,将 27 G 蝶形针插入尾静脉,并连接微管(30 μL 死体积预填充 1% 赫拉平 - 盐水溶液)。用手术胶带将针头和微管固定在MRI床上。
- 将窗室固定在 3D 打印的"固定装置"中,如图 3 所示。
- 使用 18 G 针头,将兽用眼部润滑剂注入 MRI 基准标记上的七根管子中。
- 通过将三个方形连接器对准从前框架伸出的三个柱子,将基准标记固定到 DSFC 上(图 3)。
- 将尾静脉导管连接到自动泵中的给药管线和注射器。将床插入 7 特斯拉临床前 MRI 扫描仪。
- 获取日冕和轴向 T2 加权 (T2w) 图像集以可视化窗室的平面(回波时间 TE = 25 ms;重复时间 TR = 2,500 ms;40 x 40 mm 视场 , 64 x 64 矩阵 , 平面内分辨率为 0.5 x 0.5 mm;0.5 mm 切片厚度;25 s)。规定矢状位 T2 加权集 (TE = 25 ms;TR = 2,500 毫秒;32 x 32 mm 视场 , 128 x 128 矩阵 , 平面内分辨率为 0.25 x 0.25 mm;至少 11 个成像切片;0.5 mm 切片厚度;87 秒),然后根据冠状和轴向视图将其旋转到 DSFC 和基准标记的平面中,如图 4 所示。迭代地重新定向和定位矢状面集,直到成像切片完全对齐,以便切片 5 在 DSFC 中完全包含组织信号,切片 6 在 DSFC 中不包含组织信号。
- 使用所选的微血管 MRI 方法进行微血管成像。
注:对于微血管 MR 采集,不需要对基准标记切片进行成像,因为图像是在与 T2w 配准图像相同的成像参考系中采集的。- 在 32 x 32 mm 视场 和 64 x 64 矩阵上获取步骤 5.12 和 5.13 中详述的所有采集,平面 内分辨率为 0.5 x 0.5 mm。对于所有 MRI 采集,使用一致的 RF 脉冲来提高平面几何一致性(sinc 激发、sinc3 重新聚焦、2,484 Hz 带宽)。
- 对于 DCE 成像:
- 如果需要测量钆浓度,请使用在可变重复时间(TE = 7 ms;稀有因子 = 2;TR = 350、500、750、1,000、1,500、2,500 和 4,000 毫秒;8 分 28 秒)。
- 使用 2D RARE 图像执行时间序列成像 (TE = 8.1 ms;稀有因子 = 2;TR = 200 毫秒;翻转角度 = 90°;时间分辨率 = 12.8 s;188次重复;总监测时间 = 40 分钟 6 秒)。
- 使用自动 MR 兼容注射泵完成 5 次图像重复后,通过尾静脉在 10 秒内注射 0.75 mmol/kg 体重的钆布特罗。
- 对于 IVIM MRI:
- 使用以下 B 值执行扩散加权成像:0、20、40、60、80、100、150、200、400、600、800、1,000 s/mm2,B = 0 s/mm2 的三个平均值和各向同性采样 (TE = 16 ms;TR = 800 毫秒;梯度持续时间 = 2.2 ms;梯度分离 = 9 ms;61 分钟)。
注意:弥散加权成像是使用 2D 傅里叶变换读数获得的,而不是使用易失真的回声平面成像,以确保 DSFC 内肿瘤和周围组织信号在图像集中和活体显微镜图像的几何一致性。
- 使用以下 B 值执行扩散加权成像:0、20、40、60、80、100、150、200、400、600、800、1,000 s/mm2,B = 0 s/mm2 的三个平均值和各向同性采样 (TE = 16 ms;TR = 800 毫秒;梯度持续时间 = 2.2 ms;梯度分离 = 9 ms;61 分钟)。
- 将小鼠从麻醉中取出,等到小鼠可以走动,然后将其放回笼子里。
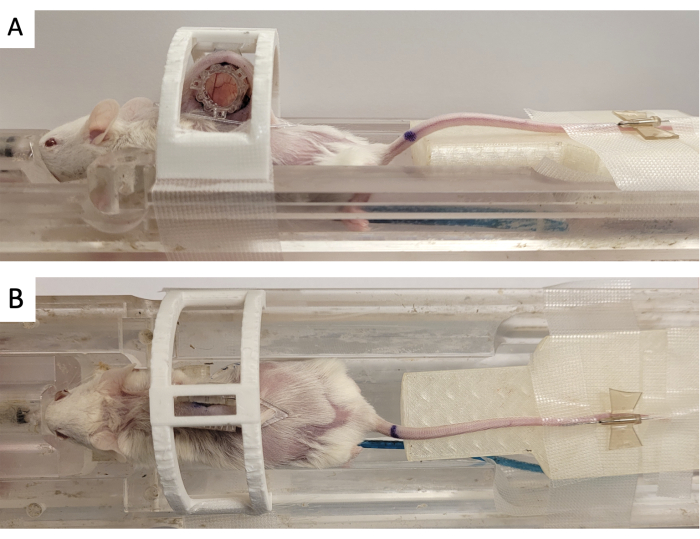
图 3:DSFC MR 成像设置。 (A) 小鼠的侧面和 (B) 顶部视图放置在 MRI 床上,DSFC 固定并固定。小鼠有一个用于注射造影剂的尾静脉导管,基准点制造商环固定在 DSFC 的前框架上。缩写:DSFC=背侧皮褶窗室;MR = 磁共振成像。 请点击这里查看此图的较大版本.
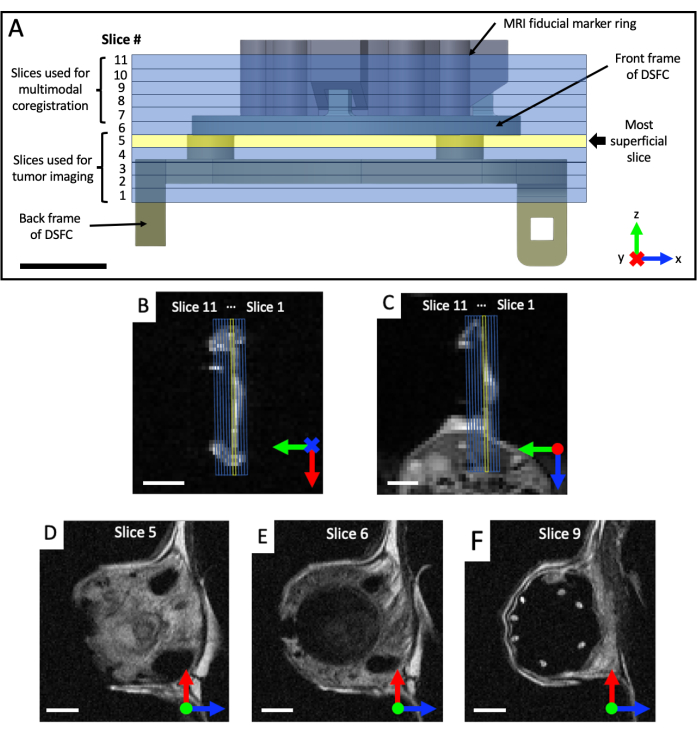
图 4:MRI 切片相对于基准标记和窗室的位置。 (A) 带有基准标记环连接的 DSFC 图,带有 11 个重叠的 MRI 切片。必须采集几张 T2 加权图像,以确保切片与 DSFC 和组织正确对齐。(B,C)从不同方向正确定位 11 个切片相对于 DSFC 中的组织。(D) 切片 5 是进行模态间相关性分析的最浅层切片。(E) 切片 6 不包含任何组织信号,表明它与 DSFC 正确对齐。(F) 最后,7 个基准标记在切片 9 中清晰可见。比例尺 = 5 毫米。轴上的"X"表示轴正在进入页面,圆圈表示轴正在从页面中出来。缩写:DSFC=背侧皮褶窗室;MRI = 磁共振成像。 请点击这里查看此图的较大版本.
6. MRI与活体显微镜联合配准
- 在 MATLAB 中,打开 补充文件 2 中包含的 Multimodal_Image_Register.m 文件。
- 在工作空间中,加载微血管图像(图5A),明场显微镜图像(图5B)和微血管MRI数据(IVIM和/或DCE MRI参数图)。
- 单击" 运行 "按钮。
- 使用弹出文件查找器,导航到包含 T2w MRI 切片的文件。
- 选择最多四个清晰显示基准标记的T2w MRI切片(图5C)。
- 将显示显示显微镜图像(图5B)和深度平均T2w MRI切片(图5C)的用户界面。在MRI图像中的七个基准标记中的每一个上放置一个点,并将它们与显微镜图像上的相应点(基准标记在DSFC前框架的玻璃周边凹陷)匹配,如图5B,C中的绿色点所示。
- 关闭窗户。
- 包含叠加的 MRI 和显微镜图像的图形将出现,以帮助评估两个数据集之间的配准质量。如果注册足够,请键入 y,然后在命令窗口中按 Enter 键来继续执行代码。否则,请在命令窗口中键入 n 并按 Enter 键重试此步骤。
注意:成功将 MRI 数据集与显微镜图像共同配准意味着 MRI 数据集中的七个明亮基准标记居中并完全包含在 DSFC 前框架上的相应凹槽中。 - 将显示显示显微镜图像(图5B)和svOCT微血管成像数据集(图5A)的用户界面。在svOCT微血管图像上选择至少三个微血管标志点,在显微镜图像中选择相应的点,如图5A,B中的蓝色点所示。
- 关闭窗户。
- 包含叠加的 svOCT 和显微镜图像的图将出现,以帮助评估两个数据集之间共同配准的质量。如果注册足够,请键入 y,然后在命令窗口中按 Enter 键来继续执行代码。否则,请在命令窗口中键入 n 并按 Enter 键重试此步骤。
注:成功将 svOCT 数据集与显微镜图像共配准意味着两个数据集中的血管彼此完美叠加。 - 关闭窗户。
- 然后,将出现共同注册的显微复制图像。在此图像中勾勒出肿瘤的轮廓。
- 关闭窗户。
- 然后将显示几个数字:svOCT微血管数据集(图5D),共同配准的显微镜图像(图5E)和共同配准的MRI参数图(图5F)。保存地图以供以后分析。
注意:显示的 MRI 图仅限于用户绘制的肿瘤轮廓(图 5F)。
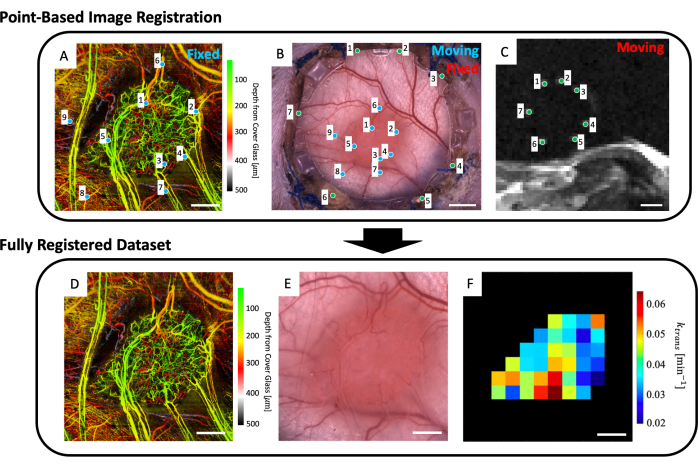
图 5:基于多模态点的共配准。 (A) 颜色深度编码微血管svOCT数据集;比例尺 = 1 mm。 (B) 窗室的明场显微镜图像;比例尺 = 2 mm。 (C) T2w MRI 切片 8-11 的平均值,显示基准标记环中包含的七个基准标记;比例尺 = 5 毫米。 (C) 首先,使用用户输入的绿色标记在两个图像集上将"移动"T2w MRI 数据集共同配准到"固定"明场显微镜图像。接下来,使用 A 和 B 中的蓝色标记将"移动"明场显微镜图像和共同配准的 MRI 图像共同配准到"固定 svOCT 数据集"。最终的共同注册数据集包括 (D) svOCT、(E) 明场显微镜图像和 (F) 功能 MRI 参数图。 F 中的黑色体素位于肿瘤之外,因此在分析中不予考虑。对于 D-F,比例尺 = 1 mm。缩写:svOCT = 散斑变异光学相干断层扫描;MRI = 磁共振成像。 请点击这里查看此图的较大版本.
结果
进行散斑变化光学相干断层扫描 (svOCT) 以获得大视场 (FOV) 3D 微血管图像(6 x 6mm,2 侧向 x 1 mm 深度)。为了获得这些图像,使用了先前描述的基于正交干涉仪的扫频源OCT系统23。OCT 图像是通过将两个横向相邻的 3 x 6 mm2 FOV 扫描拼接在一起获得的。每次 B 扫描由 400 次 A 扫描组成,每个位置执行 24 次(间隔 25 毫秒),以实现准确的散斑差异处理,正如我们之...
讨论
在这项工作中,我们开发了一种工作流程,可以在同一只动物中进行活体显微镜检查和临床适用的成像(CT、MRI 和 PET)。这样做的目的是通过将活体显微镜检查与临床成像方式(如MRI)的直接关联,将临床前显微镜检查结果转化为临床。尽管传统的 DSFC 设计由金属 2,3 制成,但我们通过使用由生物相容性塑料树脂制成的 3D 打印窗室,将 DSFC 调整为与 MR ...
披露声明
作者没有要披露的利益冲突。
致谢
我们感谢Carla Calçada博士(玛格丽特公主癌症中心博士后研究员)和Timothy Samuel博士(玛格丽特公主癌症中心博士生)在肿瘤细胞培养和接种方案开发方面的帮助。Kathleen 马博士、Anna Pietraszek 博士和 Alyssa Goldstein 博士(玛格丽特公主癌症中心动物研究中心)帮助制定了手术方案。雅各布·布罗斯克(医学工程技术专家,玛格丽特公主癌症中心)和韦恩·凯勒(Javelin Technologies - TriMech Group公司硬件客户主管)3D打印了窗户室。James Jonkman(大学健康网络高级光学显微镜设施)为明场和荧光显微镜图像采集提供了宝贵的指导。
材料
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
参考文献
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。