A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל עכבר גידול בתא החלון הגבי למיקרוסקופיה תוך-חיונית משולבת והדמיית תהודה מגנטית בחקר סרטן תרגומי
* These authors contributed equally
In This Article
Summary
תרגום ממצאי המיקרוסקופ התוך-חיוני מאותגר על ידי חדירת העומק הרדוד שלו לרקמה. כאן אנו מתארים מודל עכבר תא חלון גבי המאפשר רישום משותף של מיקרוסקופיה תוך חיונית ושיטות הדמיה ישימות קלינית (למשל, CT, MRI) למתאם מרחבי ישיר, מה שעשוי לייעל את התרגום הקליני של ממצאי מיקרוסקופ תוך חיוני.
Abstract
הדמיה תוך-חיונית פרה-קלינית כגון מיקרוסקופיה וטומוגרפיה קוהרנטית אופטית הוכיחו את עצמם ככלים רבי ערך בחקר הסרטן להדמיית המיקרו-סביבה של הגידול ותגובתו לטיפול. שיטות הדמיה אלה הן בעלות רזולוציה בקנה מידה מיקרוני אך השימוש בהן מוגבל במרפאה בשל עומק החדירה הרדוד שלהן לרקמה. שיטות הדמיה ישימות יותר מבחינה קלינית כגון CT, MRI ו- PET הן בעלות עומק חדירה גדול בהרבה, אך הן בעלות רזולוציה מרחבית נמוכה יחסית (קנה מידה של מ"מ).
כדי לתרגם ממצאי הדמיה תוך-חיונית פרה-קליניים למרפאה, יש לפתח שיטות חדשות כדי לגשר על פער הרזולוציה בין מיקרו למאקרו . כאן אנו מתארים מודל עכבר גידול של תא חלון אחורי מקופל עור שנועד לאפשר הדמיה פרה-קלינית, תוך-חיונית וישימה קלינית (CT ו-MR) באותה חיה, ואת פלטפורמת ניתוח התמונה המקשרת בין שתי שיטות הדמיה נפרדות אלה. חשוב לציין, גישת תא החלון המתוארת מאפשרת לרשום במשותף את אופני ההדמיה השונים בתלת-ממד באמצעות סמנים פידוקיאליים על תא החלון לצורך קונקורדנציה מרחבית ישירה. מודל זה יכול לשמש לאימות שיטות הדמיה קליניות קיימות, כמו גם לפיתוח שיטות חדשות באמצעות קשר ישיר עם "אמת קרקעית" ממצאים אינטרה-חיוניים ברזולוציה גבוהה.
לבסוף, ניתן לעקוב לאורך זמן אחר תגובת הגידול לטיפולים שונים - כימותרפיה, הקרנות, טיפול פוטודינמי - באמצעות מתודולוגיה זו באמצעות שיטות הדמיה פרה-קליניות וקליניות. מודל עכבר הגידול של תא החלון הגבי ופלטפורמות ההדמיה המתוארות כאן יכולות לשמש במגוון מחקרי סרטן, למשל, בתרגום ממצאי מיקרוסקופ תוך חיוני פרה-קליני לשיטות הדמיה ישימות יותר מבחינה קלינית כגון CT או MRI.
Introduction
מיקרו-וסקולטורה של הגידול היא מרכיב חשוב במיקרו-סביבה של הגידול שיכול להיות מטרה לטיפול וגורם מכריע בתגובה לטיפול. במסגרת הפרה-קלינית, מיקרו-כלי הדם נחקרים בדרך כלל באמצעות מיקרוסקופ תוך-חיוני במודלים אורתוטופיים או הטרוטופיים של בעלי חיים בתאי חלון 1,2. יש לכך מספר יתרונות על פני מחקרים היסטולוגיים מכיוון שההדמיה נעשית ברקמות חיות וניתן לעקוב אחר הגידול לאורך מספר שבועות או אפילו חודשים 2,3. מחקרים אלה יכולים למנף את יכולות ההדמיה ברזולוציה גבוהה של מיקרוסקופיה תוך חיונית כדי לחקור את מתן התרופות לגידול 4,5, הגורמים לעמידות לטיפול6, ואת התגובה של כלי הדם הזעירים לטיפולים כגון טיפול אנטי-אנגיוגני 7,8 והקרנות 2,9.
מיקרוסקופ תוך חיוני ממלא בבירור תפקיד חשוב במחקר סרטן פרה-קליני; עם זאת, כיצד ניתן למדוד תכונות מיקרו-סביבתיות של הגידול במרפאה? מידע מיקרו-וסקולרי יהיה שימושי במרפאה למדידת אספקת הדם וההיפוקסיה של תאי הגידול, החשובה לקביעת עמידות לטיפול בהקרנות10, כמו גם ליכולת של כלי הדם הזעירים לספק חומרים כימותרפיים לתאי הגידול הסובבים11. לדוגמה, בהקרנות, מידע מרחבי על המבנה והתפקוד של כלי הדם הזעירים של הגידול עשוי לעזור להתאים אישית את תוכנית הטיפול של המטופל על ידי התאמת לוח הזמנים של השבר או על ידי העדפת הגדלת המינון לאזורים אווסקולריים וככל הנראה היפוקסיים12.
מיקרוסקופ תוך חיוני יכול למדוד תכונות מיקרו-וסקולריות חשובות אלה מכיוון שיש לו רזולוציה גבוהה מאוד (קנה מידה של μמ '); עם זאת, חדירת העומק שלו לרקמה מוגבלת לכמה מאות מיקרונים או מילימטרים בודדים, מה שהופך לכל היותר את היישום הקליני למאתגר. ואכן, ישנם כמה יישומים חדשניים של מיקרוסקופ תוך חיוני במרפאה13; עם זאת, אלה עדיין מוגבלים לבדיקות של רקמות קרובות לפני השטח כגון עור14 או רירית / אנדותל של חללי גוף שונים באמצעות קטטרים גמישים / אנדוסקופים15,16.
בדרך כלל, כלי הדם הזעירים נחקרים באמצעות שיטות הדמיה כגון CT17 או MRI18. שיטות הדמיה קליניות אלה יכולות לדמיין לכל עומק בגוף, אך יש להן רזולוציה מרחבית נמוכה בהרבה (קנה מידה של מ"מ). לפיכך, יש צורך לגשר על פער רזולוציה זה בין מיקרוסקופ תוך-חיוני פרה-קליני לבין שיטות הדמיה קלינית כדי להביא מידע מיקרו-וסקולרי ברזולוציה גבוהה ומפורט למרפאה19. מספר שיטות הדמיה תפקודית פותחו כדי לשפר את יכולות ההדמיה המיקרו-וסקולרית של שיטות הדמיה קליניות כגון MRI ו-CT20 עם ניגודיות דינמית משופרת (DCE), ו-MRI21 של תנועה לא קוהרנטית תוך ווקסל (IVIM). עם זאת, מדובר בשיטות מבוססות מודל המספקות מדידות עקיפות של כלי הדם הזעירים ולכן יש לאמת אותן עם מדידות "אמת קרקעית" מתאימות של כלי הדם הזעירים19,22.
פיתחנו מודל עכבר של תא חלון אחורי מקופל עור (DSFC) כדי לגשר על פער זה בין מיקרוסקופ תוך-חיוני פרה-קליני לבין שיטות הדמיה ישימות קלינית כגון CT ו- MRI. DSFC מספק גישה ישירה לגידול להדמיית מיקרוסקופיה תוך חיונית ברזולוציה גבוהה דרך חלון זכוכית, אך גם הדמיה קלינית ישימה כגון MRI מכיוון שהוא עשוי מחומרים תואמי MR (פלסטיק וזכוכית). יתר על כן, קוד MATLAB כלול מבצע רישום משותף תלת-ממדי רב-מודאלי עבור מתאמים מרחביים ישירים בין מיקרוסקופיה תוך-חיונית פרה-קלינית לבין שיטות הדמיה ישימות מבחינה קלינית. כאן נתאר את התכנון והניתוח להתקנת DSFC, כמו גם את ההליך לרישום משותף של מיקרוסקופיה תוך חיונית ושיטות הדמיה ישימות מבחינה קלינית.
Protocol
כל ההליכים בבעלי חיים בוצעו בהתאם למדריך לטיפול ושימוש בחיות ניסוי שנקבע על ידי המועצה הקנדית לטיפול בבעלי חיים. הניסויים בוצעו על פי פרוטוקול שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של רשת הבריאות האוניברסיטאית בטורונטו, קנדה.
1. ציון דרך בחיסון הגידול
הערה: "ציון דרך" מתייחס לתהליך של סימון העור של העכבר כדי לציין היכן יש להזריק את תאי הגידול כדי לייעל את מיקום DSFC. הליך ציון דרך זה צריך להיעשות באותו יום או יום אחד לפני החיסון. NOD מדוכא חיסון. Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) עכבר נקבה שימש לעבודה זו.
- מרדימים את העכבר באמצעות 5% איזופלורן לאינדוקציה ו-2% איזופלורן לתחזוקה (קצב זרימת חמצן מוגדר ל-0.5 ליטר/דקה). שמור על טמפרטורת הגוף על ידי הנחת העכבר על כרית חימום עטופה במזרן כירורגי אוטוקלאב.
- הכן את העכבר לחיסון תאי הגידול על ידי גילוח ואחריו יישום של קרם רפואי להסרת שיער. הסירו היטב את הקרם להסרת השיער לאחר 30-60 שניות באמצעות מגבת נייר מעוקרת ורטובה. יש למרוח חומר סיכה וטרינרי לעיניים למניעת יובש.
- לחטא את העור עם ספוגית אלכוהול.
- יישר בעדינות את גוף העכבר והרם את העור לאורך עמוד השדרה של העכבר. בעזרת טוש כירורגי, ציירו נקודה אחת בצד אחד של העכבר במרכז עור האוהל. הנקודה צריכה להיות ממוקמת בערך במרכז עמוד השדרה החזי של העכבר.
הערה: זה יהיה המיקום הרצוי של הגידול.
2. חיסון הגידול
הערה: במחקר זה, אנו משתמשים בקו תאים אנושי לסרטן הלבלב (BxPC3). ניתן להשתמש גם בקווי תאים אחרים; עם זאת, שלבים ספציפיים של תרבית תאים עשויים להשתנות בין קווי תאים שונים. עיין בהוראות הכלולות בתאים לקבלת שינויים בהליך שלהלן.
- יש לגדל את התאים החל משבועיים לפני החיסון באמצעות מצע גדילה מלא (Roswell Park Memorial Institute 1640 בינוני עם 10% נסיוב בקר עוברי ו-1% פניצילין/סטרפטומיצין) בבקבוק של 75 מ"ל בטמפרטורה של 37°C ו-5% CO2. ודא שהתאים נשמרים בשלב הצמיחה המעריכית.
הערה: מספר המעבר צריך להיות מוגבל ל 10-15x ואת בקבוק 75 מ"ל צריך להכיל כ 6 מיליון תאים (~ 70% מפגש) בזמן החיסון. - שאפו את המדיה ושטפו את התאים עם 5 מ"ל של מלח חוצץ פוספט (PBS) ללא סידן או מגנזיום.
- יש להוסיף 5 מ"ל של חומר לפירוק תאים ולדגור בטמפרטורה של 37°C ו-5% CO2 למשך 6-7 דקות. ודא שהתאים התנתקו באמצעות מיקרוסקופ והוסף 5 מ"ל של מצע גידול שלם.
הערה: הקשה עדינה על צד הבקבוק יכולה לסייע בניתוק התאים. - מעבירים את המתלה לצינור צנטריפוגה של 15 מ"ל וצנטריפוגה ב 500 × גרם למשך 5 דקות כדי לגלול את התאים. לשאוף את התקשורת ולהשעות מחדש את התאים ב 5 מ"ל של מדיה צמיחה מלאה.
- לקבוע את ריכוז התא ואת ספירת התאים הכוללת באמצעות המוציטומטר.
- צנטריפוגה ב 500 × גרם במשך 5 דקות כדי לגלול תאים ולשאוף את התקשורת.
- בהתבסס על ספירת התאים הכוללת המתקבלת משלב 2.5, הוסף את הכמות המתאימה של מצע גידול מלא כדי להגיע לריכוז של
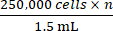 כאשר n הוא המספר הכולל של עכברים שיש לחסן. השהה מחדש את התאים.
כאשר n הוא המספר הכולל של עכברים שיש לחסן. השהה מחדש את התאים.
הערה: מספר היעד של תאים שיש לחסן לכל עכבר הוא 250,000. - העבר 1.5 מ"ל המכיל 250,000 תאים × n לתוך צינור מיקרוצנטריפוגה 1.5 מ"ל. צנטריפוגה צינור מיקרוצנטריפוגה 1.5 מ"ל ב 500 × גרם במשך 5 דקות ושאפו את התקשורת.
הערה: ניתן לשמור כל תרחיף תאים עודף באמבט מים חמים המחומם ל -37 מעלות צלזיוס כדי לשמש לחיסונים נוספים במידת הצורך. - להשעות מחדש את התאים ב 10 μL × n של PBS. הניחו את התאים על קרח כדי לקרר את התרחיף.
הערה: לאחר שהתאים התקררו על קרח, יש להזריק אותם לעכבר תוך 20 דקות. - הוסף 10 μL × n של קרום מרתף מסיס באמצעות קצות פיפטה צוננים. עומס מחטי אינסולין מקוררות של 29 מד עם 20 μL כל אחד ממתלי התא. שומרים את המזרקים על קרח.
- מרדימים את העכבר באמצעות 5% איזופלורן לאינדוקציה ו-2% איזופלורן לתחזוקה (קצב זרימת חמצן מוגדר ל-0.5 ליטר/דקה).
- הניחו את העכבר על כרית חימום עטופה במזרן ניתוחים מעוקר.
- לחטא את העור באתר ההזרקה עם ספוגית אלכוהול.
- הכנס את המחט ~ 1 ס"מ לפני נקודת ציון ולהזיז את המחט מתחת לעור עד שהיא נמצאת בנקודת הציון . מקם את הצד המשופע של המחט כלפי מעלה והזריק את 20 μL של תרחיף התא.
- המתן 45 שניות כדי לאפשר לקרום המרתף המסיס להתמצק לפני הסרת המזרק.
- הוציאו את העכבר מההרדמה, המתינו עד שהעכבר יהפוך לאמבולטורי, והחזירו אותו לכלוב שלו עם שאר העכברים.
- עקוב אחר הגידול מדי יום על ידי מישוש ולאפשר לגידול לגדול במשך 4 שבועות או עד שהגידול הוא בקוטר 4-8 מ"מ. יש להרדים את העכבר אם מתקיים אחד מהתנאים הבאים: גודל הגידול עולה על 1.5 ס"מ, גידול כיבי או כל סימן למחלה מערכתית (רדום, ירידה במשקל העולה על 20% משקל גוף תקין, אמבולציה לקויה, חוסר יכולת לווסת את טמפרטורת הגוף, אנורקסיה, יציבה כפופה, סימני כאב נראים לעין (הבעות פנים וכו ') או התייבשות).
3. ניתוח תא חלון
הערה: DSFC מורכב מארבעה חלקים המודפסים בתלת-ממד כפי שמוצג באיור 1. סכמות של כל חלק כלולות בקובץ משלים 1. כל החלקים מודפסים עם שרף פלסטיק שקוף תואם ביולוגית. מכלול תא החלון הראשי מורכב משלושה חלקים (איור 1A-C) עם טבעת סמן פידוקיאלית נוספת (איור 1D) שניתן להדביק במהלך הדמיית MRI או CT.
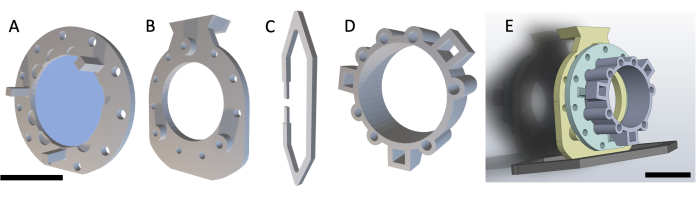
איור 1: סכמה של תא חלון קפל עור גבי. תא החלון הראשי מכיל שלושה חלקים. ראשית, (A) המסגרת הקדמית נתפרת מתחת לעור העכבר ומכילה כיסוי זכוכית המודבק באמצעות דבק UV-cured. (B) המסגרת האחורית נתפרת למסגרת הקדמית בצד החיצוני של העור. (C) תפס התמיכה מודבק לתחתית המסגרת האחורית ושומר על DSFC זקוף על גוף העכבר. (D) טבעת הסמן הפידוקיאלי מכילה שבע 'בארות' שבהן ניתן להכניס סמנים פידוקיאליים. ניתן להדביק את טבעת הסמן הפידוקיאלי על המסגרת הקדמית של DSFC באמצעות שלושת עמודי התמיכה. (E) מכלול DSFC מלא עם טבעת סמן fiducial מוצג. פסי קנה מידה = 1 ס"מ (A-D, משמאל למטה; E). קיצור: DSFC = תא חלון קיפול עור גבי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- יש לתת 1 מ"ג/ק"ג של 0.6 מ"ג/מ"ל בופרנורפין בשחרור מושהה 1-3 שעות לפני הניתוח. ודא שהעכבר הוא בעל גודל גוף ומשקל מספיקים כדי לסבול את DSFC ללא התכווצות בית החזה.
- יש לעקר את חלקי תא החלון הראשי (איור 1A-C) בחומר חיטוי נוזלי ברמה גבוהה למשך 12 דקות, ולאחר מכן להשרות באיזופרופיל אלכוהול למשך 5 דקות לפחות.
- מרדימים את העכבר באמצעות 5% איזופלורן לאינדוקציה ו-2% איזופלורן לתחזוקה (קצב זרימת חמצן מוגדר ל-0.5 ליטר/דקה).
- העבר את העכבר למזרן ניתוח סטרילי עם כרית חימום מתחת.
- יש לגלח את העכבר ולמרוח קרם רפואי להסרת שיער אם קיים שיער. לאחר 30-60 שניות, יש להסיר את הקרם להסרת שיער באמצעות מגבות נייר סטריליות ורטובות.
- יש למרוח חומר סיכה וטרינרי לעיניים למניעת יובש. יש למרוח שוב כל 30 דקות או לפי הצורך במהלך הניתוח.
- יש לחטא את העור על ידי מריחת פילינג 7.5% פובידון-יוד ושטיפה עם 70% אלכוהול איזופרופיל. הניחו לעור להתייבש באוויר.
- מרחו תמיסת 10% פובידון-יוד על העור ואפשרו לו להתייבש באוויר (איור 2A).
- החליפו את מזרן הניתוח במזרן מעוקר חדש.
- ודא שהעכבר הגיע למישור הכירורגי של ההרדמה באמצעות צביטת בוהן.
- הרימו את עור העכבר לאורך עמוד השדרה וחפשו את הגידול הגדל על אחד משני קפלי העור הרוחביים. הניחו את המסגרת האחורית של ה-DSFC (איור 2B) באותו צד של העור שהגידול גדל עליו, והקפידו למרכז את הגידול בתוך המסגרת.
- הוסיפו שלושה תפרים לכל אחד משלושת החורים העליונים של DSFC ואת המדריך הכירורגי כדי לתקן את מיקום המסגרת האחורית (איור 2B).
- הכניסו שלוש מחטים דרך המסגרת האחורית של DSFC בחורים שמכילים את הספייסרים (איור 2B).
הערה: ישנם שלושה 'ספייסרים' במסגרת האחורית של DSFC כדי לשמור על רווח בין המסגרת הקדמית והאחורית כדי להבטיח שזרימת הדם אינה מוגבלת לרקמה בתוך DSFC. הספייסרים נראים באיור 1B. - באמצעות סמן כירורגי, סמנו את שש הנקודות שבהן הספייסרים של מסגרת DSFC האחורית יהיו ממוקמים משני צידי העור (נקודות 1-6 באיור 2C,D).
הערה: המחטים המוחדרות צריכות לשמש כמדריך למיקום המדויק של נקודות אלה. - ציירו עיגול בקוטר 1 ס"מ כדי לציין את העור שיוסר בצד שממול למסגרת האחורית (איור 2D).
- הסר את המחטים ואת המסגרת האחורית מהעור על ידי חיתוך התפרים.
- חתכו את החור בקוטר 1 ס"מ בעור שסומן בשלב 3.15 באמצעות מספריים זעירים כירורגיים (איור 2E).
- הניחו את התפר הזמני כדי להצמיד את כל חלקי תא החלון לעור. הכנס תפר דרך נקודה 4, דרך החור העליון של המסגרת הקדמית של DSFC, ולאחר מכן דרך נקודה 1 בצד הנגדי של העכבר (איור 2F ושלבים 1-2 באיור משלים S1).
- השחילו את התפר דרך עמוד התמיכה העליון של המסגרת האחורית ואז חזרה דרך עמוד התמיכה במסגרת האחורית הקרובה ביותר לראש העכבר (איור 2F).
- הכנס את התפר דרך נקודה 2. לאחר מכן, השחילו את התפר דרך החור המתאים במסגרת הקדמית (איור 2G ושלב 3 באיור משלים S1).
- מתוך העור, השחילו את התפר דרך נקודה 6 כפי שמצוין באיור 2H ושלבים 3-4 באיור משלים S1.
- השחילו את התפר דרך נקודה 5 כפי שמצוין באיור 2I ושלב 4 באיור משלים S1.
- הביאו את התפר דרך המסגרת הקדמית, נקודה 3, ולאחר מכן דרך המסגרת האחורית כפי שמצוין באיור 2J ושלב 5 באיור משלים S1.
- החזירו את התפר דרך נקודה 1, המסגרת הקדמית של DSFC, ואז החוצה דרך נקודה 4 כפי שמצוין באיור 2K ושלב 6 באיור משלים S1.
- הדקו את כל המכלול עם התפר הזה והחליקו את המסגרת הקדמית מתחת לעור דרך החור שנוצר בשלב 3.17 (איור 2L,M).
- קשרו את שני הקצוות של תפר זה יחד וחתכו כל חוט עודף.
- בצע תפרים קבועים דרך החורים סביב היקף המסגרת הקדמית והאחורית של DSFC. תפרו את שתי המסגרות יחד בתבנית שמוצגת באיור 2N ובאיור משלים S2.
- חותכים ומסירים את התפר הזמני.
- הצמידו את תפס התמיכה למסגרת האחורית של DSFC על-ידי החלקתו לתוך הבליטה מהמסגרת האחורית (איור 2O).
הערה: תמונה של העכבר שבועיים לאחר הניתוח מוצגת באיור 2P,Q. תפס התמיכה משמש כדי לשמור על DSFC זקוף על העכבר כדי להפחית מתח ואי נוחות בעור. - מתן 5 מ"ג/ק"ג משקל גוף Meloxicam, תרופה נוגדת דלקת לא סטרואידית, תת עורית להפחתת כאב ודלקת.
- הוציאו את העכבר מההרדמה, המתינו עד שהעכבר יהפוך לאמבולטורי, והחזירו אותו לכלוב שלו.
- בדוק את העכבר 2-3 שעות לאחר הניתוח ולאחר מכן מדי יום במשך שבוע אחד לפחות. שקול את נקודת הסיום שהושגה חודשיים לאחר ניתוח חדר החלון או אם אחד התנאים בשלב 2.17 מתקיימים (המוקדם מביניהם).
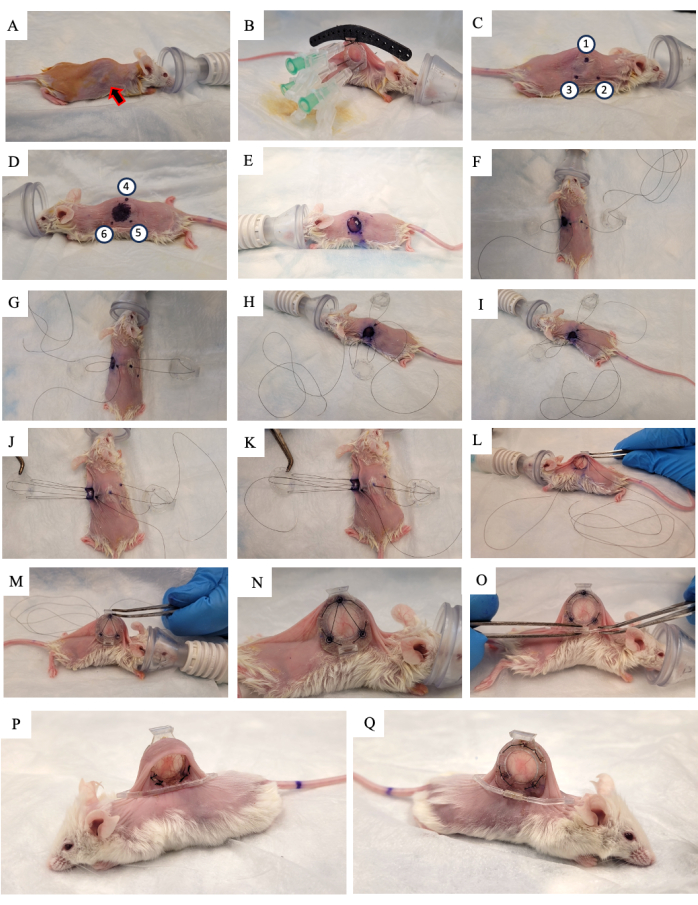
איור 2: הליך ניתוח DSFC. (A) העכבר מוכן לניתוח על-ידי הסרת השיער וחיטוי העור. הגידול התת עורי מסומן על ידי החץ. (B) המסגרת האחורית מונחת במקום המתאים ומאובטחת על ידי שלושה מזרקים וכן תפרים זמניים המודבקים למדריך הכירורגי השחור. (ג,ד) מיקומי הספייסר (נקודות 1-6) והחור מסומנים משני צידי העור. (E) העור מוסר. (פ-ק) תפר זמני מושחל דרך שתי שכבות העור, המסגרת הקדמית והאחורית של DSFC כדי לאבטח את כל החלקים יחד. (יב,ז) התפר הזמני מהודק, והמסגרת הקדמית מוחדרת מתחת לעור. (N) שמונה תפרים קבועים ממוקמים כדי לאבטח את DSFC. (O) לבסוף, התפר הזמני מוסר, ואת תפס התמיכה מחובר. (פ,כ) אותו עכבר מוצג שבועיים לאחר הניתוח משני הצדדים. קיצור: DSFC = תא חלון קיפול עור גבי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הדמיה אופטית
- לאפשר לעכבר להחלים ולדלקת לרדת לפחות 5 ימים לאחר הניתוח לפני ההדמיה.
- מרדימים את העכבר באמצעות 5% איזופלורן לאינדוקציה ו-2% איזופלורן לתחזוקה (קצב זרימת חמצן מוגדר ל-0.5 ליטר/דקה).
- יש למרוח חומר סיכה וטרינרי לעיניים למניעת יובש. יש למרוח שוב כל 30 דקות או לפי הצורך.
- אבטח את העכבר בשלב הדמיה באמצעות חיבור גז להרדמה כפי שמוצג באיור משלים S3.
- קבל תמונה במיקרוסקופ שדה ראייה רחב (>1.5 ס"מ רוחב) של brightfield. ודא שדיווטי הסמן הפידוקיאלי במסגרת הקדמית של DSFC גלויים.
הערה: ישנם שבעה דיווטים סביב היקף הזכוכית במסגרת הקדמית המתיישרים עם שבע בארות הסימון הפידוקיאליות בחיבור טבעת הסמן הפידוקיאלי. הדיבות האלה נראות באיור 1A. - באותו יום, קבל תמונה microvascular באמצעות שיטת מיקרוסקופיה intravital של בחירה. השתמש באותו שלב הדמיה משלב 4.4 (איור משלים S3) לשם כך. הוציאו את העכבר מההרדמה, המתינו עד שהעכבר יהפוך לאמבולטורי, והחזירו אותו לכלוב שלו.
הערה: אנו משתמשים בטומוגרפיה קוהרנטית אופטית של שונות כתמים (svOCT) עבור תמונות מיקרו-וסקולריות תלת-ממדיות ברזולוציה גבוהה.
5. הדמיית תהודה מגנטית
- הניחו את כלוב העכבר מתחת למנורת חום כדי לחמם את העכברים למשך כ-15 דקות לפני שאתם מרדימים את העכבר.
הערה: חימום מקדם הרחבת כלי דם, אשר יסייע במיקום קטטר ורידי הזנב. - מרדימים את העכבר באמצעות 5% איזופלורן לאינדוקציה ו-2% איזופלורן לתחזוקה (קצב זרימת חמצן מוגדר ל-0.5 ליטר/דקה).
- רשום את משקל העכבר באמצעות סולם אלקטרוני למינון נכון של תרופות.
הערה: למדידות מדויקות של משקל הגוף, הקפד להפחית את משקל מכלול DSFC (0.83 גרם). - הניחו את העכבר על מיטת ה-MRI ומרחו חומר סיכה וטרינרי לעיניים למניעת יובש.
- שמור על טמפרטורת הגוף של העכבר באמצעות דוד שמש ומערכת משאבה.
- מקם כרית ניטור נשימתי מתחת לסרעפת של העכבר ושמור על 30 ± 5 נשימות לדקה.
- אם אתה משתמש בחומר ניגוד, הכנס מחט פרפר 27 G לווריד הזנב עם microtubing מחובר (30 μL של נפח מת ממולא מראש עם 1% תמיסת מלח הראפין). הצמידו את המחט והמיקרו-אבובינג למיטת ה-MRI בעזרת סרט ניתוח.
- אבטח את תא החלון ב'התקן אימוביליזציה' מודפס בתלת-ממד כפי שמוצג באיור 3.
- באמצעות מחט 18 גרם, להזריק חומר סיכה וטרינרי לעין לתוך שבעת הצינורות על סמן fiducial MRI.
- הצמידו את הסמן הפידוקיאלי ל-DSFC על-ידי יישור שלושת המחברים המרובעים לשלושת העמודים הבולטים מהמסגרת הקדמית (איור 3).
- חבר את צנתר ורידי הזנב לקו אספקת התרופות והמזרק במשאבה האוטומטית. הכנס את המיטה לסורק MRI פרה-קליני 7-tesla.
- קבל ערכות תמונה משוקללות T2 (T2w) קורונליות וציריות כדי להמחיש את מישור תא החלון (זמן הד TE = 25 אלפיות השנייה; זמן חזרה TR = 2,500 אלפיות השנייה; שדה ראייה של 40 x 40 מ"מ עם מטריצה של 64 x 64 עבור רזולוציה של 0.5 x 0.5 מ"מ במישור; עובי פרוסה של 0.5 מ"מ; 25 שניות). רשום סט משוקלל T2 קשת (TE = 25 אלפיות השנייה; TR = 2,500 אלפיות השנייה; שדה ראייה של 32 x 32 מ"מ עם מטריצה של 128 x 128 עבור רזולוציה של 0.25 x 0.25 מ"מ במישור; לפחות 11 פרוסות הדמיה; עובי פרוסה 0.5 מ"מ; 87 שניות), המסובבות לאחר מכן למישור DSFC וסמנים פידוקיאליים, בהתבסס על התצוגות העטרה והציריות, כפי שמוצג באיור 4. כוונו מחדש באופן איטרטיבי ומקמו את ערכת הקשת עד שפרוסות ההדמיה מיושרות במלואן, כך שפרוסה 5 מכילה באופן מלא אות רקמה ב-DSFC ופרוסה 6 אינה מכילה אות רקמה ב-DSFC.
- בצע הדמיה מיקרו-וסקולרית בשיטת MRI מיקרו-וסקולרית לפי בחירתך.
הערה: עבור רכישות MR מיקרו-וסקולריות, אין צורך לצלם את פרוסות הסמן הפידוקיאלי מכיוון שהתמונות נרכשות באותה מסגרת התייחסות של הדמיה כמו תמונות הרישום T2w.- רכוש את כל הרכישות המפורטות בשלבים 5.12 ו- 5.13 בשדה ראייה של 32 x 32 מ"מ עם מטריצה של 64 x 64 עבור רזולוציה של 0.5 x 0.5 מ"מ במישור. עבור כל רכישות MRI, השתמש בפעימות RF עקביות כדי לשפר את העקביות הגיאומטרית דרך מישור (עירור sinc; מיקוד מחדש sinc3; רוחב פס של 2,484 הרץ).
- להדמיית DCE:
- אם רוצים מדידות של ריכוז גדוליניום, השג מפות T1 באמצעות תמונות דו-ממדיות-נדירות שנרכשו בזמני חזרה משתנים (TE = 7 אלפיות השנייה; גורם נדיר = 2; TR = 350, 500, 750, 1,000, 1,500, 2,500 ו- 4,000 אלפיות השנייה; 8 דקות 28 שניות).
- בצע הדמיה בסדרת זמן באמצעות תמונות נדירות דו-ממדיות (TE = 8.1 אלפיות השנייה; גורם נדיר = 2; TR = 200 אלפיות השנייה; זווית היפוך = 90°; רזולוציה זמנית = 12.8 שניות; 188 חזרות; זמן ניטור כולל = 40 דקות 6 שניות).
- יש להזריק משקל גוף של 0.75 mmol / kg Gadobutrol מעל 10 שניות דרך וריד הזנב לאחר השלמת חמש חזרות תמונה באמצעות משאבת מזרק אוטומטית תואמת MR.
- עבור IVIM MRI:
- בצע הדמיה משוקללת דיפוזיה עם ערכי B הבאים: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1,000 s/mm2 עם שלושה ממוצעים של B = 0 s/mm2 ודגימה איזוטרופית (TE = 16 ms; TR = 800 אלפיות השנייה; משך הדרגתי = 2.2 אלפיות השנייה; הפרדת שיפוע = 9 אלפיות השנייה; 61 דקות).
הערה: הדמיה משוקללת דיפוזיה נרכשת באמצעות קריאת התמרת פורייה דו-ממדית, במקום באמצעות הדמיה אקו-מישורית מועדת לעיוותים, כדי להבטיח עקביות גיאומטרית של הגידול ואותות הרקמה הסובבים אותו בתוך DSFC על פני ערכות התמונות ועם תמונות המיקרוסקופ התוך-חיוני.
- בצע הדמיה משוקללת דיפוזיה עם ערכי B הבאים: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1,000 s/mm2 עם שלושה ממוצעים של B = 0 s/mm2 ודגימה איזוטרופית (TE = 16 ms; TR = 800 אלפיות השנייה; משך הדרגתי = 2.2 אלפיות השנייה; הפרדת שיפוע = 9 אלפיות השנייה; 61 דקות).
- הוציאו את העכבר מההרדמה, המתינו עד שהעכבר יהפוך לאמבולטורי, והחזירו אותו לכלוב שלו.
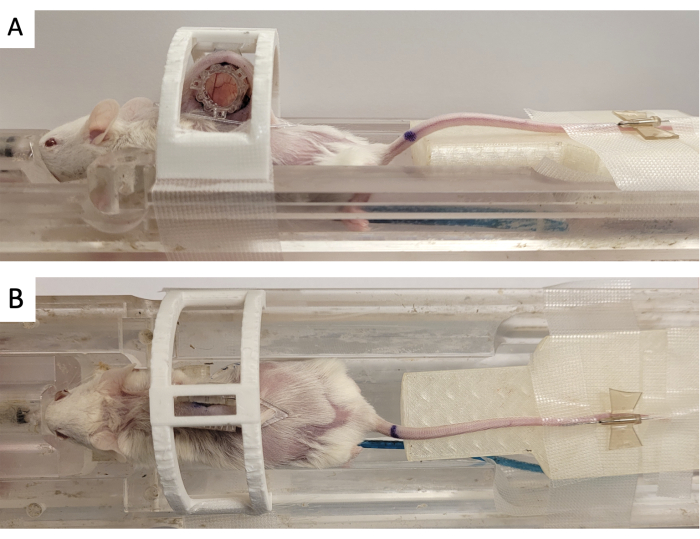
איור 3: הגדרת הדמיית MR DSFC. (A) מבט צדדי ו-(B) מבט עליון של העכבר הממוקם על מיטת ה-MRI כאשר DSFC מאובטח ומשותק. לעכבר יש צנתר ורידים זנב להזרקת חומר ניגוד וטבעת היצרן הפידוקית מוצמדת למסגרת הקדמית של DSFC. קיצורים: DSFC = תא חלון קיפול עור גבי; MR = הדמיית תהודה מגנטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
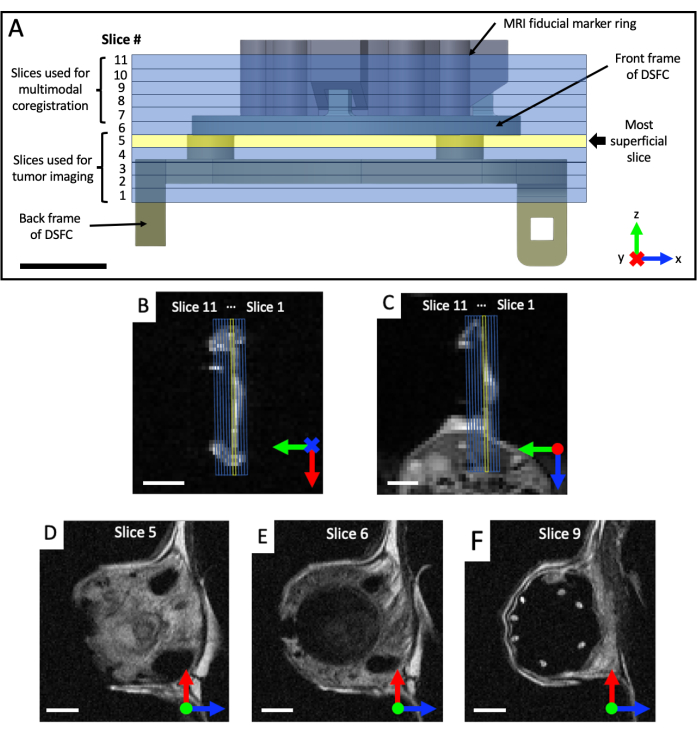
איור 4: מיקומי פרוסות MRI ביחס לסמנים פידוקיאליים ולתא החלון. (A) דיאגרמה של DSFC עם חיבור טבעת סמן פידוקיאלי עם 11 פרוסות MRI שכבת-על. יש לרכוש מספר תמונות משוקללות T2 כדי להבטיח שהפרוסות מיושרות כהלכה עם DSFC והרקמה. (ב,ג) מיקום נכון של 11 הפרוסות ביחס לרקמה ב- DSFC מכיוונים שונים. (D) פרוסה 5 היא הפרוסה השטחית ביותר שבה יבוצע ניתוח מתאם בין-מודאלי. (E) פרוסה 6 אינה מכילה אות רקמה המציין שהיא מיושרת כראוי עם DSFC. (F) לבסוף, 7 הסמנים הפידוקיאליים נראים בבירור בפרוסה 9. מוטות קנה מידה = 5 מ"מ. 'X' על הציר מציין שהציר נכנס לדף ועיגול מציין שהציר יוצא מהדף. קיצורים: DSFC = תא חלון קיפול עור גבי; MRI = הדמיית תהודה מגנטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. רישום משותף של MRI למיקרוסקופ תוך חיוני
- ב- MATLAB, פתחו את קובץ Multimodal_Image_Register.m הכלול בקובץ משלים 2.
- בסביבת העבודה, יש להעמיס את התמונה המיקרו-וסקולרית (איור 5A), את תמונת המיקרוסקופ brightfield (איור 5B) ואת נתוני ה-MRI המיקרו-וסקולרי (מפות פרמטרים של IVIM ו/או DCE MRI).
- לחץ על לחצן הפעל .
- באמצעות מאתר הקבצים הנפתחים, נווט אל הקובץ המכיל את פרוסות T2w MRI.
- בחרו עד ארבע פרוסות MRI T2w שמציגות בבירור את הסמנים הפידוקיאליים (איור 5C).
- יוצג ממשק משתמש המציג את תמונת המיקרוסקופ (איור 5B) ואת פרוסות ה-MRI T2w בעלות ממוצע העומק (איור 5C). מקמו נקודה על כל אחד משבעת הסמנים הפידוקיאליים בתמונת ה-MRI והתאימו אותם לנקודה המתאימה להם בתמונת המיקרוסקופ (סמנים פידוקיאליים מסתובבים סביב היקף הזכוכית במסגרת הקדמית של DSFC) כפי שמצוין בנקודות הירוקות באיור 5B,C.
- סגור את החלון.
- איור המכיל את תמונות ה-MRI והמיקרוסקופיה בשכבת-על יסייע בהערכת איכות הרישום בין שני מערכי הנתונים. אם הרישום מתאים, המשך את הקוד על ידי הקלדת y ולאחר מכן הקשה על Enter בחלון הפקודה. אחרת, נסה שוב שלב זה על-ידי הקלדת n בחלון הפקודה והקשה על Enter.
הערה: רישום משותף מוצלח של ערכת נתוני MRI עם תמונת המיקרוסקופ פירושו ששבעת הסמנים הפידוקיאליים הבהירים ממערך הנתונים של MRI ממורכזים ומוכלים במלואם בתוך הדיווטים המתאימים שלהם במסגרת הקדמית של DSFC. - יוצג ממשק משתמש המציג את תמונת המיקרוסקופ (איור 5B) ואת מערך הנתונים של הדמיה מיקרו-וסקולרית svOCT (איור 5A). בחר לפחות שלוש נקודות ציון דרך מיקרו-וסקולריות בתמונה המיקרו-וסקולרית svOCT ואת הנקודות המתאימות בתמונת המיקרוסקופ כפי שמצוין על-ידי הנקודות הכחולות באיור 5A,B.
- סגור את החלון.
- איור המכיל את svOCT שכבת-על ותמונות מיקרוסקופיה יופיע כדי לסייע בהערכת איכות הרישום המשותף בין שני מערכי הנתונים. אם הרישום מתאים, המשך את הקוד על ידי הקלדת y ולאחר מכן הקשה על Enter בחלון הפקודה. אחרת, נסה שוב שלב זה על-ידי הקלדת n בחלון הפקודה והקשה על Enter.
הערה: רישום משותף מוצלח של ערכת הנתונים svOCT עם תמונת המיקרוסקופ פירושו שהכלים משני מערכי הנתונים מכוסים בצורה מושלמת זה עם זה. - סגור את החלון.
- לאחר מכן תופיע תמונת המיקרו-קופי הרשומה במשותף. מיתאר את הגידול בתמונה זו.
- סגור את החלון.
- לאחר מכן יוצגו מספר דמויות: מערך הנתונים המיקרו-וסקולרי svOCT (איור 5D), תמונת המיקרוסקופ הרשום במשותף (איור 5E), ומפות פרמטרי MRI הרשומות במשותף (איור 5F). שמור את המפות לניתוח מאוחר יותר.
הערה: מפות ה-MRI המוצגות מוגבלות לקווי המתאר של הגידול שצוירו על-ידי המשתמש (איור 5F).
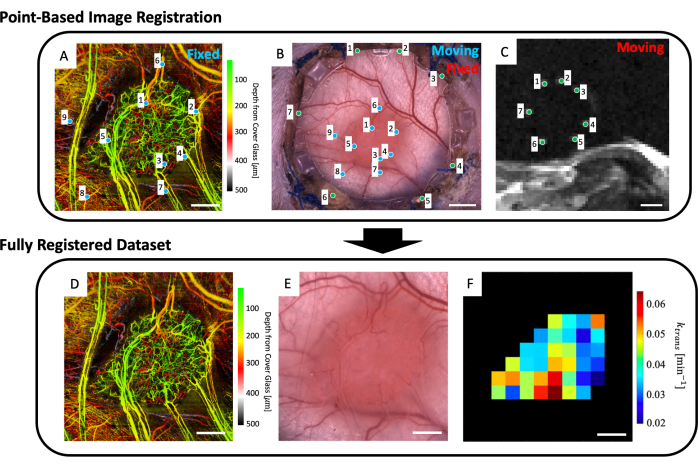
איור 5: רישום משותף מבוסס נקודות רב-מודאליות. (A) ערכת נתונים svOCT מיקרו-וסקולרית בקידוד עומק צבע; סרגל קנה מידה = 1 מ"מ. (B) תמונת מיקרוסקופ ברייטפילד של תא החלון; סרגל קנה מידה = 2 מ"מ. (C) ממוצע של פרוסות MRI T2w 8-11 המציגות את שבעת הסמנים הפידוקיאליים הכלולים בטבעת הסמן הפידוקיאלי; סרגל קנה מידה = 5 מ"מ. (C) ראשית, ערכת הנתונים 'נעה' של T2w MRI נרשמת במשותף לתמונת המיקרוסקופ 'הקבועה' של ברייטפילד באמצעות הסמנים הירוקים שהוזנו על-ידי המשתמש בשתי ערכות התמונות. לאחר מכן, תמונת המיקרוסקופ 'הנע' של שדה הבהיר ותמונת MRI הרשומה במשותף נרשמות במשותף ל'מערך הנתונים הקבוע של svOCT' באמצעות הסמנים הכחולים ב- A ו - B. מערך הנתונים הסופי שנרשם במשותף כולל את (D) svOCT, (E) תמונת מיקרוסקופ שדה בהיר ו-(F) מפת פרמטרים פונקציונלית של MRI. הווקסלים השחורים ב-F נמצאים מחוץ לגידול ולכן אינם נלקחים בחשבון בניתוח. עבור D-F, סרגל קנה מידה = 1 מ"מ. קיצורים: svOCT = טומוגרפיה קוהרנטית אופטית של שונות נקודתית; MRI = הדמיית תהודה מגנטית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
טומוגרפיית קוהרנטיות אופטית של שונות כתמים (svOCT) בוצעה כדי לקבל תמונות מיקרו-וסקולריות תלת-ממדיות של שדה ראייה גדול (FOV) (6 x 6 מ"מ,2 רוחבי x 1 מ"מ עומק). כדי להשיג תמונות אלה, נעשה שימוש במערכת OCT מקור סחף שתוארה קודם לכן, המבוססת על אינטרפרומטר ריבועי23. תמונות OCT נרכשו על ידי תפי?...
Discussion
בעבודה זו, פיתחנו זרימת עבודה לביצוע הן במיקרוסקופ תוך חיוני והן בדימות קליני (CT, MRI ו- PET) באותה חיה. זאת, במטרה לתרגם את ממצאי המיקרוסקופ הפרה-קליני למרפאה על ידי התאמה ישירה של מיקרוסקופ תוך-חיוני עם שיטות הדמיה קליניות כגון MRI. למרות שעיצובי DSFC קונבנציונליים עשויים ממתכת 2,3,...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לד"ר קרלה קלסדה (פוסט-דוקטורנטית, מרכז הסרטן ע"ש הנסיכה מרגרט) ולד"ר טימותי סמואל (דוקטורנט, מרכז הסרטן ע"ש הנסיכה מרגרט) על עזרתם בגידול תאי גידול ופיתוח פרוטוקול חיסון. ד"ר קתלין מא, ד"ר אנה פייטרשק וד"ר אליסה גולדשטיין (המרכז לחקר בעלי חיים, מרכז הסרטן על שם הנסיכה מרגרט) סייעו בפיתוח פרוטוקול ניתוח. ג'ייקוב ברוסקה (טכנולוג הנדסה רפואית, מרכז הסרטן ע"ש הנסיכה מרגרט) וויין קלר (מנהל לקוחות חומרה, Javelin Technologies – חברה מקבוצת TriMech) הדפיסו בתלת-ממד את תאי החלונות. ג'יימס יונקמן (Advanced Optical Microscopy Facility, University Health Network) סיפק הדרכה רבת ערך לרכישת תמונות במיקרוסקופ ברייטפילד ופלואורסצנטי.
Materials
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
References
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved