このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
トランスレーショナルがん研究における生体内顕微鏡検査と磁気共鳴画像法の併用のための背側Skinfold Window Chamber腫瘍マウスモデル
* これらの著者は同等に貢献しました
要約
生体内顕微鏡所見の翻訳は、組織への深さの浸透が浅いという課題があります。ここでは、生体内顕微鏡と臨床的に適用可能な画像モダリティ(CT、MRIなど)の同時登録を可能にし、直接的な空間相関を実現し、生体内顕微鏡所見の臨床翻訳を効率化する可能性のある背側窓室マウスモデルについて説明します。
要約
顕微鏡法や光干渉断層撮影法などの前臨床生体内イメージングは、がん研究において、腫瘍の微小環境とその治療に対する反応を視覚化するための貴重なツールであることが証明されています。これらのイメージングモダリティはミクロンスケールの解像度を持っていますが、組織への浸透深さが浅いため、クリニックでの使用は限られています。CT、MRI、PET などのより臨床的に適用可能な画像モダリティは、浸透深度がはるかに大きくなりますが、空間分解能 (mm スケール) は比較的低くなります。
前臨床の生体内イメージング所見を臨床に変換するには、この ミクロからマクロへの 解像度のギャップを埋める新しい方法を開発する必要があります。ここでは、前臨床の生体内 イメージングと 臨床的に適用可能な(CTおよびMR)イメージングを同じ動物で可能にするように設計された背側スキンフォールドウィンドウチャンバー腫瘍マウスモデルと、これら2つの異なる視覚化方法をリンクする画像解析プラットフォームについて説明します。重要なことに、説明されたウィンドウチャンバーアプローチにより、ウィンドウチャンバー上の基準マーカーを使用して、さまざまなイメージングモダリティを3Dで共登録し、直接的な空間的一致を実現できます。このモデルは、既存の臨床イメージング法の検証だけでなく、「グラウンドトゥルース」高解像度の生体内所見との直接的な相関による新しい画像法の開発にも使用できます。
最後に、さまざまな治療(化学療法、放射線療法、光線力学療法)に対する腫瘍反応は、前臨床および臨床的に適用可能な画像診断法を使用して、この方法論で縦断的に監視できます。したがって、ここで説明する背側スキンフォールドウィンドウチャンバー腫瘍マウスモデルおよびイメージングプラットフォームは、例えば、前臨床の生体内顕微鏡所見をCTやMRIなどのより臨床的に適用可能なイメージングモダリティに変換するなど、さまざまながん研究に使用できます。
概要
腫瘍微小血管系は、腫瘍微小環境の重要な構成要素であり、治療の標的および治療反応の決定要因となる可能性があります。前臨床の場では、微小血管系は通常、同所性または異所性の窓室動物モデル1,2で生体内顕微鏡を用いて研究されます。これは、イメージングが生きた組織で行われ、腫瘍を数週間または数か月にわたって縦断的に監視できるため、組織学的研究に比べていくつかの利点があります2,3。これらの研究では、生体内顕微鏡の高解像度イメージング機能を活用して、腫瘍4,5への治療薬の送達、治療抵抗性の原因6、および抗血管新生治療7,8や放射線療法2,9などの治療に対する微小血管の反応を研究することができます。
生体内顕微鏡検査は、前臨床がん研究において明らかに重要な役割を果たしています。しかし、腫瘍の微小環境の特徴を臨床でどのように測定できますか?微小血管情報は、放射線療法10における治療抵抗性を決定するために重要な血液供給および腫瘍細胞低酸素症を測定するために診療所で有用であり、また、微小血管系が周囲の腫瘍細胞11に化学療法剤を送達する能力も有用である。例えば、放射線療法では、腫瘍微小血管系の構造および機能に関する空間情報は、分割スケジュールを調整するか、または無血管領域およびおそらく低酸素領域12への線量を優先的に増やすことにより、患者の治療計画を個別化するのに役立つ可能性がある。
生体内顕微鏡は、非常に高い解像度(μmスケール)を備えているため、これらの重要な微小血管の特徴を測定できます。しかし、その組織への浸透深さは数百ミクロンから数ミリメートルに限られており、臨床実装は困難である。実際、クリニックでは生体内顕微鏡検査のいくつかの新しいアプリケーションがあります13;しかし、これらは依然として、軟性カテーテル/内視鏡15,16を介した皮膚14や様々な体腔の粘膜/内皮内層などの表面近傍組織の検査に限定されている。
より一般的には、微小血管系は、CT17 や MRI18 などの画像診断法を使用して研究されます。これらの臨床画像診断法は、体内の任意の深さまでイメージングできますが、空間分解能(mmスケール)ははるかに低くなっています。したがって、前臨床の生体内顕微鏡検査と臨床画像診断法との間のこの解像度のギャップを埋めて、高解像度で詳細な微小血管情報を臨床に取り込む必要があります19。動的造影(DCE)MRIおよびCT20、およびイントラボクセルインコヒーレントモーション(IVIM)MRI21などの臨床イメージングモダリティの微小血管イメージング機能を改善するために、いくつかの機能イメージング法が開発されています。しかし、これらは微小血管系の間接的な測定を提供するモデルベースの方法であり、したがって、微小血管系の適切な「グラウンドトゥルース」測定で検証されなければならない19,22。
私たちは、前臨床の生体内顕微鏡検査とCTやMRIなどの臨床的に適用可能な画像診断法との間のこのギャップを埋めるために、背側皮膚折り窓チャンバー(DSFC)腫瘍マウスモデルを開発しました。DSFCは、ガラス窓から高解像度の生体内顕微鏡イメージングのために腫瘍に直接アクセスすることができますが、MR適合材料(プラスチックやガラス)でできているため、MRIなどの臨床的に適用可能なイメージングも可能です。さらに、付属の MATLAB コードは、前臨床の生体内顕微鏡検査と臨床的に適用可能なイメージングモダリティとの間の直接的な空間的相関のためのマルチモダリティ 3D 共レジストレーションを実行します。ここでは、DSFCをインストールするための設計と手術、および生体内顕微鏡と臨床的に適用可能なイメージングモダリティを同時登録する手順について説明します。
プロトコル
すべての動物処置は、カナダ動物管理評議会が定めた実験動物の手引きに従って行われました。実験は、カナダのトロントにあるUniversity Health Network Institutional Animal Care and Use Committeeによって承認されたプロトコルに従って行われました。
1.腫瘍接種のランドマーク
注:「ランドマーク」とは、DSFCの配置を最適化するために腫瘍細胞を注入する場所を示すために、マウスの皮膚にマーキングするプロセスを指します。この画期的な手続きは、接種と同じ日または1日前に行う必要があります。免疫不全のNOD。この作業には、Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) メスマウスを使用しました。
- 導入には5%イソフルラン、維持には2%イソフルランを使用してマウスに麻酔をかけます(酸素流量は0.5 L / minに設定)。オートクレーブ滅菌された手術用マットで包まれた加熱パッドにマウスを置いて、体温を維持します。
- 腫瘍細胞の接種のためにマウスを髭剃り、続いて医療用脱毛クリームを塗布して準備します。30〜60秒後に、濡れた滅菌済みペーパータオルを使用して脱毛クリームを完全に取り除きます。乾燥を防ぐために獣医用アイローションを塗布してください。
- アルコール綿棒で皮膚を消毒します。
- マウスの体をそっとまっすぐにし、マウスの背骨に沿って皮膚を持ち上げます。外科用マーカーを使用して、テントを張った皮膚の中央にあるマウスの片側に1つの点を描きます。ポイントは、マウスの胸椎のほぼ中央に配置する必要があります。
注:これが腫瘍の望ましい位置になります。
2. 腫瘍接種
注:この研究では、ヒト膵臓がん細胞株(BxPC3)を使用しています。他の細胞株も使用できます。ただし、特定の細胞培養ステップは、細胞株によって異なる場合があります。以下の手順の変更については、セルに付属の説明書を参照してください。
- 接種の2週間前に、完全な増殖培地(ロズウェルパークメモリアルインスティテュート1640培地、10%ウシ胎児血清および1%ペニシリン/ストレプトマイシンを含む培地)を75mLフラスコ、37°C、5%CO2で使用して細胞を増殖させます。細胞が指数関数的成長期に維持されていることを確認してください。
注:継代回数は10〜15倍に制限し、75mLフラスコには接種時に約600万個の細胞(~70%のコンフルエンス)が含まれている必要があります。 - 培地を吸引し、カルシウムやマグネシウムを含まない5 mLのリン酸緩衝生理食塩水(PBS)で細胞を洗浄します。
- 5 mLの細胞解離剤を加え、37°Cおよび5%CO2 で6〜7分間インキュベートします。顕微鏡で細胞が剥離したことを確認し、5 mLの完全増殖培地を添加します。
注:フラスコの側面を軽くたたいてると、細胞を取り外すのに役立ちます。 - 懸濁液を15mLの遠心チューブに移し、500 × g で5分間遠心分離して細胞をペレット化します。培地を吸引し、細胞を5 mLの完全増殖培地に再懸濁します。
- 血球計算盤を使用して、細胞濃度と総細胞数を決定します。
- 500 × g で5分間遠心分離し、細胞をペレット化し、培地を吸引します。
- ステップ2.5から得られた総細胞数に基づいて、適切な量の完全増殖培地を添加して、
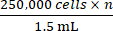 の濃度に達します( n は接種するマウスの総数)。セルを再懸濁します。
の濃度に達します( n は接種するマウスの総数)。セルを再懸濁します。
注:マウス1匹あたりの接種細胞数は250,000個を目標としています。 - 250,000個の 細胞を含む1.5mLを× n の1.5mLに1.5mLの微量遠心チューブに移します。1.5 mLの微量遠心チューブを500 × g で5分間遠心分離し、培地を吸引します。
注:余分な細胞懸濁液は、必要に応じて追加の接種に使用するために、37°Cに温めた温水浴に保管することができます。 - 細胞をPBSの10 μL × n に再懸濁します。細胞を氷の上に置いて懸濁液を冷却します。
注:細胞を氷の上で冷やした後、20分以内にマウスに注入する必要があります。 - 冷やしたピペットチップを使用して、10 μL × n の可溶化基底膜を添加します。冷やした29ゲージのインスリン針に、各細胞懸濁液20μL をロードします。注射器を氷の上に置いてください。
- 導入には5%イソフルラン、維持には2%イソフルランを使用してマウスに麻酔をかけます(酸素流量は0.5 L / minに設定)。
- 滅菌された手術マットで包まれた加熱パッドにマウスを置きます。
- 注射部位の皮膚をアルコール綿棒で消毒します。
- 目印のポイントの手前~1cmに針を挿入し、目印になるまで針を皮の下に移動します。針の斜角側を上向きに置き、20 μLの細胞懸濁液を注入します。
- シリンジを取り外す前に、可溶化した基底膜が固まるまで45秒待ちます。.
- マウスを麻酔から外し、マウスが歩行可能になるまで待ってから、他のマウスと一緒にケージに戻します。
- 触診で腫瘍を毎日監視し、腫瘍を4週間または腫瘍の直径が4〜8 mmになるまで成長させます。腫瘍の大きさが1.5cmを超える、潰瘍性腫瘍、または全身性疾患の兆候(無気力、体重減少が正常体重の20%を超える、歩行障害、体温調節ができない、食欲不振、猫背の姿勢、目に見える痛みの兆候(顔の表情など)または脱水症)のいずれかの条件が満たされた場合、マウスを安楽死させます。
3.ウィンドウチャンバー手術
注:DSFCは、図1に示すように、4つの3Dプリントパーツで構成されています。各部品の回路図は、補足ファイル1に含まれています。すべてのパーツは、生体適合性のある透明なプラスチック樹脂で印刷されています。メインウィンドウチャンバーアセンブリは、MRIまたはCTイメージング中に貼り付けることができる追加の基準マーカーリング(図1D)を備えた3つの部分(図1A-C)で構成されています。
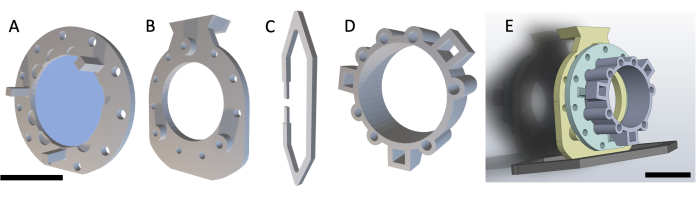
図1:背側のスキンフォールドウィンドウチャンバーの概略図。メインウィンドウチャンバーには3つの部分があります。まず、(A)フロントフレームをマウスの皮膚の下に縫合し、UV硬化型接着剤を使用して貼り付けたガラスカバースリップを含んでいます。(B)バックフレームは、皮膚の外側でフロントフレームに縫合されます。(C)サポートクリップはバックフレームの下部に取り付けられ、DSFCをマウス本体に直立させます。(D)フィデューシャルマーカーリングには、フィデューシャルマーカーを挿入できる7つの「ウェル」が含まれています。フィデューシャルマーカーリングは、3本の支柱を使用してDSFCのフロントフレームに取り付けることができます。(E)フィデューシャルマーカーリングを備えた完全なDSFCアセンブリが示されています。スケールバー= 1 cm(A-D、左下;略語:DSFC = 背側スキンフォールドウィンドウチャンバー。この図の拡大版を表示するには、ここをクリックしてください。
- 手術の1〜3時間前に1 mg / kgの0.6 mg / mL徐放性ブプレノルフィンを皮下投与します。.マウスが胸部狭窄なしにDSFCに耐えるのに十分な体のサイズと体重であることを確認してください。
- メインウィンドウチャンバー部品(図1A-C)を高レベル液体消毒剤で12分間滅菌した後、イソプロピルアルコールに少なくとも5分間浸します。
- 導入には5%イソフルラン、維持には2%イソフルランを使用してマウスに麻酔をかけます(酸素流量は0.5 L / minに設定)。
- マウスを滅菌マットに移し、その下に加熱パッドを付けます。
- マウスを剃り、髪の毛がある場合は医療用脱毛クリームを塗ります。30〜60秒後、滅菌した濡れたペーパータオルを使用して脱毛クリームを取り除きます。
- 乾燥を防ぐために獣医用アイローションを塗布してください。30分ごと、または手術中も必要に応じて再塗布してください。
- 7.5%ポビドンヨードスクラブを塗布し、70%イソプロピルアルコールで洗い流して皮膚を消毒します。肌を風乾させます。
- 10%ポビドンヨード溶液を皮膚に塗布し、風乾させます(図2A)。
- サージカルマットを新しい滅菌マットと交換します。
- マウスがつま先つまみを使用して麻酔の手術面に到達したことを確認します。
- マウスの皮膚を脊椎に沿って持ち上げ、2つの外側の皮膚のひだの1つに腫瘍が成長しているのを探します。DSFCの背面フレーム(図2B)を、腫瘍が成長している皮膚と同じ側に置き、腫瘍がフレームの中央に配置されるようにします。
- DSFCの上部3つの穴と手術ガイドのそれぞれに3つの縫合糸を追加して、バックフレームの位置を固定します(図2B)。
- DSFCの背面フレームからスペーサーを含む穴に3本の針を差し込みます(図2B)。
注:DSFCの背面フレームには、血流がDSFC内の組織に制限されないように、前面フレームと背面フレームの間に隙間を保つための3つの「スペーサー」があります。スペーサーは 図1Bに見えます。 - サージカルマーカーを使用して、DSFCバックフレームスペーサーが皮膚の両側に配置される6つのポイント( 図2C、Dのポイント1〜6)に印を付けます。
注意: 挿入された針は、これらのポイントの正確な位置のガイドとして使用する必要があります。 - バックフレームの反対側に剥がされる皮膚を示すために、直径1cmの円を描きます(図2D)。
- 縫合糸を切って、針と背もたれを皮膚から取り除きます。
- 手順3.15でマークした皮膚の直径1cmの穴を、外科用マイクロハサミを使用して切ります(図2E)。
- 一時的な縫合糸を配置して、窓室のすべての部分を皮膚に固定します。ポイント 4 から DSFC のフロント フレームの上部の穴に縫合糸を挿入し、次にマウスの反対側にあるポイント 1 に縫合糸を挿入します (図 2F および 補足図 S1 のステップ 1-2)。
- 縫合糸を背面フレームの上部サポートポストに通し、次にマウスの頭に最も近い背面フレームのサポートポストに通します(図2F)。
- ポイント2に縫合糸を挿入します。次に、フロントフレームの対応する穴に縫合糸を通します(図2G および 補足図S1のステップ3)。
- 皮膚の内側から、 図2H および 補足図S1のステップ3-4に示すように、ポイント6に縫合糸を通します。
- 図2Iおよび補足図S1のステップ4に示すように、縫合糸をポイント5に通します。
- 縫合糸をフロントフレーム、ポイント3に通し、次にバックフレームに通します( 図2J および 補足図S1のステップ5を参照)。
- 縫合糸をポイント 1 (DSFC のフロント フレーム) から戻し、 図 2K および 補足図 S1 のステップ 6 に示すように、ポイント 4 から外に送り出します。
- この縫合糸でアセンブリ全体を締め、ステップ3.17で作成した穴にフロントフレームを皮膚の下に滑り込ませます(図2L、M)。
- この縫合糸の両端を結び、余分な紐を切断します。
- DSFCのフロントフレームとバックフレームの周囲にある穴から永久縫合を行います。 図2N および 補足図S2に示すパターンで2つのフレームを縫合します。
- 仮縫合糸を切断して取り外します。
- サポートクリップをバックフレームから突起部にスライドさせて、DSFCのバックフレームに取り付けます(図2O)。
注:手術後2週間のマウスの画像を 図2P、Qに示します。サポートクリップは、DSFCをマウスに直立させ、肌の緊張や不快感を軽減するために使用されます。 - 5 mg / kg体重のメロキシカム、非ステロイド性抗炎症薬を皮下投与して、痛みと炎症を軽減します。.
- マウスを麻酔から外し、マウスが歩行可能になるまで待ってから、ケージに戻します。
- 手術後2〜3時間でマウスをチェックし、その後少なくとも1週間は毎日チェックします。ウィンドウチャンバー手術の 2 か月後に到達したエンドポイント、またはステップ 2.17 のいずれかの条件が満たされた場合 (いずれか早い方) を検討してください。
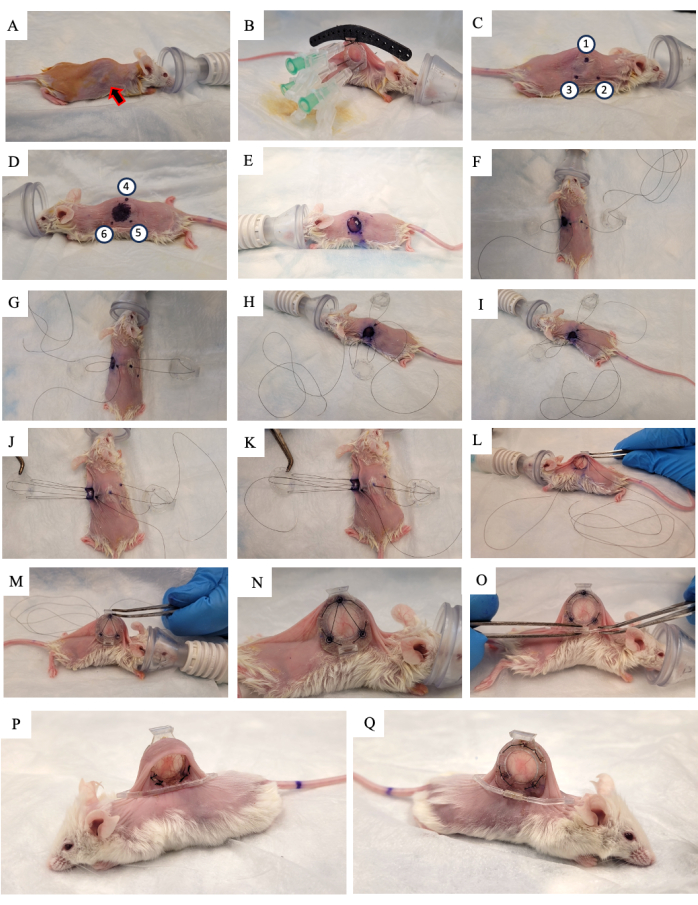
図2:DSFC手術の手順(A)マウスは、毛を取り除き、皮膚を消毒することにより、手術の準備をします。皮下腫瘍は矢印で示されます。(B)背もたれフレームを適切な位置に置き、3本の注射器と黒いサージカルガイドに取り付けられた一時的な縫合糸で固定します。(C,D)スペーサーの位置(ポイント1〜6)と穴は、スキンの両側にマークされています。(E)皮膚を切除します。(F-K)一時的な縫合糸は、DSFCの皮膚、前面、背面フレームの2つの層に通され、すべての部品を一緒に固定します。(L,M)仮縫合糸を締め、フロントフレームを皮下に挿入します。(N) DSFCを固定するために、8つの永久縫合糸が配置されています。(O)最後に仮縫合糸を取り外し、サポートクリップを取り付けます。(P、Q)手術後2週間で同じマウスを両側から見せます。略語:DSFC = 背側のスキンフォールドウィンドウチャンバー。この図の拡大版を表示するには、ここをクリックしてください。
4. 光学イメージング
- 手術後少なくとも5日間、マウスが治癒し、炎症が減少するのを待ってから、イメージングを行います。
- 導入には5%イソフルラン、維持には2%イソフルランを使用してマウスに麻酔をかけます(酸素流量は0.5 L / minに設定)。
- 乾燥を防ぐために獣医用アイローションを塗布してください。30分ごとまたは必要に応じて再適用します。
- マウスをイメージングステージに固定し、補足 図S3に示すようにガス麻酔アタッチメントを装着します。
- 広視野(幅>1.5cm)の明視野顕微鏡画像を取得します。DSFCのフロントフレームにある基準マーカーのディボットが見えていることを確認します。
注意: フロントフレームのガラスの周囲には、フィデューシャルマーカーリングアタッチメントの7つのフィデューシャルマーカーウェルと整列する7つのディボットがあります。これらのディボットは 、図 1A に示されています。 - 同じ日に、選択した生体内顕微鏡モダリティを使用して微小血管画像を取得します。これには、ステップ4.4(補足図S3)と同じイメージングステージを使用します。マウスを麻酔から外し、マウスが歩行可能になるまで待ってから、ケージに戻します。
注:高解像度の3D微小血管画像には、スペックル分散光干渉断層撮影法(svOCT)を使用します。
5. 磁気共鳴画像法
- マウスケージをヒートランプの下に置き、マウスを約15分間温めてから、マウスに麻酔をかけます。
注:温暖化は血管拡張を促進し、尾静脈カテーテルの配置に役立ちます。 - 導入には5%イソフルラン、維持には2%イソフルランを使用してマウスに麻酔をかけます(酸素流量は0.5 L / minに設定)。
- 電子スケールを使用してマウスの体重を記録し、正しい薬物投与を行います。
注意: 正確な体重測定のために、DSFCアセンブリの重量(0.83 g)を差し引いてください。 - マウスをMRIベッドに置き、乾燥を防ぐために獣医用眼用潤滑剤を塗布します。
- 給湯器とポンプシステムを使用してマウスの体温を維持します。
- マウスの横隔膜の下に呼吸モニタリング枕を置き、30±5呼吸/分に維持します。
- 造影剤を使用する場合は、マイクロチューブを取り付けた27Gのバタフライ針を尾静脈に挿入します(1%ヘラピン生理食塩水であらかじめ充填された30μLのデッドボリューム)。針とマイクロチューブをサージカルテープでMRIベッドに固定します。
- 図3に示すように、3Dプリントされた「固定装置」でウィンドウチャンバーを固定します。
- 18 Gの針を使用して、MRI基準マーカーの7つのチューブに獣医用眼潤滑剤を注入します。
- 3つの正方形のコネクタをフロントフレームから突き出た3つのポストに合わせ、基準マーカーをDSFCに貼り付けます(図3)。
- 尾静脈カテーテルをドラッグデリバリーラインに接続し、自動ポンプでシリンジを接続します。ベッドを7テスラの前臨床MRIスキャナーに挿入します。
- コロナルおよび軸方向のT2強調(T2w)画像セットを取得して、窓室の平面を視覚化します(エコー時間TE = 25 ms、繰り返し時間TR = 2,500 ms、視野角40 x 40 mm、視野角64 x 64、面内分解能0.5 x 0.5 mm、スライス厚さ0.5 mm、25秒)。矢状T2強調セットを処方します(TE = 25 ms;TR = 2,500 ミリ秒。視野角 32 x 32 mm、128 x 128 マトリックス、面内解像度 0.25 x 0.25 mm。少なくとも11枚のイメージングスライス、0.5mmのスライス厚さ、87秒)、図4に示すように、コロナルビューとアキシャルビューに基づいて、DSFCとフィデューシャルマーカーの平面に回転させます。イメージングスライスが完全に整列するまで、矢状セットの向きを繰り返し変更して配置し、スライス5がDSFCに組織シグナルを完全に含み、スライス6がDSFCに組織シグナルを含まないようにします。
- 選択した微小血管MRI法を使用して微小血管イメージングを実施します。
注:微小血管MR取得の場合、画像はT2wレジストレーション画像と同じイメージング基準フレームで取得されるため、基準マーカースライスを画像化する必要はありません。- ステップ5.12および5.13で詳述したすべての集録を 、32 x 32 mmの視野 角と 64 x 64のマトリックス で 0.5 x 0.5 mmの面内解像度で取得します。すべてのMRIアクイジションで、一貫したRFパルスを使用して、面内幾何学的な一貫性(sinc励起、sinc3リフォーカシング、2,484Hz帯域幅)を改善します。
- DCEイメージングの場合:
- ガドリニウム濃度の測定が必要な場合は、可変繰り返し時間(TE = 7 ms;レアファクター= 2;TR = 350、500、750、1,000、1,500、2,500、4,000 ms; 8 分 28 秒)。
- 2D RARE画像(TE = 8.1 ms;レアファクター= 2;TR = 200 ミリ秒;フリップ角度= 90°;時間分解能 = 12.8 秒。188回の繰り返し。合計モニタリング時間 = 40 分 6 秒)。
- 自動 MR 対応シリンジ ポンプを使用して、5 回の画像繰り返しが完了した後、0.75 mmol/kg 体重のガドブトロールを尾静脈から 10 秒かけて注入します。
- IVIM MRIの場合:
- 0、20、40、60、80、100、150、200、400、600、800、1,000 s/mm2 の 3 つの平均と等方性サンプリング (TE = 16 ms;TR = 800 ミリ秒;グラジエント期間 = 2.2 ミリ秒。グラジエント分離 = 9 ms;61分)。
注:拡散強調イメージングは、歪みが発生しやすいエコー平面イメージングではなく、2Dフーリエ変換読み出しを使用して取得され、画像セット全体および生体内顕微鏡画像でDSFC内の腫瘍および周囲の組織信号の幾何学的一貫性を確保します。
- 0、20、40、60、80、100、150、200、400、600、800、1,000 s/mm2 の 3 つの平均と等方性サンプリング (TE = 16 ms;TR = 800 ミリ秒;グラジエント期間 = 2.2 ミリ秒。グラジエント分離 = 9 ms;61分)。
- マウスを麻酔から外し、マウスが歩行可能になるまで待ってから、ケージに戻します。
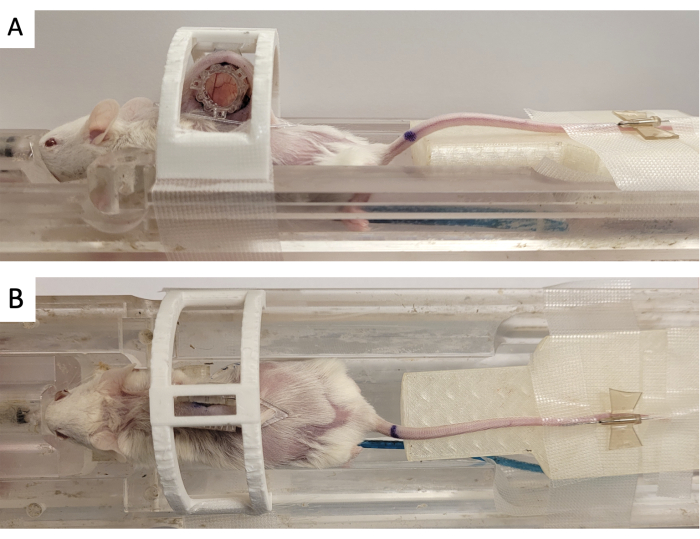
図3:DSFC MRイメージングのセットアップ(A)DSFCを固定して固定した状態でMRIベッドに配置したマウスの側面図と(B)上面図。マウスには造影剤注入用の尾静脈カテーテルが装着されており、DSFCのフロントフレームにはフィデューシャルメーカーリングが装着されています。略語:DSFC =背側スキンフォールドウィンドウチャンバー;MR=磁気共鳴画像法。この図の拡大版を表示するには、ここをクリックしてください。
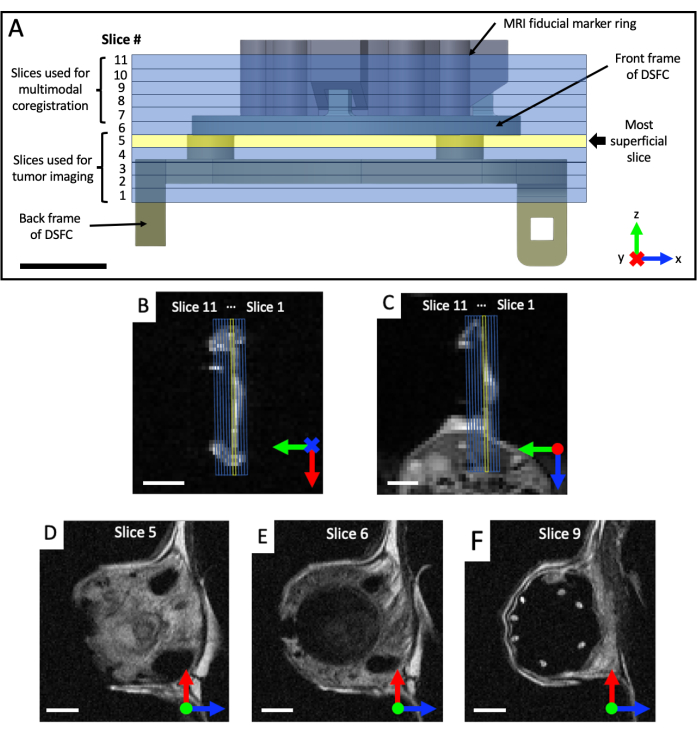
図4:フィデューシャルマーカーとウィンドウチャンバーに対するMRIスライスの位置(A)11枚のMRIスライスを重ね合わせたフィデューシャルマーカーリングアタッチメント付きのDSFCの図。スライスがDSFCおよび組織と正しく位置合わせされていることを確認するために、いくつかのT2強調画像を取得する必要があります。(B,C)DSFC内の組織に対して、異なる方向から11個のスライスを正しく配置します。(D)スライス5は、インターモダリティ相関分析が実行される最も表面的なスライスです。(E)スライス6は、DSFCと適切に整列していることを示す組織信号を含んでいない。(F)最後に、7つの基準マーカーがスライス9にはっきりと見えます。スケールバー= 5 mm。軸の「X」は軸がページに入ることを示し、円は軸がページから出ることを示します。略語:DSFC =背側スキンフォールドウィンドウチャンバー;MRI = 磁気共鳴画像法。この図の拡大版を表示するには、ここをクリックしてください。
6. MRIと生体内顕微鏡の同時登録
- MATLAB で、 Supplementary File 2 に含まれている Multimodal_Image_Register.m ファイルを開きます。
- ワークスペースに、微小血管画像(図5A)、明視野顕微鏡画像(図5B)、および微小血管MRIデータ(IVIMおよび/またはDCE MRIパラメータマップ)をロードします。
- 「実行」ボタンをクリックします。
- ポップアップ ファイル ファインダーを使用して、T2w MRI スライスを含むファイルに移動します。
- 基準マーカーがはっきりと表示されるT2w MRIスライスを最大4つ選択します(図5C)。
- 顕微鏡画像(図5B)と深さ平均T2w MRIスライス(図5C)を示すユーザーインターフェースが表示されます。MRI画像内の7つの基準マーカーのそれぞれに点を配置し、 図5B、Cの緑色の点で示されているように、顕微鏡画像上の対応する点(DSFCのフロントフレーム上のガラスの周囲にある基準マーカーのくぼみ)に一致させます。
- ウィンドウを閉じます。
- 重ね合わせたMRI画像と顕微鏡画像を含む図は、2つのデータセット間のレジストレーションの品質を評価するのに役立ちます。登録が適切な場合は、コマンド・ウィンドウで y と入力し、 Enter キーを押してコードを続行します。それ以外の場合は、コマンド ウィンドウに 「n 」と入力して Enter キーを押して、この手順を再試行してください。
注:MRIデータセットと顕微鏡画像の同時レジストレーションが成功したということは、MRIデータセットの7つの明るい基準マーカーが中央に配置され、DSFCのフロントフレーム上の対応するディボット内に完全に含まれていることを意味します。 - 顕微鏡画像(図5B)とsvOCT微小血管イメージングデータセット(図5A)を示すユーザーインターフェースが表示されます。svOCT微小血管画像上の少なくとも3つの微小血管ランドマークポイントと、 図5A、Bの青色の点で示されている顕微鏡画像内の対応するポイントを選択します。
- ウィンドウを閉じます。
- svOCT画像と顕微鏡画像を重ね合わせた図は、2つのデータセット間の共レジストレーションの品質を評価するのに役立ちます。登録が適切な場合は、コマンド・ウィンドウで y と入力し、 Enter キーを押してコードを続行します。それ以外の場合は、コマンド ウィンドウに 「n 」と入力して Enter キーを押して、この手順を再試行してください。
注:svOCTデータセットと顕微鏡画像の共レジストレーションが成功するということは、両方のデータセットの血管が互いに完全に重ね合わされていることを意味します。 - ウィンドウを閉じます。
- その後、共同登録されたマイクロコピー画像が表示されます。この画像で腫瘍の輪郭を描きます。
- ウィンドウを閉じます。
- 次に、svOCT微小血管データセット(図5D)、共登録顕微鏡画像(図5E)、および共登録MRIパラメータマップ(図5F)など、いくつかの図が表示されます。後で解析するためにマップを保存します。
注:表示されるMRIマップは、ユーザーが描画した腫瘍輪郭に限定されています(図5F)。
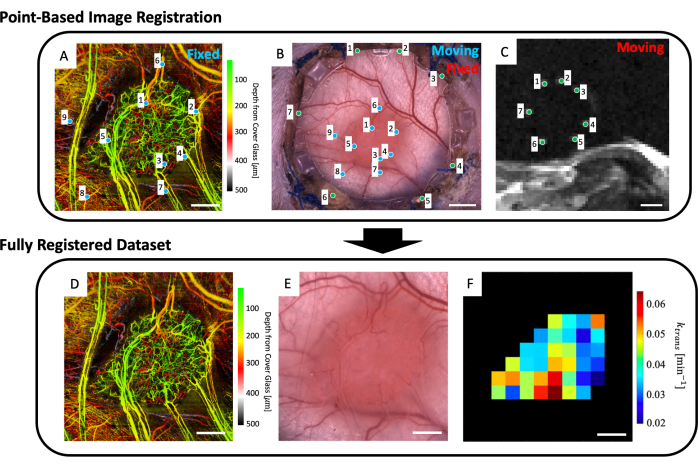
図5:マルチモーダルポイントベースの共レジストレーション(A)色深度エンコードされた微小血管svOCTデータセット。スケールバー = 1 mm. (B) 窓室の明視野顕微鏡画像;(C) T2w MRIスライス8-11の平均は、フィデューシャルマーカーリングに含まれる7つのフィデューシャルマーカーを示しています。スケールバー = 5 mm. (C) まず、「移動」T2w MRIデータセットを「固定」明視野顕微鏡画像に同時登録し、両方の画像セットにユーザーが入力した緑色のマーカーを使用します。次に、「移動」明視野顕微鏡画像と同時登録されたMRI画像を、AとBの青色マーカーを使用して「固定svOCTデータセット」に同時登録します。最終的に同時登録されたデータセットには、(D)svOCT、(E)明視野顕微鏡画像、および(F)機能的MRIパラメータマップが含まれます。F の黒いボクセルは腫瘍の外側にあるため、解析では考慮されません。D-Fの場合、スケールバー= 1 mmです。略語:svOCT =スペックル分散光干渉断層撮影;MRI = 磁気共鳴画像法。この図の拡大版を表示するには、ここをクリックしてください。
結果
スペックル分散光干渉断層撮影法(svOCT)を実施して、広い視野(FOV)3D微小血管画像(6 x 6 mm、横方向2 x 深さ1 mm)を取得しました。これらの画像を得るために、直交干渉計に基づく前述の掃引源OCTシステムを使用した23。OCT画像は、横方向に隣接する2つの3 x 6 mm2 FOVスキャンをつなぎ合わせて取得しました。各B-スキャンは400回のA-スキャンからなり、前回の研究
ディスカッション
この研究では、同じ動物で生体内顕微鏡検査と臨床的に適用可能な画像検査(CT、MRI、PET)の両方を行うワークフローを開発しました。これは、生体内顕微鏡検査とMRIなどの臨床画像診断法との直接的な相関関係により、前臨床顕微鏡検査所見を臨床に変換することを目的として行われました。従来のDSFCの設計は金属2,3でできていますが、生体適合性...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
Carla Calçada博士(プリンセス・マーガレットがんセンター博士研究員)とティモシー・サミュエル博士(プリンセス・マーガレットがんセンター博士課程学生)に対し、腫瘍細胞の培養と接種プロトコルの開発にご協力いただき、感謝いたします。Kathleen Ma博士、Anna Pietraszek博士、Alyssa Goldstein博士(動物研究センター、プリンセスマーガレットがんセンター)は、手術プロトコルの開発を支援しました。ジェイコブ・ブロスケ氏(プリンセス・マーガレットがんセンターの医療工学技術者)とウェイン・ケラー氏(ジャベリン・テクノロジーズ・トリメック・グループ・カンパニーのハードウェア・クライアント・エグゼクティブ)が窓ガラス室を3Dプリントしました。James Jonkman氏(Advanced Optical Microscopy Facility, University Health Network)は、明視野および蛍光顕微鏡の画像取得に関する貴重なガイダンスを提供してくれました。
資料
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
参考文献
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved