Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle murin de tumeur à chambre fenêtre de pli cutané dorsal pour la microscopie intravitale combinée et l’imagerie par résonance magnétique dans la recherche translationnelle sur le cancer
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’application des résultats de la microscopie intravitale est mise à l’épreuve par sa faible profondeur de pénétration dans les tissus. Nous décrivons ici un modèle de souris à chambre de fenêtre dorsale qui permet le co-enregistrement de la microscopie intravitale et des modalités d’imagerie cliniquement applicables (par exemple, CT, IRM) pour une corrélation spatiale directe, rationalisant potentiellement la traduction clinique des résultats de la microscopie intravitale.
Résumé
L’imagerie intravitale préclinique telle que la microscopie et la tomographie par cohérence optique s’est avérée être un outil précieux dans la recherche sur le cancer pour visualiser le microenvironnement tumoral et sa réponse au traitement. Ces modalités d’imagerie ont une résolution à l’échelle du micron, mais ont une utilisation limitée en clinique en raison de leur faible profondeur de pénétration dans les tissus. Les modalités d’imagerie plus cliniquement applicables telles que la tomodensitométrie, l’IRM et la TEP ont une profondeur de pénétration beaucoup plus grande, mais ont une résolution spatiale comparativement plus faible (échelle du millimètre).
Pour transposer les résultats de l’imagerie intravitale préclinique en clinique, de nouvelles méthodes doivent être développées pour combler cet écart de résolution micro à macro . Nous décrivons ici un modèle murin de tumeur à fenêtre de pli cutané dorsal conçu pour permettre l’imagerie préclinique, intravitale et cliniquement applicable (TDM et IRM) chez le même animal, ainsi que la plateforme d’analyse d’images qui relie ces deux méthodes de visualisation disparates. Il est important de noter que l’approche décrite de la chambre de fenêtre permet aux différentes modalités d’imagerie d’être co-enregistrées en 3D à l’aide de marqueurs de repère sur la chambre de fenêtre pour une concordance spatiale directe. Ce modèle peut être utilisé pour la validation de méthodes d’imagerie clinique existantes, ainsi que pour le développement de nouvelles méthodes grâce à une corrélation directe avec des résultats intravitaux à haute résolution de « vérité terrain ».
Enfin, la réponse tumorale à divers traitements - chimiothérapie, radiothérapie, thérapie photodynamique - peut être suivie longitudinalement avec cette méthodologie en utilisant des modalités d’imagerie précliniques et cliniquement applicables. Le modèle murin de tumeur, la chambre de la fenêtre du pli cutané dorsal et les plateformes d’imagerie décrits ici peuvent donc être utilisés dans une variété d’études de recherche sur le cancer, par exemple, pour traduire les résultats de la microscopie intravitale préclinique en modalités d’imagerie plus cliniquement applicables telles que la tomodensitométrie ou l’IRM.
Introduction
La microvascularisation tumorale est un composant important du microenvironnement tumoral qui peut être une cible pour le traitement et un déterminant de la réponse au traitement. Dans le cadre préclinique, la microvascularisation est généralement étudiée à l’aide de la microscopie intravitale dans des modèles animaux orthotopiques ou hétérotopiques de chambre fenêtre 1,2. Cela présente plusieurs avantages par rapport aux études histologiques puisque l’imagerie se fait dans des tissus vivants et que la tumeur peut être surveillée longitudinalement sur plusieurs semaines, voire plusieurs mois2,3. Ces études peuvent tirer parti des capacités d’imagerie à haute résolution de la microscopie intravitale pour étudier l’administration de traitements à la tumeur 4,5, les causes de la résistance au traitement6 et la réponse des micro-vaisseaux à des thérapies telles que le traitement antiangiogénique 7,8 et la radiothérapie 2,9.
La microscopie intravitale joue clairement un rôle important dans la recherche préclinique sur le cancer ; Cependant, comment les caractéristiques microenvironnementales des tumeurs peuvent-elles être mesurées en clinique ? Les informations microvasculaires seraient utiles en clinique pour mesurer l’apport sanguin et l’hypoxie des cellules tumorales, ce qui est important pour déterminer la résistance au traitement en radiothérapie10, ainsi que la capacité de la microvascularisation à délivrer des agents chimiothérapeutiques aux cellules tumorales environnantes11. Par exemple, en radiothérapie, des informations spatiales sur la structure et la fonction de la microvascularisation tumorale peuvent aider à personnaliser le plan de traitement d’un patient en ajustant le calendrier de fractionnement ou en augmentant préférentiellement la dose aux régions avasculaires et probablement hypoxiques12.
La microscopie intravitale permet de mesurer ces caractéristiques microvasculaires importantes car elle a une très haute résolution (échelle de μm) ; Cependant, sa pénétration en profondeur dans les tissus est limitée à plusieurs centaines de microns ou quelques millimètres, ce qui rend tout au plus difficile la mise en œuvre clinique. En effet, il existe de nouvelles applications de la microscopie intravitale en clinique13 ; Cependant, ceux-ci sont encore limités à l’examen des tissus proches de la surface tels que la peau14 ou les muqueuses/endothéliales de diverses cavités corporelles à l’aide de cathéters/endoscopes flexibles15,16.
Plus fréquemment, la microvascularisation est étudiée à l’aide de modalités d’imagerie telles que la TDM17 ou l’IRM18. Ces modalités d’imagerie clinique peuvent imager à n’importe quelle profondeur dans le corps, mais elles ont une résolution spatiale beaucoup plus faible (échelle mm). Ainsi, il est nécessaire de combler cet écart de résolution entre la microscopie intravitale préclinique et les modalités d’imagerie clinique afin d’apporter des informations microvasculaires détaillées et à haute résolution dans la clinique19. Plusieurs méthodes d’imagerie fonctionnelle ont été développées pour améliorer les capacités d’imagerie microvasculaire des modalités d’imagerie clinique telles que l’IRM dynamique avec contraste (DCE) et la TDM20, et l’IRM21 à mouvement incohérent intravoxel (IVIM). Cependant, il s’agit de méthodes basées sur des modèles qui fournissent des mesures indirectes de la microvascularisation et doivent donc être validées par des mesures appropriées de la microvascularisation19,22.
Nous avons développé un modèle murin de tumeur DSFC (dorsal skinfold window chamber) pour combler ce fossé entre la microscopie intravitale préclinique et les modalités d’imagerie cliniquement applicables telles que la tomodensitométrie et l’IRM. Le DSFC offre un accès direct à la tumeur pour l’imagerie par microscopie intravitale à haute résolution à travers une fenêtre en verre, mais aussi pour l’imagerie cliniquement applicable telle que l’IRM car il est fait de matériaux compatibles avec l’IRM (plastique et verre). De plus, un code MATLAB inclus effectue un co-enregistrement 3D multimodal pour des corrélations spatiales directes entre la microscopie intravitale préclinique et les modalités d’imagerie cliniquement applicables. Nous décrirons ici la conception et la chirurgie d’installation du DSFC ainsi que la procédure de co-enregistrement de la microscopie intravitale et des modalités d’imagerie cliniquement applicables.
Protocole
Toutes les interventions sur les animaux ont été effectuées conformément au Guide sur le soin et l’utilisation des animaux d’expérimentation, qui est établi par le Conseil canadien de protection des animaux. Les expériences ont été réalisées selon un protocole approuvé par le Comité institutionnel de soin et d’utilisation des animaux du Réseau universitaire de santé à Toronto, au Canada.
1. Marquage de l’inoculation tumorale
REMARQUE : Le « Landmarking » fait référence au processus de marquage de la peau de la souris pour indiquer où les cellules tumorales doivent être injectées afin d’optimiser le placement des DSFC. Cette procédure de marquage doit être effectuée le jour même ou 1 jour avant l’inoculation. Le NOD immunodéprimé. La souris femelle Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) a été utilisée pour ce travail.
- Anesthésier la souris à l’aide de 5 % d’isoflurane pour l’induction et de 2 % d’isoflurane pour l’entretien (débit d’oxygène réglé à 0,5 L/min). Maintenez la température corporelle en plaçant la souris sur un coussin chauffant enveloppé dans un tapis chirurgical autoclave.
- Préparez la souris à l’inoculation des cellules tumorales par rasage suivi de l’application d’une crème dépilatoire médicale. Retirez soigneusement la crème dépilatoire après 30 à 60 s à l’aide d’une serviette en papier humide et stérilisée. Appliquez un lubrifiant vétérinaire pour les yeux pour prévenir la sécheresse.
- Désinfectez la peau à l’aide d’un tampon imbibé d’alcool.
- Redressez doucement le corps de la souris et soulevez la peau le long de la colonne vertébrale de la souris. À l’aide d’un marqueur chirurgical, dessinez un seul point sur un côté de la souris au centre de la peau de la tente. Le point doit être situé à peu près au centre de la colonne thoracique de la souris.
REMARQUE : Ce sera l’emplacement souhaité de la tumeur.
2. Inoculation tumorale
REMARQUE : Dans cette étude, nous utilisons une lignée cellulaire de cancer du pancréas humain (BxPC3). D’autres lignées cellulaires peuvent également être utilisées ; Cependant, des étapes spécifiques de la culture cellulaire peuvent varier d’une lignée cellulaire à l’autre. Reportez-vous aux instructions fournies avec les cellules pour connaître les modifications apportées à la procédure ci-dessous.
- Cultiver les cellules en commençant 2 semaines avant l’inoculation à l’aide d’un milieu de culture complet (milieu Roswell Park Memorial Institute 1640 avec 10 % de sérum de veau fœtal et 1 % de pénicilline/streptomycine) dans une fiole de 75 mL à 37 °C et 5 % de CO2. Assurez-vous que les cellules sont maintenues dans la phase de croissance exponentielle.
REMARQUE : Le nombre de passages doit être limité à 10-15x et la fiole de 75 mL doit contenir environ 6 millions de cellules (~70% de confluence) au moment de l’inoculation. - Aspirez le milieu et lavez les cellules avec 5 ml de solution saline tamponnée au phosphate (PBS) sans calcium ni magnésium.
- Ajouter 5 mL d’agent de dissociation cellulaire et incuber à 37 °C et 5 % de CO2 pendant 6 à 7 min. Confirmez que les cellules se sont détachées à l’aide d’un microscope et ajoutez 5 ml de milieu de croissance complet.
REMARQUE : Tapoter doucement le côté du flacon peut aider à détacher les cellules. - Transférez la suspension dans un tube de centrifugation de 15 mL et centrifugez à 500 × g pendant 5 min pour granuler les cellules. Aspirez le milieu et mettez les cellules en suspension dans 5 mL de milieu de croissance complet.
- Déterminez la concentration cellulaire et le nombre total de cellules à l’aide d’un hémocytomètre.
- Centrifuger à 500 × g pendant 5 min pour granuler les cellules et aspirer le média.
- D’après le nombre total de cellules obtenu à l’étape 2.5, ajouter la quantité appropriée de milieu de croissance complet pour atteindre une concentration où
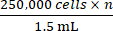 n est le nombre total de souris à inoculer. Remettez les cellules en suspension.
n est le nombre total de souris à inoculer. Remettez les cellules en suspension.
REMARQUE : Le nombre cible de cellules à inoculer par souris est de 250 000. - Transvaser 1,5 mL contenant 250 000 cellules × n dans un tube de microcentrifugation de 1,5 mL. Centrifuger le tube de microcentrifugation de 1,5 ml à 500 × g pendant 5 min et aspirer le fluide.
REMARQUE : Toute suspension cellulaire excédentaire peut être conservée dans un bain d’eau chaude chauffée à 37 °C pour être utilisée pour des inoculations supplémentaires si nécessaire. - Remettre les cellules en suspension dans 10 μL × n de PBS. Placez les cellules sur de la glace pour refroidir la suspension.
REMARQUE : Une fois que les cellules ont été refroidies sur de la glace, elles doivent être injectées dans la souris dans les 20 minutes. - Ajouter 10 μL × n de membrane basale solubilisée à l’aide d’embouts de pipette réfrigérés. Chargez des aiguilles d’insuline réfrigérées de calibre 29 avec 20 μL de chacune des suspensions cellulaires. Gardez les seringues sur de la glace.
- Anesthésier la souris à l’aide de 5 % d’isoflurane pour l’induction et de 2 % d’isoflurane pour l’entretien (débit d’oxygène réglé à 0,5 L/min).
- Placez la souris sur un coussin chauffant enveloppé dans un tapis chirurgical stérilisé.
- Désinfectez la peau au point d’injection avec un tampon imbibé d’alcool.
- Insérez l’aiguille ~1 cm avant le point de repère et déplacez l’aiguille sous la peau jusqu’à ce qu’elle soit au point de repère. Positionnez le côté biseauté de l’aiguille vers le haut et injectez les 20 μL de suspension cellulaire.
- Attendez 45 s pour permettre à la membrane basale solubilisée de se solidifier avant de retirer la seringue.
- Retirez la souris de l’anesthésie, attendez qu’elle devienne ambulatoire et remettez-la dans sa cage avec les autres souris.
- Surveillez la tumeur quotidiennement par palpation et laissez la tumeur se développer pendant 4 semaines ou jusqu’à ce que la tumeur ait un diamètre de 4 à 8 mm. Euthanasier la souris si l’une des conditions suivantes est remplie : la taille de la tumeur dépasse 1,5 cm, tumeur ulcérée ou tout signe de maladie systémique (léthargique, perte de poids supérieure à 20 % du poids corporel normal, déambulation altérée, incapacité à réguler la température corporelle, anorexie, posture voûtée, signes visibles de douleur (expressions faciales, etc.) ou déshydratation).
3. Chirurgie de la chambre de fenêtre
REMARQUE : Le DSFC se compose de quatre pièces imprimées en 3D, comme le montre la figure 1. Les schémas de chaque pièce sont inclus dans le Dossier supplémentaire 1. Toutes les pièces sont imprimées avec une résine plastique transparente biocompatible. La chambre de la fenêtre principale se compose de trois parties (figures 1A-C) avec un anneau de repère supplémentaire (figure 1D) qui peut être fixé lors de l’imagerie IRM ou CT.
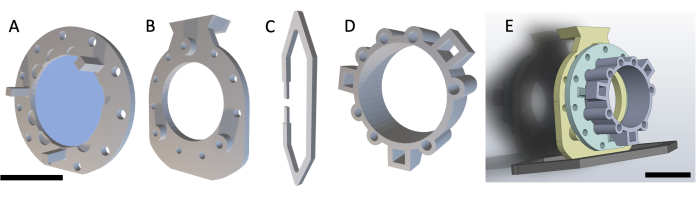
Figure 1 : Schéma de la chambre de la fenêtre du pli cutané dorsal. La chambre principale de la fenêtre contient trois parties. Tout d’abord, (A) le cadre avant est suturé sous la peau de la souris et contient une lamelle en verre fixée à l’aide d’une colle durcie aux UV. (B) Le cadre arrière est suturé au cadre avant à l’extérieur de la peau. (C) Le clip de support se fixe au bas du cadre arrière et maintient le DSFC à la verticale sur le corps de la souris. (D) L’anneau de repère contient sept « puits » où des repères peuvent être insérés. L’anneau de repère peut être fixé au cadre avant du DSFC à l’aide des trois poteaux de support. (E) L’ensemble DSFC complet avec une bague de repère est illustré. Barres d’échelle = 1 cm (A-D, en bas à gauche ; E). Abréviation : DSFC = chambre de fenêtre de pli cutané dorsal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Administrer 1 mg/kg de buprénorphine à libération prolongée de 0,6 mg/mL par voie sous-cutanée 1 à 3 h avant la chirurgie. Assurez-vous que la souris est d’une taille et d’un poids suffisants pour tolérer le DSFC sans constriction thoracique.
- Stérilisez les parties de la chambre principale de la fenêtre (figures 1A-C) dans un désinfectant liquide de haut niveau pendant 12 minutes, puis trempez-les dans de l’alcool isopropylique pendant au moins 5 minutes.
- Anesthésier la souris à l’aide de 5 % d’isoflurane pour l’induction et de 2 % d’isoflurane pour l’entretien (débit d’oxygène réglé à 0,5 L/min).
- Transférez la souris sur un tapis chirurgical stérile avec un coussin chauffant en dessous.
- Rasez la souris et appliquez une crème dépilatoire médicale si des poils sont présents. Après 30 à 60 s, retirez la crème dépilatoire à l’aide d’essuie-tout humides stériles.
- Appliquez un lubrifiant vétérinaire pour les yeux pour prévenir la sécheresse. Renouveler l’application toutes les 30 minutes ou au besoin tout au long de la chirurgie.
- Désinfectez la peau en appliquant un gommage à la povidone iodée à 7,5 % et en rinçant avec de l’alcool isopropylique à 70 %. Laissez la peau sécher à l’air libre.
- Appliquez une solution de povidone iodée à 10 % sur la peau et laissez-la sécher à l’air libre (Figure 2A).
- Remplacez le tapis chirurgical par un nouveau tapis stérilisé.
- Assurez-vous que la souris a atteint le plan chirurgical de l’anesthésie en pinçant les orteils.
- Soulevez la peau de la souris le long de la colonne vertébrale et recherchez la tumeur qui se développe sur l’un des deux plis cutanés latéraux. Placez le cadre arrière du DSFC (Figure 2B) du même côté de la peau sur lequel la tumeur se développe, en veillant à centrer la tumeur dans le cadre.
- Ajoutez trois sutures à chacun des trois trous supérieurs du DSFC et du guide chirurgical pour fixer la position du cadre arrière (Figure 2B).
- Insérez trois aiguilles dans le cadre arrière du DSFC dans les trous contenant les entretoises (Figure 2B).
REMARQUE : Il y a trois « entretoises » sur le cadre arrière du DSFC pour maintenir un espace entre les cadres avant et arrière afin de garantir que le flux sanguin n’est pas limité aux tissus à l’intérieur du DSFC. Les entretoises sont visibles sur la figure 1B. - À l’aide d’un marqueur chirurgical, marquez les six points où les entretoises du cadre dorsal DSFC seront situées des deux côtés de la peau (points 1 à 6 de la figure 2C et D).
REMARQUE : Les aiguilles insérées doivent être utilisées comme guide pour l’emplacement précis de ces points. - Tracez un cercle de 1 cm de diamètre pour indiquer la peau qui sera retirée du côté opposé au cadre arrière (Figure 2D).
- Retirez les aiguilles et le cadre arrière de la peau en coupant les sutures.
- Découpez le trou de 1 cm de diamètre dans la peau qui a été marqué à l’étape 3.15 à l’aide de microciseaux chirurgicaux (figure 2E).
- Placez la suture temporaire pour fixer toutes les parties de la chambre de la fenêtre à la peau. Insérez une suture à travers le point 4, à travers le trou supérieur du cadre avant du DSFC, puis à travers le point 1 sur le côté opposé de la souris (Figure 2F et étapes 1-2 de la Figure supplémentaire S1).
- Enfilez la suture dans le poteau de support supérieur du cadre arrière, puis dans le poteau de support du cadre arrière le plus proche de la tête de la souris (Figure 2F).
- Insérez la suture par le point 2. Ensuite, enfilez la suture dans le trou correspondant dans le cadre avant (figure 2G et étape 3 de la figure supplémentaire S1).
- De l’intérieur de la peau, enfilez la suture à travers le point 6 comme indiqué sur la figure 2H et les étapes 3-4 de la figure supplémentaire S1.
- Enfilez la suture à travers le point 5 comme indiqué sur la figure 2I et l’étape 4 sur la figure supplémentaire S1.
- Passez la suture à travers le cadre avant, point 3, puis à travers le cadre arrière comme indiqué sur la figure 2J et à l’étape 5 sur la figure supplémentaire S1.
- Ramenez la suture par le point 1, le cadre avant du DSFC, puis par le point 4 comme indiqué sur la figure 2K et l’étape 6 sur la figure supplémentaire S1.
- Serrez l’ensemble avec cette suture et glissez le cadre avant sous la peau à travers le trou créé à l’étape 3.17 (Figure 2L,M).
- Attachez les deux extrémités de cette suture ensemble et coupez l’excédent de ficelle.
- Effectuez des sutures permanentes à travers les trous autour du périmètre des cadres avant et arrière du DSFC. Suturez les deux cadres ensemble selon le motif illustré à la figure 2N et à la figure supplémentaire S2.
- Coupez et retirez la suture temporaire.
- Fixez le clip de support au cadre arrière du DSFC en le faisant glisser dans la saillie du cadre arrière (Figure 2O).
REMARQUE : Une image de la souris 2 semaines après la chirurgie est illustrée à la figure 2P,Q. Le clip de support est utilisé pour maintenir le DSFC à la verticale sur la souris afin de réduire la tension et l’inconfort de la peau. - Administrer 5 mg/kg de poids corporel de méloxicam, un anti-inflammatoire non stéroïdien, par voie sous-cutanée pour réduire la douleur et l’inflammation.
- Retirez la souris de l’anesthésie, attendez qu’elle devienne ambulatoire et remettez-la dans sa cage.
- Vérifiez sur la souris 2-3 h après l’opération, puis tous les jours pendant au moins 1 semaine. Considérez le point final atteint 2 mois après la chirurgie de la chambre vitrée ou si l’une des conditions de l’étape 2.17 est remplie (selon la première éventualité).
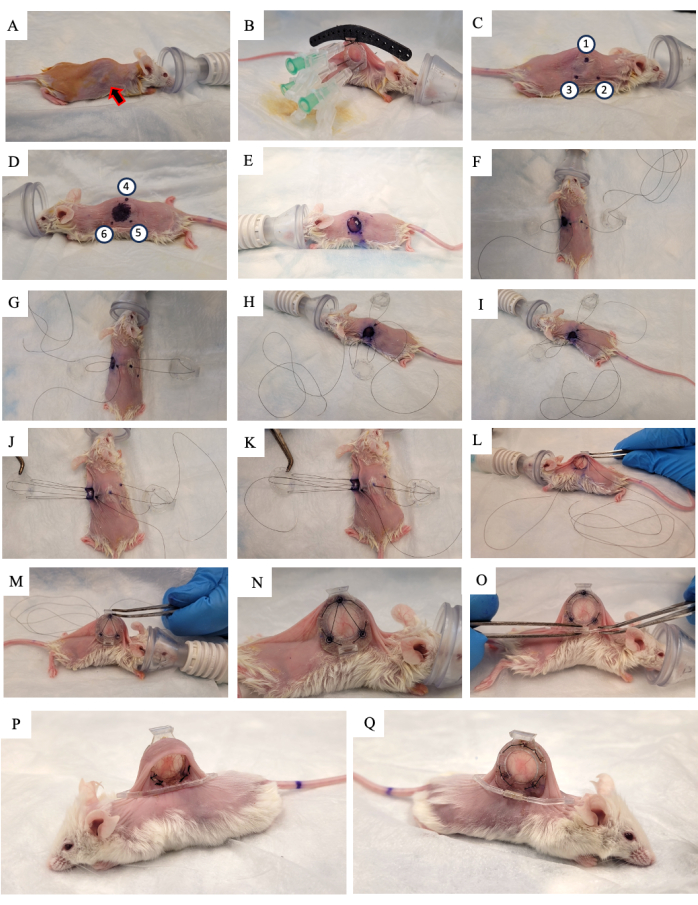
Figure 2 : Procédure chirurgicale DSFC. (A) La souris est préparée pour la chirurgie en enlevant les poils et en désinfectant la peau. La tumeur sous-cutanée est indiquée par la flèche. (B) Le cadre arrière est placé dans la position appropriée et fixé par trois seringues ainsi que des sutures temporaires fixées au guide chirurgical noir. (C, D) L’emplacement des entretoises (points 1 à 6) et le trou sont marqués des deux côtés de la peau. (E) La peau est enlevée. (F-K) Une suture temporaire est enfilée à travers les deux couches de peau, les cadres avant et arrière du DSFC pour fixer toutes les pièces ensemble. (L,M) La suture temporaire est resserrée et le cadre avant est inséré sous la peau. (N) Huit sutures permanentes sont mises en place pour fixer le DSFC. (O) Enfin, la suture temporaire est retirée et le clip de support est fixé. (P,Q) La même souris est montrée 2 semaines après la chirurgie des deux côtés. Abréviation : DSFC = chambre de fenêtre de pli cutané dorsal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Imagerie optique
- Laissez la souris guérir et l’inflammation diminuer pendant au moins 5 jours après la chirurgie avant l’imagerie.
- Anesthésier la souris à l’aide de 5 % d’isoflurane pour l’induction et de 2 % d’isoflurane pour l’entretien (débit d’oxygène réglé à 0,5 L/min).
- Appliquez un lubrifiant vétérinaire pour les yeux pour prévenir la sécheresse. Renouveler l’application toutes les 30 minutes ou au besoin.
- Fixez la souris dans une étape d’imagerie à l’aide d’un accessoire d’anesthésie gazeuse, comme illustré à la figure supplémentaire S3.
- Obtenez une image de microscopie à fond clair à large champ de vision (>1,5 cm de largeur). Assurez-vous que les divots de repère sur le cadre avant du DSFC sont visibles.
REMARQUE : Il y a sept divots autour du périmètre du verre sur le cadre avant qui s’alignent avec les sept puits de repère sur la fixation de l’anneau de repère de repère. Ces divots sont visibles sur la figure 1A. - Le même jour, obtenir une image microvasculaire en utilisant la modalité de microscopie intravitale de votre choix. Pour cela, utilisez la même platine d’imagerie que celle de l’étape 4.4 (figure supplémentaire S3). Retirez la souris de l’anesthésie, attendez qu’elle devienne ambulatoire et remettez-la dans sa cage.
REMARQUE : Nous utilisons la tomographie par cohérence optique à variance de chatoiement (svOCT) pour les images microvasculaires 3D à haute résolution.
5. Imagerie par résonance magnétique
- Placez la cage de souris sous une lampe chauffante pour réchauffer les souris pendant environ 15 minutes avant d’anesthésier la souris.
REMARQUE : Le réchauffement favorise la vasodilatation, ce qui aidera à la mise en place du cathéter de la veine de la queue. - Anesthésier la souris à l’aide de 5 % d’isoflurane pour l’induction et de 2 % d’isoflurane pour l’entretien (débit d’oxygène réglé à 0,5 L/min).
- Enregistrez le poids de la souris à l’aide d’une balance électronique pour un dosage correct du médicament.
REMARQUE : Pour des mesures précises du poids corporel, assurez-vous de soustraire le poids de l’ensemble DSFC (0.83 g). - Placez la souris sur le lit d’IRM et appliquez un lubrifiant vétérinaire pour les yeux pour éviter le dessèchement.
- Maintenez la température corporelle de la souris à l’aide d’un chauffe-eau et d’un système de pompe.
- Placez un coussin de surveillance respiratoire sous le diaphragme de la souris et maintenez-le à 30 ± 5 respirations/min.
- Si vous utilisez un agent de contraste, insérez une aiguille papillon de 27 G dans la veine de la queue avec un microtube attaché (30 μL de volume mort prérempli d’une solution saline d’hérapine à 1 %). Fixez l’aiguille et le microtube au lit d’IRM avec du ruban chirurgical.
- Fixez la chambre de la fenêtre dans un « dispositif d’immobilisation » imprimé en 3D, comme le montre la figure 3.
- À l’aide d’une aiguille de 18 G, injectez du lubrifiant vétérinaire pour les yeux dans les sept tubes du repère IRM.
- Fixez le repère sur le DSFC en alignant les trois connecteurs carrés sur les trois montants dépassant du cadre avant (Figure 3).
- Connectez le cathéter veineux de la queue à la ligne d’administration du médicament et à la seringue dans la pompe automatique. Insérez le lit dans un scanner IRM préclinique de 7 teslas.
- Acquérez des ensembles d’images coronales et axiales pondérées en T2 (T2w) pour visualiser le plan de la chambre de fenêtre (temps d’écho TE = 25 ms ; temps de répétition TR = 2 500 ms ; champ de vision de 40 x 40 mm avec une matrice de 64 x 64 pour une résolution dans le plan de 0,5 x 0,5 mm ; épaisseur de coupe de 0,5 mm ; 25 s). Prescrire un ensemble sagittal pondéré en T2 (TE = 25 ms ; TR = 2 500 ms ; Champ de vision de 32 x 32 mm avec matrice 128 x 128 pour une résolution dans le plan de 0,25 x 0,25 mm ; au moins 11 coupes d’imagerie, épaisseur de coupe de 0,5 mm, 87 s), qui est ensuite tournée dans le plan du DSFC et des marqueurs repères, sur la base des vues coronale et axiale, comme le montre la figure 4. Réorientez et positionnez itérativement l’ensemble sagittal jusqu’à ce que les coupes d’imagerie soient complètement alignées de sorte que la tranche 5 contienne entièrement le signal tissulaire dans le DSFC et que la tranche 6 ne contienne aucun signal tissulaire dans le DSFC.
- Effectuez l’imagerie microvasculaire à l’aide de la méthode d’IRM microvasculaire de votre choix.
REMARQUE : Pour les acquisitions IRM microvasculaires, il n’est pas nécessaire d’imager les tranches du marqueur repère puisque les images sont acquises dans le même cadre de référence d’imagerie que les images de recalage T2w.- Acquérez toutes les acquisitions détaillées aux étapes 5.12 et 5.13 sur un champ de vision de 32 x 32 mm avec une matrice de 64 x 64 pour une résolution dans le plan de 0,5 x 0,5 mm. Pour toutes les acquisitions IRM, utilisez des impulsions RF cohérentes pour améliorer la cohérence géométrique à travers le plan (excitation sinc, refocalisation sinc3, bande passante de 2 484 Hz).
- Pour l’imagerie DCE :
- Si des mesures de la concentration de gadolinium sont souhaitées, obtenir des cartes T1 à l’aide d’images 2D-RARE acquises à des temps de répétition variables (TE = 7 ms ; Facteur RARE = 2 ; TR = 350, 500, 750, 1 000, 1 500, 2 500 et 4 000 ms ; 8 min 28 s).
- Réaliser des séries chronologiques d’imagerie à l’aide d’images RARE 2D (TE = 8,1 ms ; Facteur RARE = 2 ; TR = 200 ms ; angle de retournement = 90° ; résolution temporelle = 12,8 s ; 188 répétitions ; temps total de surveillance = 40 min 6 s).
- Injecter 0,75 mmol/kg de poids corporel Gadobutrol sur 10 s par la veine caudale après avoir terminé cinq répétitions d’images à l’aide d’un pousse-seringue automatisé compatible avec l’IRM.
- Pour l’IRM IVIM :
- Effectuer l’imagerie pondérée en diffusion avec les valeurs B suivantes : 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1 000 s/mm2 avec trois moyennes de B = 0 s/mm2 et un échantillonnage isotrope (TE = 16 ms ; TR = 800 ms ; durée du gradient = 2,2 ms ; séparation de gradient = 9 ms ; 61 min).
REMARQUE : L’imagerie pondérée en diffusion est acquise à l’aide d’une lecture par transformée de Fourier 2D, plutôt qu’à l’aide d’une imagerie écho-planaire sujette à la distorsion, afin d’assurer la cohérence géométrique de la tumeur et des signaux tissulaires environnants au sein du DSFC à travers les ensembles d’images et avec les images de microscopie intravitale.
- Effectuer l’imagerie pondérée en diffusion avec les valeurs B suivantes : 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1 000 s/mm2 avec trois moyennes de B = 0 s/mm2 et un échantillonnage isotrope (TE = 16 ms ; TR = 800 ms ; durée du gradient = 2,2 ms ; séparation de gradient = 9 ms ; 61 min).
- Retirez la souris de l’anesthésie, attendez qu’elle devienne ambulatoire et remettez-la dans sa cage.
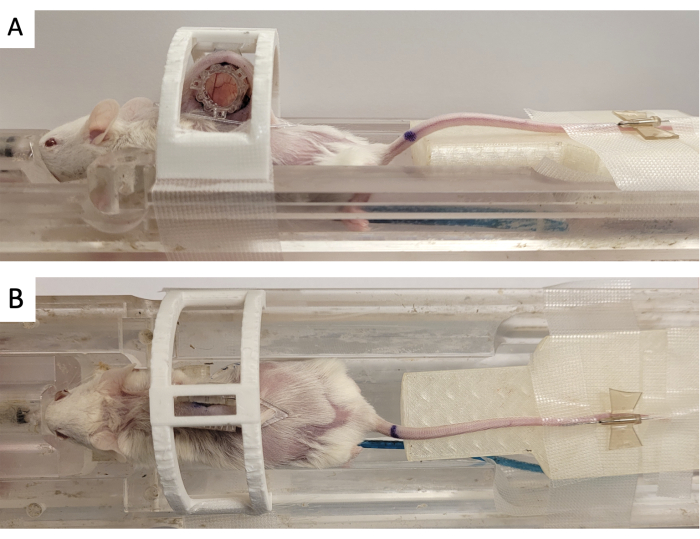
Figure 3 : Configuration de l’imagerie IRM DSFC. (A) Vues latérales et (B) vues de dessus de la souris positionnée sur le lit IRM avec DSFC fixé et immobilisé. La souris est équipée d’un cathéter veineux caudal pour l’injection d’agent de contraste et l’anneau de fabrication de repère est fixé au cadre avant du DSFC. Abréviations : DSFC = chambre de fenêtre de pli cutané dorsal ; IRM = imagerie par résonance magnétique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
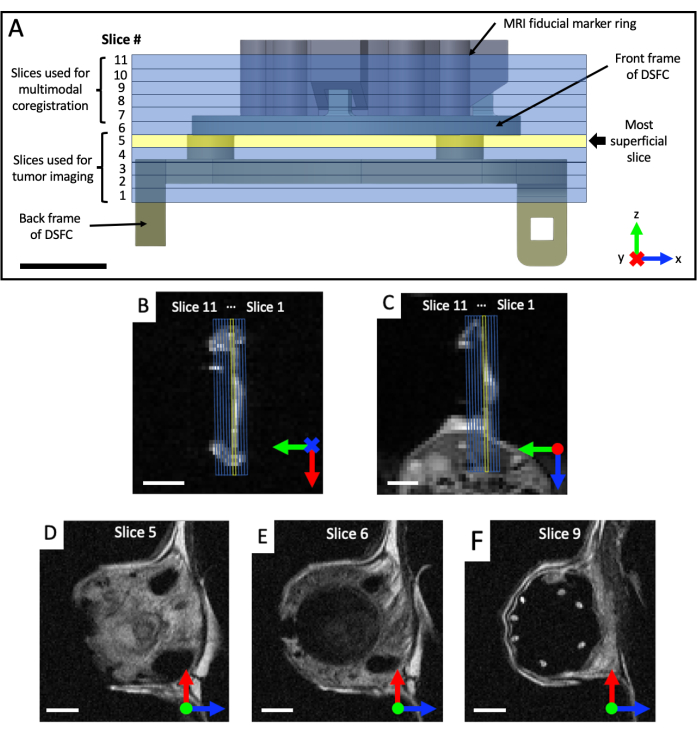
Figure 4 : Emplacements des coupes IRM par rapport aux repères et à la chambre de la fenêtre. (A) Un schéma de la DSFC avec fixation de l’anneau de repère avec les 11 coupes IRM superposées. Plusieurs images pondérées en T2 doivent être acquises pour s’assurer que les coupes sont correctement alignées avec le DSFC et le tissu. (B, C) Positionnement correct des 11 coupes par rapport au tissu dans le DSFC à partir de différentes orientations. (D) La tranche 5 est la tranche la plus superficielle où l’analyse de corrélation d’intermodalité sera effectuée. (E) La tranche 6 ne contient aucun signal tissulaire indiquant qu’elle est correctement alignée avec le DSFC. (F) Enfin, les 7 repères sont bien visibles dans la tranche 9. Barres d’échelle = 5 mm. Un « X » sur l’axe indique que l’axe va dans la page et un cercle indique que l’axe sort de la page. Abréviations : DSFC = chambre de fenêtre de pli cutané dorsal ; IRM = imagerie par résonance magnétique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Co-enregistrement de l’IRM à la microscopie intravitale
- Dans MATLAB, ouvrez le fichier Multimodal_Image_Register.m contenu dans le Fichier supplémentaire 2.
- Dans l’espace de travail, chargez l’image microvasculaire (Figure 5A), l’image de microscopie en fond clair (Figure 5B) et les données d’IRM microvasculaire (cartes de paramètres IRM IVIM et/ou DCE).
- Cliquez sur le bouton Exécuter .
- À l’aide de l’outil de recherche de fichiers contextuels, accédez au fichier contenant les tranches d’IRM T2w.
- Sélectionnez jusqu’à quatre coupes IRM T2w qui affichent clairement les repères (Figure 5C).
- Une interface utilisateur montrant l’image de microscopie (Figure 5B) et les coupes IRM T2w moyennées en profondeur (Figure 5C) s’affiche. Placez un point sur chacun des sept marqueurs repères de l’image IRM et faites-les correspondre à leur point correspondant sur l’image de microscopie (divots de repère autour du périmètre du verre sur le cadre avant du DSFC) comme indiqué par les points verts sur les figures 5B et C.
- Fermez la fenêtre.
- Une figure contenant les images IRM et microscopiques superposées apparaîtra pour aider à évaluer la qualité de l’alignement entre les deux ensembles de données. Si l’enregistrement est adéquat, continuez le code en tapant y, puis en appuyant sur Entrée dans la fenêtre de commande. Sinon, réessayez cette étape en tapant n dans la fenêtre de commande et en appuyant sur Entrée.
REMARQUE : Le co-enregistrement réussi de l’ensemble de données IRM avec l’image de microscopie signifie que les sept marqueurs repères brillants de l’ensemble de données IRM sont centrés et entièrement contenus dans leurs divots correspondants sur le cadre avant du DSFC. - Une interface utilisateur montrant l’image de microscopie (Figure 5B) et l’ensemble de données d’imagerie microvasculaire svOCT (Figure 5A) sera affichée. Sélectionnez au moins trois points de repère microvasculaires sur l’image microvasculaire svOCT et les points correspondants dans l’image microscopique, comme indiqué par les points bleus de la figure 5A, B.
- Fermez la fenêtre.
- Une figure contenant les images superposées de svOCT et de microscopie apparaîtra pour aider à évaluer la qualité du co-enregistrement entre les deux ensembles de données. Si l’enregistrement est adéquat, continuez le code en tapant y, puis en appuyant sur Entrée dans la fenêtre de commande. Sinon, réessayez cette étape en tapant n dans la fenêtre de commande et en appuyant sur Entrée.
REMARQUE : Le co-enregistrement réussi de l’ensemble de données svOCT avec l’image de microscopie signifie que les récipients des deux ensembles de données sont parfaitement superposés les uns aux autres. - Fermez la fenêtre.
- L’image de microcopie co-enregistrée apparaîtra alors. Contournez la tumeur dans cette image.
- Fermez la fenêtre.
- Plusieurs figures seront alors affichées : l’ensemble de données microvasculaires svOCT (Figure 5D), l’image de microscopie co-enregistrée (Figure 5E) et les cartes de paramètres IRM co-enregistrées (Figure 5F). Enregistrez les cartes pour une analyse ultérieure.
REMARQUE : Les cartes IRM affichées sont limitées au contour de la tumeur dessiné par l’utilisateur (Figure 5F).
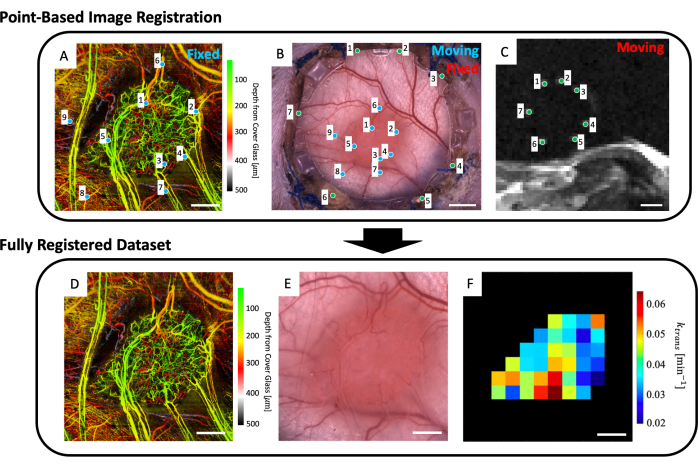
Figure 5 : Co-enregistrement multimodal basé sur des points. (A) Ensemble de données svOCT microvasculaires codées en profondeur de couleur ; barre d’échelle = 1 mm. (B) Image de microscopie à fond clair de la chambre de la fenêtre ; barre d’échelle = 2 mm. (C) Moyenne des tranches d’IRM T2w 8-11 montrant les sept marqueurs repères contenus dans l’anneau de repère ; barre d’échelle = 5 mm. (C) Tout d’abord, l’ensemble de données IRM T2w « en mouvement » est co-enregistré sur l’image de microscopie à fond clair « fixe » à l’aide des marqueurs verts saisis par l’utilisateur sur les deux ensembles d’images. Ensuite, l’image de microscopie à fond clair « mobile » et l’image IRM co-enregistrée sont co-enregistrées dans l'« ensemble de données svOCT fixes » à l’aide des marqueurs bleus en A et B. L’ensemble de données final co-enregistré comprend (D) le svOCT, (E) l’image de microscopie en fond clair et (F) la carte des paramètres fonctionnels de l’IRM. Les voxels noirs dans F sont à l’extérieur de la tumeur et ne sont donc pas pris en compte dans l’analyse. Pour D-F, barre d’échelle = 1 mm. Abréviations : svOCT = tomographie par cohérence optique à variance de chatoiement ; IRM = imagerie par résonance magnétique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
La tomographie par cohérence optique à variance de chatoiement (svOCT) a été réalisée pour obtenir des images microvasculaires 3D à grand champ de vision (FOV) (6 x 6 mm,2 latéraux x 1 mm de profondeur). Pour obtenir ces images, un système OCT à source balayée précédemment décrit et basé sur un interféromètre en quadrature a été utilisé23. Les images OCT ont été acquises en assemblant deux balayages FOV 3 x 6 mm2 latéralement adjacents. Chaque B-scan co...
Discussion
Dans ce travail, nous avons développé un flux de travail permettant d’effectuer à la fois la microscopie intravitale et l’imagerie cliniquement applicable (TDM, IRM et TEP) chez le même animal. Cela a été fait dans le but de traduire les résultats de la microscopie préclinique à la clinique en corrélant directement la microscopie intravitale avec des modalités d’imagerie clinique telles que l’IRM. Bien que les conceptions conventionnelles des DSFC soient en métal 2,3...
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions la Dre Carla Calçada (boursière postdoctorale, Princess Margaret Cancer Centre) et le Dr Timothy Samuel (étudiant au doctorat, Princess Margaret Cancer Centre) pour leur aide dans la culture de cellules tumorales et l’élaboration du protocole d’inoculation. La Dre Kathleen Ma, la Dre Anna Pietraszek et la Dre Alyssa Goldstein (Centre de recherche animale, Centre de cancérologie Princess Margaret) ont participé à l’élaboration du protocole chirurgical. Jacob Broske (technologue en génie médical, Centre de cancérologie Princess Margaret) et Wayne Keller (responsable de la clientèle matérielle, Javelin Technologies – une société du groupe TriMech) ont imprimé en 3D les chambres de la fenêtre. James Jonkman (Advanced Optical Microscopy Facility, University Health Network) a fourni de précieux conseils pour l’acquisition d’images en microscopie à fond clair et à fluorescence.
matériels
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
Références
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon