Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Translasyonel Kanser Araştırmalarında Kombine İntravital Mikroskopi ve Manyetik Rezonans Görüntüleme için Dorsal Deri Kıvrımlı Pencere Odası Tümör Fare Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
İntravital mikroskopi bulgularının translasyonu, dokuya sığ derinlik penetrasyonu ile karşı karşıyadır. Burada, intravital mikroskopi bulgularının klinik translasyonunu potansiyel olarak kolaylaştıran, doğrudan uzamsal korelasyon için intravital mikroskopi ve klinik olarak uygulanabilir görüntüleme modalitelerinin (örneğin, BT, MRI) birlikte kaydedilmesini sağlayan bir dorsal pencere odası fare modelini açıklıyoruz.
Özet
Mikroskopi ve optik koherens tomografi gibi klinik öncesi intravital görüntülemenin, tümör mikroçevresini ve tedaviye yanıtını görselleştirmek için kanser araştırmalarında değerli araçlar olduğu kanıtlanmıştır. Bu görüntüleme modaliteleri mikron ölçeğinde çözünürlüğe sahiptir ancak dokuya sığ penetrasyon derinlikleri nedeniyle klinikte sınırlı kullanıma sahiptir. BT, MRG ve PET gibi klinik olarak daha uygulanabilir görüntüleme modaliteleri çok daha fazla penetrasyon derinliğine sahiptir, ancak nispeten daha düşük uzamsal çözünürlüğe (mm ölçeği) sahiptir.
Klinik öncesi intravital görüntüleme bulgularını kliniğe dönüştürmek için, bu mikro-makro çözünürlük boşluğunu kapatmak için yeni yöntemler geliştirilmelidir. Burada, aynı hayvanda klinik öncesi intravital ve klinik olarak uygulanabilir (BT ve MR) görüntülemeyi mümkün kılmak için tasarlanmış bir dorsal deri kıvrımlı pencere odası tümör fare modelini ve bu iki farklı görselleştirme yöntemini birbirine bağlayan görüntü analiz platformunu açıklıyoruz. Daha da önemlisi, açıklanan pencere odası yaklaşımı, farklı görüntüleme modalitelerinin, doğrudan uzamsal uyum için pencere odası üzerindeki referans işaretleyiciler kullanılarak 3D olarak birlikte kaydedilmesini sağlar. Bu model, mevcut klinik görüntüleme yöntemlerinin doğrulanması için kullanılabileceği gibi, "temel gerçek" yüksek çözünürlüklü intravital bulgularla doğrudan korelasyon yoluyla yenilerinin geliştirilmesi için de kullanılabilir.
Son olarak, kemoterapi, radyoterapi, fotodinamik tedavi gibi çeşitli tedavilere tümör yanıtı, preklinik ve klinik olarak uygulanabilir görüntüleme modaliteleri kullanılarak bu metodoloji ile uzunlamasına izlenebilir. Bu nedenle, burada açıklanan dorsal deri kıvrımlı pencere odası tümör fare modeli ve görüntüleme platformları, örneğin klinik öncesi intravital mikroskopi bulgularının BT veya MRI gibi daha klinik olarak uygulanabilir görüntüleme yöntemlerine çevrilmesi gibi çeşitli kanser araştırma çalışmalarında kullanılabilir.
Giriş
Tümör mikrovaskülatürü, tedavi için bir hedef ve tedavi yanıtının belirleyicisi olabilen tümör mikroçevresinin önemli bir bileşenidir. Klinik öncesi ortamda, mikrovaskülatür tipik olarak ortotopik veya heterotopik pencere odası hayvan modellerindeintravital mikroskopi kullanılarak incelenir 1,2. Görüntüleme canlı dokularda yapıldığından ve tümör birkaç hafta hatta aylar boyunca uzunlamasına izlenebildiğinden, bunun histolojik çalışmalara göre çeşitli avantajları vardır 2,3. Bu çalışmalar, terapötiklerin tümöre4,5 verilmesini, tedavi direncinin6 nedenlerini ve mikro damarların antianjiyojenik tedavi 7,8 ve radyoterapi 2,9 gibi tedavilere yanıtını incelemek için intravital mikroskopinin yüksek çözünürlüklü görüntüleme yeteneklerinden yararlanabilir.
İntravital mikroskopi, klinik öncesi kanser araştırmalarında açıkça önemli bir rol oynar; Bununla birlikte, tümörün mikroçevresel özellikleri klinikte nasıl ölçülebilir? Mikrovasküler bilgiler, radyoterapide10 tedavi direncini belirlemek için önemli olan kan temini ve tümör hücresi hipoksisini ölçmek için klinikte yararlı olacaktır ve ayrıca mikrovaskülatürün çevredeki tümör hücrelerine kemoterapötik ajanları iletme kabiliyeti11. Örneğin, radyoterapide, tümör mikrovaskülatürünün yapısı ve işlevi hakkındaki mekansal bilgiler, fraksiyonasyon programını ayarlayarak veya dozu tercihen avasküler ve olası hipoksik bölgelere artırarak hastanın tedavi planını kişiselleştirmeye yardımcı olabilir12.
İntravital mikroskopi, çok yüksek çözünürlüğe (μm ölçeği) sahip olduğu için bu önemli mikrovasküler özellikleri ölçebilir; Bununla birlikte, dokuya derinlemesine nüfuz etmesi birkaç yüz mikron veya birkaç milimetre ile sınırlıdır ve bu da en fazla klinik uygulamayı zorlaştırır. Gerçekten de, klinikte intravital mikroskopinin bazı yeni uygulamaları vardır13; Bununla birlikte, bunlar hala esnek kateterler/endoskoplar15,16 aracılığıyla cilt14 veya çeşitli vücut boşluklarının mukozal/endotel astarları gibi yüzey seviyesine yakın dokuların incelenmesiyle sınırlıdır.
Daha yaygın olarak, mikrovaskülatür CT17 veya MRI18 gibi görüntüleme yöntemleri kullanılarak incelenir. Bu klinik görüntüleme yöntemleri vücut içindeki herhangi bir derinliğe kadar görüntüleme yapabilir, ancak çok daha düşük bir uzamsal çözünürlüğe (mm ölçeği) sahiptirler. Bu nedenle, yüksek çözünürlüklü ve ayrıntılı mikrovasküler bilgileri kliniğe getirmek için klinik öncesi intravital mikroskopi ile klinik görüntüleme modaliteleri arasındaki bu çözünürlük boşluğunu kapatmaya ihtiyaç vardır19. Klinik görüntüleme modalitelerinin mikrovasküler görüntüleme yeteneklerini geliştirmek için dinamik kontrastlı (DCE) MRG ve CT20 ve Intravoksel tutarsız hareket (IVIM) MRI21 gibi çeşitli fonksiyonel görüntüleme yöntemleri geliştirilmiştir. Bununla birlikte, bunlar, mikrovaskülatür ölçümlerini sağlayan model tabanlı yöntemlerdir ve bu nedenle, mikrovaskülatür 19,22'nin uygun "temel gerçek" ölçümleri ile doğrulanması gerekir.
Klinik öncesi intravital mikroskopi ile BT ve MRG gibi klinik olarak uygulanabilir görüntüleme modaliteleri arasındaki bu boşluğu kapatmak için bir dorsal deri kıvrım pencere odası (DSFC) tümör fare modeli geliştirdik. DSFC, bir cam pencereden yüksek çözünürlüklü, intravital mikroskopi görüntülemenin yanı sıra MR uyumlu malzemelerden (plastik ve cam) yapıldığı için MRI gibi klinik olarak uygulanabilir görüntüleme için tümöre doğrudan erişim sağlar. Ayrıca, dahil edilen bir MATLAB kodu, klinik öncesi intravital mikroskopi ile klinik olarak uygulanabilir görüntüleme modaliteleri arasındaki doğrudan uzamsal korelasyonlar için çok modaliteli 3D ortak kayıt gerçekleştirir. Burada, DSFC'yi kurmak için tasarım ve cerrahinin yanı sıra intravital mikroskopi ve klinik olarak uygulanabilir görüntüleme modalitelerini birlikte kaydetme prosedürünü açıklayacağız.
Protokol
Tüm hayvan prosedürleri, Kanada Hayvan Bakımı Konseyi tarafından belirlenen Deney Hayvanlarının Bakımı ve Kullanımı Kılavuzu'na uygun olarak gerçekleştirilmiştir. Deneyler, Toronto, Kanada'daki Üniversite Sağlık Ağı Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanan bir protokole göre gerçekleştirildi.
1. Tümör aşılama dönüm noktası
NOT: "Yer İşaretleme", DSFC yerleşimini optimize etmek için tümör hücrelerinin nereye enjekte edilmesi gerektiğini belirtmek için farenin derisini işaretleme işlemini ifade eder. Bu işaretleme işlemi aşılamadan aynı gün veya 1 gün önce yapılmalıdır. Bağışıklığı baskılanmış NOD. Bu çalışma için Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG) dişi fare kullanıldı.
- İndüksiyon için %5 izofluran ve bakım için %2 izofluran kullanarak fareyi uyuşturun (oksijen akış hızı 0,5 L/dk'ya ayarlanmıştır). Fareyi otoklavlanmış bir cerrahi mata sarılmış bir ısıtma yastığına yerleştirerek vücut ısısını koruyun.
- Fareyi tıraş ederek ve ardından tıbbi epilasyon kremi uygulayarak tümör hücresi aşılaması için hazırlayın. Tüy dökücü kremi 30-60 saniye sonra ıslak, sterilize edilmiş bir kağıt havlu kullanarak iyice çıkarın. Kuruluğu önlemek için veteriner göz kayganlaştırıcı uygulayın.
- Cildi alkollü bir bezle dezenfekte edin.
- Farenin gövdesini nazikçe düzeltin ve cildi farenin omurgası boyunca kaldırın. Cerrahi bir işaretleyici kullanarak, farenin bir tarafına, çadırlı derinin ortasına tek bir nokta çizin. Nokta, farenin torasik omurgasının yaklaşık merkezinde bulunmalıdır.
NOT: Bu, tümörün istenen yeri olacaktır.
2. Tümör aşılaması
NOT: Bu çalışmada, bir insan pankreas kanseri hücre hattı (BxPC3) kullanıyoruz. Diğer hücre hatları da kullanılabilir; Bununla birlikte, spesifik hücre kültürü adımları, farklı hücre hatları arasında değişebilir. Aşağıdaki prosedürde yapılacak değişiklikler için hücrelerle birlikte verilen talimatlara bakın.
- Hücreleri aşılamadan 2 hafta önce başlayarak, 37 ° C'de 75 mL'lik bir şişede tam büyüme ortamı (% 10 fetal sığır serumu ve% 1 Penisilin / streptomisin içeren Roswell Park Memorial Institute 1640 ortamı) kullanarak% 5 CO2'de büyütün. Hücrelerin üstel büyüme aşamasında tutulduğundan emin olun.
NOT: Geçiş sayısı 10-15x ile sınırlandırılmalı ve 75 mL'lik şişe, aşılama sırasında yaklaşık 6 milyon hücre (~% 70 birleşme) içermelidir. - Ortamı aspire edin ve hücreleri kalsiyum veya magnezyum içermeyen 5 mL fosfat tamponlu salin (PBS) ile yıkayın.
- 5 mL hücre ayrışma maddesi ekleyin ve 37 ° C ve% 5 CO2'de 6-7 dakika inkübe edin. Hücrelerin bir mikroskop kullanarak ayrıldığını onaylayın ve 5 mL tam büyüme ortamı ekleyin.
NOT: Şişenin kenarına hafifçe vurmak, hücrelerin ayrılmasına yardımcı olabilir. - Süspansiyonu 15 mL'lik bir santrifüj tüpüne aktarın ve hücreleri peletlemek için 5 dakika boyunca 500 × g'da santrifüjleyin. Ortamı aspire edin ve hücreleri 5 mL tam büyüme ortamında yeniden süspanse edin.
- Bir hemositometre kullanarak hücre konsantrasyonunu ve toplam hücre sayısını belirleyin.
- Pelet hücrelerine 5 dakika boyunca 500 × g'da santrifüjleyin ve ortamı aspire edin.
- Adım 2.5'ten elde edilen toplam hücre sayısına dayanarak, n'nin aşılanacak toplam fare sayısı olduğu bir konsantrasyona
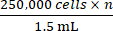 ulaşmak için uygun miktarda tam büyüme ortamı ekleyin. Hücreleri yeniden askıya alın.
ulaşmak için uygun miktarda tam büyüme ortamı ekleyin. Hücreleri yeniden askıya alın.
NOT: Fare başına aşılanacak hedef hücre sayısı 250.000'dir. - 250.000 hücre içeren 1.5 mL'× 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın . 1.5 ml'lik mikrosantrifüj tüpünü 500 × g'da 5 dakika santrifüjleyin ve ortamı aspire edin.
NOT: Herhangi bir fazla hücre süspansiyonu, gerekirse ek aşılamalar için kullanılmak üzere 37 ° C'ye ısıtılmış bir sıcak su banyosunda tutulabilir. - Hücreleri 10 μL × n PBS'de yeniden süspanse edin. Süspansiyonu soğutmak için hücreleri buzun üzerine yerleştirin.
NOT: Hücreler buz üzerinde soğutulduktan sonra, 20 dakika içinde fareye enjekte edilmelidir. - Soğutulmuş pipet uçları kullanarak 10 μL × n çözünmüş bazal membran ekleyin. Hücre süspansiyonlarının her biri 20 μL olan soğutulmuş 29 gauge insülin iğnelerini yükleyin. Şırıngaları buz üzerinde tutun.
- İndüksiyon için %5 izofluran ve bakım için %2 izofluran kullanarak fareyi uyuşturun (oksijen akış hızı 0,5 L/dk'ya ayarlanmıştır).
- Fareyi sterilize edilmiş bir cerrahi mata sarılmış bir ısıtma yastığının üzerine yerleştirin.
- Enjeksiyon bölgesindeki cildi alkollü bir bezle dezenfekte edin.
- İğneyi yer işaretli noktadan ~ 1 cm önce sokun ve iğneyi yer işaretine gelene kadar derinin altında hareket ettirin. İğnenin eğimli tarafını yukarı doğru konumlandırın ve 20 μL hücre süspansiyonunu enjekte edin.
- Şırıngayı çıkarmadan önce çözünmüş bazal membranın katılaşması için 45 s bekleyin.
- Fareyi anesteziden çıkarın, fare yürüyene kadar bekleyin ve diğer farelerle birlikte kafesine geri koyun.
- Tümörü günlük olarak palpasyonla izleyin ve tümörün 4 hafta boyunca veya tümörün çapı 4-8 mm olana kadar büyümesine izin verin. Aşağıdaki koşullardan herhangi biri karşılanırsa fareye ötenazi yapın: tümör boyutu 1,5 cm'yi aşıyor, ülsere tümör veya herhangi bir sistemik hastalık belirtisi (uyuşuk, normal vücut ağırlığının %20'sini aşan kilo kaybı, bozulmuş ambulasyon, vücut ısısını düzenleyememe, iştahsızlık, kambur duruş, gözle görülür ağrı belirtileri (yüz ifadeleri vb.) veya dehidrasyon).
3. Pencere odası cerrahisi
NOT: DSFC, Şekil 3'de gösterildiği gibi dört adet 1D baskılı parçadan oluşur. Her parçanın şemaları Ek Dosya 1'de yer almaktadır. Tüm parçalar biyouyumlu şeffaf plastik reçine ile basılmıştır. Ana pencere odası tertibatı, MRI veya CT görüntülemesi sırasında takılabilen ek bir referans işaretleyici halkası (Şekil 1D) ile üç parçadan (Şekil 1A-C) oluşur.
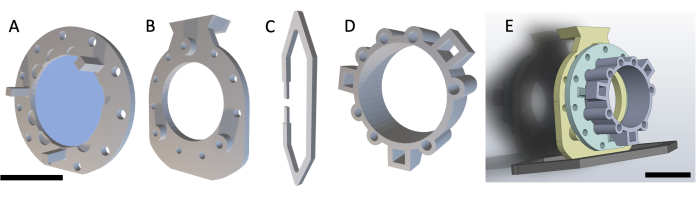
Şekil 1: Dorsal deri kıvrımlı pencere odası şeması. Ana pencere odası üç bölümden oluşur. İlk olarak, (A) ön çerçeve farenin derisinin altına dikilir ve UV ile kürlenmiş yapıştırıcı kullanılarak yapıştırılmış bir cam lamel içerir. (B) Arka çerçeve, cildin dış tarafındaki ön çerçeveye dikilir. (C) Destek klipsi, arka çerçevenin altına takılır ve DSFC'yi fare gövdesi üzerinde dik tutar. (D) Referans işaret halkası, referans işaretleyicilerin yerleştirilebileceği yedi 'kuyu' içerir. Referans işaret halkası, üç destek direği kullanılarak DSFC'nin ön çerçevesine yapıştırılabilir. (E) Referans işaretleyici halkalı tam DSFC düzeneği gösterilmiştir. Ölçek çubukları = 1 cm (A-D, sol altta; E). Kısaltma: DSFC = dorsal deri kıvrımlı pencere odası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Ameliyattan 1-3 saat önce deri altına 1 mg / kg 0.6 mg / mL sürekli salımlı buprenorfin uygulayın. Farenin, torasik daralma olmadan DSFC'yi tolere etmek için yeterli vücut boyutuna ve ağırlığına sahip olduğundan emin olun.
- Ana pencere haznesi parçalarını (Şekil 1A-C) yüksek seviyeli bir sıvı dezenfektanda 12 dakika sterilize edin, ardından en az 5 dakika izopropil alkolde bekletin.
- İndüksiyon için %5 izofluran ve bakım için %2 izofluran kullanarak fareyi uyuşturun (oksijen akış hızı 0,5 L/dk'ya ayarlanmıştır).
- Fareyi, altında bir ısıtma yastığı bulunan steril bir cerrahi mata aktarın.
- Fareyi tıraş edin ve tüy varsa tıbbi tüy dökücü krem uygulayın. 30-60 saniye sonra steril ıslak kağıt havlu kullanarak tüy dökücü kremi çıkarın.
- Kuruluğu önlemek için veteriner göz kayganlaştırıcı uygulayın. Ameliyat boyunca her 30 dakikada bir veya gerektiğinde tekrar uygulayın.
- %7,5 povidon-iyot ovma uygulayarak ve %70 izopropil alkol ile durulayarak cildi dezenfekte edin. Cildin kurumasına izin verin.
- Cilde %10 povidon-iyot solüsyonu uygulayın ve kurumaya bırakın (Şekil 2A).
- Cerrahi matı yeni bir sterilize edilmiş matla değiştirin.
- Farenin bir ayak parmağı tutamını kullanarak cerrahi anestezi düzlemine ulaştığından emin olun.
- Farenin derisini omurga boyunca kaldırın ve iki yan deri kıvrımından birinde büyüyen tümörü arayın. DSFC'nin arka çerçevesini (Şekil 2B) tümörün büyüdüğü cildin aynı tarafına yerleştirin ve tümörü çerçevede ortaladığınızdan emin olun.
- Arka çerçevenin konumunu sabitlemek için DSFC'nin ve cerrahi kılavuzun üst üç deliğinin her birine üç dikiş ekleyin (Şekil 2B).
- DSFC'nin arka çerçevesinden, ara parçaları içeren deliklere üç iğne sokun (Şekil 2B).
NOT: Kan akışının DSFC içindeki doku ile sınırlı olmamasını sağlamak için ön ve arka çerçeveler arasında bir boşluk bırakmak için DSFC'nin arka çerçevesinde, üç 'ara parça' vardır. Ara parçalar Şekil 1B'de görülebilir. - Cerrahi bir işaretleyici kullanarak, DSFC arka çerçeve ara parçalarının cildin her iki tarafına yerleştirileceği altı noktayı işaretleyin ( Şekil 2C, D'de 1-6 noktaları).
NOT: Yerleştirilen iğneler, bu noktaların kesin konumu için bir kılavuz olarak kullanılmalıdır. - Arka çerçevenin karşı tarafında çıkarılacak deriyi belirtmek için 1 cm çapında bir daire çizin (Şekil 2D).
- Dikişleri keserek iğneleri ve arka çerçeveyi ciltten çıkarın.
- Adım 3.15'te işaretlenen deride 1 cm çapındaki deliği cerrahi mikro makas kullanarak kesin (Şekil 2E).
- Pencere haznesinin tüm kısımlarını cilde sabitlemek için geçici dikişi yerleştirin. 4. noktadan, DSFC'nin ön çerçevesinin üst deliğinden ve ardından farenin karşı tarafındaki 1. noktadan bir sütür yerleştirin (Şekil 2F ve Ek Şekil S1'deki 2-2. adımlar).
- Sütürü arka çerçevenin üst destek direğinden geçirin ve ardından farenin kafasına en yakın olan arka çerçevedeki destek direğinden geri geçirin (Şekil 2F).
- Sütürü 2. noktadan geçirin. Ardından, sütürü ön çerçevedeki ilgili delikten geçirin (Şekil 2G ve Ek Şekil S1'deki adım 3).
- Derinin içinden, sütürü Şekil 2H'de ve Ek Şekil S1'de 3-4. adımlarda gösterildiği gibi 6. noktadan geçirin.
- Sütürü, Şekil 2I'de ve Ek Şekil S1'de adım 4'te gösterildiği gibi 5. noktadan geçirin.
- Sütürü Şekil 3'ten ve ardından Şekil 2J'de ve Ek Şekil S5'deki adım 1'te gösterildiği gibi arka çerçeveden geçirin.
- Sütürü, DSFC'nin ön çerçevesi olan 1. noktadan geri getirin ve ardından Şekil 2K'da ve Ek Şekil S1'deki 6. adımda gösterildiği gibi 4. noktadan dışarı çıkarın.
- Bu dikişle tüm tertibatı sıkın ve ön çerçeveyi adım 3.17'de oluşturulan delikten cildin altına kaydırın (Şekil 2L,M).
- Bu dikişin iki ucunu birbirine bağlayın ve fazla ipi kesin.
- DSFC'nin ön ve arka çerçevelerinin çevresindeki deliklerden kalıcı dikişler gerçekleştirin. İki çerçeveyi Şekil 2N ve Ek Şekil S2'de gösterilen desende birbirine dikin.
- Geçici dikişi kesin ve çıkarın.
- Destek klipsini, arka çerçeveden çıkıntıya kaydırarak DSFC'nin arka çerçevesine yapıştırın (Şekil 2O).
NOT: Ameliyattan 2 hafta sonra farenin bir görüntüsü Şekil 2P, Q'da gösterilmiştir. Destek klipsi, cilt gerginliğini ve rahatsızlığını azaltmak için DSFC'yi fare üzerinde dik tutmak için kullanılır. - Ağrı ve iltihabı azaltmak için steroid olmayan bir antienflamatuar ilaç olan 5 mg / kg vücut ağırlığı Meloksikam'ı deri altına uygulayın.
- Fareyi anesteziden çıkarın, fare yürüyene kadar bekleyin ve kafesine geri koyun.
- Ameliyattan 2-3 saat sonra fareyi kontrol edin ve ardından en az 1 hafta boyunca her gün kontrol edin. Pencere odası ameliyatından 2 ay sonra ulaşılan son noktayı veya adım 2.17'deki koşullardan herhangi birinin karşılanıp karşılanmadığını (hangisi önce gerçekleşirse) göz önünde bulundurun.
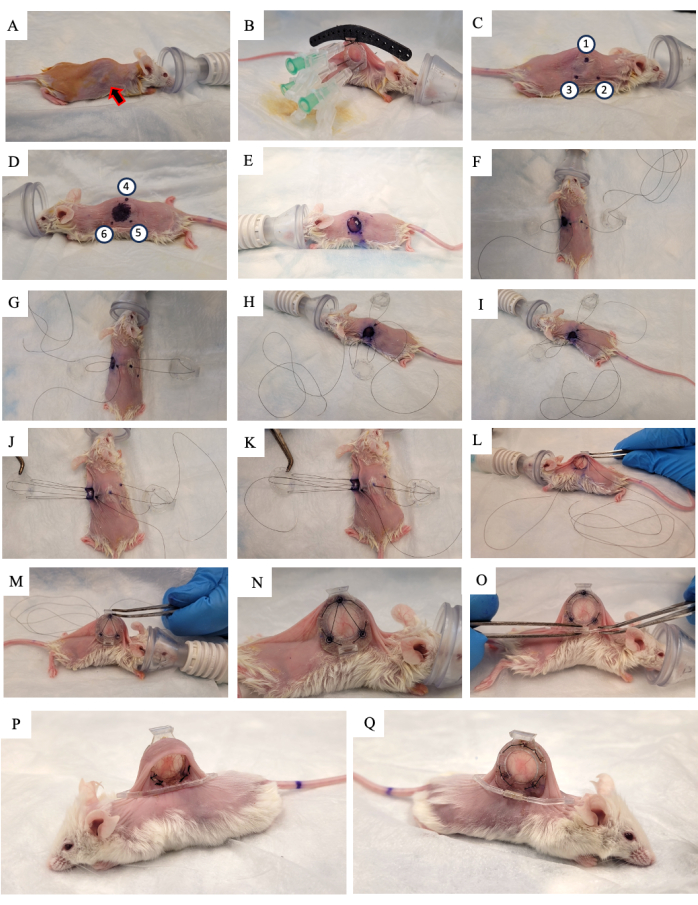
Şekil 2: DSFC cerrahi prosedürü. (A) Fare, tüyleri alınarak ve cildi dezenfekte ederek ameliyata hazırlanır. Deri altı tümör okla gösterilir. (B) Arka çerçeve uygun pozisyona yerleştirilir ve üç şırınga ve siyah cerrahi kılavuza yapıştırılmış geçici dikişlerle sabitlenir. (C,D) Ara parça konumları (1-6 arasındaki noktalar) ve delik cildin her iki tarafında işaretlenmiştir. (E) Deri çıkarılır. (F-K) Tüm parçaları bir araya getirmek için DSFC'nin iki deri tabakası, ön ve arka çerçevelerinden geçici bir dikiş geçirilir. (L,M) Geçici dikiş sıkılaşır ve ön çerçeve cildin altına yerleştirilir. (N) DSFC'yi sabitlemek için sekiz kalıcı sütür yerleştirilir. (O) Son olarak, geçici dikiş çıkarılır ve destek klipsi takılır. (P,Q) Aynı fare ameliyattan 2 hafta sonra her iki taraftan da gösterilir. Kısaltma: DSFC = dorsal deri kıvrımlı pencere odası. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Optik görüntüleme
- Görüntülemeden önce ameliyattan sonra en az 5 gün boyunca farenin iyileşmesine ve iltihabın azalmasına izin verin.
- İndüksiyon için %5 izofluran ve bakım için %2 izofluran kullanarak fareyi uyuşturun (oksijen akış hızı 0,5 L/dk'ya ayarlanmıştır).
- Kuruluğu önlemek için veteriner göz kayganlaştırıcı uygulayın. Her 30 dakikada bir veya gerektiğinde tekrar uygulayın.
- Fareyi, Ek Şekil S3'te gösterildiği gibi bir gaz anestezi eki ile bir görüntüleme aşamasında sabitleyin.
- Geniş bir görüş alanı (>1,5 cm genişlik) parlak alan mikroskobu görüntüsü elde edin. DSFC'nin ön çerçevesindeki referans işaretleyici bölmelerinin görünür olduğundan emin olun.
NOT: Ön çerçevedeki camın çevresinde, referans işaret halkası ekindeki yedi referans işaret kuyusu ile hizalanan yedi bölme vardır. Bu bölmeler Şekil 1A'da görülebilir. - Aynı gün, tercih edilen intravital mikroskopi modalitesini kullanarak mikrovasküler bir görüntü elde edin. Bunun için adım 4.4'teki (Ek Şekil S3) aynı görüntüleme aşamasını kullanın. Fareyi anesteziden çıkarın, fare yürüyene kadar bekleyin ve kafesine geri koyun.
NOT: Yüksek çözünürlüklü 3D mikrovasküler görüntüler için benek varyans optik koherens tomografi (svOCT) kullanıyoruz.
5. Manyetik rezonans görüntüleme
- Fareyi uyuşturmadan önce fareleri yaklaşık 15 dakika ısıtmak için fare kafesini bir ısı lambasının altına yerleştirin.
NOT: Isınma, kuyruk ven kateterinin yerleştirilmesine yardımcı olacak vazodilatasyonu teşvik eder. - İndüksiyon için %5 izofluran ve bakım için %2 izofluran kullanarak fareyi uyuşturun (oksijen akış hızı 0,5 L/dk'ya ayarlanmıştır).
- Doğru ilaç dozu için elektronik bir ölçek kullanarak farenin ağırlığını kaydedin.
NOT: Doğru vücut ağırlığı ölçümleri için, DSFC tertibatının ağırlığını (0.83 g) çıkardığınızdan emin olun. - Fareyi MRI yatağına yerleştirin ve kuruluğu önlemek için veteriner göz kayganlaştırıcı uygulayın.
- Bir su ısıtıcısı ve pompa sistemi kullanarak farenin vücut ısısını koruyun.
- Farenin diyaframının altına bir solunum izleme yastığı yerleştirin ve dakikada 30 ± 5 nefeste tutun.
- Bir kontrast madde kullanıyorsanız, mikrotüp takılı olarak kuyruk damarına 27 G'lik bir kelebek iğne yerleştirin (% 1 herapin-salin çözeltisi ile önceden doldurulmuş 30 μL ölü hacim). İğneyi ve mikrotüpü cerrahi bantla MRI yatağına sabitleyin.
- Pencere odasını Şekil 3'te gösterildiği gibi 3D baskılı bir 'hareketsizleştirme cihazı' ile sabitleyin.
- 18 G'lik bir iğne kullanarak, MRI referans işaretleyicisindeki yedi tüpe veteriner göz kayganlaştırıcı enjekte edin.
- Üç kare konektörü ön çerçeveden çıkıntı yapan üç direğe hizalayarak referans işaretleyiciyi DSFC'ye yapıştırın (Şekil 3).
- Kuyruk ven kateterini ilaç dağıtım hattına bağlayın ve otomatik pompadaki şırıngayı bağlayın. Yatağı 7 tesla klinik öncesi MRI tarayıcısına yerleştirin.
- Pencere odasının düzlemini görselleştirmek için koronal ve eksenel T2 ağırlıklı (T2w) görüntü setleri elde edin (yankı süresi TE = 25 ms; tekrarlama süresi TR = 2.500 ms; 0,5 x 0,5 mm düzlem içi çözünürlük için 64 x 64 matrisli 40 x 40 mm görüş alanı; 0,5 mm kesit kalınlığı; 25 sn). Sagital T2 ağırlıklı bir set reçete edin (TE = 25 ms; TR = 2.500 ms; 0,25 x 0,25 mm düzlem içi çözünürlük için 128 x 128 matris ile 32 x 32 mm görüş alanı; en az 11 görüntüleme dilimi; 0,5 mm dilim kalınlığı; 87 s), daha sonra Şekil 4'te gösterildiği gibi koronal ve eksenel görünümlere dayalı olarak DSFC ve referans belirteçlerinin düzlemine döndürülür. Görüntüleme dilimleri tamamen hizalanana kadar sagital seti yinelemeli olarak yeniden yönlendirin ve konumlandırın, böylece dilim 5 DSFC'de tam olarak doku sinyali içerir ve dilim 6 DSFC'de doku sinyali içermez.
- Tercih edilen mikrovasküler MRG yöntemini kullanarak mikrovasküler görüntüleme gerçekleştirin.
NOT: Mikrovasküler MR çekimleri için, görüntüler T2w kayıt görüntüleri ile aynı görüntüleme referans çerçevesinde elde edildiğinden, referans işaretleyici kesitlerinin görüntülenmesine gerek yoktur.- 0,5 x 0,5 mm düzlem içi çözünürlük için 64 x 64 matris ile 32 x 32 mm görüş alanı üzerinden adım 5.12 ve 5.13'te ayrıntılı olarak açıklanan tüm alımları edinin. Tüm MRG alımları için, düzlem boyunca geometrik tutarlılığı iyileştirmek için tutarlı RF darbeleri kullanın (sinc uyarımı; sinc3 yeniden odaklama; 2.484 Hz bant genişliği).
- DCE görüntüleme için:
- Gadolinyum konsantrasyonunun ölçülmesi isteniyorsa, değişken tekrarlama sürelerinde elde edilen 2D-RARE görüntüleri kullanarak T1 haritaları elde edin (TE = 7 ms; NADİR faktörü = 2; TR = 350, 500, 750, 1.000, 1.500, 2.500 ve 4.000 ms; 8 dk 28 sn).
- 2D NADİR görüntüleri kullanarak zaman serisi görüntüleme gerçekleştirin (TE = 8,1 ms; NADİR faktörü = 2; TR = 200 ms; çevirme açısı = 90°; zamansal çözünürlük = 12,8 sn; 188 tekrar; toplam izleme süresi = 40 dak 6 sn).
- Otomatik MR uyumlu bir şırınga pompası kullanarak beş görüntü tekrarının tamamlanmasından sonra kuyruk damarı yoluyla 10 saniye boyunca 0.75 mmol / kg vücut ağırlığı Gadobutrol enjekte edin.
- IVIM MRG için:
- Aşağıdaki B değerleriyle difüzyon ağırlıklı görüntüleme gerçekleştirin: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2, B = 0 s/mm2 ve izotropik örneklemenin üç ortalaması (TE = 16 ms; TR = 800 ms; gradyan süresi = 2,2 ms; gradyan ayrımı = 9 ms; 61 dk).
NOT: Difüzyon ağırlıklı görüntüleme, görüntü setleri ve intravital mikroskopi görüntüleri ile DSFC içindeki tümörün ve çevresindeki doku sinyallerinin geometrik tutarlılığını sağlamak için distorsiyona eğilimli eko-düzlemsel görüntüleme yerine bir 2D Fourier dönüşümü okuması kullanılarak elde edilir.
- Aşağıdaki B değerleriyle difüzyon ağırlıklı görüntüleme gerçekleştirin: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2, B = 0 s/mm2 ve izotropik örneklemenin üç ortalaması (TE = 16 ms; TR = 800 ms; gradyan süresi = 2,2 ms; gradyan ayrımı = 9 ms; 61 dk).
- Fareyi anesteziden çıkarın, fare yürüyene kadar bekleyin ve kafesine geri koyun.
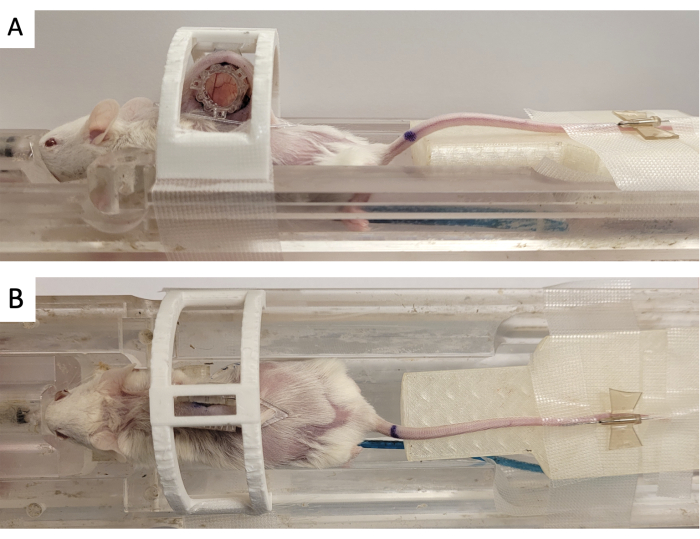
Şekil 3: DSFC MR görüntüleme kurulumu. (A) DSFC güvenli ve hareketsiz hale getirilmiş olarak MRI yatağına yerleştirilmiş farenin yan ve (B) üst görünümleri. Fare, kontrast madde enjeksiyonu için bir kuyruk damar kateterine sahiptir ve referans yapıcı halka, DSFC'nin ön çerçevesine yapıştırılmıştır. Kısaltmalar: DSFC = dorsal deri kıvrımlı pencere odası; MR = manyetik rezonans görüntüleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
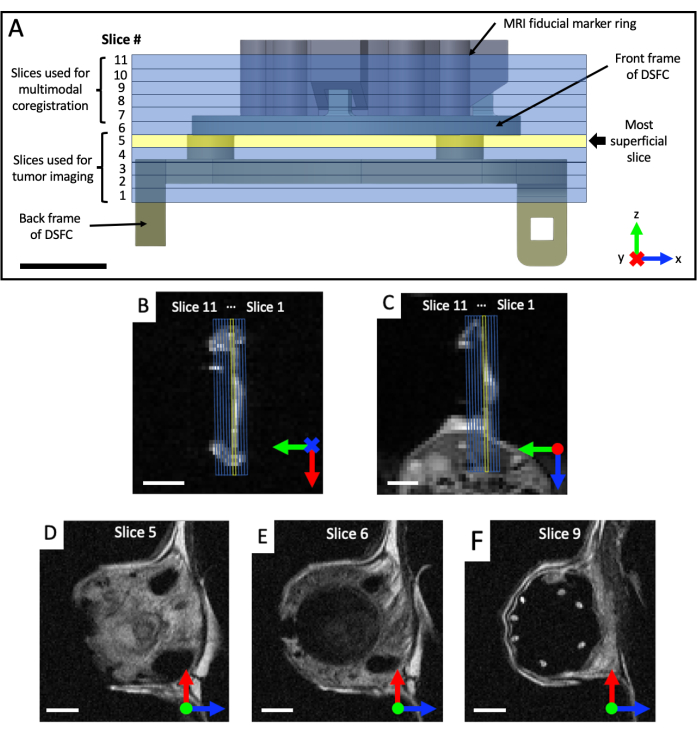
Şekil 4: Referans belirteçlerine ve pencere odasına göre MRI dilim konumları. (A) Üst üste bindirilmiş 11 MRI dilimi ile referans işaretleyici halka eki ile DSFC'nin bir diyagramı. Dilimlerin DSFC ve doku ile doğru şekilde hizalandığından emin olmak için birkaç T2 ağırlıklı görüntü elde edilmelidir. (B,C) 11 dilimin DSFC'deki dokuya göre farklı yönlerden doğru konumlandırılması. (D) Dilim 5, intermodalite korelasyon analizinin yapılacağı en yüzeysel dilimdir. (E) Dilim 6, DSFC ile düzgün şekilde hizalandığını gösteren hiçbir doku sinyali içermiyor. (F) Son olarak, 7 referans işareti 9. dilimde açıkça görülmektedir. Ölçek çubukları = 5 mm. Eksen üzerindeki 'X' harfi, eksenin sayfaya girdiğini, daire ise eksenin sayfadan çıktığını gösterir. Kısaltmalar: DSFC = dorsal deri kıvrımlı pencere odası; MRG = manyetik rezonans görüntüleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. MRG'den intravital mikroskopi ortak kaydına
- MATLAB'da, Ek Dosya 2'de bulunan Multimodal_Image_Register.m dosyasını açın.
- Çalışma alanına mikrovasküler görüntüyü (Şekil 5A), parlak alan mikroskobu görüntüsünü (Şekil 5B) ve mikrovasküler MRI verilerini (IVIM ve/veya DCE MRI parametre haritaları) yükleyin.
- Çalıştır düğmesine tıklayın.
- Açılır dosya bulucuyu kullanarak, T2w MRI dilimlerini içeren dosyaya gidin.
- Referans belirteçlerini açıkça gösteren dört adede kadar T2w MRI dilimi seçin (Şekil 5C).
- Mikroskopi görüntüsünü (Şekil 5B) ve derinlik ortalamalı T2w MRI dilimlerini (Şekil 5C) gösteren bir kullanıcı arayüzü görüntülenecektir. MRI görüntüsündeki yedi referans işaretleyicinin her birine bir nokta yerleştirin ve bunları Şekil 5B, C'deki yeşil noktalarla gösterildiği gibi mikroskopi görüntüsündeki karşılık gelen noktayla eşleştirin (DSFC'nin ön çerçevesindeki camın çevresi etrafındaki referans işaretleyici bölmeleri).
- Pencereyi kapatın.
- Üst üste bindirilmiş MRI ve mikroskopi görüntülerini içeren bir şekil, iki veri kümesi arasındaki kaydın kalitesini değerlendirmeye yardımcı olmak için görünecektir. Kayıt yeterliyse, y yazarak ve ardından komut penceresinde enter tuşuna basarak koda devam edin. Aksi takdirde, komut penceresine n yazıp enter tuşuna basarak bu adımı yeniden deneyin.
NOT: MRI veri setinin mikroskopi görüntüsü ile başarılı bir şekilde birlikte kaydedilmesi, MRI veri setinden gelen yedi parlak referans işaretleyicinin ortalandığı ve DSFC'nin ön çerçevesindeki karşılık gelen bölmeleri içinde tam olarak yer aldığı anlamına gelir. - Mikroskopi görüntüsünü (Şekil 5B) ve svOCT mikrovasküler görüntüleme veri setini (Şekil 5A) gösteren bir kullanıcı arayüzü görüntülenecektir. Şekil 5A,B'deki mavi noktalarla gösterildiği gibi, svOCT mikrovasküler görüntüsünde en az üç mikrovasküler yer işareti noktası ve mikroskopi görüntüsünde karşılık gelen noktaları seçin.
- Pencereyi kapatın.
- Üst üste bindirilmiş svOCT ve mikroskopi görüntülerini içeren bir şekil, iki veri kümesi arasındaki ortak kaydın kalitesini değerlendirmeye yardımcı olmak için görünecektir. Kayıt yeterliyse, y yazarak ve ardından komut penceresinde enter tuşuna basarak koda devam edin. Aksi takdirde, komut penceresine n yazıp enter tuşuna basarak bu adımı yeniden deneyin.
NOT: svOCT veri setinin mikroskopi görüntüsü ile başarılı bir şekilde birlikte kaydedilmesi, her iki veri setindeki damarların birbiriyle mükemmel bir şekilde üst üste bindirildiği anlamına gelir. - Pencereyi kapatın.
- Ortak kayıtlı mikro kopya görüntüsü daha sonra görünecektir. Bu görüntüdeki tümörü konturlayın.
- Pencereyi kapatın.
- Daha sonra birkaç şekil görüntülenecektir: svOCT mikrovasküler veri seti (Şekil 5D), birlikte kaydedilmiş mikroskopi görüntüsü (Şekil 5E) ve ortak kayıtlı MRI parametre haritaları (Şekil 5F). Haritaları daha sonra analiz etmek için kaydedin.
NOT: Görüntülenen MRI haritaları, kullanıcı tarafından çizilen tümör konturu ile sınırlıdır (Şekil 5F).
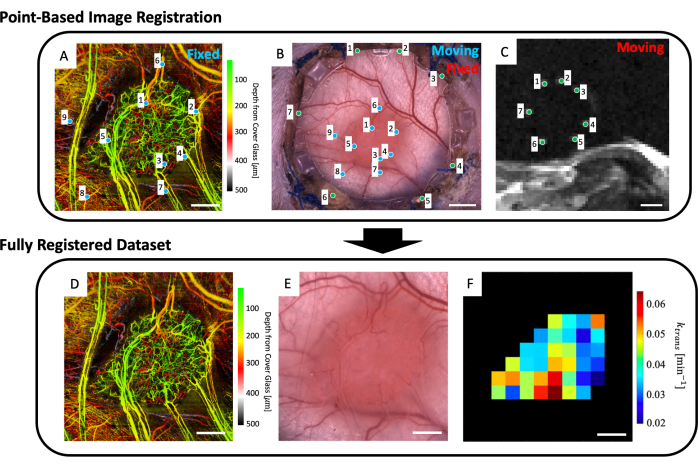
Şekil 5: Çok modlu nokta tabanlı ortak kayıt. (A) Renk derinliği kodlu mikrovasküler svOCT veri seti; ölçek çubuğu = 1 mm. (B) Pencere odasının parlak alan mikroskobu görüntüsü; ölçek çubuğu = 2 mm. (C) Referans işaretleyici halkasında bulunan yedi referans belirtecini gösteren T2w MRI dilimleri 8-11'in ortalaması; ölçek çubuğu = 5 mm. (C) İlk olarak, 'hareketli' T2w MRI veri seti, her iki görüntü setinde kullanıcı tarafından girilen yeşil işaretçiler kullanılarak 'sabit' parlak alan mikroskobu görüntüsüne birlikte kaydedilir. Daha sonra, 'hareketli' parlak alan mikroskobu görüntüsü ve birlikte kaydedilmiş MRI görüntüsü, A ve B'deki mavi işaretler kullanılarak 'sabit svOCT veri kümesine' birlikte kaydedilir. Nihai ortak kayıtlı veri seti, (D) svOCT, (E) parlak alan mikroskobu görüntüsü ve (F) fonksiyonel MRI parametre haritasını içerir. F'deki siyah vokseller tümörün dışındadır ve bu nedenle analizde dikkate alınmaz. DF için ölçek çubuğu = 1 mm. Kısaltmalar: svOCT = benek varyans optik koherens tomografi; MRG = manyetik rezonans görüntüleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Geniş görüş alanlı (FOV) 3D mikrovasküler görüntüler (6 x 6 mm,2 lateral x 1 mm derinlik) elde etmek için benek varyans optik koherens tomografi (svOCT) yapıldı. Bu görüntüleri elde etmek için, daha önce tanımlanmış bir karesel interferometreye dayanan süpürülmüş kaynak OCT sistemi kullanıldı23. OCT görüntüleri, yanal olarak bitişik iki 3 x 6 mm2 FOV taramasının birbirine dikilmesiyle elde edildi. Her B-taraması 400 A-taramasından oluşuyord...
Tartışmalar
Bu çalışmada, aynı hayvanda hem intravital mikroskopi hem de klinik olarak uygulanabilir görüntüleme (BT, MRI ve PET) gerçekleştirmek için bir iş akışı geliştirdik. Bu, intravital mikroskopi ile MRG gibi klinik görüntüleme modaliteleri arasında doğrudan korelasyon sağlayarak preklinik mikroskopi bulgularını kliniğe çevirmek amacıyla yapıldı. Konvansiyonel DSFC tasarımları metal 2,3'ten yapılmış olsa da, biyouyumlu bir plastik reç...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Dr. Carla Calçada'ya (Doktora Sonrası Araştırmacı, Prenses Margaret Kanser Merkezi) ve Dr. Timothy Samuel'e (Doktora Öğrencisi, Prenses Margaret Kanser Merkezi) tümör hücresi kültürü ve aşılama protokolü geliştirme konusundaki yardımları için teşekkür ederiz. Dr. Kathleen Ma, Dr. Anna Pietraszek ve Dr. Alyssa Goldstein (Hayvan Araştırma Merkezi, Prenses Margaret Kanser Merkezi) cerrahi protokol geliştirmeye yardımcı oldu. Jacob Broske (Tıp Mühendisliği Teknoloji Uzmanı, Prenses Margaret Kanser Merkezi) ve Wayne Keller (Donanım Müşteri Yöneticisi, Javelin Technologies - Bir TriMech Group Şirketi) pencere odalarını 3D olarak yazdırdı. James Jonkman (Gelişmiş Optik Mikroskopi Tesisi, Üniversite Sağlık Ağı), parlak alan ve floresan mikroskobu görüntü alımı için değerli rehberlik sağladı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
Referanslar
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır