A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الميثان المذاب في النظم البيئية المائية باستخدام محلل غاز التحليل الطيفي البصري
In This Article
Summary
توضح هذه الدراسة نهجا لقياس تركيزات غاز الميثان في العينات المائية باستخدام أجهزة تحليل بصرية محمولة مقترنة بغرفة حقن في حلقة مغلقة. وتتشابه النتائج مع كروماتوغرافيا الغاز التقليدية، حيث تقدم بديلا عمليا ومنخفض التكلفة مناسبا بشكل خاص للدراسات الميدانية عن بعد.
Abstract
أصبح قياس تدفقات غازات الاحتباس الحراري (GHG) وتجمعات في النظم البيئية شائعا بشكل متزايد في الدراسات البيئية نظرا لأهميتها بتغير المناخ. مع ذلك ، تزداد أيضا الحاجة إلى منصات تحليلية قابلة للتكيف مع قياس التجمعات والتدفقات المختلفة داخل مجموعات البحث. تهدف هذه الدراسة إلى تطوير إجراء لاستخدام أجهزة تحليل الغاز المحمولة القائمة على التحليل الطيفي البصري ، والتي تم تصميمها وتسويقها في الأصل لقياسات تدفق الغاز ، لقياس تركيزات غازات الدفيئة في العينات المائية. يتضمن البروتوكول تقنية توازن فراغ الرأس التقليدية متبوعة بحقن عينة فرعية من غاز فراغ الرأس في غرفة متصلة من خلال حلقة مغلقة بمنافذ المدخل والمخرج لمحلل الغاز. يتم تصنيع الغرفة من جرة ميسون عامة ومستلزمات معملية بسيطة ، وهي حل مثالي للعينات التي قد تتطلب تخفيفا قبل الحقن. ترتبط تركيزات الميثان المقاسة بالغرفة ارتباطا وثيقا (ص2 > 0.98) بالتركيزات المحددة بشكل منفصل من خلال الكشف عن تأين اللهب الكروماتوغرافيا الغازية (GC-FID) على عينات فرعية من نفس القوارير. هذا الإجراء مناسب بشكل خاص للدراسات الميدانية في المناطق النائية حيث لا تتوفر معدات وإمدادات الكروماتوغرافيا بسهولة ، مما يوفر حلا عمليا وأرخص وأكثر كفاءة لقياس تركيزات غاز الميثان وغيره من غازات الدفيئة الذائبة في النظم المائية.
Introduction
تعد النظم البيئية في الطور البيني الأرضي المائي ، مثل الأراضي الرطبة والبحيرات والخزانات والأنهار والجداول ، أحواض ومصادر مهمة لغازات الاحتباس الحراري (GHG) مثل ثاني أكسيد الكربون (CO2) والميثان (CH4) وأكسيد النيتروز (N2O) 1،2. CH4 ، على وجه التحديد ، يتم إنتاجه أثناء التنفس اللاهوائي في مساحات المسام المشبعة لمسام الرواسب. بمجرد إنتاجه ، يتأكسد جزء ويتحول إلى ثاني أكسيد الكربون2 ، بينما ينتشر الباقي في النهاية عبر عمود الماء والغطاء النباتي أو ينفجر في فقاعات3. يقدم تركيز CH4 في الماء الذي يشبع مسام الرواسب (أي المياه المسامية) في وقت معين لمحة عن التوازن بين CH4 المنتجة والمستهلكة والمنقولة4. عند القياس على الملامح الرأسية أو الوقت ، يسمح تركيز مياه المسام أيضا بتحديد المناطق الأكثر نشاطا في إنتاج واستهلاك CH4 وتنوعها الموسمي.
تقليديا ، تتضمن طرق تحديد تركيز غازات الدفيئة من المياه المسامية في النظم البيئية معالجة عينات المياه التي تم جمعها في الحقل لموازنة الغازات في فراغ تم إنشاؤه. بعد ذلك ، يتم تحليل فراغ الرأس من خلال كروماتوغرافيا الغاز لتحديد التركيزات5. في حين أن هذه الطريقة مطبقة على نطاق واسع في الدراسات البيئية ، إلا أنها تتطلب أنظمة الكشف عن تأين اللهب الكروماتوغرافيا الغازية (GC-FID) التي تستلزم تخصيص مساحة مختبرية تقليدية ودرجة عالية من المعرفة المتخصصة للمعايرة والتشغيل (على سبيل المثال6). كما يتطلب استخدام المواد الاستهلاكية المتخصصة ، مثل الخزانات الكبيرة للغازات الحاملة (أي النيتروجين (N 2) والهيليوم (He)) ، والتي لا تتوفر بسهولة في المواقع النائية. قد تقيد هذه المتطلبات والخدمات اللوجستية المرتبطة بنقل العينات إلى المختبر تصميم أخذ العينات ، وفي بعض الحالات ، تحد من نطاق الدراسة عندما لا تتوفر معدات الكروماتوغرافيا.
هدفت هذه الدراسة إلى تطوير طريقة بديلة لقياس تركيزات غازات الدفيئة الذائبة من عينات فراغ المحاليل المائية باستخدام أجهزة تحليل الغازات المحمولة القائمة على التحليل الطيفي البصري. يعد هذا النوع من محللات الغاز الضوئية بديلا فعالا من حيث التكلفة لأنظمة GC-FID القياسية ، كما أن قابليته للنقل تجعله خيارا مثاليا لتطبيقات العمل الميداني. تنتج أجهزة تحليل الغاز المحمولة القائمة على التحليل الطيفي البصري قياسات تركيز الغاز عالية التردد (أي ~ 1 ثانية -1) مع أوقات استجابة تتراوح من 2 إلى 5 ثوان ، اعتمادا على العلامات التجارية والموديلات. تم تصميم هذه الأدوات وتسويقها بشكل أساسي لتحديد تدفقات الغاز من الأسطح الباعثة لغازات الدفيئة مثل التربة والمياه والغطاء النباتي7،8،9. تسمح أجهزة التحليل البصرية بحساب التدفق من قياسات التركيز المستمرة في غرف مساحة الحالة غير المستقرة المنتشرة فوق الأسطح المنبعثة ذات الأهمية. في استخدامها المنتظم المقصود مع الغرف السطحية ، تسمح القياسات عالية التردد لمعدل التغير في التركيزات الملحوظة في الغرفة وأبعاد الغرفة المعروفة والضغط ودرجة الحرارة بتفسير تلك البيانات فيما يتعلق بمعدل الانبعاث (أو الامتصاص) لكل مساحة سطح (أي التدفقات السطحية)10. ومع ذلك ، فإن أجهزة تحليل الغاز المحمولة ليست مجهزة ولا محسنة للتركيزات الذائبة في الوسائط المائية ، مما يستلزم تعديلات وتفسيرات إضافية لهذا النوع من التحليل.
من خلال الاستفادة من العروض التوضيحية السابقة لاستخدام أجهزة التحليل البصري لتحديد التركيزات في العينات المنفصلة من المساحاتالرئيسية 8 ، قمنا بتصميم غرفة صغيرة مغلقة (أي لا تنبعث منها الأسطح) تتصل بالمحلل في حلقة مغلقة. يسمح التغيير في التركيزات بعد حقن العينة الفرعية لغاز فراغ الرأس ، متبوعا بحسابات التخفيف ، بتحديد تركيزات فراغ الرأس الأصلي. تم تقييم دقة هذا النهج من خلال مقارنة نتائجه بتلك التي تم الحصول عليها من خلال GC-FID في نفس العينات. يتم توضيح هذه الطريقة بشكل أكبر من خلال حالة الاستخدام التي حللت الملامح الرأسية ل CH4 في عينات المياه المسامية التي تم جمعها من المواقع التجريبية في مستنقع المياه العذبة في لويزيانا.
Protocol
1. أخذ عينات وتحليل مياه المسام
- اجمع العينات باستخدام أجهزة أخذ عينات غسيل الكلى في مياه المسام (مختلس النظرين)11. انشر مختلسي النظر في المواقع ذات الصلة في موقع الدراسة. في الدراسة التوضيحية ، تم نشر 6 مختلس النظر على الرقعتين النباتيتين المهيمتين في مستنقع المياه العذبة: ثلاثة على رقعة تهيمن عليها Sagitaria lancifolia والثلاثة الأخرى على رقعة تهيمن عليها S. lancifolia و Typha latifolia .
- اجمع العينات 4 مرات في يونيو وسبتمبر وأكتوبر وديسمبر. اجمع العينات على 10 أعماق مختلفة من سطح التربة حتى ~ 50 سم تحتها. اتبعت العينات الطريقة الموضحة في12،13.
- املأ خلايا أخذ العينات ب 61 مل من الماء منزوع الأيونات ~ 20 يوما قبل أخذ العينات. قم بفقاعة الماء منزوع الأيونات مع N2 لمدة 5 دقائق في المختبر لإزالة الأكسجين قبل استخدامه في الحقل.
- أثناء أخذ العينات ، اسحب 25 مل من الماء من الخلية باستخدام حقنة متصلة بخط استخراج الخلية. بعد ذلك ، أعد ملء الخلايا بالماء العذب منزوع الأيونات مسبقا باستخدام N2 من خلال خط إعادة شحن الخلية الثانوي. إذا كانت قياسات التركيز مطلوبة بعد التجميع مباشرة، فتابع إلى الخطوة 2.1.
- أضف الماء المستخرج إلى 10 مل من القوارير الزجاجية المحفوظة ب 0.2 مل من 0.1 مل من حمض الهيدروكلوريك ، وغطيها بالحاجز ، وضعيها في الثلاجة حتى التحليل في المختبر.
ملاحظة: نرحب بمستخدمي هذه الطريقة لتعديل أعماق التجميع وجدول أخذ العينات والتكرار بناء على احتياجات الدراسة المحددة.
2. قياس تركيز غازات الاحتباس الحراري
- إجراء موازنة مساحة الرأس لعينات مياه المسام في حقنة
- قم بإنشاء عينات من غاز مسافة الرأس باستخدام تقنية التوازن14. استخدم حقنة سعة 30 مل لسحب 5 مل من الماء (Vpw) من العينات التي تم جمعها في الحقل ثم أضف 15 مل من N2 (نقاء فائق 99.999٪) لإنشاء مسافة الرأس (Vhs).
- حرك المحقنة بقوة وثبات لمدة 5 دقائق ، يدويا أو باستخدام شاكر هزاز (إن وجد). قم بحقن 12 مل من عينة فرعية من غاز الفراغ في قارورة 10 مل تم إخلاؤها مسبقا تستخدم لقياسات تركيز الغاز باستخدام المحلل البصري في الخطوات التالية (الشكل 1). قم بإخلاء القوارير بمضخة تمعجية15 أو اسحب المكبس يدويا من حقنة 60 مل على القارورة المغلقة وضخ الهواء 3x.
ملاحظة: يمكن استخدامه بدلا من N2 لإنشاء مسافة الرأس. يعتمد إجراء إضافة N2 أو He إلى المحقنة على التكيف أو المنظم المحدد للخزان الفعلي المتاح للمستخدمين. تتضمن هذه الإضافة عادة اقتران المحقنة بالخزان باستخدام أنبوب مطابقة أو استخراج مع المحقنة من منفذ أخذ العينات الذي يتكيف مع الخزان. اعتمادا على ظروف الموقع والخدمات اللوجستية المرتبطة بها ، يمكن للمستخدمين استخدام الهواء المحيط لإنشاء الفراغ.
- إنشاء غرفة الحقن
- قم بتصنيع غرفة حقن يمكنها قبول كمية صغيرة من الهواء (~ 1 - 5 مل) في حجم محكم الغلق من الهواء يتصل بتدفق محلل الغاز وخارجه لتشكيل حلقة مغلقة (جدول المواد). غرفة الحقن والمحلل هما العنصران الرئيسيان للنظام (الشكل 2).
- قم بتعديل الغطاء المعدني لوعاء ميسون سعة 365 مل عن طريق حفر ثقب واحد بقطر 11 مم ليناسب حاجزا واحدا كمنفذ حقن وفتحتين بقطر 7 مم لإدخال صمامات محبس تتصل بالمحلل. استخدم غراء الايبوكسي لتشديد منفذ الحقن والتجهيزات وضمان إغلاق الغرفة.
- قم بتوصيل غرفة الحقن بالمحلل البصري
- قم بتوصيل البرطمان بمنافذ المدخل والمخرج للمحلل البصري باستخدام قطر داخلي 5/32 بوصة (ID) وقطر خارجي 1/4 بوصة (OD) أنابيب بلاستيكية PFA وحساب حجمها الإضافي. تأكد من أن الأنبوب يتبع توصية الشركة المصنعة للأداة وأنه نظيف وجاف بدون تكاثف.
- اضبط الصمامات التي تربط غرفة الحقن بالجهاز لفتحها لإنشاء دائرة هواء مغلقة الحلقة. انتظر حتى تستقر تركيزات الغاز.
- حقن عينة في الغرفة
- عندما يستقر التركيز في الغرفة والإشارة في المحلل (أي الانحراف المعياري <0.03 جزء في المليون) ، قم بحقن 2 مل من عينة فرعية من القوارير التي تحتوي على عينة مسافة الرأس التي تم إنشاؤها في الخطوة 2.1.2. انتظر حتى تستقر التركيزات في المحلل مرة أخرى قبل حقن العينة الفرعية التالية (الشكل 3).
- حقن ما يصل إلى 20 عينة فرعية متتالية أو أقل إذا اقترب التركيز من 100 جزء في المليون (انظر8للاطلاع على التأثيرات على الدقة فوق هذه العتبة). تحليل CH4 تحقق من المعايير لكل 5 عينات وتقييم الفرق مع القياسات الفعلية باستخدام الانحراف المعياري النسبي (RSD).
- عند الانتهاء من مجموعة الحقن المكدسة ، افصل أحد الخطوط المتصلة بالجهاز لإعادة ضبط الغرفة إلى الضغط المحيط وتجنب الضغط الكبير وتراكم تركيز الميثان.
ملاحظة: بناء على عمليات الاختبار المتعددة ، تم تحديد أن الإشارة استقرت ~ 15 ثانية بعد الحقن ، ولكن قد تكون هناك حاجة إلى أوقات مختلفة استجابة لمواصفات تسجيل الأداة الأخرى (الشكل 3). كان معدل تدفق الأداة المستخدمة ~ 1 لتر / دقيقة مع وقت استجابة 5 ثوان وضغط التجويف أثناء التحليلات المختلفة في أيام مختلفة تتراوح من 720 إلى 745 Torr.
- احسب تركيزات CH4 في الفراغ
- لكل عينة فرعية ، احسب تركيز غازات الدفيئة المستهدفة (على سبيل المثال ، CH4 ،CO 2 ، N 2O) في فراغ الرأس (Chs - μmol / mol) مع المعادلة 1:
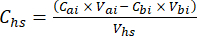 المعادلة [1]
المعادلة [1]
حيث Vhs هو حجم العينة الفرعية لمسافة الرأس. - احسب التركيزات قبل (Cbi - μmol mol-1) وبعد (Cai - μmol mol-1) كمتوسط 15 قياسا (~ 15 ثانية) قبل الحقن و 15 بعد تثبيت الإشارة بعد الحقن. احسب الأحجام بالمل ، قبل الحقن (Vbi) وبعد (Vai) بالمعادلتين 2 و 3:
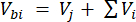 [2]
[2]
و
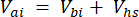 [3]
[3]
حيث Vj (مل) هو الحجم المضاف للجرة (365 مل) والخراطيم (125.4 مل) ، و Vi (مل) هو الحجم المتراكم للعينات الفرعية المحقونة.
- لكل عينة فرعية ، احسب تركيز غازات الدفيئة المستهدفة (على سبيل المثال ، CH4 ،CO 2 ، N 2O) في فراغ الرأس (Chs - μmol / mol) مع المعادلة 1:
- احسب تركيز مياه المسام
- احسب الضغط الجزئي (Pi - MPa) ل CO2 أو CH4 أو N2O في الفراغ باستخدام جزء الخلد من الغاز في فراغ الرأس والضغط الجوي (P) أثناء معالجة العينة باستخدام المعادلة 4:
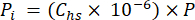 [4]
[4] - احسب التركيز المكافئ المائي لغازات الدفيئة في المياه المسامية باستخدام معادلة التخفيف (المعادلة 5) مع تباعد الرأس والتركيزات والأحجام المائية المكافئة:
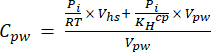 [5]
[5]
حيث R هو ثابت الغاز العالمي (0.008314 L MPa mol−1 K−1) ، هو درجة حرارة الهواء (K) ، Vhs هو حجم فراغ الرأس (مل) ، KHcp هو ثابت تقلب هنري ل CO2 أو CH4 أو N2O (2.96 ، 67.13 ، و 3.82 L MPa / mol ، على التوالي) 16 ، و Vpw حجم العينة الفرعية السائلة المستخدمة لإنشاء مسافة الرأس (مل). - استخدم T و P المسجلين أثناء القياسات. كان متوسط T و P أثناء تحليل عينات المشروع التوضيحي 295.15 كلفن و 0.101325 ميجا باسكال ، على التوالي.
- احسب الضغط الجزئي (Pi - MPa) ل CO2 أو CH4 أو N2O في الفراغ باستخدام جزء الخلد من الغاز في فراغ الرأس والضغط الجوي (P) أثناء معالجة العينة باستخدام المعادلة 4:
3. التحقق من الصحة مقابل قياسات الكروماتوغرافيا القياسية
- تحليل تركيزات CH4 المعروفة المختلفة في قوارير 10 مل في كروماتوجراف الغاز التقليدي. استخدم ثلاث مجموعات متطابقة من 20 معيارا لكل منها. تراوحت التركيزات الدنيا من 5 إلى 100 جزء في المليون وزادت بزيادات قدرها 5 جزء في المليون.
- تحديد تركيزات CH4 عن طريق الكشف عن تأين اللهب على كروماتوجراف الغاز. استخدم الكروماتوجراف عمودا مساميا معبأ بالبوليمر الماص مع He (25 مل / دقيقة) كغاز ناقل. لتشغيل قياسات تركيزات المعايير ، قم بمعايرة الكروماتوجراف إلى منحنى مناسب (ص2) > 0.99.
- بعد الكروماتوغرافيا ، تابع تحديد تركيز CH4 في نفس القوارير القياسية باستخدام الطريقة الموضحة أعلاه ، باستخدام محلل بصري تمت معايرته من قبل الشركة المصنعة (أي الدقة (300 ثانية ، 1σ): 0.3 جزء في البليون CH4).
- تقييم دقة الطريقة من خلال تركيب انحدار خطي على نتائج الكروماتوغرافيا والمحلل البصري للمجموعات القياسية الثلاث. تقييم قابلية تكرار الطريقة من خلال مقارنة المنحدرات واعتراضات الانحدارات التي يتم إجراؤها داخل كل مجموعة من المعايير. قم بتقييم المقارنة باستخدام نموذج قياسي للمربع الأدنى مع التركيز على الرافعة المالية للتأثير. تقييم جميع الانحدارات والمقارنات عند مستوى دلالة 0.05.
النتائج
المحلل البصري مقابل كروماتوغرافيا الغاز
أظهرت النتائج التي تم الحصول عليها من خلال كروماتوغرافيا الغاز والمحلل البصري لمجموعات المعايير الثلاث نوبات خطية جيدة (أي ص2 > 0.98) مع منحدرات قريبة من واحد (الشكل 4). كانت منحدرات الانحدارات ف?...
Discussion
أظهرت هذه الدراسة قابلية تطبيق أجهزة تحليل الغاز المحمولة القائمة على التحليل الطيفي البصري إلى جانب غرفة حقن مخصصة لتحليل المساحات التي تم إنشاؤها من عينات المياه. ركز العرض التوضيحي على CH4 ، ولكن يمكن تطبيق البروتوكول على تحليل غازات الدفيئة الأخرى ذات الصلة مث?...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل هذا العمل من خلال جوائز وزارة الطاقة DE-SC0021067 و DE-SC0023084 و DE-SC0022972. بيانات تركيز المياه المسامية للمواقع التي تم أخذ عينات منها في المستنقع متاحة للجمهور في أرشيف بيانات ESS-DIVE (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524 ، تم الوصول إليه في 21 يونيو 2024)
Materials
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
References
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50 (2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973 (2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498 (2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920 (2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved