É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição de metano dissolvido em ecossistemas aquáticos usando um analisador de gás de espectroscopia óptica
Neste Artigo
Resumo
Este estudo demonstra uma abordagem para medir as concentrações de gás metano em amostras aquosas usando analisadores ópticos portáteis acoplados a uma câmara de injeção em circuito fechado. Os resultados são semelhantes à cromatografia gasosa convencional, apresentando uma alternativa prática e de baixo custo, particularmente adequada para estudos de campo remotos.
Resumo
A medição de fluxos e pools de gases de efeito estufa (GEE) em ecossistemas está se tornando cada vez mais comum em estudos ecológicos devido à sua relevância para as mudanças climáticas. Com isso, cresce também a necessidade de plataformas analíticas adaptáveis à medição de diferentes pools e fluxos dentro de grupos de pesquisa. Este estudo tem como objetivo desenvolver um procedimento para usar analisadores de gases portáteis baseados em espectroscopia óptica, originalmente projetados e comercializados para medições de fluxo de gás, para medir concentrações de GEE em amostras aquosas. O protocolo envolve a técnica tradicional de equilíbrio do headspace, seguida pela injeção de uma subamostra de gás do headspace em uma câmara conectada por meio de um circuito fechado às portas de entrada e saída do analisador de gás. A câmara é fabricada a partir de um frasco de pedreiro genérico e suprimentos de laboratório simples, e é uma solução ideal para amostras que podem exigir diluição pré-injeção. As concentrações de metano medidas com a câmara estão fortemente correlacionadas (r2 > 0,98) com as concentrações determinadas separadamente por cromatografia gasosa-detecção de ionização de chama (GC-FID) em subamostras dos mesmos frascos. O procedimento é particularmente relevante para estudos de campo em áreas remotas onde equipamentos e suprimentos de cromatografia não estão prontamente disponíveis, oferecendo uma solução prática, mais barata e mais eficiente para medir as concentrações de metano e outros gases de efeito estufa dissolvidos em sistemas aquáticos.
Introdução
Os ecossistemas na interfase terrestre-aquática, como pântanos, lagos, reservatórios, rios e riachos, são importantes sumidouros e fontes de gases de efeito estufa (GEE), como dióxido de carbono (CO2), metano (CH4) e óxido nitroso (N2O)1,2. O CH4, especificamente, é produzido durante a respiração anaeróbica nos espaços porosos saturados dos poros dos sedimentos. Uma vez produzido, uma fração é oxidada e transformada em CO2, enquanto o restante acabará se difundindo pela coluna d'água e pela vegetação ou explodindo em bolhas3. A concentração de CH4 na água que satura os poros do sedimento (ou seja, água dos poros) em um determinado momento oferece um vislumbre do equilíbrio entre CH4 produzido, consumido e transportado4. Quando medida em perfis verticais ou tempo, a concentração de água porosa também permite identificar zonas mais ativas na produção e consumo de CH4 e sua variação sazonal.
Tradicionalmente, os métodos para determinar a concentração de GEE da água porosa nos ecossistemas envolvem o processamento de amostras de água coletadas no campo para equilibrar os gases em um headspace criado. Em seguida, o headspace é analisado por cromatografia gasosa para determinar as concentrações5. Embora esse método seja amplamente aplicado em estudos ecológicos, ele requer sistemas de detecção de ionização de chama por cromatografia gasosa de bancada (GC-FID) que envolvem a alocação de espaço de laboratório convencional e um alto grau de conhecimento especializado para calibrar e operar (por exemplo,6). Também requer o uso de consumíveis especializados, como grandes tanques de gases de arraste (ou seja, nitrogênio (N2) e hélio (He)), que não estão prontamente disponíveis em locais remotos. Esses requisitos e a logística associada ao transporte da amostra para o laboratório podem restringir o projeto de amostragem e, em alguns casos, limitar o escopo do estudo quando o equipamento de cromatografia não estiver disponível.
Este estudo teve como objetivo desenvolver um método alternativo para medir as concentrações de gases de efeito estufa dissolvidos a partir de amostras de soluções aquosas usando analisadores de gases portáteis baseados em espectroscopia óptica. Este tipo de analisador óptico de gás é uma alternativa econômica aos sistemas GC-FID padrão, e sua portabilidade o torna a escolha ideal para aplicações de trabalho de campo. Os analisadores de gás portáteis baseados em espectroscopia óptica produzem medições de concentração de gás de alta frequência (ou seja, ~ 1 s-1) com tempos de resposta de 2 a 5 s, dependendo das marcas e modelos. Esses instrumentos são projetados e comercializados principalmente para determinar os fluxos de gases de superfícies emissoras de GEE, como solos, água e vegetação 7,8,9. Os analisadores ópticos permitem o cálculo do fluxo a partir de medições contínuas de concentração em câmaras de headspace não estacionárias implantadas sobre as superfícies emissoras de interesse. Em seu uso regular pretendido com câmaras de superfície, as medições de alta frequência da taxa de mudança nas concentrações observadas na câmara e as dimensões, pressão e temperatura conhecidas da câmara permitem a interpretação desses dados quanto à taxa de emissão (ou absorção) por área de superfície (ou seja, fluxos de superfície) 10 . No entanto, os analisadores de gás portáteis não são equipados nem otimizados para concentrações dissolvidas em meio aquoso, necessitando de adaptações e interpretações adicionais para esse tipo de análise.
Aproveitando demonstrações anteriores do uso de analisadores ópticos para determinar concentrações em amostras discretas de headspaces8, projetamos uma câmara pequena e fechada (ou seja, sem superfícies emissoras) que se conecta ao analisador em um circuito fechado. A alteração das concentrações após a injecção da subamostra de gás do headspace, seguida de cálculos de diluição, permite determinar as concentrações do headspace original. A precisão dessa abordagem foi avaliada comparando-se seus resultados com os obtidos por GC-FID nas mesmas amostras. O método é demonstrado ainda por meio de um caso de uso que analisou os perfis verticais de CH4 em amostras de água porosa coletadas de locais experimentais em um pântano de água doce na Louisiana.
Protocolo
1. Amostragem e análise de águas porosas
- Colete as amostras usando amostradores de diálise em água porosa (peepers)11. Implante os espiões em locais relevantes do local de estudo. No estudo de demonstração, 6 observadores foram implantados nas duas manchas de vegetação dominantes de um pântano de água doce: três em uma mancha dominada por Sagitaria lancifolia e as outras três em uma mancha co-dominada por S. lancifolia e Typha latifolia .
- Colete amostras 4x em junho, setembro, outubro e dezembro. Colete amostras em 10 profundidades diferentes da superfície do solo até ~ 50 cm abaixo dela. A amostragem seguiu o método descrito em 12,13.
- Encha as células de amostragem com 61 mL de água deionizada ~ 20 dias antes da amostragem. Borbulhe água deionizada com N2 por 5 min no laboratório para remover o oxigênio antes de usá-lo no campo.
- Durante a amostragem, retire 25 mL de água da célula com uma seringa conectada à linha de extração da célula. Em seguida, reabasteça as células com água fresca deionizada pré-borbulhada com N2 através de uma linha de recarga celular secundária. Se forem necessárias medições de concentração logo após a coleta, continue para a etapa 2.1.
- Adicione a água extraída a frascos de vidro de 10 mL preservados com 0,2 mL de HCl 0,1 M, tampe com septo e leve à geladeira até a análise em laboratório.
NOTA: Os usuários deste método podem modificar as profundidades de coleta, o cronograma de amostragem e a frequência com base nas necessidades específicas do estudo.
2. Medição da concentração de gases de efeito estufa
- Realizar o equilíbrio do headspace de amostras de água porosa em uma seringa
- Crie amostras de gás do headspace usando a técnica de equilíbrio14. Use uma seringa de 30 mL para extrair 5 mL de água (Vpw) das amostras coletadas no campo e, em seguida, adicione 15 mL de N2 (Ultra High Purity 99,999%) para criar o headspace (Vhs).
- Agite a seringa vigorosa e consistentemente durante 5 min, manualmente ou utilizando um agitador oscilante (se disponível). Injete 12 mL de subamostra de gás headspace em um frasco pré-evacuado de 10 mL usado para medições de concentração de gás com o analisador óptico nas etapas a seguir (Figura 1). Evacue os frascos para injetáveis com uma bomba peristáltica15 ou puxe manualmente o êmbolo de uma seringa de 60 mL no frasco fechado e bombeie o ar para fora 3x.
NOTA: Ele pode ser usado em vez de N2 para criar o headspace. O procedimento para adicionar N2 ou He à seringa depende da adaptação específica ou regulador do tanque real disponível para os usuários. Essa adição normalmente envolve o acoplamento da seringa ao tanque usando tubos correspondentes ou a extração com a seringa de uma porta de amostragem adaptada ao tanque. Dependendo das condições do local e da logística associada, os usuários podem usar o ar ambiente para criar o headspace.
- Crie a câmara de injeção
- Fabrique uma câmara de injeção que possa aceitar um pequeno volume de ar (~ 1 - 5 mL) em um volume selado de ar que se conecta à entrada e saída do analisador de gás para formar um circuito fechado (Tabela de Materiais). A câmara de injeção e o analisador são os dois principais elementos do sistema (Figura 2).
- Modifique a tampa metálica de um frasco de vidro de 365 mL perfurando um orifício de 11 mm de diâmetro para encaixar um septo como porta de injeção e dois orifícios de 7 mm de diâmetro para inserir válvulas de torneira que se conectam ao analisador. Use cola epóxi para apertar a porta de injeção e as conexões e garantir a vedação da câmara.
- Conecte a câmara de injeção ao analisador óptico
- Conecte o frasco com as portas de entrada e saída do analisador óptico usando 5/32 de polegada de diâmetro interno (ID) e 1/4 de polegada de diâmetro externo (OD) Tubos de plástico PFA e são responsáveis por seu volume adicional. Certifique-se de que a tubulação siga a recomendação do fabricante do instrumento e esteja limpa e seca, sem condensação.
- Defina as válvulas que conectam a câmara de injeção ao instrumento para abrir para criar um circuito de ar de circuito fechado. Aguarde até que as concentrações de gás se estabilizem.
- Injetar uma amostra na câmara
- Quando a concentração na câmara e o sinal no analisador se estabilizarem (ou seja, desvio padrão <0,03 ppm), injete 2 mL de uma subamostra dos frascos contendo a amostra de headspace criada na etapa 2.1.2. Aguarde que as concentrações no analisador se estabilizem novamente antes de injetar a próxima subamostra (Figura 3).
- Injetar até 20 subamostras consecutivas ou menos se a concentração se aproximar de 100 ppm (ver8para efeitos sobre a precisão acima deste limiar). Analise os padrões de verificação CH4 para cada 5 amostras e avalie a diferença com as medições reais usando o desvio padrão relativo (RSD).
- Quando terminar com o conjunto de injeções empilhadas, desconecte uma das linhas conectadas ao instrumento para redefinir a câmara para a pressão ambiente e evitar o acúmulo significativo de pressão e concentração de metano.
NOTA: Com base em vários testes, foi determinado que o sinal se estabilizou ~ 15 s após a injeção, mas tempos diferentes podem ser necessários em resposta a outras especificações de gravação do instrumento (Figura 3). A vazão do instrumento utilizado foi de ~1 L/min com tempo de resposta de 5 s e pressão cavitária durante as diferentes análises em diferentes dias variando de 720 a 745 Torr.
- Calcule as concentrações de CH4 no headspace
- Para cada subamostra, calcular a concentração do GEE alvo (por exemplo, CH4, CO2, N2O) no headspace (Chs - μmol/mol) com a equação 1:
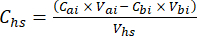 equação [1]
equação [1]
Onde Vhs é o volume da subamostra do headspace. - Calcule as concentrações antes (Cbi - μmol mol-1) e depois (Cai - μmol mol-1) injeções como a média de 15 medições (~ 15 s) antes da injeção e 15 após a estabilização do sinal pós-injeção. Calcular os volumes em ml antes de (Vbi) e depois das injecções (Vai) com as equações 2 e 3:
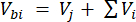 [2]
[2]
e
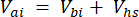 [3]
[3]
Onde Vj (mL) é o volume adicionado do frasco (365 mL) e da mangueira (125,4 mL) e Vi (mL) é o volume acumulado das subamostras injetadas.
- Para cada subamostra, calcular a concentração do GEE alvo (por exemplo, CH4, CO2, N2O) no headspace (Chs - μmol/mol) com a equação 1:
- Calcular a concentração de água porosa
- Calcular a pressão parcial (Pi - MPa) de CO2, CH4 ou N2O no headspace utilizando a fracção molar do gás no headspace e a pressão atmosférica (P) durante o processamento da amostra utilizando a equação 4:
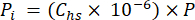 [4]
[4] - Calcular a concentração equivalente aquosa de GEE na água porosa utilizando uma equação de diluição (equação 5) com concentrações e volumes equivalentes aquosos e de espaço livre:
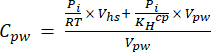 [5]
[5]
Onde R é a constante universal do gás (0,008314 L MPa mol−1 K−1), é a temperatura do ar (K), Vhs é o volume do headspace (mL), KHcp é a constante de volatilidade de Henry de CO2, CH4 ou N2O (2,96, 67,13 e 3,82 L MPa/mol, respectivamente)16, e Vpw o volume da subamostra líquida usada para criar o headspace (mL). - Use T e P registrados durante as medições. As médias de T e P durante a análise das amostras do projeto de demonstração foram de 295,15 K e 0,101325 MPa, respectivamente.
- Calcular a pressão parcial (Pi - MPa) de CO2, CH4 ou N2O no headspace utilizando a fracção molar do gás no headspace e a pressão atmosférica (P) durante o processamento da amostra utilizando a equação 4:
3. Validação em relação a medições de cromatografia padrão
- Analise diferentes concentrações conhecidas de CH4 em frascos de 10 mL em um cromatógrafo de gás convencional. Use três grupos idênticos de 20 padrões cada. As concentrações mais baixas variaram de 5 a 100 ppm e aumentaram em incrementos de 5 ppm.
- Determinar as concentrações de CH4 por detecção de ionização de chama num cromatógrafo de fase gasosa. O cromatógrafo utilizou uma coluna compactada com absorvente de polímero poroso com He (25 mL/min) como gás de arraste. Para efectuar as medições das concentrações dos padrões, calibrar o cromatógrafo para um ajuste de curva (r2) > 0,99.
- Após a cromatografia, proceda à determinação da concentração de CH4 nos mesmos frascos padrão usando o método descrito acima, usando um analisador óptico calibrado pelo fabricante (ou seja, precisão (300 s, 1σ): 0,3 ppb CH4).
- Avaliar a precisão do método ajustando uma regressão linear aos resultados da cromatografia e do analisador óptico dos três grupos padrão. Avaliar a replicabilidade do método comparando as inclinações e interceptações das regressões realizadas dentro de cada grupo de padrões. Avalie a comparação usando um Modelo Padrão de Mínimos Quadrados com ênfase na Alavancagem de Efeito. Avaliar todas as regressões e comparações ao nível de significância de 0,05.
Resultados
Analisador óptico versus cromatografia gasosa
Os resultados obtidos por cromatografia gasosa e pelo analisador óptico para os três grupos de padrões mostraram bons ajustes lineares (ou seja, r2 > 0,98) com inclinações próximas a um (Figura 4). As inclinações das regressões nos três experimentos foram estatisticamente semelhantes (F(2) = 0,478, p = 0,623), sugerindo a reprodutibilidade dos resultados. É impo...
Discussão
Este estudo demonstrou a aplicabilidade de analisadores de gás portáteis baseados em espectroscopia óptica acoplados a uma câmara de injeção personalizada para analisar headspaces criados a partir de amostras de água. A demonstração se concentrou no CH4, mas o protocolo pode ser aplicado à análise de outros GEEs relevantes, como CO2 e N2O8. O objetivo era expandir as avaliações sistemáticas anteriores desses sistemas ...
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi financiado por meio dos prêmios DOE DE-SC0021067, DE-SC0023084 e DE-SC0022972. Os dados de concentração de água porosa dos locais amostrados no pântano estão disponíveis publicamente no ESS-DIVE Data Archive (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524 , acessado em 21 de junho de 2024)
Materiais
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
Referências
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50 (2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973 (2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498 (2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920 (2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados