Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de metano disuelto en ecosistemas acuáticos mediante un analizador de gases por espectroscopia óptica
En este artículo
Resumen
Este estudio demuestra un enfoque para medir las concentraciones de gas metano en muestras acuosas utilizando analizadores ópticos portátiles acoplados a una cámara de inyección en un circuito cerrado. Los resultados son similares a los de la cromatografía de gases convencional, presentando una alternativa práctica y de bajo coste especialmente adecuada para estudios de campo a distancia.
Resumen
La medición de los flujos y reservas de gases de efecto invernadero (GEI) en los ecosistemas es cada vez más común en los estudios ecológicos debido a su relevancia para el cambio climático. Con ello, también crece la necesidad de plataformas analíticas adaptables a la medición de diferentes pools y flujos dentro de los grupos de investigación. Este estudio tiene como objetivo desarrollar un procedimiento para utilizar analizadores de gases portátiles basados en espectroscopia óptica, originalmente diseñados y comercializados para mediciones de flujo de gas, para medir concentraciones de GEI en muestras acuosas. El protocolo implica la técnica tradicional de equilibrio del espacio de cabeza seguida de la inyección de una submuestra de gas de espacio de cabeza en una cámara conectada a través de un circuito cerrado a los puertos de entrada y salida del analizador de gases. La cámara se fabrica a partir de un frasco de vidrio genérico y suministros de laboratorio simples, y es una solución ideal para muestras que pueden requerir dilución previa a la inyección. Las concentraciones de metano medidas con la cámara están estrechamente correlacionadas (r2 > 0,98) con las concentraciones determinadas por separado mediante cromatografía de gases-detección de ionización de llama (GC-FID) en submuestras de los mismos viales. El procedimiento es particularmente relevante para estudios de campo en áreas remotas donde el equipo y los suministros de cromatografía no están fácilmente disponibles, ofreciendo una solución práctica, más barata y más eficiente para medir las concentraciones de metano y otros gases de efecto invernadero disueltos en los sistemas acuáticos.
Introducción
Los ecosistemas en la interfase terrestre-acuática, como humedales, lagos, embalses, ríos y arroyos, son importantes sumideros y fuentes de gases de efecto invernadero (GEI) como el dióxido de carbono (CO2), el metano (CH4) y el óxido nitroso (N2O)1,2. ElCH4, específicamente, se produce durante la respiración anaeróbica en los espacios porosos saturados de los poros de los sedimentos. Una vez que se produce, una fracción se oxida y se transforma en CO2, mientras que el resto eventualmente se difundirá a través de la columna de agua y la vegetación o estallará en burbujas3. La concentración de CH4 en el agua que satura los poros del sedimento (es decir, el agua de los poros) en un momento dado permite vislumbrar el equilibrio entre el CH4 producido, consumido y transportado4. Cuando se mide en perfiles verticales o en el tiempo, la concentración de agua de poro también permite identificar las zonas más activas en la producción y el consumo de CH4 y su variación estacional.
Tradicionalmente, los métodos para determinar la concentración de GEI del agua de poros en los ecosistemas implican el procesamiento de muestras de agua recolectadas en el campo para equilibrar los gases en un espacio de cabeza creado. Luego, se analiza el espacio de cabeza a través de cromatografía de gases para determinar las concentraciones5. Si bien este método se aplica ampliamente en estudios ecológicos, requiere sistemas de detección de ionización de llama y cromatografía de gases de sobremesa que implican la asignación de espacio de laboratorio convencional y un alto grado de conocimiento experto para calibrar y operar (por ejemplo,6). También requiere el uso de consumibles especializados, como grandes tanques de gases portadores (es decir, nitrógeno (N2) y helio (He)), que no están fácilmente disponibles en lugares remotos. Estos requisitos y la logística asociada del transporte de la muestra al laboratorio pueden restringir el diseño de la muestra y, en algunos casos, limitar el alcance del estudio cuando no se dispone de equipo de cromatografía.
Este estudio tuvo como objetivo desarrollar un método alternativo para medir las concentraciones de gases de efecto invernadero disueltos a partir de muestras de espacio de cabeza de soluciones acuosas utilizando analizadores de gases portátiles basados en espectroscopia óptica. Este tipo de analizador óptico de gases es una alternativa rentable a los sistemas GC-FID estándar, y su portabilidad lo convierte en una opción ideal para aplicaciones de trabajo de campo. Los analizadores de gases portátiles basados en espectroscopia óptica producen mediciones de concentración de gas de alta frecuencia (es decir, ~ 1 s-1) con tiempos de respuesta de 2 a 5 s, según las marcas y modelos. Estos instrumentos están diseñados y comercializados principalmente para determinar los flujos de gas de las superficies emisoras de GEI como los suelos, el agua y la vegetación 7,8,9. Los analizadores ópticos permiten el cálculo del flujo a partir de mediciones continuas de concentración en cámaras de espacio de cabeza de estado no estacionario desplegadas sobre las superficies emisoras de interés. En su uso habitual con cámaras de superficie, las mediciones de alta frecuencia de la tasa de cambio en las concentraciones observadas en la cámara y las dimensiones, la presión y la temperatura conocidas de la cámara permiten interpretar esos datos en cuanto a la tasa de emisión (o absorción) por área de superficie (es decir, flujos superficiales)10. Sin embargo, los analizadores de gases portátiles no están equipados ni optimizados para concentraciones disueltas en medios acuosos, lo que requiere adaptaciones e interpretaciones adicionales para ese tipo de análisis.
Aprovechando las demostraciones anteriores del uso de analizadores ópticos para determinar concentraciones en muestras discretas de espacios de cabeza8, diseñamos una cámara pequeña y cerrada (es decir, sin superficies emisoras) que se conecta al analizador en un circuito cerrado. El cambio en las concentraciones después de la inyección de la submuestra de gas del espacio de cabeza, seguido de cálculos de dilución, permite determinar las concentraciones del espacio de cabeza original. La precisión de este enfoque se evaluó comparando sus resultados con los obtenidos a través de GC-FID en las mismas muestras. El método se demuestra aún más a través de un caso de uso que analizó los perfiles verticales de CH4 en muestras de agua de poros recolectadas de sitios experimentales en un pantano de agua dulce en Louisiana.
Protocolo
1. Muestreo y análisis de agua de poros
- Recoger las muestras utilizando muestreadores de diálisis de agua de poros (peepers)11. Despliegue los mirones en lugares relevantes del sitio de estudio. En el estudio de demostración, se desplegaron 6 mirones en los dos parches de vegetación dominantes de un pantano de agua dulce: tres en un parche dominado por Sagitaria lancifolia y los otros tres en un parche codominado por vegetación de S. lancifolia y Typha latifolia .
- Recoja muestras 4 veces en junio, septiembre, octubre y diciembre. Recoja muestras a 10 profundidades diferentes desde la superficie del suelo hasta ~50 cm por debajo de ella. El muestreo siguió el método descrito en12,13.
- Llene las celdas de muestreo con 61 mL de agua desionizada ~ 20 días antes del muestreo. Burbujee agua desionizada con N2 durante 5 minutos en el laboratorio para eliminar el oxígeno antes de usarla en el campo.
- Durante el muestreo, extraiga 25 ml de agua de la célula con una jeringa conectada a la línea de extracción de la célula. A continuación, rellene las celdas con agua desionizada fresca preburbujeada con N2 a través de una línea de recarga de celdas secundarias. Si se requieren mediciones de concentración inmediatamente después de la recolección, continúe con el paso 2.1.
- Añadir el agua extraída a viales de vidrio de 10 mL conservados con 0,2 mL de HCl 0,1 M, tapar con tabique y refrigerar hasta su análisis en el laboratorio.
NOTA: Los usuarios de este método pueden modificar las profundidades de recolección, el horario de muestreo y la frecuencia en función de las necesidades específicas del estudio.
2. Medición de la concentración de gases de efecto invernadero
- Realizar el equilibrio del espacio de cabeza de muestras de agua de poros en una jeringa
- Cree muestras de gas en el espacio de cabeza utilizando la técnica de equilibrio14. Utilice una jeringa de 30 mL para extraer 5 mL de agua (Vpw) de las muestras recogidas en el campo y luego agregue 15 mL de N2 (pureza ultra alta 99.999%) para crear el espacio de cabeza (Vhs).
- Agite la jeringa vigorosa y consistentemente durante 5 minutos, manualmente o usando un agitador oscilante (si está disponible). Inyecte 12 mL de submuestra de gas de espacio de cabeza en un vial preevacuado de 10 mL utilizado para mediciones de concentración de gas con el analizador óptico en los siguientes pasos (Figura 1). Evacúe los viales con una bomba peristáltica15 o extraiga manualmente el émbolo de una jeringa de 60 ml en el vial cerrado y bombee el aire 3 veces.
NOTA: Se puede usar en lugar de N2 para crear el espacio de cabeza. El procedimiento para añadir N2 o He a la jeringa depende de la adaptación o regulador específico del tanque real disponible para los usuarios. Esta adición generalmente implica el acoplamiento de la jeringa al tanque usando un tubo correspondiente o la extracción con la jeringa de un puerto de muestreo adaptado al tanque. Dependiendo de las condiciones del sitio y la logística asociada, los usuarios pueden usar aire ambiente para crear el espacio libre.
- Crear la cámara de inyección
- Fabricar una cámara de inyección que pueda aceptar un pequeño volumen de aire (~1 - 5 mL) en un volumen de aire sellado que se conecta al flujo de entrada y salida del analizador de gases para formar un circuito cerrado (Tabla de materiales). La cámara de inyección y el analizador son los dos elementos principales del sistema (Figura 2).
- Modifique la tapa metálica de un frasco de vidrio de 365 mL perforando un orificio de 11 mm de diámetro para que quepa un tabique como puerto de inyección y dos orificios de 7 mm de diámetro para insertar válvulas de llave de paso que se conecten con el analizador. Use pegamento epoxi para apretar el puerto de inyección y los accesorios y asegurar el sellado de la cámara.
- Conecte la cámara de inyección al analizador óptico
- Conecte el frasco con los puertos de entrada y salida del analizador óptico utilizando un diámetro interior (D.I.) de 5/32 de pulgada y un diámetro exterior (D.O.) de 1/4 de pulgada Tubos de plástico PFA y representan su volumen adicional. Asegúrese de que el tubo siga las recomendaciones del fabricante del instrumento y esté limpio y seco sin condensación.
- Ajuste las válvulas que conectan la cámara de inyección al instrumento para abrir para crear un circuito de aire de circuito cerrado. Espere a que las concentraciones de gas se estabilicen.
- Inyectar una muestra en la cámara
- Cuando la concentración en la cámara y la señal en el analizador se hayan estabilizado (es decir, con una desviación estándar <0,03 ppm), inyecte 2 ml de una submuestra de los viales que contienen la muestra de espacio de cabeza creada en el paso 2.1.2. Espere a que las concentraciones en el analizador se estabilicen nuevamente antes de inyectar la siguiente submuestra (Figura 3).
- Inyecte hasta 20 submuestras consecutivas o menos si la concentración se acerca a 100 ppm(consulte 8para conocer los efectos sobre la precisión por encima de este umbral). Analice los estándares de verificación de CH4 por cada 5 muestras y evalúe la diferencia con las mediciones reales utilizando la desviación estándar relativa (RSD).
- Cuando termine con el conjunto de inyecciones apiladas, desconecte una de las líneas conectadas al instrumento para restablecer la cámara a la presión ambiente y evitar la acumulación significativa de presión y concentración de metano.
NOTA: Sobre la base de múltiples pruebas, se determinó que la señal se estabilizó ~ 15 s después de la inyección, pero es posible que se requieran diferentes tiempos en respuesta a otras especificaciones de registro del instrumento (Figura 3). El caudal del instrumento utilizado fue de ~1 L/min con un tiempo de respuesta de 5 s y presión de cavidad durante los diferentes análisis en diferentes días que oscilaron entre 720 y 745 Torr.
- Calcular las concentraciones de CH4 en el espacio de cabeza
- Para cada submuestra, calcule la concentración del GEI objetivo (por ejemplo, CH4, CO2, N2O) en el espacio de cabeza (Chs - μmol/mol) con la ecuación 1:
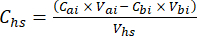 Ecuación [1]
Ecuación [1]
Donde Vhs es el volumen de la submuestra del espacio de cabeza. - Calcule las concentraciones antes (Cbi - μmol mol-1) y después (Cai - μmol mol-1) inyecciones como la media de 15 mediciones (~15 s) antes de la inyección y 15 después de la estabilización de la señal post-inyección. Calcule los volúmenes en mL, antes (Vbi) y después de (Vai) inyecciones con las ecuaciones 2 y 3:
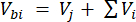 [2]
[2]
y
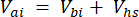 [3]
[3]
Donde Vj (mL) es el volumen añadido del frasco (365 mL) y de la manguera (125,4 mL), y Vi (mL) es el volumen acumulado de las submuestras inyectadas.
- Para cada submuestra, calcule la concentración del GEI objetivo (por ejemplo, CH4, CO2, N2O) en el espacio de cabeza (Chs - μmol/mol) con la ecuación 1:
- Calcular la concentración de agua de poro
- Calcule la presión parcial (Pi - MPa) de CO2, CH4 o N2O en el espacio de cabeza utilizando la fracción molar de gas en el espacio de cabeza y la presión atmosférica (P) durante el procesamiento de la muestra utilizando la ecuación 4:
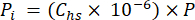 [4]
[4] - Calcule la concentración acuosa equivalente de GEI en el agua de los poros utilizando una ecuación de dilución (ecuación 5) con espacio de cabeza y concentraciones y volúmenes acuosos equivalentes:
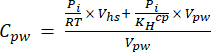 [5]
[5]
Donde R es la constante universal del gas (0,008314 L MPa mol−1 K−1), es la temperatura del aire (K), Vhs es el volumen del espacio de cabeza (mL), KHcp es la constante de volatilidad de Henry de CO2, CH4 o N2O (2,96, 67,13 y 3,82 L MPa/mol, respectivamente)16, y Vpw el volumen de la submuestra líquida utilizada para crear el espacio de cabeza (mL). - Utilice T y P registrados durante las mediciones. El promedio de T y P durante el análisis de las muestras del proyecto de demostración fue de 295.15 K y 0.101325 MPa, respectivamente.
- Calcule la presión parcial (Pi - MPa) de CO2, CH4 o N2O en el espacio de cabeza utilizando la fracción molar de gas en el espacio de cabeza y la presión atmosférica (P) durante el procesamiento de la muestra utilizando la ecuación 4:
3. Validación con respecto a las mediciones de cromatografía estándar
- Analice diferentes concentraciones conocidas de CH4 en viales de 10 mL en un cromatógrafo de gases convencional. Utilice tres grupos idénticos de 20 estándares cada uno. Las concentraciones más bajas oscilaron entre 5 y 100 ppm y aumentaron en incrementos de 5 ppm.
- Determine las concentraciones de CH4 mediante la detección de ionización de llama en un cromatógrafo de gases. El cromatógrafo utilizó una columna empaquetada de absorbente de polímero poroso con He (25 mL/min) como gas portador. Para realizar las mediciones de las concentraciones de los estándares, calibre el cromatógrafo a un ajuste de curva (r2) > 0,99.
- Después de la cromatografía, se proceda a determinar la concentración de CH4 en los mismos viales estándar utilizando el método descrito anteriormente, utilizando un analizador óptico calibrado por el fabricante (es decir, precisión (300 s, 1σ): 0,3 ppb CH4).
- Evaluar la precisión del método ajustando una regresión lineal a los resultados de la cromatografía y del analizador óptico de los tres grupos estándar. Evalúe la replicabilidad del método comparando las pendientes y las intersecciones de las regresiones realizadas dentro de cada grupo de estándares. Evalúe la comparación utilizando un modelo de mínimos cuadrados estándar con énfasis en el apalancamiento de efectos. Evalúe todas las regresiones y comparaciones con un nivel de significación de 0,05.
Resultados
Analizador óptico frente a cromatografía de gases
Los resultados obtenidos mediante cromatografía de gases y el analizador óptico para los tres grupos de patrones mostraron buenos ajustes lineales (es decir, r2 > 0,98) con pendientes cercanas a uno (Figura 4). Las pendientes de las regresiones en los tres experimentos fueron estadísticamente similares (F(2) = 0,478, p = 0,623), lo que sugiere la reproducibilidad d...
Discusión
Este estudio demostró la aplicabilidad de analizadores de gases portátiles basados en espectroscopia óptica acoplados a una cámara de inyección hecha a medida para analizar los espacios de cabeza creados a partir de muestras de agua. La demostración se centró en el CH4, pero el protocolo podría aplicarse al análisis de otros GEI relevantes como el CO2 y el N2O8. El objetivo era ampliar las evaluaciones sistemáticas previa...
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Este trabajo fue financiado a través de los premios DE-SC0021067, DE-SC0023084 y DE-SC0022972 del DOE. Los datos de concentración de agua de poro de los sitios muestreados en la marisma están disponibles públicamente en ESS-DIVE Data Archive (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524 , consultado el 21 de junio de 2024)
Materiales
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
Referencias
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50 (2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973 (2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498 (2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920 (2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados