A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת מתאן מומס במערכות אקולוגיות מימיות באמצעות מנתח גז ספקטרוסקופיה אופטית
In This Article
Summary
מחקר זה מדגים גישה למדידת ריכוזי גז מתאן בדגימות מימיות באמצעות אנלייזרים אופטיים ניידים המחוברים לתא הזרקה בלולאה סגורה. התוצאות דומות לכרומטוגרפיית גז קונבנציונלית, ומציגות חלופה מעשית ובעלות נמוכה המתאימה במיוחד למחקרי שדה מרוחקים.
Abstract
מדידת שטפי גזי חממה (GHG) ומאגרים במערכות אקולוגיות הופכת נפוצה יותר ויותר במחקרים אקולוגיים בשל הרלוונטיות שלהם לשינויי אקלים. בעזרתו גדל גם הצורך בפלטפורמות אנליטיות המותאמות למדידת מאגרים ושטפים שונים בתוך קבוצות מחקר. מחקר זה נועד לפתח נוהל לשימוש במנתחי גז ניידים מבוססי ספקטרוסקופיה אופטית, שתוכננו ושווקו במקור למדידות שטף גזים, למדידת ריכוזי גזי חממה בדגימות מימיות. הפרוטוקול כולל את טכניקת שיווי המשקל המסורתית של מרווח הראש ואחריה הזרקת תת-דגימת גז Headspace לתוך תא המחובר דרך לולאה סגורה ליציאות הכניסה והיציאה של מנתח הגז. התא מיוצר מצנצנת בנאי גנרית וציוד מעבדה פשוט, והוא פתרון אידיאלי לדגימות שעשויות לדרוש דילול לפני ההזרקה. ריכוזי המתאן הנמדדים בתא נמצאים בקורלציה הדוקה (r2 > 0.98) עם ריכוזים שנקבעו בנפרד באמצעות כרומטוגרפיה של גז - זיהוי יינון להבה (GC-FID) על תת-דגימות מאותם בקבוקונים. הנוהל רלוונטי במיוחד למחקרי שדה באזורים מרוחקים שבהם ציוד וציוד כרומטוגרפיה אינם זמינים, ומציע פתרון מעשי, זול ויעיל יותר למדידת ריכוזי מתאן וגזי חממה מומסים אחרים במערכות ימיות.
Introduction
מערכות אקולוגיות באינטרפאזה היבשתית-ימית, כמו אדמות ביצות, אגמים, מאגרים, נהרות ונחלים, הן כיורים חשובים ומקורות של גזי חממה (GHG) כמו פחמן דו-חמצני (CO2), מתאן (CH4) ותחמוצת החנקן (N2O)1,2. CH4, באופן ספציפי, מיוצר במהלך נשימה אנאירובית בחללי הנקבוביות הרוויות של נקבוביות המשקעים. ברגע שהוא מיוצר, חלק מתחמצן והופך ל-CO2, בעוד שהשאר בסופו של דבר יתפזר דרך עמוד המים והצמחייה או יתפוצץ החוצה לבועות3. ריכוז CH4 במים הרווים את נקבוביות המשקעים (כלומר, מי נקבוביות) בזמן נתון מציע הצצה לאיזון בין CH4 המיוצר, הנצרך והמועבר4. כאשר נמדדים על פני פרופילים אנכיים או זמן, ריכוז מי הנקבוביות מאפשר גם לזהות אזורים פעילים יותר בייצור וצריכה של CH4 והשונות העונתית שלהם.
באופן מסורתי, השיטות לקביעת ריכוז גזי החממה ממי נקבוביות במערכות אקולוגיות כוללות עיבוד דגימות מים שנאספו בשדה כדי לאזן גזים במרחב ראש שנוצר. לאחר מכן, מרחב הראש מנותח באמצעות כרומטוגרפיית גז כדי לקבוע את הריכוזים5. בעוד ששיטה זו מיושמת באופן נרחב במחקרים אקולוגיים, היא דורשת מערכות כרומטוגרפיה של גז וזיהוי יינון להבה (GC-FID) הכרוכות בהקצאת שטח מעבדה קונבנציונלי ורמה גבוהה של ידע מומחה לכיול ותפעול (לדוגמה6). זה גם דורש שימוש בחומרים מתכלים מיוחדים, כגון מכלים גדולים של גזים נשאים (כלומר, חנקן (N2) והליום (He)), שאינם זמינים במקומות מרוחקים. דרישות אלו והלוגיסטיקה הנלווית של הובלת הדגימה למעבדה עשויות להגביל את תכנון הדגימה ובמקרים מסוימים להגביל את היקף המחקר כאשר ציוד כרומטוגרפיה אינו זמין.
מחקר זה נועד לפתח שיטה חלופית למדידת ריכוזי גזי חממה מומסים מדגימות חלל ראש של תמיסות מימיות באמצעות מנתחי גז ניידים מבוססי ספקטרוסקופיה אופטית. סוג זה של מנתח גז אופטי הוא אלטרנטיבה חסכונית למערכות GC-FID סטנדרטיות, והניידות שלו הופכת אותו לבחירה אידיאלית עבור יישומי עבודת שטח. מנתחי גז ניידים מבוססי ספקטרוסקופיה אופטית מייצרים מדידות ריכוז גז בתדר גבוה (כלומר, ~ 1 שניות) עם זמני תגובה של 2 - 5 שניות, תלוי במותגים ובדגמים. מכשירים אלה מתוכננים ומשווקים בעיקר לקביעת שטפי גז ממשטחים פולטי גזי חממה כמו קרקעות, מים וצמחייה 7,8,9. מנתחים אופטיים מאפשרים חישוב שטף ממדידות ריכוז רציפות בתאי מרווח ראש במצב לא יציב הפרוסים על פני המשטחים הפולטים המעניינים. בשימוש המיועד הרגיל שלהם עם תאי שטח, המדידות בתדירות גבוהה של קצב השינוי בריכוזים שנצפו בתא וממדי התא, הלחץ והטמפרטורה הידועים מאפשרים לפרש את הנתונים הללו לגבי קצב הפליטה (או הספיגה) לשטח פנים (כלומר, שטפי פני השטח)10. עם זאת, מנתחי גז ניידים אינם מצוידים ואינם מותאמים לריכוזים מומסים במדיה מימית, מה שמחייב התאמות ופרשנויות נוספות לסוג זה של ניתוח.
תוך מינוף הדגמות קודמות של שימוש במנתחים אופטיים לקביעת ריכוזים בדגימות בדידות ממרווחי ראש8, תכננו תא קטן וסגור (כלומר, ללא משטחים פולטים) המתחבר למנתח בלולאה סגורה. השינוי בריכוזים לאחר הזרקת תת-דגימת הגז של חלל הראש, ואחריו חישובי דילול, מאפשר לקבוע את ריכוזי ה-headspace המקורי. הדיוק של גישה זו הוערך על ידי השוואת תוצאותיה לאלו שהתקבלו באמצעות GC-FID באותן דגימות. השיטה מודגמת עוד יותר באמצעות מקרה שימוש שניתח את הפרופילים האנכיים של CH4 בדגימות מי נקבוביות שנאספו מאתרי ניסוי בביצת מים מתוקים בלואיזיאנה.
Protocol
1. דגימה וניתוח מי נקבוביות
- אסוף את הדגימות באמצעות דגימות דיאליזה של מי נקבוביות (מציצים)11. פרוס את המציצים במקומות הרלוונטיים באתר המחקר. במחקר ההדגמה, 6 מציצים נפרסו על שני כתמי הצמחייה הדומיננטיים של ביצת מים מתוקים: שלושה על חלקה שנשלטת על ידי Sagitaria lancifolia ושלושת האחרים על חלקה שנשלטת במשותף על ידי צמחיית S. lancifolia ו-Typha latifolia .
- אסוף דגימות פי 4 ביוני, ספטמבר, אוקטובר ודצמבר. אספו דגימות ב-10 עומקים שונים מפני השטח של האדמה עד ~50 ס"מ מתחתיה. הדגימה עקבה אחר השיטה המתוארתב-12,13.
- מלאו את תאי הדגימה ב-61 מ"ל מים נטולי יונים ~ 20 יום לפני הדגימה. בועות מים נטולי יונים עם N2 למשך 5 דקות במעבדה כדי להסיר את החמצן לפני השימוש בו בשטח.
- במהלך הדגימה יש להוציא 25 מ"ל מים מהתא באמצעות מזרק המחובר לקו החילוץ של התא. לאחר מכן, מלאו מחדש תאים במים טריים נטולי יונים מבועבעים מראש עם N2 דרך קו טעינה משני של תאים. אם נדרשות מדידות ריכוז מיד לאחר האיסוף, המשך לשלב 2.1.
- מוסיפים את המים המופקים לבקבוקוני זכוכית של 10 מ"ל שנשמרו עם 0.2 מ"ל של 0.1 מ"ל HCl, מכסה עם מחיצה ומקררים עד לניתוח במעבדה.
הערה: משתמשים בשיטה זו מוזמנים לשנות את עומק האיסוף, לוח הזמנים של הדגימה והתדירות בהתאם לצרכי המחקר הספציפיים.
2. מדידת ריכוז גזי חממה
- בצע שיווי משקל ראש של דגימות מי נקבוביות במזרק
- צור דגימות גז מרחב ראש באמצעות טכניקת שיווי המשקל14. השתמש במזרק של 30 מ"ל כדי לשאוב 5 מ"ל מים (Vpw) מהדגימות שנאספו בשטח ולאחר מכן הוסף 15 מ"ל של N2 (טוהר גבוה במיוחד 99.999%) כדי ליצור את מרווח הראש (Vhs).
- ערבבו את המזרק במרץ ובעקביות במשך 5 דקות, באופן ידני או באמצעות שייקר נדנדה (אם זמין). הזרקו 12 מ"ל של תת-דגימת גז במרווח ראש לתוך בקבוקון מפונה מראש של 10 מ"ל המשמש למדידות ריכוז גז עם האנלייזר האופטי בשלבים הבאים (איור 1). פנה את הבקבוקונים עם משאבה פריסטלטית15 או משוך ידנית את הבוכנה של מזרק 60 מ"ל על הבקבוקון הסגור ושאב את האוויר החוצה פי 3.
הערה: ניתן להשתמש בו במקום N2 כדי ליצור את מרווח הראש. ההליך להוספת N2 או He למזרק תלוי בהתאמה או בווסת הספציפי של המיכל בפועל העומד לרשות המשתמשים. תוספת זו כוללת בדרך כלל צימוד המזרק למיכל באמצעות צינורות תואמים או חילוץ עם המזרק מיציאת דגימה המותאמת למיכל. בהתאם לתנאי האתר והלוגיסטיקה הנלווית, המשתמשים עשויים להשתמש באוויר הסביבה כדי ליצור את מרחב הראש.
- צור את תא ההזרקה
- ייצור תא הזרקה שיכול לקבל נפח קטן של אוויר (~ 1 - 5 מ"ל) לנפח אוויר אטום המתחבר לזרימה ויציאה של מנתח הגז ליצירת לולאה סגורה (טבלת חומרים). תא ההזרקה והאנלייזר הם שני המרכיבים העיקריים של המערכת (איור 2).
- שנה את המכסה המתכתי של צנצנת מייסון בנפח 365 מ"ל על ידי קידוח חור אחד בקוטר 11 מ"מ כך שיתאים למחיצה אחת כיציאת ההזרקה ושני חורים בקוטר 7 מ"מ להכנסת שסתומי עצירה המתחברים למנתח. השתמש בדבק אפוקסי כדי להדק את יציאת ההזרקה והאביזרים ולהבטיח איטום תא.
- חבר את תא ההזרקה למנתח האופטי
- חבר את הצנצנת עם יציאות הכניסה והיציאה של המנתח האופטי באמצעות קוטר פנימי של 5/32 אינץ' (ID) וקוטר חיצוני של 1/4 אינץ' (OD) צינורות פלסטיק PFA ומסבירים את הנפח הנוסף שלהם. ודא שהצינור תואם את המלצת יצרן המכשיר והוא נקי ויבש ללא עיבוי.
- הגדר את השסתומים המחברים את תא ההזרקה למכשיר כך שייפתחו ליצירת מעגל אוויר בלולאה סגורה. המתן עד שריכוזי הגז יתייצבו.
- הזרקת דגימה לתא
- כאשר הריכוז בתא והאות במנתח התייצבו (כלומר, סטיית תקן <0.03 עמודים לדקה), הזריק 2 מ"ל של תת-דגימה מהבקבוקונים המכילים את דגימת ה-headspace שנוצרה בשלב 2.1.2. המתן עד שהריכוזים במנתח יתייצבו שוב לפני הזרקת תת-הדגימה הבאה (איור 3).
- להזריק עד 20 תת-דגימות ברצף או פחות אם הריכוז מתקרב ל-100 ppm (ראה8להשפעות על דיוק מעל סף זה). נתח את תקני בדיקת CH4 עבור כל 5 דגימות והעריך את ההבדל עם מדידות בפועל באמצעות סטיית התקן היחסית (RSD).
- בסיום עם סט ההזרקות המוערמות, נתק את אחד הקווים המחוברים למכשיר כדי לאפס את התא ללחץ הסביבה ולמנוע הצטברות משמעותית של לחץ וריכוז מתאן.
הערה: בהתבסס על ריצות בדיקה מרובות, נקבע שהאות התייצב ~15 שניות לאחר ההזרקה, אך ייתכן שיידרשו זמנים שונים בתגובה למפרטי הקלטת מכשירים אחרים (איור 3). קצב הזרימה של המכשיר בו נעשה שימוש היה ~1 ליטר לדקה עם זמן תגובה של 5 שניות ולחץ חלל במהלך הניתוחים השונים בימים שונים שנעו בין 720 ל-745 טור.
- חישוב ריכוזי CH4 במרחב הראש
- עבור כל תת-דגימה, חשב את ריכוז גזי החממה היעד (למשל, CH4, CO2, N2O) במרחב הראש (Chs - μmol/mol) עם משוואה 1:
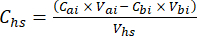 משוואה [1]
משוואה [1]
כאשר Vhs הוא עוצמת הקול של תת-הדגימה של headspace. - חשב את הריכוזים לפני (Cbi - μmol mol-1) ואחרי (Cai - μmol mol-1) כממוצע של 15 מדידות (~15 שניות) לפני ההזרקה ו-15 לאחר ייצוב האות לאחר ההזרקה. חשב את הנפחים בהזרקות מ"ל, לפני (Vbi) ואחרי (Vai) עם משוואות 2 ו-3:
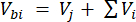 [2]
[2]
ו
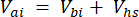 [3]
[3]
כאשר Vj (מ"ל) הוא הנפח הנוסף של הצנצנת (365 מ"ל) והצינור (125.4 מ"ל), ו-Vi (מ"ל) הוא הנפח המצטבר של תת-הדגימות שהוזרקו.
- עבור כל תת-דגימה, חשב את ריכוז גזי החממה היעד (למשל, CH4, CO2, N2O) במרחב הראש (Chs - μmol/mol) עם משוואה 1:
- חשב את ריכוז מי הנקבוביות
- חשב את הלחץ החלקי (Pi - MPa) של CO2, CH4 או N2O במרחב הראש באמצעות חלק השומה של הגז בחלל הראש והלחץ האטמוספרי (P) במהלך עיבוד הדגימה באמצעות משוואה 4:
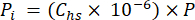 [4]
[4] - חשב את הריכוז המקביל המימי של גזי חממה במי נקבוביות באמצעות משוואת דילול (משוואה 5) עם מרווח ראש וריכוזים ונפחים שווי ערך מימיים:
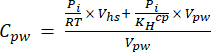 [5]
[5]
כאשר R הוא קבוע הגז האוניברסלי (0.008314 L MPa mol−1 K−1), הוא טמפרטורת האוויר (K), Vhs הוא נפח מרווח הראש (mL), KHcp הוא קבוע התנודתיות של הנרי של CO2, CH4 או N2O (2.96, 67.13 ו-3.82 L MPa/mol, בהתאמה)16, ו-Vpw נפח תת-הדגימה הנוזלית המשמשת ליצירת מרחב הראש (mL). - השתמש ב-T ו-P מוקלטים במהלך המדידות. ה-T וה-P הממוצעים במהלך ניתוח דגימות פרויקט ההדגמה היו 295.15 K ו-0.101325 MPa, בהתאמה.
- חשב את הלחץ החלקי (Pi - MPa) של CO2, CH4 או N2O במרחב הראש באמצעות חלק השומה של הגז בחלל הראש והלחץ האטמוספרי (P) במהלך עיבוד הדגימה באמצעות משוואה 4:
3. ולידציה מול מדידות כרומטוגרפיה סטנדרטיות
- לנתח ריכוזים ידועים שונים של CH4 בבקבוקונים של 10 מ"ל בכרומטוגרף גז קונבנציונלי. השתמש בשלוש קבוצות זהות של 20 תקנים כל אחת. הריכוזים הנמוכים ביותר נעו בין 5 ל-100 חלקים למיליון ועלו במרווחים של 5 חלקים למיליון.
- קבע ריכוזי CH4 על ידי זיהוי יינון להבה בכרומטוגרף גז. הכרומטוגרף השתמש בעמודה ארוזה סופגת פולימר נקבובית עם He (25 מ"ל לדקה) כגז הנשא. כדי להריץ את מדידות ריכוזי התקנים, כייל את הכרומטוגרף להתאמת עקומה (r2) > 0.99.
- לאחר כרומטוגרפיה, המשך לקבוע את ריכוז CH4 באותם בקבוקונים סטנדרטיים בשיטה שתוארה לעיל, באמצעות מנתח אופטי המכויל על ידי היצרן (כלומר, דיוק (300 שניות, 1σ): 0.3 ppb CH4).
- הערך את דיוק השיטה על ידי התאמת רגרסיה ליניארית לתוצאות הכרומטוגרפיה והמנתח האופטי של שלוש הקבוצות הסטנדרטיות. להעריך את יכולת השכפול של השיטה על ידי השוואת השיפועים והיירוטים של רגרסיות שבוצעו בכל קבוצת תקנים. הערך את ההשוואה באמצעות מודל סטנדרטי של הריבוע המינימלי עם דגש על מינוף האפקט. הערך את כל הרגרסיות וההשוואות ברמת מובהקות של 0.05.
תוצאות
מנתח אופטי לעומת כרומטוגרפיית גז
התוצאות שהתקבלו באמצעות כרומטוגרפיית גז והאנלייזר האופטי עבור שלוש קבוצות התקנים הראו התאמות ליניאריות טובות (כלומר, r2 > 0.98) עם שיפועים קרובים לאחד (איור 4). שיפועי הרגרסיות בשלושת הניסויים היו דומים ...
Discussion
מחקר זה הדגים את הישימות של מנתחי גז ניידים מבוססי ספקטרוסקופיה אופטית בשילוב עם תא הזרקה בהתאמה אישית לניתוח מרווחי ראש שנוצרו מדגימות מים. ההדגמה התמקדה ב-CH4, אך ניתן ליישם את הפרוטוקול לניתוח גזי חממה רלוונטיים אחרים כמו CO2 ו-N2O8. המטרה הי?...
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
עבודה זו מומנה באמצעות פרסי DOE DE-SC0021067, DE-SC0023084 ו-DE-SC0022972. נתוני ריכוז מי הנקבוביות של האתרים שנדגמו בביצה זמינים לציבור בארכיון נתוני ESS-DIVE (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524, גישה אליו ב-21 ביוני 2024)
Materials
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
References
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50 (2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973 (2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498 (2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920 (2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved