Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Messung von gelöstem Methan in aquatischen Ökosystemen mit einem Gasanalysator mit optischer Spektroskopie
In diesem Artikel
Zusammenfassung
Diese Studie demonstriert einen Ansatz zur Messung von Methangaskonzentrationen in wässrigen Proben mit tragbaren optischen Analysatoren, die in einem geschlossenen Kreislauf mit einer Injektionskammer gekoppelt sind. Die Ergebnisse ähneln denen der konventionellen Gaschromatographie und stellen eine praktische und kostengünstige Alternative dar, die sich besonders für Fernfeldstudien eignet.
Zusammenfassung
Die Messung von Treibhausgasflüssen (THG) und Pools in Ökosystemen wird aufgrund ihrer Relevanz für den Klimawandel immer häufiger in ökologischen Studien eingesetzt. Damit wächst auch der Bedarf an analytischen Plattformen, die an die Messung verschiedener Pools und Flüsse innerhalb von Forschungsgruppen angepasst werden können. Ziel dieser Studie ist es, ein Verfahren zu entwickeln, mit dem tragbare auf optischer Spektroskopie basierende Gasanalysatoren, die ursprünglich für Gasflussmessungen entwickelt und vermarktet wurden, zur Messung von THG-Konzentrationen in wässrigen Proben verwendet werden können. Das Protokoll beinhaltet die traditionelle Headspace-Equilibrierungstechnik, gefolgt von der Injektion einer Headspace-Gasteilprobe in eine Kammer, die durch einen geschlossenen Kreislauf mit den Einlass- und Auslassöffnungen des Gasanalysators verbunden ist. Die Kammer besteht aus einem generischen Einmachglas und einfachem Laborzubehör und ist eine ideale Lösung für Proben, die möglicherweise eine Verdünnung vor der Injektion erfordern. Die mit der Kammer gemessenen Methankonzentrationen sind eng korreliert (r2 > 0,98) mit den Konzentrationen, die separat durch Gaschromatographie-Flammenionisationsdetektion (GC-FID) an Teilproben aus denselben Fläschchen bestimmt werden. Das Verfahren ist besonders relevant für Feldstudien in abgelegenen Gebieten, in denen Chromatographiegeräte und -zubehör nicht ohne weiteres verfügbar sind, und bietet eine praktische, kostengünstigere und effizientere Lösung für die Messung der Konzentrationen von Methan und anderen gelösten Treibhausgasen in aquatischen Systemen.
Einleitung
Ökosysteme an der Schnittstelle zwischen Land und Wasser, wie Feuchtgebiete, Seen, Stauseen, Flüsse und Bäche, sind wichtige Senken und Quellen von Treibhausgasen (THG) wie Kohlendioxid (CO2), Methan (CH4) und Distickstoffmonoxid (N2O)1,2. CH4 wird insbesondere während der anaeroben Atmung in den gesättigten Porenräumen der Sedimentporen produziert. Sobald es hergestellt ist, wird ein Teil oxidiert und in CO2 umgewandelt, während der Rest schließlich durch die Wassersäule und die Vegetation diffundiert oder in Blasenzerbricht 3. Die Konzentration von CH4 im Wasser, das die Sedimentporen (d. h. das Porenwasser) zu einem bestimmten Zeitpunkt sättigt, bietet einen Einblick in das Gleichgewicht zwischen produziertem, verbrauchtem und transportiertem CH4 4. Wenn die Porenwasserkonzentration über vertikale Profile oder Zeit gemessen wird, ermöglicht sie es auch, Zonen zu identifizieren, die bei der Produktion und dem Verbrauch von CH4 aktiver sind, sowie deren saisonale Schwankungen.
Traditionell beinhalten die Methoden zur Bestimmung der Konzentration von Treibhausgasen aus Porenwasser in Ökosystemen die Aufbereitung von Wasserproben, die vor Ort gesammelt wurden, um Gase in einem geschaffenen Kopfraum auszugleichen. Anschließend wird der Kopfraum durch Gaschromatographie analysiert, um die Konzentrationen zu bestimmen5. Während diese Methode in ökologischen Studien weit verbreitet ist, erfordert sie Tisch-Gaschromatographie-Flammenionisationsdetektionssysteme (GC-FID), die die Zuweisung von konventionellem Laborraum und ein hohes Maß an Expertenwissen für die Kalibrierung und den Betrieb erfordern (z. B.6). Es erfordert auch die Verwendung spezieller Verbrauchsmaterialien, wie z. B. große Tanks mit Trägergasen (z. B. Stickstoff (N2) und Helium (He)), die an abgelegenen Orten nicht ohne weiteres verfügbar sind. Diese Anforderungen und die damit verbundene Logistik des Probentransports zum Labor können das Probenahmedesign einschränken und in einigen Fällen den Umfang der Studie einschränken, wenn keine Chromatographiegeräte verfügbar sind.
Ziel dieser Studie war es, eine alternative Methode zur Messung der Konzentrationen gelöster Treibhausgase aus Headspace-Proben wässriger Lösungen mit Hilfe von tragbaren optischen Spektroskopie-basierten Gasanalysatoren zu entwickeln. Diese Art von optischem Gasanalysator ist eine kostengünstige Alternative zu Standard-GC-FID-Systemen und aufgrund seiner Portabilität die ideale Wahl für Feldanwendungen. Tragbare, auf optischer Spektroskopie basierende Gasanalysatoren erzeugen hochfrequente Gaskonzentrationsmessungen (d. h. ~ 1 s-1) mit Ansprechzeiten von 2 - 5 s, je nach Marke und Modell. Diese Instrumente wurden in erster Linie für die Bestimmung von Gasflüssen von THG-emittierenden Oberflächen wie Böden, Wasser und Vegetation entwickelt und vermarktet 7,8,9. Optische Analysatoren ermöglichen die Berechnung des Flusses aus kontinuierlichen Konzentrationsmessungen in nichtstationären Headspace-Kammern, die über den interessierenden Emissionsoberflächen eingesetzt werden. Bei ihrer regulären bestimmungsgemäßen Verwendung mit Oberflächenkammern ermöglichen die hochfrequenten Messungen der in der Kammer beobachteten Änderungsrate der Konzentrationen und der bekannten Kammerabmessungen, des Drucks und der Temperatur die Interpretation dieser Daten als für die Emissionsrate (oder Aufnahme) pro Oberfläche (d. h. Oberflächenflüsse)10. Tragbare Gasanalysatoren sind jedoch weder für gelöste Konzentrationen in wässrigen Medien ausgerüstet noch optimiert, so dass zusätzliche Anpassungen und Interpretationen für diese Art der Analyse erforderlich sind.
Unter Nutzung früherer Demonstrationen der Verwendung optischer Analysatoren zur Bestimmung von Konzentrationen in diskreten Proben aus Headspaces8 haben wir eine kleine, geschlossene Kammer (d. h. keine emittierenden Oberflächen) entwickelt, die in einem geschlossenen Regelkreis mit dem Analysator verbunden ist. Die Änderung der Konzentrationen nach der Injektion der Kopfraumgas-Teilprobe, gefolgt von Verdünnungsberechnungen, ermöglicht die Bestimmung der Konzentrationen des ursprünglichen Kopfraums. Die Genauigkeit dieses Ansatzes wurde bewertet, indem seine Ergebnisse mit denen verglichen wurden, die durch GC-FID in denselben Stichproben erzielt wurden. Die Methode wird weiter durch einen Anwendungsfall demonstriert, bei dem die vertikalen Profile von CH4 in Porenwasserproben analysiert wurden, die an Versuchsstandorten in einem Süßwassersumpf in Louisiana gesammelt wurden.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Porenwasserprobenahme und -analyse
- Entnehmen Sie die Proben mit Porenwasser-Dialyse-Probenehmern (Peepers)11. Platzieren Sie die Peepers an relevanten Stellen des Untersuchungszentrums. In der Demonstrationsstudie wurden 6 Spanner auf den beiden dominanten Vegetationsflächen eines Süßwassersumpfes eingesetzt: drei auf einem Fleck, der von Sagitaria lancifolia dominiert wird, und die anderen drei auf einem Fleck, der von S. lancifolia - und Typha latifolia-Vegetation mitdominiert wird.
- Sammeln Sie 4x Proben im Juni, September, Oktober und Dezember. Sammeln Sie Proben in 10 verschiedenen Tiefen von der Bodenoberfläche bis hinunter zu ~50 cm darunter. Die Probenahme erfolgte nach der unter12,13 beschriebenen Methode.
- Füllen Sie die Probenahmezellen ~20 Tage vor der Probenahme mit 61 mL deionisiertem Wasser. Blasen Sie deionisiertes Wasser 5 Minuten lang im Labor mit N2 aus, um den Sauerstoff zu entfernen, bevor Sie es im Feld verwenden.
- Entnehmen Sie während der Probenahme 25 ml Wasser aus der Zelle mit einer Spritze, die an die Extraktionsleitung der Zelle angeschlossen ist. Füllen Sie dann die Zellen mit frischem deionisiertem Wasser auf, das über eine sekundäre Zellaufladeleitung mit N2 vorgesprudelt ist. Wenn direkt nach der Entnahme Konzentrationsmessungen erforderlich sind, fahren Sie mit Schritt 2.1 fort.
- Geben Sie das extrahierte Wasser in 10-ml-Glasfläschchen, die mit 0,2 ml 0,1 M HCl konserviert sind, verschließen Sie es mit Septum und kühlen Sie es bis zur Analyse im Labor.
HINWEIS: Benutzer dieser Methode sind herzlich eingeladen, die Entnahmetiefe, den Probenahmeplan und die Häufigkeit je nach spezifischen Studienanforderungen zu ändern.
2. Messung der Treibhausgaskonzentration
- Führen Sie eine Headspace-Äquilibrierung von Porenwasserproben in einer Spritze durch
- Erzeugung von Headspace-Gasproben unter Verwendung der Äquilibrierungstechnik14. Verwenden Sie eine 30-ml-Spritze, um 5 mL Wasser (Vpw) aus den vor Ort gesammelten Proben zu entnehmen, und fügen Sie dann 15 mL N2 (Ultra High Purity 99,999 %) hinzu, um den Kopfraum (Vhs) zu schaffen.
- Rühren Sie die Spritze 5 Minuten lang kräftig und gleichmäßig um, manuell oder mit einem Schaukelschüttler (falls vorhanden). Injizieren Sie 12 mL der Headspace-Gasteilprobe in ein vorevakuiertes 10-ml-Fläschchen, das für Gaskonzentrationsmessungen mit dem optischen Analysator in den folgenden Schritten verwendet wird (Abbildung 1). Evakuieren Sie die Fläschchen mit einer Peristaltikpumpe15 oder ziehen Sie manuell den Kolben einer 60-ml-Spritze an das geschlossene Fläschchen und pumpen Sie die Luft 3x ab.
HINWEIS: Er kann anstelle von N2 verwendet werden, um den Kopfraum zu erzeugen. Das Verfahren zur Zugabe von N2 oder He zur Spritze hängt von der spezifischen Anpassung oder dem Regler des tatsächlichen Tanks ab, der dem Benutzer zur Verfügung steht. Diese Ergänzung beinhaltet typischerweise das Koppeln der Spritze mit dem Tank unter Verwendung eines passenden Schlauchs oder das Herausziehen mit der Spritze aus einer an den Tank angepassten Probenahmeöffnung. Abhängig von den Standortbedingungen und der damit verbundenen Logistik können die Benutzer Umgebungsluft verwenden, um den Kopfraum zu schaffen.
- Erstellen der Injektionskammer
- Stellen Sie eine Injektionskammer her, die ein kleines Luftvolumen (~1 - 5 ml) in ein versiegeltes Luftvolumen aufnehmen kann, das mit dem Zu- und Abfluss des Gasanalysators verbunden ist, um einen geschlossenen Kreislauf zu bilden (Materialtabelle). Die Injektionskammer und der Analysator sind die beiden Hauptelemente des Systems (Abbildung 2).
- Modifizieren Sie den Metalldeckel eines 365-ml-Einmachglases, indem Sie ein Loch mit einem Durchmesser von 11 mm bohren, in das ein Septum als Injektionsöffnung passt, und zwei Löcher mit einem Durchmesser von 7 mm, um Absperrventile einzusetzen, die mit dem Analysator verbunden sind. Verwenden Sie Epoxidkleber, um den Injektionsanschluss und die Anschlüsse festzuziehen und die Abdichtung der Kammer sicherzustellen.
- Verbinden Sie die Injektionskammer mit dem optischen Analysator
- Verbinden Sie das Glas mit den Einlass- und Auslassanschlüssen des optischen Analysators mit einem Innendurchmesser von 5/32 Zoll (ID) und einem Außendurchmesser von 1/4 Zoll (AD). PFA-Kunststoffschläuche und berücksichtigen deren zusätzliches Volumen. Stellen Sie sicher, dass der Schlauch den Empfehlungen des Geräteherstellers entspricht und sauber und trocken ohne Kondensation ist.
- Stellen Sie die Ventile, die die Injektionskammer mit dem Instrument verbinden, auf Öffnung, um einen geschlossenen Luftkreislauf zu schaffen. Warten Sie, bis sich die Gaskonzentrationen stabilisiert haben.
- Injizieren Sie eine Probe in die Kammer
- Wenn sich die Konzentration in der Kammer und das Signal im Analysator stabilisiert haben (d. h. Standardabweichung <0,03 ppm), injizieren Sie 2 ml einer Teilprobe aus den Fläschchen mit der in Schritt 2.1.2 erstellten Headspace-Probe. Warten Sie, bis sich die Konzentrationen im Analysator wieder stabilisiert haben, bevor Sie die nächste Teilprobe injizieren (Abbildung 3).
- Injizieren Sie bis zu 20 Teilproben nacheinander oder weniger, wenn die Konzentration näher an 100 ppm heranrückt (siehe8für Auswirkungen auf die Genauigkeit über diesem Schwellenwert). Analysieren Sie CH4-Prüfstandards für jeweils 5 Proben und bewerten Sie die Differenz zu den tatsächlichen Messungen anhand der relativen Standardabweichung (RSD).
- Wenn Sie mit dem Satz gestapelter Injektionen fertig sind, ziehen Sie eine der an das Gerät angeschlossenen Leitungen, um die Kammer auf Umgebungsdruck zurückzusetzen und einen erheblichen Aufbau von Druck und Methankonzentration zu vermeiden.
HINWEIS: Basierend auf mehreren Testläufen wurde festgestellt, dass sich das Signal ~15 s nach der Injektion stabilisierte, aber als Reaktion auf andere Spezifikationen der Geräteaufzeichnung können andere Zeiten erforderlich sein (Abbildung 3). Die Durchflussrate des verwendeten Instruments betrug ~1 L/min mit einer Ansprechzeit von 5 s und einem Werkzeuginnendruck während der verschiedenen Analysen an verschiedenen Tagen im Bereich von 720 bis 745 Torr.
- Berechnen Sie CH4 Konzentrationen im Kopfraum
- Berechnen Sie für jede Teilprobe die Konzentration des Ziel-THG (z. B. CH4, CO2, N2O) im Kopfraum (Chs - μmol/mol) mit Gleichung 1:
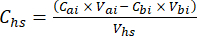 Gleichung [1]
Gleichung [1]
Dabei ist Vhs das Volumen der Headspace-Teilstichprobe. - Berechnen Sie die Konzentrationen vor (Cbi - μmol mol-1) und nach (Cai - μmol mol-1) Injektionen als Mittelwert von 15 Messungen (~15 s) vor der Injektion und 15 nach der Stabilisierung des Signals nach der Injektion. Berechnen Sie die Volumina in ml, vor (Vbi) und nach (Vai) Injektionen mit den Gleichungen 2 und 3:
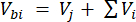 [2]
[2]
und
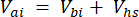 [3]
[3]
Dabei ist Vj (mL) das hinzugefügte Volumen des Glases (365 mL) und des Schlauchs (125,4 mL) und Vi (mL) das akkumulierte Volumen der injizierten Teilproben.
- Berechnen Sie für jede Teilprobe die Konzentration des Ziel-THG (z. B. CH4, CO2, N2O) im Kopfraum (Chs - μmol/mol) mit Gleichung 1:
- Porenwasserkonzentration berechnen
- Berechnen Sie den Partialdruck (Pi - MPa) von CO2, CH4 oder N2O im Kopfraum unter Verwendung des Molenbruchs des Gases im Kopfraum und des Atmosphärendrucks (P) während der Verarbeitung der Probe unter Verwendung von Gleichung 4:
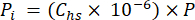 [4]
[4] - Berechnen Sie die wässrige Äquivalentkonzentration von Treibhausgasen im Porenwasser unter Verwendung einer Verdünnungsgleichung (Gleichung 5) mit den Konzentrationen und Volumina des Kopfraums und der wässrigen Äquivalentkonzentrationen:
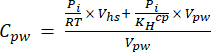 [5]
[5]
Dabei ist R die universelle Gaskonstante (0,008314 L MPa mol-1 K-1), die Lufttemperatur (K), Vhs das Volumen des Kopfraums (mL), KHcp die Henry-Volatilitätskonstante von CO2, CH4 oder N2O (2,96, 67,13 bzw. 3,82 L MPa/mol)16 und Vpw das Volumen der flüssigen Teilprobe, die zur Erstellung des Kopfraums (mL) verwendet wird. - Verwenden Sie während der Messungen die aufgezeichneten T und P. Die durchschnittlichen T und P während der Analyse der Proben des Demonstrationsprojekts betrugen 295,15 K bzw. 0,101325 MPa.
- Berechnen Sie den Partialdruck (Pi - MPa) von CO2, CH4 oder N2O im Kopfraum unter Verwendung des Molenbruchs des Gases im Kopfraum und des Atmosphärendrucks (P) während der Verarbeitung der Probe unter Verwendung von Gleichung 4:
3. Validierung anhand von Standard-Chromatographie-Messungen
- Analysieren Sie verschiedene bekannte CH4-Konzentrationen in 10-ml-Fläschchen in einem konventionellen Gaschromatographen. Verwenden Sie drei identische Gruppen zu je 20 Normen. Die niedrigsten Konzentrationen lagen zwischen 5 und 100 ppm und stiegen in Schritten von 5 ppm an.
- Bestimmung der CH4-Konzentrationen durch Flammenionisationsdetektion auf einem Gaschromatographen. Der Chromatograph verwendete eine poröse Polymer-Absorptionsmittel-gepackte Säule mit He (25 mL/min) als Trägergas. Um die Messungen der Konzentrationen der Standards durchzuführen, kalibrieren Sie den Chromatographen auf eine Kurvenanpassung (r2) > 0,99.
- Fahren Sie nach der Chromatographie mit der Bestimmung der CH4-Konzentration in denselben Standardfläschchen mit der oben beschriebenen Methode unter Verwendung eines vom Hersteller kalibrierten optischen Analysators fort (d. h. Präzision (300 s, 1σ): 0,3 ppb CH4).
- Bewerten Sie die Genauigkeit der Methode, indem Sie eine lineare Regression an die Ergebnisse der Chromatographie und des optischen Analysators der drei Standardgruppen anpassen. Bewerten Sie die Replizierbarkeit der Methode, indem Sie die Steigungen und Schnittpunkte von Regressionen vergleichen, die innerhalb jeder Gruppe von Standards durchgeführt wurden. Werten Sie den Vergleich anhand eines Standardmodells der kleinsten Quadrate mit Schwerpunkt auf der Effekthebelwirkung aus. Werten Sie alle Regressionen und Vergleiche auf einem Signifikanzniveau von 0,05 aus.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Optischer Analysator versus Gaschromatographie
Die Ergebnisse, die durch die Gaschromatographie und den optischen Analysator für die drei Gruppen von Standards erzielt wurden, zeigten gute lineare Anpassungen (d. h. r2 > 0,98) mit Steigungen nahe eins (Abbildung 4). Die Steigungen der Regressionen in den drei Experimenten waren statistisch ähnlich (F(2) = 0,478, p = 0,623), was auf die Reproduzierbarkeit der Ergebnis...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Diese Studie demonstrierte die Anwendbarkeit von tragbaren, auf optischer Spektroskopie basierenden Gasanalysatoren, die mit einer speziell angefertigten Injektionskammer gekoppelt sind, um Kopfräume aus Wasserproben zu analysieren. Die Demonstration konzentrierte sich auf CH4, aber das Protokoll konnte auch auf die Analyse anderer relevanter Treibhausgase wie CO2 und N2O8 angewendet werden. Ziel war es, die bisherige systematisch...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde durch die DOE-Awards DE-SC0021067, DE-SC0023084 und DE-SC0022972 finanziert. Die Porenwasserkonzentrationsdaten der beprobten Standorte im Sumpf sind im ESS-DIVE Data Archive öffentlich zugänglich (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524 , abgerufen am 21. Juni 2024)
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
Referenzen
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50(2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973(2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498(2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920(2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten