Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure du méthane dissous dans les écosystèmes aquatiques à l’aide d’un analyseur de gaz par spectroscopie optique
Dans cet article
Résumé
Cette étude met en évidence une approche permettant de mesurer les concentrations de méthane dans des échantillons aqueux à l’aide d’analyseurs optiques portables couplés à une chambre d’injection en boucle fermée. Les résultats sont similaires à ceux de la chromatographie en phase gazeuse conventionnelle, ce qui constitue une alternative pratique et peu coûteuse, particulièrement adaptée aux études sur le terrain à distance.
Résumé
La mesure des flux de gaz à effet de serre (GES) et des réserves dans les écosystèmes est de plus en plus courante dans les études écologiques en raison de leur pertinence pour le changement climatique. Avec elle, le besoin de plates-formes analytiques adaptables à la mesure de différents bassins et flux au sein des groupes de recherche augmente également. Cette étude vise à développer une procédure pour utiliser des analyseurs de gaz portables basés sur la spectroscopie optique, conçus et commercialisés à l’origine pour mesurer les concentrations de GES dans les échantillons aqueux. Le protocole implique la technique traditionnelle d’équilibrage de l’espace de tête, suivie de l’injection d’un sous-échantillon de gaz de l’espace de tête dans une chambre reliée par une boucle fermée aux orifices d’entrée et de sortie de l’analyseur de gaz. La chambre est fabriquée à partir d’un pot Mason générique et de simples fournitures de laboratoire, et c’est une solution idéale pour les échantillons qui peuvent nécessiter une dilution avant l’injection. Les concentrations de méthane mesurées avec la chambre sont étroitement corrélées (r2 > 0,98) avec les concentrations déterminées séparément par chromatographie en phase gazeuse et détection par ionisation de flamme (GC-FID) sur des sous-échantillons provenant des mêmes flacons. La procédure est particulièrement pertinente pour les études sur le terrain dans des zones reculées où l’équipement et les fournitures de chromatographie ne sont pas facilement disponibles, offrant une solution pratique, moins coûteuse et plus efficace pour mesurer les concentrations de méthane et d’autres gaz à effet de serre dissous dans les systèmes aquatiques.
Introduction
Les écosystèmes situés à l’interphase terrestre-aquatique, comme les zones humides, les lacs, les réservoirs, les rivières et les ruisseaux, sont d’importants puits et sources de gaz à effet de serre (GES) comme le dioxyde de carbone (CO2), le méthane (CH4) et le protoxyde d’azote (N2O)1,2. Le CH4, en particulier, est produit lors de la respiration anaérobie dans les espaces interstitiels saturés des pores des sédiments. Une fois produite, une fraction est oxydée et transformée en CO2, tandis que le reste finira par se diffuser dans la colonne d’eau et la végétation ou éclater en bulles3. La concentration de CH4 dans l’eau qui sature les pores des sédiments (c’est-à-dire l’eau interstitielle) à un moment donné donne un aperçu de l’équilibre entre le CH4 produit, consommé et transporté4. Mesurée sur des profils verticaux ou dans le temps, la concentration en eau interstitielle permet également d’identifier les zones les plus actives dans la production et la consommation de CH4 et leur variation saisonnière.
Traditionnellement, les méthodes pour déterminer la concentration de GES de l’eau interstitielle dans les écosystèmes impliquent le traitement d’échantillons d’eau prélevés sur le terrain pour équilibrer les gaz dans un espace de tête créé. Ensuite, l’espace de tête est analysé par chromatographie en phase gazeuse pour déterminer les concentrations5. Bien que cette méthode soit largement appliquée dans les études écologiques, elle nécessite des systèmes de chromatographie en phase gazeuse et de détection par ionisation de flamme (GC-FID) de paillasse qui impliquent l’allocation d’un espace de laboratoire conventionnel et un haut degré de connaissances spécialisées pour l’étalonnage et le fonctionnement (par exemple6). Cela nécessite également l’utilisation de consommables spécialisés, tels que de grands réservoirs de gaz vecteurs (c’est-à-dire de l’azote (N2) et de l’hélium (He)), qui ne sont pas facilement disponibles dans les endroits éloignés. Ces exigences et la logistique associée au transport des échantillons au laboratoire peuvent limiter la conception de l’échantillonnage et, dans certains cas, limiter la portée de l’étude lorsque l’équipement de chromatographie n’est pas disponible.
Cette étude visait à développer une méthode alternative pour mesurer les concentrations de gaz à effet de serre dissous à partir d’échantillons de solutions aqueuses dans l’espace de tête à l’aide d’analyseurs de gaz portables basés sur la spectroscopie optique. Ce type d’analyseur de gaz optique est une alternative rentable aux systèmes GC-FID standard, et sa portabilité en fait un choix idéal pour les applications de travail sur le terrain. Les analyseurs de gaz portables basés sur la spectroscopie optique produisent des mesures de concentration de gaz à haute fréquence (c’est-à-dire ~ 1 s-1) avec des temps de réponse de 2 à 5 s, selon les marques et les modèles. Ces instruments sont conçus et commercialisés principalement pour déterminer les flux de gaz à partir de surfaces émettrices de GES comme les sols, l’eau et la végétation 7,8,9. Les analyseurs optiques permettent de calculer le flux à partir de mesures de concentration continues dans des chambres d’espace de tête non stationnaires déployées sur les surfaces d’émission d’intérêt. Dans le cadre de leur utilisation habituelle avec des chambres de surface, les mesures à haute fréquence du taux de variation des concentrations observées dans la chambre et des dimensions, de la pression et de la température connues de la chambre permettent d’interpréter ces données comme pour le taux d’émission (ou d’absorption) par surface (c’est-à-dire les flux de surface)10. Cependant, les analyseurs de gaz portables ne sont ni équipés ni optimisés pour les concentrations dissoutes dans les milieux aqueux, ce qui nécessite des adaptations et des interprétations supplémentaires pour ce type d’analyse.
En nous appuyant sur les démonstrations précédentes de l’utilisation d’analyseurs optiques pour déterminer les concentrations dans des échantillons discrets à partir d’espaces de tête8, nous avons conçu une petite chambre fermée (c’est-à-dire sans surfaces d’émission) qui se connecte à l’analyseur en boucle fermée. La variation des concentrations après l’injection du sous-échantillon de gaz dans l’espace de tête, suivie des calculs de dilution, permet de déterminer les concentrations de l’espace de tête d’origine. La précision de cette approche a été évaluée en comparant ses résultats à ceux obtenus par GC-FID dans les mêmes échantillons. La méthode est également démontrée par un cas d’utilisation qui a analysé les profils verticaux de CH4 dans des échantillons d’eau interstitielle prélevés sur des sites expérimentaux dans un marais d’eau douce en Louisiane.
Protocole
1. Échantillonnage et analyse de l’eau interstitielle
- Prélever les échantillons à l’aide d’échantillonneurs à dialyse à eau interstitielle11. Déployez les regards dans les endroits pertinents du site d’étude. Dans l’étude de démonstration, 6 rainettes ont été déployées sur les deux parcelles de végétation dominante d’un marais d’eau douce : trois sur une parcelle dominée par Sagitaria lancifolia et les trois autres sur une parcelle co-dominée par la végétation de S. lancifolia et de Typha latifolia.
- Prélevez des échantillons 4x en juin, septembre, octobre et décembre. Prélevez des échantillons à 10 profondeurs différentes de la surface du sol jusqu’à ~50 cm en dessous. L’échantillonnage a suivi la méthode décrite auxparagraphes 12 et 13.
- Remplissez les cellules d’échantillonnage avec 61 mL d’eau déminéralisée ~20 jours avant l’échantillonnage. Buller de l’eau désionisée avec du N2 pendant 5 min en laboratoire pour éliminer l’oxygène avant de l’utiliser sur le terrain.
- Pendant l’échantillonnage, prélever 25 mL d’eau de la cellule à l’aide d’une seringue reliée à la conduite d’extraction de la cellule. Ensuite, remplissez les cellules avec de l’eau fraîche déminéralisée pré-bulle de N2 à travers une ligne de recharge de cellule secondaire. Si des mesures de concentration sont nécessaires juste après le prélèvement, passez à l’étape 2.1.
- Ajouter l’eau extraite dans des flacons en verre de 10 mL conservés avec 0,2 mL de HCl 0,1 M, les boucher avec du septum et les réfrigérer jusqu’à l’analyse en laboratoire.
REMARQUE : Les utilisateurs de cette méthode sont invités à modifier les profondeurs de collecte, le calendrier d’échantillonnage et la fréquence en fonction des besoins spécifiques de l’étude.
2. Mesure de la concentration de gaz à effet de serre
- Effectuer l’équilibrage de l’espace de tête d’échantillons d’eau interstitielle dans une seringue
- Créez des échantillons de gaz dans l’espace de tête à l’aide de la technique d’équilibrage14. À l’aide d’une seringue de 30 ml, prélevez 5 ml d’eau (Vpw) dans les échantillons prélevés sur le terrain, puis ajoutez 15 mL de N2 (Ultra Haute Pureté 99,999 %) pour créer l’espace libre (Vhs).
- Agitez la seringue vigoureusement et régulièrement pendant 5 min, manuellement ou à l’aide d’un agitateur à bascule (si disponible). Injectez 12 mL de sous-échantillon de gaz dans l’espace de tête dans un flacon pré-évacué de 10 mL utilisé pour les mesures de concentration de gaz avec l’analyseur optique en suivant les étapes suivantes (Figure 1). Évacuez les flacons à l’aide d’une pompe péristaltique15 ou tirez manuellement le piston d’une seringue de 60 ml sur le flacon fermé et pompez l’air 3 fois.
REMARQUE : Il peut être utilisé à la place de N2 pour créer l’espace de tête. La procédure d’ajout de N2 ou He à la seringue dépend de l’adaptation spécifique ou du régulateur du réservoir réel disponible pour les utilisateurs. Cet ajout implique généralement le couplage de la seringue au réservoir à l’aide d’un tube adapté ou l’extraction avec la seringue à partir d’un orifice d’échantillonnage adapté au réservoir. Selon les conditions du site et la logistique associée, les utilisateurs peuvent utiliser l’air ambiant pour créer l’espace de tête.
- Créer la chambre d’injection
- Fabriquer une chambre d’injection capable d’accepter un petit volume d’air (~1 à 5 ml) dans un volume d’air scellé qui se connecte à l’entrée et à la sortie de l’analyseur de gaz pour former une boucle fermée (Tableau des matériaux). La chambre d’injection et l’analyseur sont les deux éléments principaux du système (Figure 2).
- Modifier le couvercle métallique d’un pot Mason de 365 mL en perçant un trou de 11 mm de diamètre pour y installer un septum comme orifice d’injection et deux trous de 7 mm de diamètre pour insérer des robinets d’arrêt qui se connectent à l’analyseur. Utilisez de la colle époxy pour serrer l’orifice d’injection et les raccords et assurer l’étanchéité de la chambre.
- Connecter la chambre d’injection à l’analyseur optique
- Connectez le bocal aux orifices d’entrée et de sortie de l’analyseur optique en utilisant un diamètre intérieur (D.I.) de 5/32 de pouce et un diamètre extérieur de 1/4 de pouce (O.D.) Tubes en plastique PFA et tenir compte de leur volume supplémentaire. Assurez-vous que le tube suit les recommandations du fabricant de l’instrument et qu’il est propre et sec sans condensation.
- Réglez les vannes qui relient la chambre d’injection à l’instrument pour qu’elles s’ouvrent afin de créer un circuit d’air en boucle fermée. Attendez que les concentrations de gaz se stabilisent.
- Injecter un échantillon dans la chambre
- Lorsque la concentration dans la chambre et le signal dans l’analyseur se sont stabilisés (c.-à-d. écart type <0,03 ppm), injecter 2 mL d’un sous-échantillon des flacons contenant l’échantillon d’espace de tête créé à l’étape 2.1.2. Attendez que les concentrations dans l’analyseur se stabilisent à nouveau avant d’injecter le sous-échantillon suivant (figure 3).
- Injecter jusqu’à 20 sous-échantillons consécutivement ou moins si la concentration se rapproche de 100 ppm (voir8pour les effets sur la précision au-dessus de ce seuil). Analysez CH4 , vérifiez les étalons pour 5 échantillons et évaluez la différence avec les mesures réelles à l’aide de l’écart-type relatif (RSD).
- Une fois l’ensemble d’injections empilées terminé, débranchez l’une des conduites connectées à l’instrument pour réinitialiser la chambre à la pression ambiante et éviter une accumulation importante de pression et de concentration de méthane.
REMARQUE : Sur la base de plusieurs essais, il a été déterminé que le signal s’est stabilisé ~15 s après l’injection, mais des moments différents peuvent être nécessaires en réponse à d’autres spécifications d’enregistrement de l’instrument (Figure 3). Le débit de l’instrument utilisé était de ~1 L/min avec un temps de réponse de 5 s et une pression de cavité lors des différentes analyses à différents jours allant de 720 à 745 Torr.
- Calculer Concentrations de CH4 dans l’espace de tête
- Pour chaque sous-échantillon, calculer la concentration du GES cible (p. ex., CH4, CO2, N2O) dans l’espace de tête (Chs - μmol/mol) à l’aide de l’équation 1 :
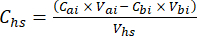 Équation [1]
Équation [1]
Où Vhs est le volume du sous-échantillon de l’espace de tête. - Calculer les concentrations avant (Cbi - μmol mol-1) et après les injections (Cai - μmol mol-1) comme la moyenne de 15 mesures (~15 s) avant l’injection et de 15 après la stabilisation du signal après l’injection. Calculez les volumes en mL, avant (Vbi) et après les injections (Vai) avec les équations 2 et 3 :
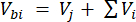 [2]
[2]
et
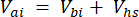 [3]
[3]
Où Vj (mL) est le volume ajouté du bocal (365 mL) et du tuyau (125,4 mL), et Vi (mL) est le volume cumulé des sous-échantillons injectés.
- Pour chaque sous-échantillon, calculer la concentration du GES cible (p. ex., CH4, CO2, N2O) dans l’espace de tête (Chs - μmol/mol) à l’aide de l’équation 1 :
- Calculer concentration d’eau interstitielle
- Calculer la pression partielle (Pi - MPa) de CO2, CH4 ou N2O dans l’espace de tête en utilisant la fraction molaire de gaz dans l’espace de tête et la pression atmosphérique (P) pendant le traitement de l’échantillon à l’aide de l’équation 4 :
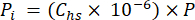 [4]
[4] - Calculer la concentration équivalente aqueuse de GES dans l’eau interstitielle à l’aide d’une équation de dilution (équation 5) avec l’espace de tête et les concentrations et volumes équivalents aqueux :
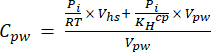 [5]
[5]
Où R est la constante universelle des gaz (0,008314 L MPa mol−1 K−1), est la température de l’air (K), Vhs est le volume de l’espace de tête (mL), KHcp est la constante de volatilité de Henry de CO2, CH4 ou N2O (2,96, 67,13 et 3,82 L MPa/mol, respectivement)16, et Vpw le volume du sous-échantillon liquide utilisé pour créer l’espace de tête (mL). - Utilisez les T et P enregistrés pendant les mesures. Les valeurs moyennes de T et de P lors de l’analyse des échantillons du projet de démonstration étaient de 295,15 K et de 0,101325 MPa, respectivement.
- Calculer la pression partielle (Pi - MPa) de CO2, CH4 ou N2O dans l’espace de tête en utilisant la fraction molaire de gaz dans l’espace de tête et la pression atmosphérique (P) pendant le traitement de l’échantillon à l’aide de l’équation 4 :
3. Validation par rapport aux mesures de chromatographie standard
- Analysez différentes concentrations connues de CH4 dans des flacons de 10 mL à l’aide d’un chromatographe en phase gazeuse classique. Utilisez trois groupes identiques de 20 étalons chacun. Les concentrations les plus faibles variaient de 5 à 100 ppm et augmentaient par tranches de 5 ppm.
- Déterminer les concentrations de CH4 par détection par ionisation de flamme sur un chromatographe en phase gazeuse. Le chromatographe a utilisé une colonne poreuse absorbante de polymère remplie avec He (25 mL/min) comme gaz vecteur. Pour effectuer les mesures des concentrations des étalons, étalonnez le chromatographe selon un ajustement de courbe (r2) > 0,99.
- Après la chromatographie, on procède à la détermination de la concentration en CH4 dans les mêmes flacons étalons à l’aide de la méthode décrite ci-dessus, à l’aide d’un analyseur optique étalonné par le fabricant (c.-à-d. précision (300 s, 1σ) : 0,3 ppb CH4).
- Évaluez la précision de la méthode en ajustant une régression linéaire aux résultats de la chromatographie et de l’analyseur optique des trois groupes d’étalons. Évaluer la réplicabilité de la méthode en comparant les pentes et les interceptions des régressions effectuées au sein de chaque groupe de normes. Évaluez la comparaison à l’aide d’un modèle standard des moindres carrés en mettant l’accent sur l’effet de levier. Évaluez toutes les régressions et comparaisons à un niveau de signification de 0,05.
Résultats
Analyseur optique versus chromatographie en phase gazeuse
Les résultats obtenus par chromatographie en phase gazeuse et par analyseur optique pour les trois groupes d’étalons ont montré de bons ajustements linéaires (c’est-à-dire r2 > 0,98) avec des pentes proches de un (figure 4). Les pentes des régressions dans les trois expériences étaient statistiquement similaires (F(2) = 0,478, p = 0,623), ce qui sugg...
Discussion
Cette étude a démontré l’applicabilité d’analyseurs de gaz portables basés sur la spectroscopie optique couplés à une chambre d’injection sur mesure pour analyser les espaces de tête créés à partir d’échantillons d’eau. La démonstration s’est concentrée sur le CH4, mais le protocole pourrait être appliqué à l’analyse d’autres GES pertinents comme le CO2 et le N2O8. L’objectif était d’élargir l...
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été financé par les subventions du DOE DE-SC0021067, DE-SC0023084 et DE-SC0022972. Les données sur les concentrations d’eau interstitielle des sites échantillonnés dans le marais sont accessibles au public à l’adresse ESS-DIVE Data Archive (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524 , consultée le 21 juin 2024)
matériels
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
Références
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50 (2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973 (2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498 (2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920 (2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon