È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione del metano disciolto negli ecosistemi acquatici utilizzando un analizzatore di gas per spettroscopia ottica
In questo articolo
Riepilogo
Questo studio dimostra un approccio per misurare le concentrazioni di gas metano in campioni acquosi utilizzando analizzatori ottici portatili accoppiati a una camera di iniezione in un circuito chiuso. I risultati sono simili alla gascromatografia convenzionale, presentando un'alternativa pratica e a basso costo, particolarmente adatta per studi sul campo a distanza.
Abstract
La misurazione dei flussi e delle piscine di gas serra negli ecosistemi sta diventando sempre più comune negli studi ecologici a causa della loro rilevanza per il cambiamento climatico. Con esso, cresce anche la necessità di piattaforme analitiche adattabili alla misurazione di diversi pool e flussi all'interno dei gruppi di ricerca. Questo studio mira a sviluppare una procedura per utilizzare analizzatori di gas portatili basati su spettroscopia ottica, originariamente progettati e commercializzati per misure di flusso di gas, per misurare le concentrazioni di gas serra in campioni acquosi. Il protocollo prevede la tradizionale tecnica di equilibratura dello spazio di testa seguita dall'iniezione di un sottocampione di gas nello spazio di testa in una camera collegata tramite un circuito chiuso alle porte di ingresso e uscita dell'analizzatore di gas. La camera è fabbricata con un barattolo di vetro generico e semplici forniture di laboratorio, ed è una soluzione ideale per i campioni che possono richiedere una diluizione pre-iniezione. Le concentrazioni di metano misurate con la camera sono strettamente correlate (r2 > 0,98) con le concentrazioni determinate separatamente attraverso gascromatografia-rivelazione a ionizzazione di fiamma (GC-FID) su sottocampioni delle stesse fiale. La procedura è particolarmente rilevante per gli studi sul campo in aree remote dove le apparecchiature e le forniture per cromatografia non sono prontamente disponibili, offrendo una soluzione pratica, più economica e più efficiente per misurare le concentrazioni di metano e di altri gas serra disciolti nei sistemi acquatici.
Introduzione
Gli ecosistemi all'interfase terra-acquatica, come le zone umide, i laghi, i bacini idrici, i fiumi e i torrenti, sono importanti pozzi di assorbimento e fonti di gas serra (GHG) come l'anidride carbonica (CO2), il metano (CH4) e il protossido di azoto (N2O)1,2. CH4, in particolare, viene prodotto durante la respirazione anaerobica negli spazi porosi saturi dei pori dei sedimenti. Una volta prodotta, una frazione viene ossidata e trasformata in CO2, mentre il resto alla fine si diffonderà attraverso la colonna d'acqua e la vegetazione o scoppierà in bolle3. La concentrazione di CH4 nell'acqua che satura i pori dei sedimenti (cioè l'acqua interstiziale) in un dato momento offre uno sguardo sull'equilibrio tra CH4 prodotto, consumato e trasportato4. Se misurata su profili verticali o temporali, la concentrazione di acqua interstiziale consente anche di identificare le zone più attive nella produzione e nel consumo di CH4 e la loro variazione stagionale.
Tradizionalmente, i metodi per determinare la concentrazione di gas serra dalle acque interstiziali negli ecosistemi prevedono il trattamento di campioni d'acqua raccolti sul campo per equilibrare i gas in uno spazio di testa creato. Quindi, lo spazio di testa viene analizzato attraverso la gascromatografia per determinare le concentrazioni5. Sebbene questo metodo sia ampiamente applicato negli studi ecologici, richiede sistemi di rilevamento a ionizzazione di fiamma (GC-FID) da banco per gascromatografia che comportano l'allocazione di uno spazio di laboratorio convenzionale e un alto grado di conoscenza esperta per la calibrazione e il funzionamento (ad esempio6). Richiede anche l'uso di materiali di consumo specializzati, come grandi serbatoi di gas di trasporto (ad esempio, azoto (N2) ed elio (He)), che non sono prontamente disponibili in luoghi remoti. Questi requisiti e la logistica associata al trasporto dei campioni al laboratorio possono limitare la progettazione del campionamento e, in alcuni casi, limitare l'ambito dello studio quando le apparecchiature cromatografiche non sono disponibili.
Questo studio mirava a sviluppare un metodo alternativo per misurare le concentrazioni di gas serra disciolti da campioni dello spazio di testa di soluzioni acquose utilizzando analizzatori di gas portatili basati su spettroscopia ottica. Questo tipo di analizzatore ottico di gas è un'alternativa economica ai sistemi GC-FID standard e la sua portabilità lo rende la scelta ideale per le applicazioni di lavoro sul campo. Gli analizzatori di gas portatili basati su spettroscopia ottica producono misure di concentrazione di gas ad alta frequenza (ad esempio, ~ 1 s-1) con tempi di risposta di 2 - 5 s, a seconda delle marche e dei modelli. Questi strumenti sono progettati e commercializzati principalmente per determinare i flussi di gas da superfici che emettono gas serra come terreni, acqua e vegetazione 7,8,9. Gli analizzatori ottici consentono il calcolo del flusso da misure di concentrazione continue in camere dello spazio di testa non stazionarie distribuite sulle superfici emittenti di interesse. Nell'uso abituale previsto con le camere di superficie, le misurazioni ad alta frequenza del tasso di variazione delle concentrazioni osservate nella camera e le dimensioni, la pressione e la temperatura note della camera consentono di interpretare tali dati come il tasso di emissione (o assorbimento) per area superficiale (cioè i flussi superficiali)10. Tuttavia, gli analizzatori di gas portatili non sono né attrezzati né ottimizzati per le concentrazioni disciolte in mezzi acquosi, il che richiede ulteriori adattamenti e interpretazioni per questo tipo di analisi.
Sfruttando le precedenti dimostrazioni dell'uso di analizzatori ottici per determinare le concentrazioni in campioni discreti provenienti dagli spazi di testa8, abbiamo progettato una piccola camera chiusa (cioè senza superfici di emissione) che si collega all'analizzatore in un circuito chiuso. La variazione delle concentrazioni dopo l'iniezione del sottocampione di gas nello spazio di testa, seguita dai calcoli di diluizione, consente di determinare le concentrazioni dello spazio di testa originale. La precisione di questo approccio è stata valutata confrontando i suoi risultati con quelli ottenuti tramite GC-FID negli stessi campioni. Il metodo è ulteriormente dimostrato attraverso un caso d'uso che ha analizzato i profili verticali di CH4 in campioni di acque interstiziali raccolti da siti sperimentali in una palude d'acqua dolce in Louisiana.
Protocollo
1. Campionamento e analisi delle acque interstiziali
- Raccogliere i campioni utilizzando campionatori per dialisi con acqua porosa (peepers)11. Distribuire i guardoni nelle posizioni pertinenti del sito dello studio. Nello studio dimostrativo, 6 peepers sono stati dispiegati sulle due macchie di vegetazione dominanti di una palude d'acqua dolce: tre su una macchia dominata da Sagitaria lancifolia e gli altri tre su una macchia co-dominata da vegetazione di S. lancifolia e Typha latifolia .
- Raccogli campioni 4 volte a giugno, settembre, ottobre e dicembre. Raccogli campioni a 10 diverse profondità dalla superficie del suolo fino a ~50 cm al di sotto di essa. Il campionamento ha seguito il metodo descritto in12,13.
- Riempire le celle di campionamento con 61 mL di acqua deionizzata ~20 giorni prima del campionamento. Bollire l'acqua deionizzata con N2 per 5 minuti in laboratorio per rimuovere l'ossigeno prima di utilizzarlo sul campo.
- Durante il campionamento, prelevare 25 mL di acqua dalla cellula con una siringa collegata alla linea di estrazione della cellula. Quindi, riempire le celle con acqua fresca deionizzata pre-gorgogliata con N2 attraverso una linea di ricarica secondaria delle celle. Se sono necessarie misurazioni della concentrazione subito dopo la raccolta, continuare con il passaggio 2.1.
- Aggiungere l'acqua estratta a fiale di vetro da 10 mL conservate con 0,2 mL di HCl 0,1 M, tappo con setto e conservare in frigorifero fino all'analisi in laboratorio.
NOTA: Gli utenti di questo metodo sono invitati a modificare le profondità di raccolta, il programma di campionamento e la frequenza in base alle specifiche esigenze di studio.
2. Misurazione della concentrazione di gas serra
- Eseguire l'equilibratura dello spazio di testa di campioni di acqua interstiziale in una siringa
- Creare campioni di gas nello spazio di testa utilizzando la tecnica di equilibrio14. Utilizzare una siringa da 30 ml per prelevare 5 ml di acqua (Vpw) dai campioni raccolti sul campo e quindi aggiungere 15 ml di N2 (Ultra High Purity 99,999%) per creare lo spazio di testa (Vhs).
- Agitare la siringa energicamente e costantemente per 5 minuti, manualmente o utilizzando uno shaker a dondolo (se disponibile). Iniettare 12 mL di sottocampione di gas nello spazio di testa in una fiala pre-evacuata da 10 mL utilizzata per le misure della concentrazione di gas con l'analizzatore ottico nei passaggi seguenti (Figura 1). Evacuare i flaconcini con una pompa peristaltica15 o tirare manualmente lo stantuffo di una siringa da 60 ml sul flaconcino chiuso e pompare l'aria fuori 3 volte.
NOTA: Può essere utilizzato al posto di N2 per creare lo spazio di testa. La procedura per aggiungere N2 o He alla siringa dipende dall'adattamento specifico o dal regolatore del serbatoio effettivo a disposizione degli utenti. Questa aggiunta comporta in genere l'accoppiamento della siringa al serbatoio utilizzando un tubo corrispondente o l'estrazione con la siringa da una porta di campionamento adattata al serbatoio. A seconda delle condizioni del sito e della logistica associata, gli utenti possono utilizzare l'aria ambiente per creare lo spazio di testa.
- Creare la camera di iniezione
- Produrre una camera di iniezione in grado di accettare un piccolo volume d'aria (~1 - 5 mL) in un volume d'aria sigillato che si collega all'afflusso e al deflusso dell'analizzatore di gas per formare un circuito chiuso (Tabella dei materiali). La camera di iniezione e l'analizzatore sono i due elementi principali del sistema (Figura 2).
- Modificare il coperchio metallico di un barattolo di vetro da 365 ml praticando un foro di 11 mm di diametro per inserire un setto come porta di iniezione e due fori di 7 mm di diametro per inserire le valvole del rubinetto che si collegano all'analizzatore. Utilizzare colla epossidica per serrare la porta di iniezione e i raccordi e garantire la tenuta della camera.
- Collegare la camera di iniezione all'analizzatore ottico
- Collegare il barattolo con le porte di ingresso e uscita dell'analizzatore ottico utilizzando un diametro interno (ID) di 5/32 di pollice (ID) e un diametro esterno di 1/4 di pollice (OD) Tubi in plastica PFA e tengono conto del loro volume aggiunto. Assicurarsi che il tubo segua le raccomandazioni del produttore dello strumento e che sia pulito e asciutto senza condensa.
- Impostare le valvole che collegano la camera di iniezione allo strumento in modo che si aprano per creare un circuito d'aria a circuito chiuso. Attendere che le concentrazioni di gas si stabilizzino.
- Iniettare un campione nella camera
- Quando la concentrazione nella camera e il segnale nell'analizzatore si sono stabilizzati (ad esempio, deviazione standard <0,03 ppm), iniettare 2 mL di un sottocampione dalle fiale contenenti il campione dello spazio di testa creato al punto 2.1.2. Attendere che le concentrazioni nell'analizzatore si stabilizzino nuovamente prima di iniettare il sottocampione successivo (Figura 3).
- Iniettare fino a 20 sottocampioni consecutivamente o meno se la concentrazione si avvicina a 100 ppm (vedere8per gli effetti sull'accuratezza al di sopra di questa soglia). Analizza gli standard di controllo CH4 per ogni 5 campioni e valuta la differenza con le misurazioni effettive utilizzando la deviazione standard relativa (RSD).
- Al termine della serie di iniezioni impilate, scollegare una delle linee collegate allo strumento per ripristinare la camera alla pressione ambiente ed evitare un significativo accumulo di pressione e concentrazione di metano.
NOTA: Sulla base di più test, è stato determinato che il segnale si è stabilizzato di ~15 s dopo l'iniezione, ma potrebbero essere necessari tempi diversi in risposta ad altre specifiche di registrazione dello strumento (Figura 3). La portata dello strumento utilizzato è stata di ~1 L/min con un tempo di risposta di 5 s e una pressione della cavità durante le diverse analisi in giorni diversi che varia da 720 a 745 Torr.
- Calcolare le concentrazioni di CH4 nello spazio di testa
- Per ogni sottocampione, calcolare la concentrazione del GHG target (ad esempio, CH4, CO2, N2O) nello spazio di testa (Chs - μmol/mol) con l'equazione 1:
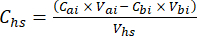 equazione [1]
equazione [1]
Dove Vhs è il volume del sottocampione dello spazio di testa. - Calcolare le concentrazioni prima (Cbi - μmol mol-1) e dopo (Cai - μmol mol-1) le iniezioni come media di 15 misurazioni (~15 s) prima dell'iniezione e 15 dopo la stabilizzazione del segnale dopo l'iniezione. Calcolare i volumi in mL, prima (Vbi) e dopo le iniezioni (Vai) con le equazioni 2 e 3:
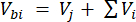 [2]
[2]
e
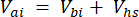 [3]
[3]
Dove Vj (mL) è il volume aggiunto del barattolo (365 mL) e del tubo (125,4 mL) e Vi (mL) è il volume accumulato dei sottocampioni iniettati.
- Per ogni sottocampione, calcolare la concentrazione del GHG target (ad esempio, CH4, CO2, N2O) nello spazio di testa (Chs - μmol/mol) con l'equazione 1:
- Calcola la concentrazione di acqua interstiziale
- Calcolare la pressione parziale (Pi - MPa) di CO2, CH4 o N2O nello spazio di testa utilizzando la frazione molare di gas nello spazio di testa e la pressione atmosferica (P) durante il trattamento del campione utilizzando l'equazione 4:
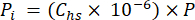 [4]
[4] - Calcolare la concentrazione acquosa equivalente di gas serra nell'acqua interstiziale utilizzando un'equazione di diluizione (equazione 5) con lo spazio di testa e le concentrazioni e i volumi equivalenti acquosi:
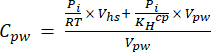 [5]
[5]
Dove R è la costante universale dei gas (0,008314 L MPa mol−1 K−1), è la temperatura dell'aria (K), Vhs è il volume dello spazio di testa (mL), KHcp è la costante di volatilità di Henry di CO2, CH4 o N2O (2,96, 67,13 e 3,82 L MPa/mol, rispettivamente)16 e Vpw il volume del sottocampione liquido utilizzato per creare lo spazio di testa (mL). - Utilizzare T e P registrati durante le misurazioni. La media di T e P durante l'analisi dei campioni del progetto dimostrativo è stata rispettivamente di 295,15 K e 0,101325 MPa.
- Calcolare la pressione parziale (Pi - MPa) di CO2, CH4 o N2O nello spazio di testa utilizzando la frazione molare di gas nello spazio di testa e la pressione atmosferica (P) durante il trattamento del campione utilizzando l'equazione 4:
3. Convalida rispetto alle misure cromatografiche standard
- Analizza diverse concentrazioni note di CH4 in fiale da 10 mL in un gascromatografo convenzionale. Utilizzare tre gruppi identici di 20 standard ciascuno. Le concentrazioni più basse variavano da 5 a 100 ppm e aumentavano con incrementi di 5 ppm.
- Determinare le concentrazioni di CH4 mediante rilevamento a ionizzazione di fiamma su un gascromatografo. Il cromatografo ha utilizzato una colonna impaccata assorbente in polimero poroso con He (25 mL/min) come gas di trasporto. Per eseguire le misurazioni delle concentrazioni degli standard, calibrare il cromatografo su un adattamento della curva (r2) > 0,99.
- Dopo la cromatografia, procedere alla determinazione della concentrazione di CH4 nelle stesse fiale standard utilizzando il metodo sopra descritto, utilizzando un analizzatore ottico calibrato dal produttore (ad esempio, precisione (300 s, 1σ): 0,3 ppb CH4).
- Valutare l'accuratezza del metodo adattando una regressione lineare ai risultati della cromatografia e dell'analizzatore ottico dei tre gruppi standard. Valutare la replicabilità del metodo confrontando le pendenze e le intercette delle regressioni eseguite all'interno di ciascun gruppo di standard. Valuta il confronto utilizzando un modello dei minimi quadrati standard con un'enfasi sulla leva dell'effetto. Valutare tutte le regressioni e i confronti con un livello di significatività di 0,05.
Risultati
Analizzatore ottico e gascromatografia
I risultati ottenuti attraverso la gascromatografia e l'analizzatore ottico per i tre gruppi di standard hanno mostrato buoni adattamenti lineari (cioè r2 > 0,98) con pendenze vicine a uno (Figura 4). Le pendenze delle regressioni nei tre esperimenti erano statisticamente simili (F(2) = 0,478, p = 0,623), suggerendo la riproducibilità dei risultati. È importante notare che le p...
Discussione
Questo studio ha dimostrato l'applicabilità di analizzatori di gas portatili basati su spettroscopia ottica accoppiati a una camera di iniezione personalizzata per analizzare gli spazi di testa creati da campioni d'acqua. La dimostrazione si è concentrata sul CH4, ma il protocollo potrebbe essere applicato all'analisi di altri gas serra rilevanti come CO2 e N2O8. L'obiettivo era quello di ampliare le precedenti valutazioni sistem...
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questo lavoro è stato finanziato attraverso i premi DOE DE-SC0021067, DE-SC0023084 e DE-SC0022972. I dati sulla concentrazione delle acque interstiziali dei siti campionati nella palude sono disponibili al pubblico su ESS-DIVE Data Archive (https://data.ess-dive.lbl.gov/view/doi:10.15485/1997524 , consultato il 21 giugno 2024)
Materiali
| Name | Company | Catalog Number | Comments |
| 1/4 in. I.D. x 3/8 in. O.D. Clear Vinyl Tubing | Home Depot | SKU # 702098 | Use to couple stopcocks and tubing connected to the instrument. Two short pieces (~4 cm). |
| 5/16 - 5/8 in. Stainless Steel Hose Clamp | Everbilt | 6260294 | Use to secure tubing connecting the stopcock valves and tubing connected to the instrument. |
| Crack-Resistant Teflon PFA Semi-Clear Tube for chemicals, 5/32" ID, 1/4" OD | McMaster-Carr | 51805K86 | Use to connect the injection chamber to the inlet and outlet ports of the instrument. We used two 0.68 m-long tubing in our experiment. |
| Drill with titanium step drillbit | Multiple companies | Use to drill the holes for septum and stopcocks in the jar's metallic lid. | |
| Gay butyl septum (stopper) | Weathon Microliter | 20-0025-B | Use as injection port and as vial septum (if compatible). |
| Headspace vials 20ml (23x75mm), Clear, Crimp Rounded Bottom | Restek | 21162 | Use to store the headspace sample. |
| Heavy Duty Steel Bond Epoxy GorillaWeld | Gorilla | 4330101 | Use to glue stopcock valves and septum to the jar's metallic lid. |
| Hypodermic Needles | Air-Tite Products Co. | N221 | Use to extract water from field vials, inject heaspace sample in vial and inject subsample to the injection chamber. |
| Mason jar (12 oz) | Ball, Kerr, Jarden | Larger or smaller chamber volumes can be chosen depending on sample concentrations. | |
| Optical spectroscopy-based gas analyzer | Multiple companies | Picarro G4301, Licor 7810, Licor 7820, ABB GLA131-GGA | These are some specific examples of analyzers that could be coupled to the injection chamber. We recognize that it is not an extensive list and other optical spectroscopy analyzers may also be suitable for the method. |
| Stopcock valve | DWK Life Sciences | 420163-0001 | Keep the valves open during normal operation. |
| Syringe (2.5 mL) | Air-Tite Products Co. | R2 | Use to extract subsamples from the headspace vials and inject them in the injecion chamber for analysis. |
| Syringe (30 mL) | Air-Tite Products Co. | R30HJ | Use to create headspace for gas analysis. |
Riferimenti
- Bastviken, D., Tranvik, L. J., Downing, J. A., Crill, P. M., Enrich-Prast, A. Freshwater methane emissions offset the continental carbon sink. Science. 331 (6013), 50 (2011).
- Quick, A. M., et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables. Earth-Sci Rev. 191, 224-262 (2019).
- Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., Zhuang, Q. Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob Chang Biol. 19 (5), 1325-1346 (2013).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- McAuliffe, C. Gas chromatographic determination of solutes by multiple phase equilibrium. Chem Technol. 1, 46-51 (1971).
- Hoyos Ossa, D. E., Gallego Rios, S. E., Rodríguez Loaiza, D. C., Peñuela, G. A. Implementation of an analytical method for the simultaneous determination of greenhouse gases in a reservoir using FID/µECD gas chromatography. Int J Environ Anal Chem. 103 (12), 2915-2929 (2023).
- Kittler, F., et al. Long-term drainage reduces CO2 uptake and CH4 emissions in a Siberian permafrost ecosystem. Glob Biogeochem Cycles. 31 (12), 1704-1717 (2017).
- Wilkinson, J., Bors, C., Burgis, F., Lorke, A., Bodmer, P. Measuring CO2 and CH4 with a portable gas analyzer: Closed-loop operation, optimization and assessment. PLoS One. 13 (4), e0193973 (2018).
- Villa, J. A., et al. Ebullition dominates methane fluxes from the water surface across different ecohydrological patches in a temperate freshwater marsh at the end of the growing season. Sci Tot Environ. 767, 144498 (2021).
- Holland, E. A., et al. Soil CO2, N2O and CH4 exchange. Std Soil Meth Long-Term Ecol Res. , 185-201 (1999).
- MacDonald, L. H., Paull, J. S., Jaffé, P. R. Enhanced semipermanent dialysis samplers for long-term environmental monitoring in saturated sediments. Environ Monitor Assess. 185 (5), 3613-3624 (2013).
- Villa, J. A., et al. Plant-mediated methane transport in emergent and floating-leaved species of a temperate freshwater mineral-soil wetland. Limnol Oceanography. 65, 1635-1650 (2020).
- Villa, J. A., et al. Methane and nitrous oxide porewater concentrations and surface fluxes of a regulated river. Sci Tot Environ. 715, 136920 (2020).
- Kampbell, D. H., Wilson, J. T., Vandegrift, S. A. Dissolved oxygen and methane in water by a GC headspace equilibration technique. Int J Environ Anal Chem. 36 (4), 249-257 (1989).
- Rochette, P., Bertrand, N. Soil air sample storage and handling using polypropylene syringes and glass vials. Canadian J Soil Sci. 83 (5), 631-637 (2003).
- Sander, R. Compilation of Henry's law constants (version 4.0) for water as solvent. Atmos Chem Phys. 15 (8), 4399-4981 (2015).
- Keller, J. K., Wolf, A. A., Weisenhorn, P. B., Drake, B. G., Megonigal, J. P. Elevated CO2 affects porewater chemistry in a brackish marsh. Biogeochemistry. 96 (1), 101-117 (2009).
- Comer-Warner, S. A., et al. Seasonal variability of sediment controls of carbon cycling in an agricultural stream. Sci Total Environ. 688, 732-741 (2019).
- U.S. Government Publishing Office. Title 42 - The Public Health and Wefare. U.S. Government Publishing Office. , (2009).
- Magen, C., et al. A simple headspace equilibration method for measuring dissolved methane. Limnol Oceanography Meth. 12 (9), 637-650 (2014).
- Regmi, B. P., Agah, M. Micro gas chromatography: An overview of critical components and their integration. Anal Chem. 90 (22), 13133-13150 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon